Similar presentations:
Классы дисперсных систем (аэрозоли, порошки, суспензии, эмульсии). Мицеллярные коллоидные системы. Лекция 5
1. Физико-химические основы получения лекарственных препаратов
Лекция: Классы дисперсных систем (аэрозоли,порошки, суспензии, эмульсии). Мицеллярные
коллоидные системы.
Пасека Александра Евгеньевна
2. План лекции
I. Основные понятия и определенияII. Структура и классификация дисперсных систем
III. Мицеллярные коллоидные системы:
1. строение мицеллы;
2. устойчивость коллоидных растворов:
кинетическая (седиментационная);
агрегативная;
3. коагуляция, виды коагуляции;
4. коллоидная защита.
IV. Системы с жидкой и газообразной дисперсионной средой:
1. суспензии;
2. эмульсии;
3. аэрозоли и порошки.
2
3. Структура и классификация дисперсных систем
Дисперсные системы (д.с.) - это гетерогенные системы, вкоторых одна из фаз представлена мелкими частицами
(дисперсная фаза), равномерно распределенными в объеме другой
однородной фазы (дисперсионной среды).
Признаки д.с.: высокая раздробленность (дисперсность) и
гетерогенность.
Дисперсная фаза – это мелкораздробленные частицы
нерастворимого тонкоизмельчённого вещества, распределённые
по всему объёму дисперсионной среды.
Дисперсионная среда – однородная непрерывная фаза, в
которой распределены частицы дисперсной фазы.
3
4. Структура и классификация дисперсных систем
Основной характеристикой д.с. и мерой раздробленностивещества является дисперсность и степень дисперсности.
Дисперсность: D = 1/a,
где а – размер частицы (диаметр или длина ребра), м-1.
Степень дисперсности (а) – это минимальный размер частицы,
выраженный в м (см);
Другой характеристикой степени раздробленности служит
удельная поверхность:
Sуд = S/V (м-1) или Sуд = S/m (м2/кг).
Sуд = К·D, где К – коэффициент пропорциональности.
4
5. Классификация: а) по степени дисперсности частиц дисперсной фазы
РазмерНазвание системы
Основные признаки
частиц,
прозрачность прохождение частиц
м
через фильтр
10-6 –
Микрогетерогенные
мутные
не проходят через
-4
10 (суспензии, эмульсии, пены,
бумажный фильтр
аэрозоли)
проходят через
10-9 – Ультрамикрогетерогенные, Прозрачные;
10-6
(коллоидные)
опалесцируют
бумажный фильтр.
при боковом
Не проходят через
освещении
биомембраны
Проходят через
10-10 – Молекулярно-дисперсные: прозрачные
биомембраны
10-9 истинные растворы НМС
5
6. От размеров частиц дисперсной фазы зависят свойства дисперсных систем
Микрогетерогенныесистемы
задерживаются
ультрафильтрами (целлофан, пергамент); гетерогенные;
кинетически и термодинамически неустойчивы; стареют во
времени; частицы видны в оптический микроскоп.
Ультрамикрогетерогенные, (коллоидные) – гетерогенные,
кинетически относительно устойчивы; стареют во времени;
частицы видны в электронный микроскоп.
Молекулярно-дисперсные: истинные растворы НМС –
гомогенные, кинетически и термодинамически устойчивы; не
стареют во времени; частицы не видны в современные
микроскопы.
6
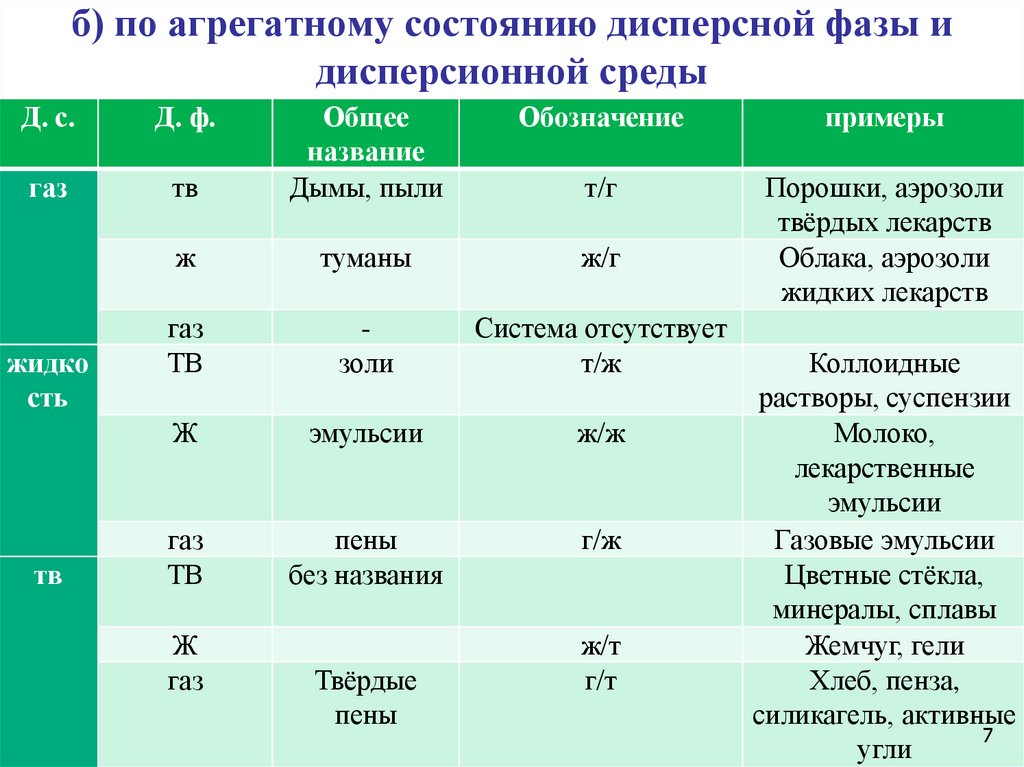
7. б) по агрегатному состоянию дисперсной фазы и дисперсионной среды
Д. с.Д. ф.
газ
жидко
сть
тв
Обозначение
примеры
тв
Общее
название
Дымы, пыли
т/г
ж
туманы
ж/г
Порошки, аэрозоли
твёрдых лекарств
Облака, аэрозоли
жидких лекарств
газ
ТВ
золи
Система отсутствует
т/ж
Ж
эмульсии
ж/ж
газ
ТВ
пены
без названия
г/ж
Ж
газ
Твёрдые
пены
ж/т
г/т
Коллоидные
растворы, суспензии
Молоко,
лекарственные
эмульсии
Газовые эмульсии
Цветные стёкла,
минералы, сплавы
Жемчуг, гели
Хлеб, пенза,
силикагель, активные
7
угли
8. в) по характеру взаимодействия между частицами дисперсной фазы и дисперсионной среды
№1
Лиофобные системы
Слабое взаимодействие между
д.ф. и д.с.
Лиофильные системы
Сильное взаимодействие
2
Образуются за счет энергии
извне
Образуются самопроизвольно
3
Эндэргонический процесс
Экзэргонический процесс
4
Термодинамически неустойчивы Термодинамически устойчивы
5
Необходим стабилизатор
6
Коллоидные растворы со
Коллоидные растворы ПАВ и ВМС,
стабилизатором (золи золота,
дисперсии некоторых глин.
серебра, галогенидов серебра,
сульфида мышьяка), суспензии,
эмульсии, пены
Стабилизатор не требуется
8
9. Мицеллярные коллоидные системы
Строение мицеллыВ гидрозолях дисперсионной средой является вода, а твердая
дисперсная фаза распределяется в виде коллоидных частиц.
Структурной единицей коллоидного раствора является мицелла.
Мицеллой лиофобной системы называется микрогетерогенная
система, состоящая из микрокристаллов дисперсной фазы,
окружённой сольватированными ионами стабилизатора.
Например: золь AgI, стабилизированный KI
Диссоциация стабилизатора, вещества, находящегося в избытке:
9
10. Строение мицеллы
Основную часть мицеллы составляет агрегат: атомы, ионы,молекулы нерастворимого в воде вещества, имеющие
кристаллическое строение.
Поверхность агрегата обладает запасом свободной энергии и
избирательно адсорбирует ионы из стабилизатора согласно
правилу Панета-Фаянса-Пескова:
На поверхности твердого вещества предпочтительно
адсорбируются
ионы,
способные
достраивать
его
кристаллическую решетку. Это ионы либо родственные, либо
сходные по химической природе и форме.
10
11. Строение мицеллы
Потенциалопределяющие ионы (ПОИ) – ионы, адсорбирующиеся вколичестве n на поверхности агрегата и сообщающие ему заряд.
Агрегат с потенциалопределяющии ионами составляет ядро мицеллы.
Вблизи ядра располагаются противоионы из стабилизатора вследствие
электростатического притяжения.
Противоины компенсируют заряд поверхности твёрдой фазы и
находятся в жидкой фазе мицеллы. На границе раздела фаз возникает
ДЭС.
K+
K+
K+
IK+
I
-
I
-
K+
K+
mAgI II- IK+
x{m[AgI] n I (n - x) K } x K+
-
+
12. Потенциалы
+ x} x K+n
-x)
K
{m[AgI] nI (
Потенциалы
-
ТВЕРДАЯ ФАЗА
ЯДРО
ЖИДКАЯ ФАЗА
+
+
+
+
+
МЕЖФАЗНЫЙ
ПОТЕНЦИАЛ
+
+
ЭЛЕКТРОКИНЕТИЧЕСКИЙ
ПОТЕНЦИАЛ
Межфазный (поверхностный, φ-потенциал) возникает на границе
раздела между жидкой и твердой фазами в мицелле.
Электрокинетический (ξ - потенциал) возникает на границе
скольжения между диффузным и адсорбционным слоем мицеллы
13. Устойчивость коллоидных растворов
1.2.
1.
2.
Характеризует
способность
д.ф.
сохранять
состояние
равномерного распределения частиц д.ф. во всем объеме
дисперсионной среды.
Различают:
Кинетическая
(седиментационная)
устойчивость
–
способность частиц д.ф. находиться во взвешенном состоянии и
не оседать под действием силы тяжести
Агрегативная устойчивость – способность частиц д.ф.
противодействовать их слипанию между собой и тем самым
сохранять неизменными свои размеры
Коллоидные растворы обычно седиментационно устойчивы, т.к.
Имеют относительно малые размеры частиц (высокую
дисперсность)
Достаточно интенсивное «броуновское движение»
13
14. Устойчивость коллоидных растворов
Агрегативная устойчивость коллоидных растворов обусловленаналичием на поверхности частиц «рыхлой» ионной атмосферы из
гидратированных противоионов, увеличивающих сродство коллоидных
частиц к дисперионной среде и препятствующих их слипанию.
При сближении коллоидных частиц на расстояние 10-6-10-9 м, в области
перекрывания их ионных атмосфер, разделяющих две твёрдые
поверхности, возникает расклинивающее давление.
Если диффузный слой мицеллы тонкий и ξ < 30 мВ, упругие свойства
диф. слоя невелики , поэтому при столкновении мицелл происходит
перекрывание этих слоёв, что приводит к преобладанию сил
притяжения и потере агрегативной устойчивости.
14
15. Коагуляция
Коагуляция – это процесс слипания коллоидных частиц с образованиемкрупных агрегатов из-за потери коллоидным раствором агрегативной
устойчивости.
Следствием коагуляции является седиментация.
Факторы, вызывающие коагуляцию:
Изменение температуры
Увеличение концентрации коллоидного раствора
Ультразвук
Электромагнитное поле
Добавление небольшого количества электролита
15
16. Коагуляция под действием электролитов
Порог коагуляции – минимальное количество электролита, котороенадо добавить к коллоидному раствору, чтобы вызвать явную
коагуляцию – помутнение раствора или изменение окраски.
Правило Шульце-Гарди:
Коагуляцию коллоидных растворов вызывают любые ионы,
имеющие знак заряда противоположный заряду гранул.
1.
2.
Коагулирующее действие ионов тем сильнее, чем выше заряд
иона-коагулянта.
Коагулирующее действие иона-коагулянта прямо пропорционально его
заряду в шестой степени:
16
17. Коагуляция под действием электролитов
Механизм коагуляцииРоль электролита – уменьшение расклинивающего давления между
сближающимися коллоидными частицами.
Это возможно 2 путями:
За счёт уменьшения заряда поверхности твёрдой фазы (заряда
поверхности ядра), т.е. за счёт снижения межфазного потенциала (φ);
1.
За счёт уменьшения толщины ионных атмосфер мицелл при неизменном
заряде поверхности ядер.
2.
Виды коагуляции:
Нейтрализационная коагуляция
1.
Концентрационная коагуляция
2.
18. Коагуляция под действием электролитов
Нейтрализационная коагуляцияПроисходит при действии электролита, который химически
взаимодействует с потенциалопределяющими ионами, связывая их в
прочное соединение, уменьшая этим заряд поверхности ядра.
ПРИМЕР: к золю AgI, стабилизированному AgNO3, добавили
ионы S2-
Концентрация ПОИ (Ag+) уменьшается, межфазный потенциал (φ)
падает, число противоионов (NO3-), необходимых для компенсации
заряда поверхности ядра, уменьшается, ионные атмосферы вокруг ядер
становятся тоньше, снижается расклинивающее давление, частицы
слипаются (коагулируют).
18
19. Коагуляция под действием электролитов
Концентрационная коагуляцияНет химического взаимодействия электролита с ионами стабилизатора.
ПРИМЕР: к золю AgI, стабилизированному AgNO3, добавили ионы
NO3- +
{m[AgI] nAg+ (n - x)NO3 }x xNO3
NO3
Добавляемые ионы вталкивают противоионы диффузного слоя в
адсорбционный слой. Диффузный слой сжимается. Может наступить
такое состояние, при котором диффузный слой исчезнет и гранула
станет электронейтральной (изоэлектрическое состояние).
19
20. Коагуляция под действием электролитов
Изоэлектрическое состояние – состояние коллоидных частиц,при котором электрокинетический потенциал равен 0 и
характеризующееся отсутствием направленного движения
гранул в электрическом поле.
В таком состоянии расклинивающее давление между
сближающимися частицами min.
Частицы коагулируют и осаждаются.
20
21. Гетерокоагуляция. Взаимная коагуляция
Гетерокоагуляция – коагуляция коллоидных растворов,содержащих разнородные частицы, отличающиеся по химической
природе, знаку или величине заряда.
• Частный случай гетерокоагуляции – взаимная коагуляция –
слипание разноимённо заряженных гранул колллоидных
растворов.
Взаимная коагуляция тем полнее, чем полнее нейтрализуются
заряды гранул.
Взаимная коагуляция
22. Коллоидная защита
1.a)
b)
2.
a)
b)
Коллоидная защита – это повышение устойчивости лиофобных золей по
отношению к электролитам.
Достигается добавлением к золям:
ВМС:
белки (желатин, яичный белок, альбумин, казеин);
полисахариды (крахмал, декстрины);
ПАВ:
растворимые соли ВЖК - стеарат и олеат натрия;
сапонины и др.
Механизм защитного действия:
макромолекулы ВМС адсорбируются на поверхности коллоидных частиц,
создавая адсорбционные сольватные слои, повышающие гидрофильность
коллоидных частиц.
усиливается взаимодействие частица – растворитель.
сольватные слои обеспечивают большое расклинивающее давление при
сближении двух частиц и препятствуют их слипанию.
если в адсорбционном слое ВМС образуются гелеобразные структуры,
22
обладающие повышенной прочностью и упругостью.
23. Коллоидная защита
Количественная характеристика защитного действия (Р. Зигмонди) –“Защитное число”.
“Защитное число” – такое количество мг защитного вещества (ВМС),
которое необходимо добавить к 10 мл золя , чтобы предотвратить
коагуляцию при приливании 1 мл 10 % раствора NaCl.
От природы золя различают:
золотое число (относится к золю золота)
серебряное число (относится к золю серебра)
железное число (относится к золю железа)
Чем меньше защитное число, тем сильнее защитное действие
высокомолекулярного вещества.
Различные ВМС обладают различным защитным числом
23
24. СИСТЕМЫ С ЖИДКОЙ И ГАЗООБРАЗНОЙ ДИСПЕРСИОННОЙ СРЕДОЙ
Суспензии – это дисперсные системы с твердой дисперсной фазой ижидкой дисперсионной средой.
По концентрации дисперсной фазы суспензии делят на:
Разбавленные (до 25 %)
Концентрированные (свыше 25 %), которые также называются пастами
(используются при лечении кожных заболеваний, в стоматологии и
косметике).
Суспензии получают аналогично коллоидным растворам.
1) Метод диспергирования. Твердые вещества измельчают в порошки с
размером частиц 10-7 - 10-5 м, а затем взмучивают в дисперсионной
среде.
2) Методы конденсации.
a) Физическая конденсация: переохлаждение расплава или выделение
из пересыщенного раствора.
b) Химическая конденсация: реакции осаждения (AgCl, CaSO4, BaSO4).
c) Коагуляция коллоидных частиц.
24
25. Стабилизация суспензий
Суспензии агрегативно и кинетически неустойчивые системы. Стабилизаторы:1) ЭЛЕКТРОЛИТЫ.
Механизм стабилизации:
ионы электролита избирательно адсорбируются вокруг твердой частицы
(согласно правилу Панета-Фаянса-Пескова).
возникает ДЭС с ξ-потенциалом.
Агрегативная устойчивость за счет электростатического отталкивания.
2)
ПОВЕРХНОСТНО-АКТИВНЫЕ
ВЕЩЕСТВА
(ПАВ)
И
ВЫСОКОМОЛЕКУЛЯРНЫЕ СОЕДИНЕНИЯ (ВМС).
Если частицы суспензии смачиваются дисперсионной средой, то агрегативная
устойчивость возрастает.
Природная смачиваемость. Например, CaCO3, CaSO4, Na2SiO3 (песок)
смачиваются водой, а активированный уголь – бензином.
Смачиваемость придают с помощью ПАВ.
Молекулы ПАВ адсорбируются на частице сажи неполярным углеводородным
радикалом, а полярная группа ориентирована к воде и сообщает смачиваемость
частице.
Молекулы ВМС вокруг частицы сажи образует механическую защитную
оболочку. Полярные группы ВМС притягивают полярные молекулы воды. 25
26. Эмульсии
Эмульсия – это дисперсная система, состоящая из двух взаимнонерастворимых жидкостей, одна из которых в виде капелек
диспергирована в другой.
Размер капли 10-7 – 10-5 м.
ПРИМЕРЫ: теплое молоко, сливочное масло, маргарин, мясной
бульон.
Способы получения:
Диспергирование.
a) самопроизвольное (если одну жидкость вливают с
определенной скоростью в другую);
b) с помощью мешалок различных конструкций;
c) гомогенизация (вторичное диспергирование через фильтры под
давлением).
26
27. Классификация эмульсий
В зависимости от природы образующих жидкостей:- Эмульсии масла в воде (М/В) или эмульсии I рода (прямые).
- Эмульсии воды в масле (В/М) или эмульсии II рода (обратные).
В зависимости от концентрации дисперсной фазы:
- Разбавленные (содержание дисперсной фазы не больше 0,1 %
объема). Диаметр частицы приблизительно равен диаметру
мицеллы, образуются самопроизвольно, форма сферическая.
- Концентрированные (содержание дисперсной фазы не более 74
% объема). Сохраняется сферическая форма капли.
- Высококонцентрированные (содержание дисперсной фазы
больше 74 %). Капли сдавливают друг друга. Имеют форму
многогранника, разделенного тонкой пленкой, т.е. образуются
27
“соты”. Вязкость большая.
28. Эмульсии
Эмульсии термодинамически неустойчивые системы.Самопроизвольное
коалесценция.
слияние
капелек
дисперсной
фазы
–
Этот процесс приводит к разрушению эмульсии и разделению на
две жидкости.
Для получения устойчивой эмульсии нужны стабилизаторы –
эмульгаторы.
Устойчивые эмульсии получаются тогда, когда эмульгатор
растворяется в дисперсионной среде или смачивается ею (правило
Банкрофта).
В качестве эмульгаторов применяются вещества 2 типов:
a) Жидкие вещества: ПАВ и ВМС (по аналогии с суспензиями).
28
b) Твердые эмульгаторы (порошки).
29. Стабилизация эмульсий
Стабилизация эмульсий ионогенными коллоидными ПАВ связана садсорбцией и определенной ориентацией молекул ПАВ на
поверхности капель.
По правилу уравнивания полярностей Ребиндера:
полярные группы ПАВ обращены к полярной фазе, а неполярные
радикалы — к неполярной фазе.
Чтобы ПАВ могло защитить каплю от слияния с другой, оно должно
создавать защитную оболочку снаружи капли.
Поэтому оно должно лучше (но не полностью!) растворяться в
жидкости, которая является дисперсионной средой, чем в жидкости,
из которой состоит капля.
29
30. Эмульгирующее действие ПАВ
Поверхностная активность определяется соотношением междугидрофильной и гидрофобной частями молекул ПАВ.
Уравновешивание гидрофильного и лиофильного взаимодействий, так
называемый гидрофильно-липофильный баланс (ГЛБ),
Определенное оптимальное соотношение действия воды и масла на
молекулы ПАВ, определяет условие образования адсорбционного слоя
на границе раздела двух жидкостей.
ГЛБ - эмпирическая безразмерная величина, равная отношению
сродства неполярных групп молекул ПАВ к углеводородной жидкости
и сродства полярной группы молекулы ПАВ к воде.
Максимальная эмульгирующая способность зависит от свойств
полярной гидрофильной части молекулы ПАВ и для мыла она
реализуется, когда групповое число составляет 12-18.
ПАВ с числом ГЛБ от 8 до 13 лучше растворимы в воде, чем в масле,
они образуют эмульсии I рода.
30
ПАВ с числом ГЛБ от 3 до 6 образуют эмульсии II рода.
31. Инверсия
b) Твердые эмульгаторы (порошки). Гидрофильные эмульгаторы,которые хорошо смачиваются водой (глина, мел, гипс), стабилизируют
эмульсии I рода (М/В). Гидрофобные эмульгаторы (уголь, сажа)
стабилизируют эмульсии II рода (В/М).
Инверсия – это взаимное превращение эмульсии 2-х типов:
Эмульсия I рода (М/В) ⇆ Эмульсия II рода (В/М)
Инверсию вызвают:
a) Введением эмульгатора, стабилизирующего обратный тип эмульсии.
Например, эмульсию I рода стабилизирует гидрофильный эмульгатор
(олеат натрия – С17Н35СООNa). Добавляя гидрофобный эмульгатор
(олеат Ca, Cr, Mg, Fe, Al) можно перевести эмульсию 1 рода в эмульсию
2 рода
b) Введение добавок, которые в результате химической реакции
превращают эмульгатор данного типа эмульсии в эмульгатор для
обратного типа эмульсии.
2 RCOONa + CaCl2 → (RCOO)2Ca + 2 NaCl
31
32. Характеристики эмульсий
c) Обращение эмульсии может быть вызвано длительным механическим воздействием.d) Обращение фаз эмульсии при достижении определенной концентрации дисперсной
фазы.
Основные характеристики эмульсий.
1) дисперсность эмульсии;
2) устойчивость во времени;
3) концентрация дисперсной фазы.
Дисперсность эмульсии определяется размерами частиц дисперсной фазы. Если
эмульсия полидисперсна, то для ее характеристики необходимо указать распределение
частиц по размерам, чаще всего в виде гистограммы.
Устойчивость во времени обычно характеризуется одной из двух величин — скоростью
расслоения эмульсии и временем жизни отдельных капель в контакте с другими.
Скорость расслоения эмульсии определяют, измеряя высоту (объем) отслоившейся фазы
через определенные промежутки времени после получения эмульсии.
Время жизни отдельных капель определяют путем микроскопических наблюдений за
каплей, помещенной на межфазную границу. Например, капля масла подводится к
границе раздела со стороны воды и измеряется время, через которое она сольется с
фазой масла.
32
33. СИСТЕМА С ГАЗООБРАЗНОЙ ДИСПЕРСИОННОЙ СРЕДОЙ. АЭРОЗОЛИ
Аэрозоли – грубодисперсные системы, у которых дисперсная фаза –частички твердого или жидкого вещества, а дисперсионная среда – газ.
Различают простые и сложные аэрозоли.
Простые делятся на: пыль, дым, порошки (Т/Г) и туман (Ж/Г).
Сложные: смог (Т/Г + Ж/Г).
Форма частиц аэрозоля зависит от агрегатного состояния дисперсной
фазы. В туманах капли жидкости имеют шарообразную форму, а у пыли
форма частицы различна.
Аэрозоли образуются:
1) Методами конденсации.
Физическая конденсация.
При понижении температуры происходит конденсация паров.
Например, при конденсации паров атмосферы образуются облака,
состоящие из водяных капель и кристалликов льда.
Химическая конденсация. HCl + NH3 → NH4Cl – белый дым.
33
34. АЭРОЗОЛИ
2) Методами диспергирования.Твердое или жидкое вещество измельчают механическим путем, а затем
распыляют в газовой фазе с помощью форсунок, пульвизаторов,
газовых баллончиков.
Аэрозоли по свойствам близки к коллоидным растворам.
1) Частички аэрозоля имеют ДЭС, препятствующий их слипанию в
крупные агрегаты.
Электрический заряд у частиц аэрозоля возникает за счет:
Механического трения частиц друг о друга;
Под действием лучей различного происхождения;
Адсорбции ионов из газов.
2) Частицы аэрозоля по размеру близки к мицеллам, способны
рассеивать и поглощать свет. Поэтому аэрозоли имеют голубые оттенки
(например, дым сигарет). Однако для некоторых аэрозолей имеет место
большая разница в показателях преломлениях газовой дисперсионной
среды и жидкой или твердой фазы, поэтому рассеяние у них более
34
35. Порошки
Порошки — это свободно – дисперсные системы, у которыхдисперсионная среда – газ, а дисперсная фаза – твердое тело с
размерами частиц 10-8 – 10-4 м.
• текучесть (сыпучесть) - подвижность частиц порошка
относительно друг друга и способность перемещаться под действием
внешней силы;
• гигроскопичность – способность поглощать влагу. Ее можно ↑ или ↓
путем добавления ПАВ;
• гранулирование – процесс образования в порошкообразной массе
конгломератов (гранул) шарообразной или цилиндрической формы,
однородных по величине.
35
36. Разрушение эмульсий и аэрозолей
Химические методы:1. добавление в эмульсии или пены минеральных кислот или солей
многовалентных металлов;
2. вводить ПАВ с поверхностной активностью большей, чем у
стабилизаторов; эмульгатор нейтрализовать другим эмульгатором;
3. добавлять растворители.
Физические методы разрушения эмульсий:
• повышение температуры;
• центрифугирование;
• фильтрование через пористые материалы.
Для разрушения аэрозолей:
• метод конденсации паров воды в среде аэрозоля;
• взаимной коагуляции;
• ультразвук;
• токи высокого напряжения;
36
• фильтрацию.
37. Список литературы
1. Физическая химия: учебник / Ю.Я. Харитонов. – М.: ГЭОТАР - Медиа, 2013.2.
3.
4.
5.
– 608 с. http://www.studentlibrary.ru/book/ISBN9785970423 905.html
Евстратова К.И. Физическая и коллоидная химия / К. И. Евстратова, Н. А.
Купина, Е. Е. Малахова. – М.: Высшая школа, 1990. -487 с.
Коллоидная химия. Физическая химия дисперсных систем: учебник/ Ю.А.
Ершов. – М.: ГЭОТАР - Медиа, 2012. – 352 с.
Физическая и коллоидная химия [Электронный ресурс] / А. П. Беляев, В. И.
Кучук; под ред. А. П. Беляева - М.: ГЭОТАР-Медиа, 2014. - 752 с.
http://www.studentlibrary.ru/book/ISBN9785970427 668.html
Мушкамбаров Н.Н., Физическая и коллоидная химия: учебник для
медицинских вузов (с задачами и решениями) [Электронный ресурс] учебник
для медицинских вузов (с задачами и решениями). / Мушкамбаров Н.Н. - 4-е
изд.,
стер.
М.:
ФЛИНТА,
2015.
455
с.:
http://www.studentlibrary.ru/book/ISBN97859976522954.html





































 chemistry
chemistry