Similar presentations:
Растворы высокомолекулярных соединений (ВМС)
1.
ЛЕКЦИЯ«РАСТВОРЫ ВЫСОКОМОЛЕКУЛЯРНЫХ
СОЕДИНЕНИЙ (ВМС)»
2.
План• 1. Понятие о растворах высокомолекулярных соединений (ВМС). Биополимеры.
2. Особенности свойств растворов ВМС. Сравнительная характеристика растворов
высокомолекулярных соединений, истинных и коллоидных растворов.
• 3. Белки, как высокомолекулярные электролиты. Изоэлектрическая точка. Электрофорез
частиц белков.
• 4. Разрушение растворов ВМС: высаливание, коацервация (расслоение), денатурация.
• 5. Коллоидная защита и ее биологическое значение.
• 6. Студни: строение, получение, свойства и биологическое значение. Явления
тиксотропии и синерезиса.
• 7. Коллоидно-осмотическоедавление в растворах ВМС. Мембранное равновесие
Доннана.
3.
1. Понятие о растворах высокомолекулярных соединений(ВМС). Биополимеры.
Высокомолекулярные соединения (ВМС) – это
вещества с большой молекулярной массой порядка
104 – 106 а.е.м. Макромолекулы построены из большого
числа повторяющихся звеньев.
ВМС (или полимеры) получаются в результате
полимеризации или поликонденсации.
4.
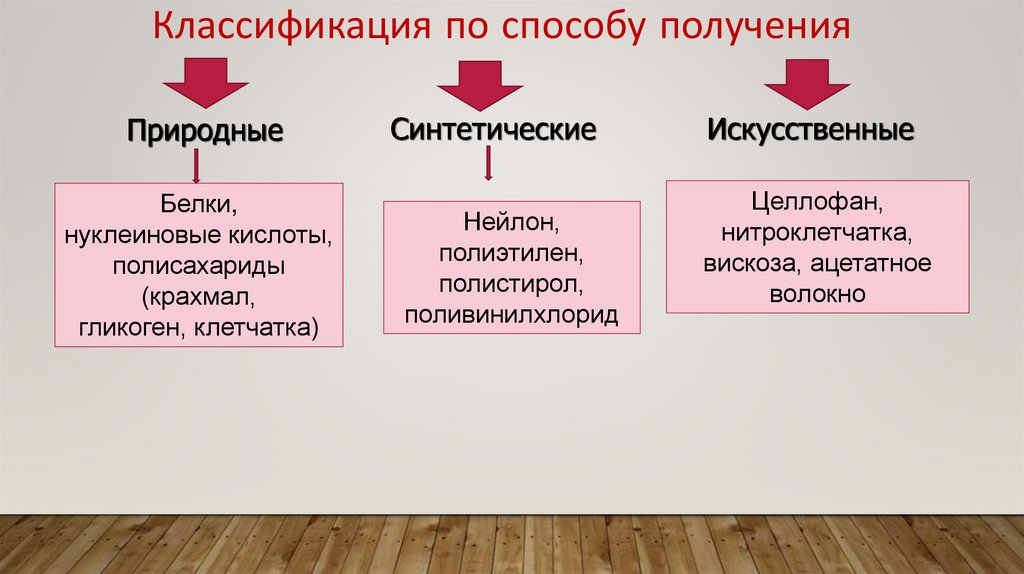
Классификация по способу полученияПриродные
Белки,
нуклеиновые кислоты,
полисахариды
(крахмал,
гликоген, клетчатка)
Синтетические
Нейлон,
полиэтилен,
полистирол,
поливинилхлорид
Искусственные
Целлофан,
нитроклетчатка,
вискоза, ацетатное
волокно
5.
Природные ВМСБиополимеры являются структурной основой всех живых организмов. К ним
относятся, прежде всего нуклеиновые кислоты, белки и их производные:
нуклепротеиды, гликопротеиды, липопротеиды и т.д., а ткже гликоген. Эти соединения
являются основным строительным материалом для протоплазмы и ядерного вещества
клеток и содержатся во многих биологических жидкостях.
Нуклеиновые кислоты являются полимерами, содержащими от десятков до сотен
тысяч нуклеотидов. Они являются важнейшим классом биополимеров, выполняя
генетические функции и определяя весь ход развития живого организма.
Полисахариды (крахмал, гликоген и др.) являются полимерами глюкозы. Они
выполняют структурную функцию и являются запасной формой питательных веществ.
6.
Природные ВМСБелки являются природными полимерами, которые образуются в результате
реакции поликонденсации аминокислот. Относительная молекулярная масса белков
варьирует в пределах от 5 000 до 1 000000 и более.
Высокомолекулярные соединения широко применяются в самых различных
областях техники, в быту, в медицине. В частности, они используются при
изготовлении протезов искусственных сосудов, клапанов сердца, хрусталиков,
биологических клеев, диализных мембран, перевязочных и тампонажных материалов.
Создание полимеров медико-биологического назначения – важное направление в
современной химии полимеров. Для развития этого направления требуется самое
тесное сотрудничество специалистов в области материаловедения, клинической
медицины и различных фундаментальных биологических наук.
7.
1. Особенности свойств растворов ВМССходство ВМС с золям:
1. Близкие значения размеров макромолекул и мицелл, и по форме они близки,
так как макромолекулы (в частности белков) закручиваются в глобулу.
2. Макромолекулы не проходят через полупроницаемую мембрану, т.е. имеет
место диализ.
3. Сходные молекулярно-кинетические свойства:
- Наличие броуновского движения;
- Медленная диффузия, как у золей;
- Низкое осмотическое давление.
4. Близкие электрические (электрофорез, электроосмос) и оптические (рассеяние,
поглощение) свойства.
5. Могут коагулировать.
8.
Сходство ВМС с истинными растворами1. Молекулярная степень дисперсности
2. Физико-химическая природа растворения
3. Агрегативная и термодинамическая устойчивость
4. Процесс растворения происходит самопроизвольно
9.
Отличие ВМС от золей:Растворы ВМС в отличие от коллоидных растворов характеризуются
следующими особенностями:
1. Структурной единицей раствора ВМС является макромолекула, имеющая
дисперсность коллоидных растворов 10-9 - 10-7 м. Мицелла состоит из тысяч и
миллионов молекул низкомолекулярного вещества.
2. Процесс растворения ВМС протекает самопроизвольно, осуществляемый с
уменьшением свободной энергии (ΔG < 0), поэтому растворы ВМС –
термодинамически устойчивые системы. Коллоидные растворы получают
специальными методами (диспергирования и конденсации), затрачивая при этом
механическую, химическую и электрическую энергию, и представляют собой
гетерогенные термодинамически неустойчивые системы.
10.
Отличие ВМС от золей:3. Растворы ВМС образуются и существуют долгое время и при высоких
концентрациях без стабилизатора.
4. Для растворов ВМС характерна аномально высокая вязкость. Тогда как вязкость
коллоидных растворов равна вязкости дисперсионной среды (в частности, воды).
5. Макромолекулы ВМС сильно сольватированы.
6. ВМС способны образовывать не только истинные растворы, но и типичные
лиофобные золи, если в качестве дисперсионной среды использовать такую жидкость,
по отношению к которой данное ВМС является лиофобным, т.е. не способным
раствориться в ней.
7. Для растворов ВМС характерно сильное межмолекулярное взаимодействие.
11.
12.
Специфические свойства ВМС:ВМС набухают, их растворы обладают высокой вязкостью и
способностью желатинироваться.
По современной классификации растворы ВМС относят к
гомогенным растворам, имеющим ряд свойств коллоидов и
специфические свойства.
Растворы ВМС занимают промежуточное положение между
истинными и коллоидными растворами.
13.
3. Белки, как высокомолекулярные электролиты. Изоэлектрическаяточка. Электрофорез
Молекула белка имеет электрический заряд, обусловленный
диссоциацией ионогенных групп (–СООН) и (–NH2): эти группы
принадлежат концевым аминокислотам, а также дикарбоновым и
диаминовым аминокислотам, расположенным в середине полипептидной
цепи. В результате диссоциации образуется биполярный ион (амфиион),
имеющий положительный и отрицательный заряд. Схематически
диссоциацию можно представить так:
14.
Изоэлектрическая точкаТаким образом, заряд белка зависит от реакции среды, соотношения
количества карбоксильных групп и степени их диссоциации.
Значение рН, при котором белок находится в изоэлектрическом
состоянии, т.е. в состоянии, при котором число положительных и
отрицательных зарядов одинаково, общий заряд равен нулю,
называется изоэлектрической точкой белка (ИЭТ).
Изоэлектрическая точка является важной характеристикой белков. Каждый
белок имеет свою индивидуальную ИЭТ.
15.
Изоэлектрическая точкаСуществуют следующие методы ее определения:
1. По электрофоретической подвижности. При проведении
электрофореза белок при значении рН, равному ИЭТ, не перемещается в
электрическом поле.
2. По степени коагуляции (высаливания). В ИЭТ наблюдается
наибольшее помутнение раствора и белок выпадает в осадок.
3. По скорости желатинирования. Желатинирование (или застудневание)
происходит быстрее всего в ИЭТ.
4. По величине набухания. Наименьшее набухание белка происходит в
пробирке, где рН ближе к ИЭТ.
16.
ЭлектрофорезДля исследования белков широко применяют метод электрофореза,
который широко используют в биологии и медицине для разделения белков
в исследовательских и клинических целях.
С помощью электрофореза белковую смесь можно разделить на
отдельные компоненты, что позволяет установить молекулярную массу
белка и подтвердить чистоту выделенного белка. При электрофорезе
происходит пространственное разделение молекул, имеющих разный заряд
и размеры, путем помещения их в электрическое поле.
При этом получают электрофореграмму - картину, полученную после
разделения сложной смеси с помощью электрофореза.
17.
ЭлектрофорезЭлектрофореграмма белков биологических жидкостей человека
(сыворотка крови, моча, спинномозговая жидкость и др.) позволяет врачам
получить значительную диагностическую информацию.
Например, у здорового человека относительное содержание белковых
фракций при определении их в сыворотке крови методом электрофореза на
бумаге, следующее: альбумины- 55-65%, α1-глобулины 3-6%, α2-глобулины
7-10%, β-глобулины - 7-12%, γ-глобулины - 13-19%.
При многих заболеваниях наблюдается изменение соотношения
фракций, тогда как общее количество белка обычно мало изменяется.
Выявление этих изменений с помощью метода электрофореза широко
используется в диагностических целях.
18.
ЭлектрофорезЭлектрофореграммы белков-ферментов (зимограммы) позволяют
изучать изменения активности и изоферментного спектра таких белков
под действием внешних и внутренних факторов как у человека, так и у
других организмов. Получаемые данные используются в медицине,
биотехнологии, различных отраслях сельского хозяйства и пищевой
промышленности.
19.
4.Разрушение
растворов
ВМС:
высаливание, коацервация, денатурация.
расслоение,
Основным фактором термодинамической устойчивости растворов
биополимеров (ВМС) является их высокая гидрофильность, которая
обусловлена наличием таких гидрофильных групп, как – NH2, – COOH, –
OH, –SH, – CO – NH – и др.
В результате вокруг макромолекулы образуется монослой растворителя,
называемый сольватной или гидратной оболочкой. Дополнительным
фактором устойчивости является наличие заряда на молекуле белка,
обусловленное ионогенными группами. Растворы ВМС самопроизвольно
не осаждаются.
Чтобы лишить высокомолекулярные частицы устойчивости, необходимо
удалить гидратную оболочку и снять электрический заряд.
20.
ВысаливаниеОдним из методов осаждения белков является высаливание.
Высаливание – это процесс осаждения белков с помощью
концентрированных растворов солей. Для высаливания чаще всего
используют соли Na2SO4, (NH4)2SO4, фосфаты.
Высаливание наиболее эффективно в ИЭТ белка, что и используется для
её определения.
21.
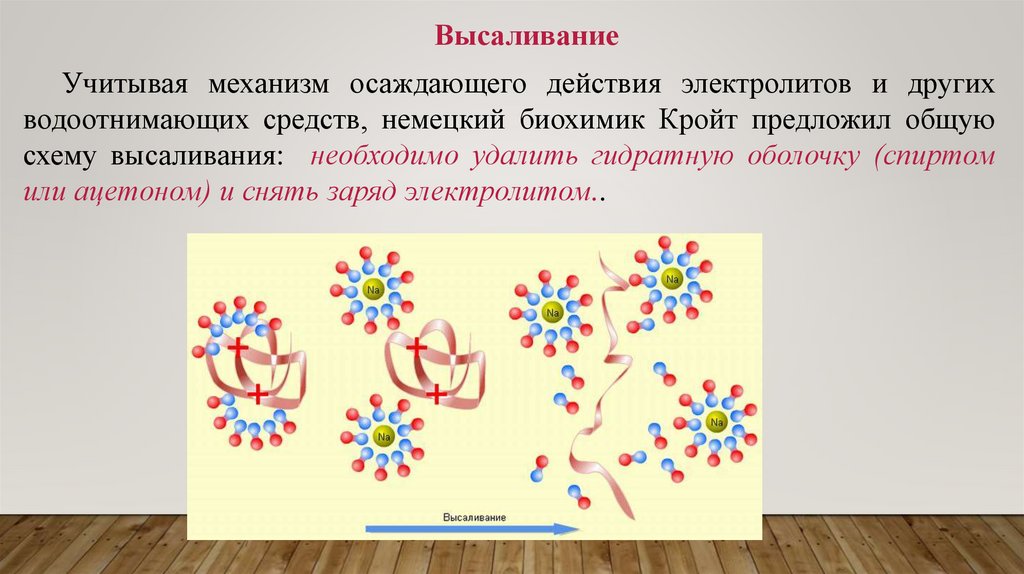
ВысаливаниеУчитывая механизм осаждающего действия электролитов и других
водоотнимающих средств, немецкий биохимик Кройт предложил общую
схему высаливания: необходимо удалить гидратную оболочку (спиртом
или ацетоном) и снять заряд электролитом..
22.
ВысаливаниеПричем последовательность этих действий не имеет значения. Для
осаждения многих белков достаточно большой концентрации одного
электролита, особенно сульфатов, которые обеспечивают снятие и заряда,
и дегидратацию частицы.
Высаливающее действие электролитов зависит от способности их
ионов
гидратироваться.
Ученый
Гофмейстер
установил
последовательность высаливающего действия анионов и катионов:
23.
ВысаливаниеНа
величину
высаливания
белков
оказывают влияние не только природа и
концентрация соли, но и рН среды и
температура, а также ионная сила раствора.
Процесс высаливания используется для
приготовления некоторых лечебных сывороток
и противокоревого α-глобулина, а также для
разделения
белков
на
фракции
при
биологических исследованиях.
В
результате
высаливания
обычно
возникают образования, похожие на коагуляты
– волокна, хлопья, творожистые осадки.
Высалива
ние
24.
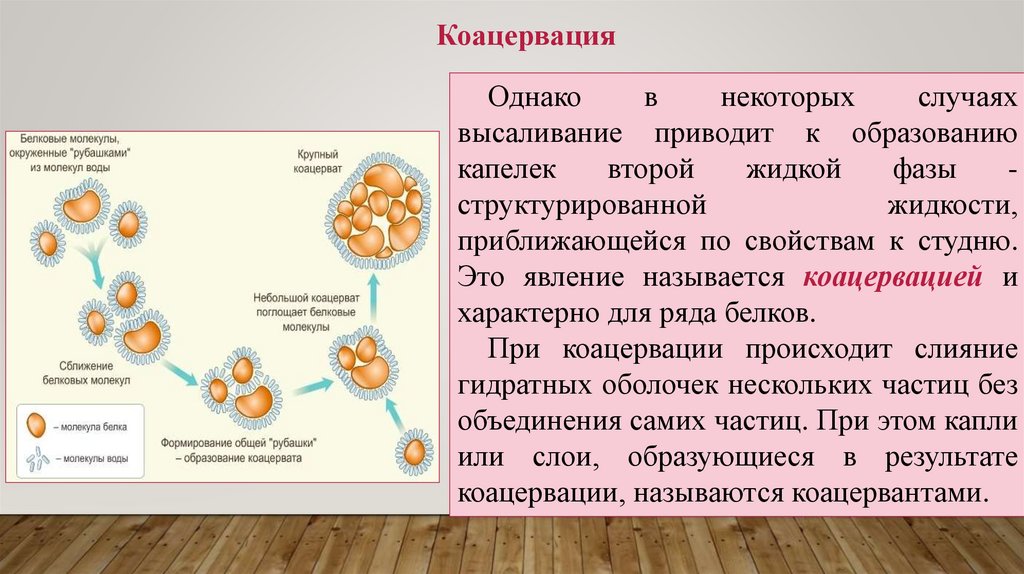
КоацервацияОднако
в
некоторых
случаях
высаливание приводит к образованию
капелек
второй
жидкой
фазы
структурированной
жидкости,
приближающейся по свойствам к студню.
Это явление называется коацервацией и
характерно для ряда белков.
При коацервации происходит слияние
гидратных оболочек нескольких частиц без
объединения самих частиц. При этом капли
или слои, образующиеся в результате
коацервации, называются коацервантами.
25.
КоацервацияКоацервации способствует понижение температуры, изменение рН.
Коацервация является процессом самоорганизации и структурирования
органических веществ в водной среде в самостоятельную фазу.
Возникновение белковых коацервантов из белковых молекул положено в
основу теории происхождения жизни на Земле, разработанную академиком
А.И. Опариным.
Коацервацию используют при микрокапсулировании лекарств. Для этого
лекарственное вещество диспергируют в растворе полимера, а затем,
изменяя температуру или рН среды, испаряя часть растворителя или вводя
высаливатель, выделяют из раствора фазу, обогащенную полимером.
26.
КоацервацияМелкие капли этой фазы отлагаются
на поверхности капсулируемых частиц,
образуя
сплошную
оболочку.
Микрокапсулирование
лекарств
обеспечивает
устойчивость,
пролонгирует
действие,
маскирует
неприятный вкус лекарств.
В
научных
исследованиях
микрокапсулы могут использоваться как
модели живой клетки.
27.
ДенатурацияДенатурация – разрушение уникальной нативной (природной)
структуры молекулы белка под внешним воздействием. При денатурации
разрушаются все структуры белка, преимущественно его третичная
структура, кроме первичной. Денатурация приводит к потере характерных
для белка свойств (растворимость, электрофоретическая подвижность,
биологическая активность и др.).
Большинство белков денатурирует при нагревании их растворов выше
50–60°С, добавление концентрированных кислот и щелочей, дубильных
веществ, дегидратантов (ацетон, этанол, мочевина), облучение УФ,
рентгеновские лучи, изменении рН и ионной силы раствора.
28.
ДенатурацияВнешние проявления денатурации сводятся к потере растворимости,
особенно в ИЭТ (pI), повышению вязкости белковых растворов,
увеличению количества свободных функциональных SH-групп и
изменению характера рассеивания рентгеновских лучей. Наиболее
характерным признаком денатурации является резкое снижение или
полная потеря белком его биологической активности (каталитической,
антигенной или гормональной). При денатурации белка развертываются
глобулы нативных белковых молекул и образуются случайные и
беспорядочные структуры
29.
ДенатурацияДенатурация белков происходит в желудке, где имеется сильнокислая
среда (рН 0,5 - 1,5), и это способствует расщеплению белков
протеолитическими ферментами.
Отравление ионами тяжелых металлов основано на денатурации белковферментов. В тоже время, денатурация белков положена в основу лечения
отравлений тяжелыми металлами, когда больной принимает per os ("через
рот") молоко или сырые яйца для того, чтобы ионы металлов, денатурируя
белки молока или яиц, адсорбировались на их поверхности и не
действовали на белки слизистой оболочки желудка и кишечника, а также не
всасывались в кровь.
Денатурация происходит при кулинарной обработке пищи, что
облегчает ее переваривание в ЖКТ.
30.
5. Коллоидная защита и ее биологическое значениеСмесь высокомолекулярных соединений и коллоидов нередко
проявляет особые свойства. Например, если в смеси преобладает полимер
(белок), то он абсорбируется на поверхности коллоидной частицы, образуя
крупный агрегат, проявляющий гидрофильные свойства. Устойчивость его
будет средней между обоими видами взаимодействующих частиц.
Такое явление называется защитой золя высокомолекулярными
соединениями – коллоидной защитой.
Коллоидная защита - снижение способности коллоидов коагулировать
в результате введения в них некоторых высокомолекулярных веществ.
31.
Коллоидная защитаИсследования показали, что степень защитного действия растворов
высокомолекулярного
строения
(ВМС)
зависит
от
природы
растворенного полимера и от природы защищаемого гидрофобного золя.
Количественной мерой защитного действия растворов ВМС являются
золотое, рубиновое и железное число.
Золотое число – это минимальное число миллиграммов
защищающего высокополимера, достаточное, чтобы воспрепятствовать
перемене красного цвета в фиолетовый у 10 мл гидрозоля золота
(концентрации 6∙10-9 г/л, полученного по методу Зигмонди) от
коагулирующего действия 1 мл раствора хлорида натрия с массовой
концентрацией 100 г/л.
32.
Коллоидная защитаЗолотое число, введенное в практику Зигмонди, рассчитано на самый
чувствительный золь – гидрозоль золота.
Позднее В. Оствальд в качестве стандарта вместо золотого числа предложил
рубиновое. Оно определяется как минимальное число миллиграммов защищающего
золя, которое способно защитить 10 мл раствора красителя конго красного (конгорубина)
с массовой концентрацией 0,1 г/л от коагулирующего действия 1 мл раствора хлорида
натрия с массовой концентрацией 100 г/л.
Помимо золотого и рубинового чисел, некоторое применение получило еще более
простое и легкодоступное железное число, которое можно определить как число
миллиграммов защищающего высокополимера, способного защитить 10 мл золя
гидроксида железа от коагулирующего действия 1 мл 0,025 М раствора Na2SO4.
33.
Коллоидная защитаЯвление коллоидной защиты имеет большое физиологическое значение:
многие гидрофобные коллоиды и частички в крови и биологических
жидкостях защищены белками от коагуляции.
Так, белки крови защищают капельки жира, холестерин и ряд других
гидрофобных веществ. Снижение степени этой защиты приводит к
отложению, например, холестерина и кальция в стенках сосудов
(атеросклероз и кальциноз).
34.
Коллоидная защитаСуществует теория, согласно которой гидрофильность белков крови человека и их
способность к абсорбции на холестерине с возрастом уменьшается и соответственно
понижается их защитное действие на холестерин.
Холестерин откладывается в стенках сосудов, обусловливая возрастные изменения
сосудов, а в связи с этим и соответствующие изменения в тканях. Вероятно, этот
процесс является одним из существенных факторов старения организма.
Понижение защитных свойств белков и других гидрофильных соединений в крови
может привести к выпадению солей мочевой кислоты (при подагре), к образованию
камней в почках, печени, протоках пищеварительных желез и т.п.
Явление коллоидной защиты используется при изготовлении ряда
фармакологических препаратов; так, были предложены защищенные белком золи
металлов (колларгол и др.).
35.
6. Студни: строение, получение, свойства и биологическоезначение. Явления тиксотропии и синерезиса
Большинство растворов ВМС, таких как агар-агар, желатин, а также
коллоидные растворы типа гидроксида железа (III) или кремниевые
кислоты, способны при определенных условиях переходить в твердое
состояние без видимого разделения фаз.
Этот процесс носит название застудневание или желатинирование. А
продукты,
образовавшиеся
в
результате
этих
процессов,
называются студнями или гелями.
36.
Студни и гелиСтудни или гели – это дисперсные системы, у которых частицы
дисперсной фазы не движутся свободно, а связаны между собой, т.е. это
золи, потерявшие агрегативную устойчивость, но сохранившие
кинетическую устойчивость.
Гели могут быть естественного и искусственного происхождения. К числу
естественных относятся цитоплазма живых клеток, кожа, хрусталик глаза и
т.д.
Искусственные гели можно приготовить из желатина, агар-агара, каучука.
Многие продукты питания представляют собой студни (хлеб, сыр, джемы и
т.д.). Причиной застудневания является возникновение связей между
молекулами ВМС. Связи могут быть гидрофобные, водородные, ионные.
Они зависят от природы вещества и условий застудневания.
37.
Студни и гелиЗастудневание - это процесс образования и упрочнения
пространственной сетки.
Процесс застудневания зависит от следующих факторов: формы и
природы ВМС, концентрации, температуры, наличия электролитов, рН
среды. Лучше всего застудневание происходит в ИЭТ.
Ионы, увеличивающие набухание, замедляют застудневание.
38.
Тиксотропия и синерезисПонижение температуры способствует застудневанию.
Студни под влиянием механических воздействий способны
разжижаться, переходить в золи, а затем при хранении снова застудневать.
Такое явление превращения студней в золи и наоборот золей в гели
называют тиксотропией.
Однако студни со временем меняют свои свойства, т.е. стареют.
Старение студня, связанное с разделением его на две фазы:
уплотнённый гель и разведённый золь, называют синерезисом.
Структурная сетка геля при этом стягивается и выжимает из себя
растворитель. У белков синерезис зависит от рН и активнее всего в ИЭТ.
39.
Биологическое значение процессовстарения студней
Биологическое значение процессов старения студней очень важно, так
как при этом происходит их уплотнение, что отражается на проницаемости
клеточных мембран и цитоплазмы.
Снижение проницаемости нарушает обмен веществ между клеткой и
окружающей средой.
Появление у тканей с увеличением возраста организма таких качеств,
как большая жесткость и меньшая эластичность, объясняется процессами
синерезиса и дегидратации.
40.
7. Коллоидно-осмотическое давление в растворах ВМС.Мембранное равновесие Доннана
Осмотическое давление, как свойство коллигативное, зависит от числа
частиц в единице объема системы. Осмотическое давление в растворах
коллоидов очень низкое, так как низкая концентрация частиц в растворе изза их большого размера в сравнении с молекулами.
Так, осмотическое давление 1% раствора сахарозы равно 79,46 кПа, а 1%
раствор золя сульфида мышьяка – 0,0034 кПа. Осмотическое давление в
растворах белков и других высокомолекулярных соединений значительно
выше, чем в коллоидах. Так, 1% раствор желатина имеет давление, равное
1,02 кПа. Для очень разбавленных растворов полимеров осмотическое
давление подчиняется уравнению Вант-Гоффа:
Р=СRT
41.
Онкотическое давлениеОсмотическое давление в растворах белков оказывает существенное
влияние на ряд процессов в организме.
Часть осмотического давления крови, обусловленная белками,
называется онкотическим давлением. Оно невелико и составляет 0,5%
( 3,5-3,9 кПа ) от общего осмотического давления крови.
Онкотическое
давление
играет
определённую
роль
в
жизнедеятельности организма. При отклонении его от нормы возникают
отёки.
При понижении белка в крови вследствие голодания или потери
белка с мочой при заболевании почек возникает разница онкотического
давления в крови и в соединительной ткани, вода из русла крови
попадает в соединительную ткань и образуются отеки.
42.
Равновесие ДоннанаИзучение осмотических свойств организма показало, что внутри клетки
осмотическое давление всегда выше, чем во внеклеточной жидкости.
Присутствие в организме солей белков, отделенных мембраной от
растворов электролитов, приводит к перераспределению электролитов и,
таким образом, влияет на осмотическое давление по обе стороны
мембраны.
Явление неравномерного распределения какого-нибудь электролита по
обе стороны полупроницаемой мембраны под влиянием коллоидного
электролита получило название мембранного равновесия Доннана.
43.
Мембранное равновесие ДоннанаРассмотрим основные положения теории мембранного равновесия.
Клеточная мембрана выполняет роль полупроницаемой мембраны – пропускает
ионы электролита, но задерживает коллоидные частицы - анионы R- (белки клетки).
Во внеклеточной жидкости по другую сторону мембраны находится электролит
NaCl, оба иона которого могут свободно проходить через мембрану. Состав растворов в
в начале процесса можно представить следующей схемой:
В этой схеме буквами С1 и С2 обозначены
начальные концентрации соответствующих
ионов
внутри
клетки
и
вне
ее
соответственно.
44.
Мембранное равновесие ДоннанаПо истечении некоторого промежутка времени ионы Na+ и Сl– начнут свободно
проходить в клетку, коллоидный анион-белок R– все время остается в клетке.
Перемещение ионов закончится установлением динамического равновесия, т. е.
количество ионов, переходящих в единицу времени в клетку и из нее, будет одинаково.
Обозначая через х количество ионов Na+ и Cl–, перешедших в клетку, состояние
равновесия по обе стороны мембраны можно представить следующим образом:
где х не равняется 1/2 С2, как этого следовало ожидать.
45.
Мембранное равновесие ДоннанаРаспределение хлорида натрия по обе стороны мембраны не будет равномерным.
Ионы, свободно диффундирующие через мембрану, должны распределиться так,
чтобы произведение концентраций их в обоих отсеках сосуда было одинаковым, т. е
Решая это уравнение относительно х, получим
46.
Мембранное равновесие Доннана1. Если до начала перераспределения Свн >> Скл, то в знаменателе
уравнения можно пренебречь слагаемым Скл. Тогда получим:
х = Свн/2 т.е. во внутрь клетки переходит половина ионов из внешней
среды.
2. Если до начала перераспределения Скл >> Свн, то числитель будет малой
величиной, а х ещё меньше. И в этом случае внутрь клетки перейдет какоето количество ионов, зависящее от соотношения Скл и Свн.
3. Если Скл = Свн, то уравнение имеет вид
х = Свн/3
В этом случае перейдет в клетку третья часть ионов из внешнего раствора.
47.
Мембранное равновесие ДоннанаТаким образом, внутри клетки количество ионов всегда больше, чем
снаружи. Этим объясняется повышенное осмотическое давление клетки по
сравнению с давлением окружающей клетки
жидкости. Это и
поддерживает тургор клеток.
Эффект Доннана (т.е. неравномерное распределение электролитов
между клетками и омывающей их жидкостью) оказывает большое влияние
на
жизнедеятельность
клеток,
на
величину
биопотенциалов,
распределение электролитов и пр. наряду с физиологическими
механизмами.












































 chemistry
chemistry








