Similar presentations:
Алюминий и его соединения
1.
17.02.20222.
Алюминий – самыйраспространенный в природе металл.
3.
Нахождение в природе4.
рубинГлинозём
сапфир
AL2O3
Корунд
Боксит
5.
Уральскийкорунд
Оксид алюминия применяется
в качестве катализатора, для
разделения веществ в
хроматографии.
Оксид алюминия в виде корунда
используется как абразивный
материал для обработки
металлических изделий.
6.
Применение сапфировзнаменитые сапфиры
английской королевской семьи
7.
Применение рубинов8.
Рубины и сапфирыв наше время
получают
искусственным
путем в
промышленных
Оксид алюминия в виде
масштабах.
рубина широко используется
в лазерной технике.
9.
Алюминий входит в состав глин, полевых шпатов, слюд.Важнейший минерал алюминия – боксит содержит 2860% глинозёма - оксида алюминия Al2O3 .
нефелин
боксит
10.
Алюминий ( лат. Aluminiumназвание образовано от лат. «Aluminis» – квасцы)-
химический элемент третьей группы
периодической системы Менделеева.
I. Положение алюминия в ПСХЭ
Д.И.Менделеева.
11.
Составьте схемустроения атома
алюминия.
•Определите какая
степень окисления
характерна для алюминия
в соединениях?
•Какие свойства
проявляет алюминий в
реакциях?
12.
II. Алюминий – простое вещество.Физические свойства.
Алюминий – серебристый металл,
его плотность – 2,7 г/ см3, tпл = 660 0C, tкип = 2350
0C. Алюминий обладает высокой
электропроводностью и теплопроводностью,
высокой отражающей способностью.
13.
14.
Холл Чарльз(1863 – 1914)
американский
инженер-химик
Будучи студентом Оберлинского колледжа,
он узнал, что можно разбогатеть и получить благодарность
человечества, если изобрести способ получения алюминия
в промышленных масштабах.
Как одержимый, Чарльз проводил эксперименты
по выработке алюминия путем электролиза криолитноглиноземного расплава.
23 февраля 1886 года спустя год после окончания колледжа
Чарльз получил с помощью электролиза первый алюминий.
15.
Поль Эру (1863-1914) –французский
инженер - химик
В 1889 году открыл алюминиевый
завод во Фроне (Франция), став его
директором, он сконструировал
электродуговую печь для выплавки
стали, названную его именем; он
разработал также
электролитический способ
получения алюминиевых сплавов
16.
I. Реакции с простыми веществами:17.
18.
I. Реакции с простыми веществами:а) с кислородом, образуя оксид алюминия:
Al + O2 = …..
б) с серой, образуя сульфид алюминия:
Al + S = ….
в) с азотом, образуя нитрид алюминия:
Al + N2 = …
г) с углеродом, образуя карбид алюминия:
Al + С = ….
д) с хлором, образуя хлорид алюминия:
Al + Cl2 = …..
19.
II. Реакции со сложными веществами:1. с
2. с
водой (после удаления защитной оксидной пленки)
Al + H2O = …..
растворами щелочей (с образов. алюминатов)
Al + NaOH + H2O =……
3.
c соляной и разбавленной серной кислотами:
Al + HCl = ……
Al + H2SO4 (разб) = ……..
4.
с оксидами менее активных металлов
(алюминотермия)
Al + Fe3O4 =…….
20.
III. Соединения алюминияОксид алюминия
(AL2O3)
Соединения алюминия
Гидроксид алюминия
AL(OH)3
21.
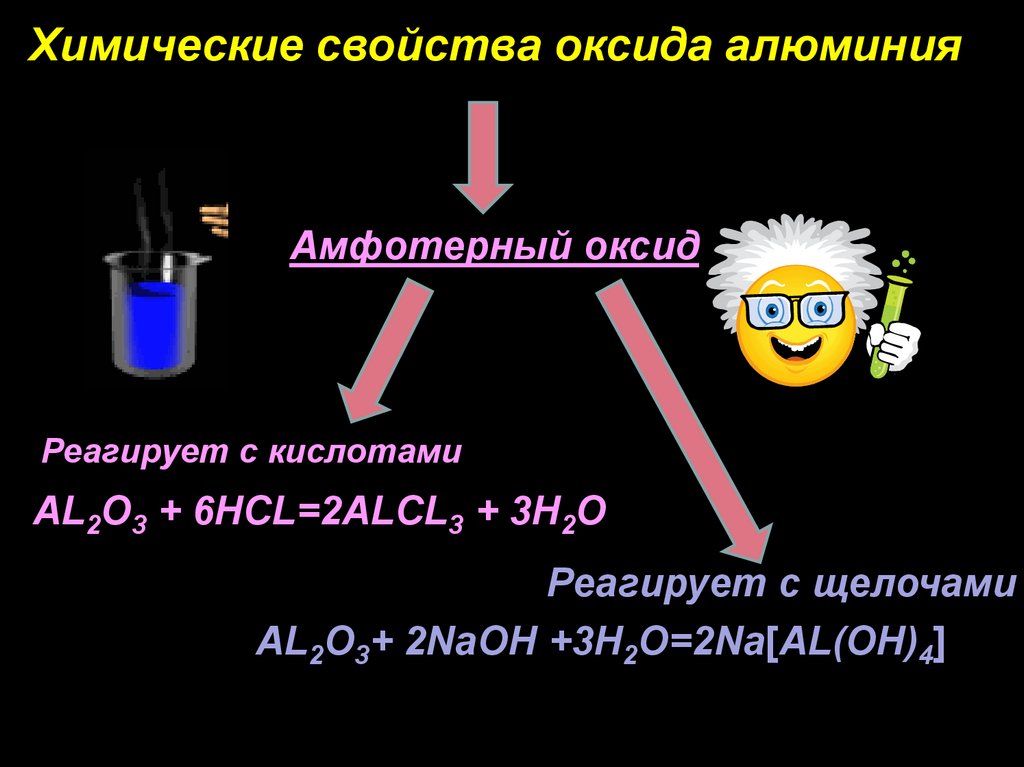
Химические свойства оксида алюминияАмфотерный оксид
Реагирует с кислотами
AL2O3 + 6HCL=2ALCL3 + 3H2O
Реагирует с щелочами
AL2O3+ 2NaOH +3H2O=2Na[AL(OH)4]
22.
Гидроксид алюминияAL(OH)3
23.
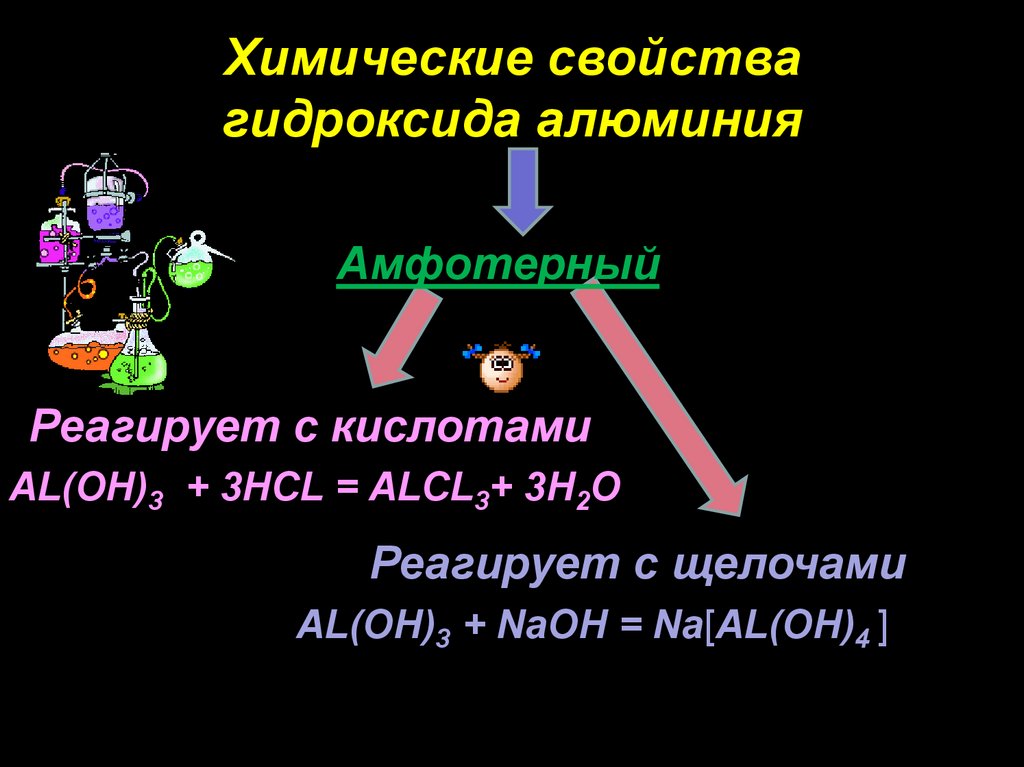
Химические свойствагидроксида алюминия
Амфотерный
Реагирует с кислотами
AL(OH)3 + 3HCL = ALCL3+ 3H2O
Реагирует с щелочами
AL(OH)3 + NaOH = Nа[AL(OH)4 ]
24.
Закончите уравнения реакций изапишите их в ионном виде:
1)
AL2O3+ NaOH + H2O = Na[AL(OH)4]
2)
Al2O3 + HCl = …..
3)
Al(OH)3 + HCl = …..
4)
Al(OH)3 + NaOH = Na[AL(OH)4]
25.
26.
Какие из соединений вступят в реакцию с алюминием:Cl2
K2O
CuSO4
H2O
S
BaSO4
HCL
Fe2O3
Cr
























 chemistry
chemistry








