Similar presentations:
Соединения галогенов
1.
Взаимодействие галогенов с водородомГалогеноводороды — бесцветные газы, с резким запахом,
токсичны.
Н2 + F2 = 2HF
H2 + Cl2 = 2HCl
H2 + Br2 = 2HBr
H2 + I2 = 2HI
2.
Галогеноводородные кислотыHF
фтороводородная (плавиковая) кислота
HCl
хлороводородная (соляная) кислота
HBr
бромоводородная кислота
HI
йодоводородная кислота
3.
Степень диссоциации, а, следовательно, и сила кислот,увеличиваются от плавиковой к йодоводородной.
4.
Получение хлороводородаВ промышленности:
H2 + Cl2 = 2HCl
В лаборатории:
NaCl + H2SO4 = NaHSO4 + HCl
5.
Соляная кислота — это бесцветнаяжидкость, которая дымится на воздухе.
Соляная кислота тяжелее воды.
6.
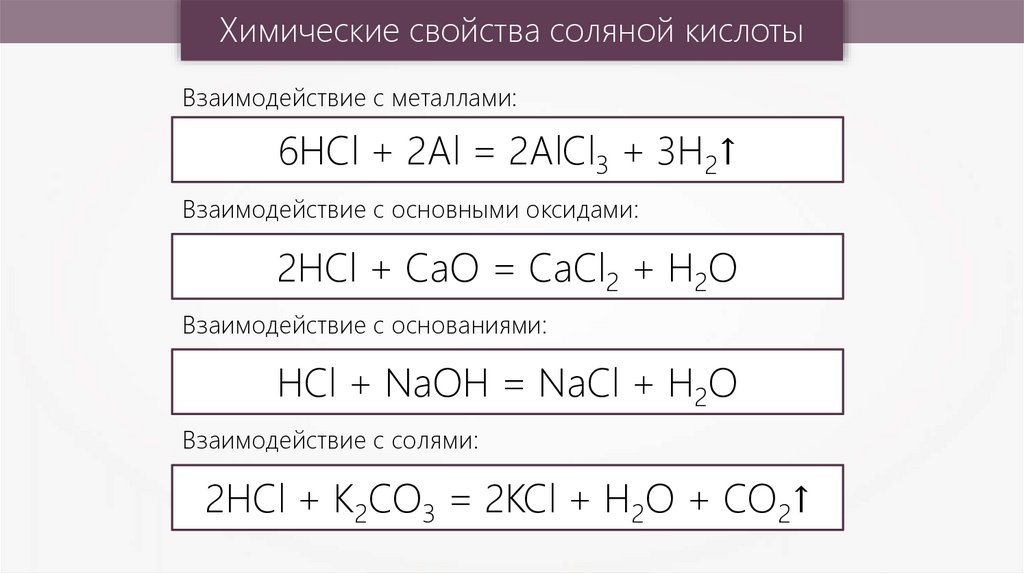
Химические свойства соляной кислотыВзаимодействие с металлами:
6HCl + 2Al = 2AlCl3 + 3H2↑
Взаимодействие с основными оксидами:
2HCl + CaO = CaCl2 + H2O
Взаимодействие с основаниями:
HCl + NaOH = NaCl + H2O
Взаимодействие с солями:
2HCl + K2CO3 = 2KCl + H2O + CO2↑
7.
Соляная кислота широко используется в практической деятельности человека:в химической, пищевой промышленности, в металлургии и медицине.
8.
Галогеноводородные кислотыобразуют соли: фториды, хлориды,
бромиды и йодиды. Большинство
таких солей хорошо растворимы
в воде.
9.
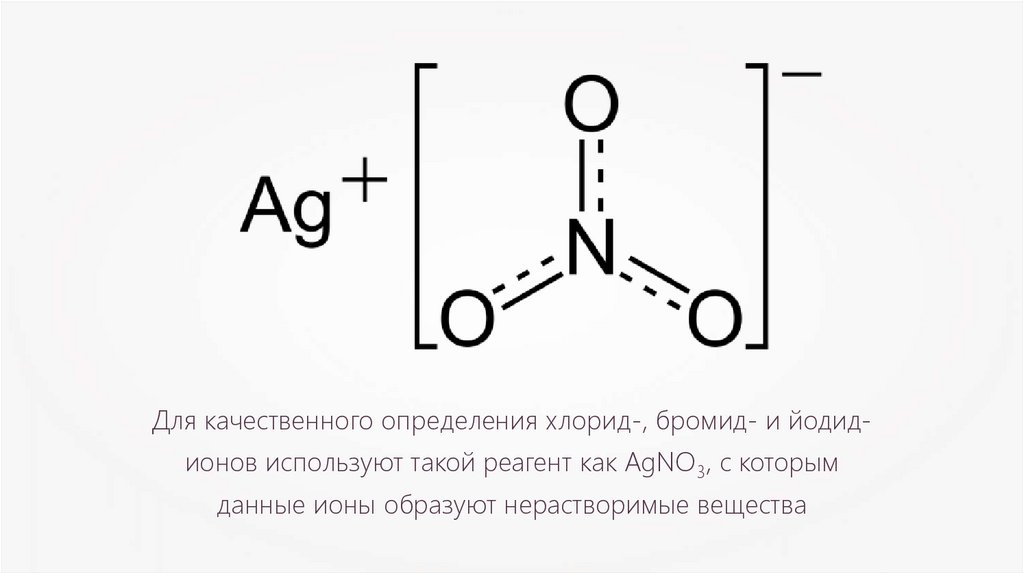
Для качественного определения хлорид-, бромид- и йодидионов используют такой реагент как AgNO3, с которымданные ионы образуют нерастворимые вещества
10.
При взаимодействии хлоридов (и самой соляной кислоты)с нитратом серебра образуется белый творожистый осадок
хлорида серебра.
Ag+ + Cl- = AgCl↓
При взаимодействии бромоводородной кислоты и её
солями и йодоводородной кислоты и её солями с нитратом
серебра также образуются осадки, но только жёлтого цвета,
которые различаются оттенками.
Ag+ + Br- = AgBr↓
11.
Для определения ионов фтора чаще всего используютрастворимые соли кальция, в результате реакции
образуется нерастворимое вещество фторид кальция:
Ca2+ + 2F- = CaF2↓
Взаимодействие фтороводородной кислоты с оксидом
кремния:
SiO2+4HF = SiF4↑ + 2H2O
12.
Ввиду большой реакционнойспособности галогенов в природе
они встречаются исключительно
в виде соединений.
13.
Самыми распространёнными среди галогенов являются хлор,который составляет 0,19% от массы земной коры, и фтор — 0,03%.
14.
Хлор чаще всего встречается в виде соединений в составе минералов:галита (каменная или поваренная соль), сильвина, сильвинита и карналлита.
15.
Природные минералы фтора — флюорит (плавиковый шпат), криолит, фторопатит и др.16.
Соединения брома и йода по большей части концентрируютсяв морских и подземных водах, накапливаются в морских водорослях.












 chemistry
chemistry








