Similar presentations:
Связь между строением и свойствами материалов. Лекция 1
1.
МАТЕРИАЛОВЕДЕНИЕКУРС ЛЕКЦИЙ
«Металлы суть светлые тела, которые ковать можно.»
М.В. Ломоносов
2.
ЛЕКЦИЯ 1. СВЯЗЬ МЕЖДУСТРОЕНИЕМ И СВОЙСТВАМИ
МАТЕРИАЛОВ
3.
4.
ЛомоносовМ.В.(17111765г.) теоретические
обобщения в
области
металлургии
П.П. Аносов (17971851г.) впервые
применили
микроскоп для
исследования и
установил
зависимость
свойств сплавов
от структуры
Д.К.Чернов (18391921г.) установил
критические
точки стали и
признан всеми
металлургами
«отцом
металлографии»
5.
МАТЕРИАЛЫ В ИСТОРИИЧЕЛОВЕЧЕСТВА
• Каменный век
• Бронзовый век
• Железный век
6.
Материаловедение– наука,
изучающая связь между химическим
составом, структурой и свойствами
материалов и изменение этих свойств
при различных воздействиях на
материал.
С↔С↔С
7.
Взаимосвязь между структурой исвойствами
• Монокристалл
Al2O3 прозрачен.
• Плотный поликристалл Al2O3
полупрозрачен.
• Пористый поликристалл Al2O3
совершенно
непрозрачен.
8.
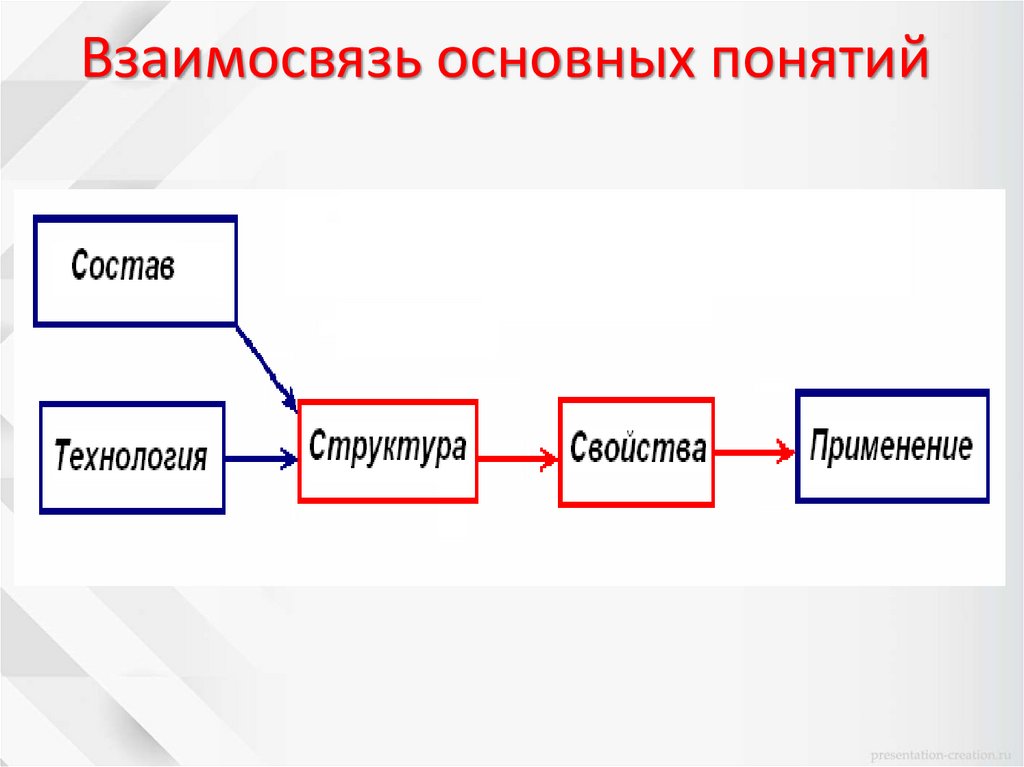
Взаимосвязь основных понятий9.
ВСЕ МАТЕРИАЛЫ ДЕЛЯТСЯ НА:1.Металлы и сплавы;
2.Не металлические материалы;
3.Композиты;
4.Минерал-силикаты.
10.
Основные направленияОсновными направлениями в
развитии металловедения является
разработка способов производства чистых
и сверхчистых металлов, свойства которых
сильно отличаются от свойств металлов
технической чистоты, с которыми
преимущественно работают.
11.
Генеральная задачаГенеральной задачей материаловедения
является создание материалов с заранее
рассчитаными свойствами применительно к
заданным параметрам и условиям работы.
Большое внимание уделяется изучению металлов
в экстремальных условиях (низкие и высокие
температуры и давление).
12.
CХЕМАТИЧЕСКАЯ МОДЕЛЬ РАСПОЛОЖЕНИЯЧАСТИЦ В ВЕЩЕСТВЕ
газы не имеют постоянных объема и формы при
постоянной температуре;
жидкости имеют постоянный объем, но форма
зависит от сосуда;
твердые вещества имеют постоянную форму и
объем.
13.
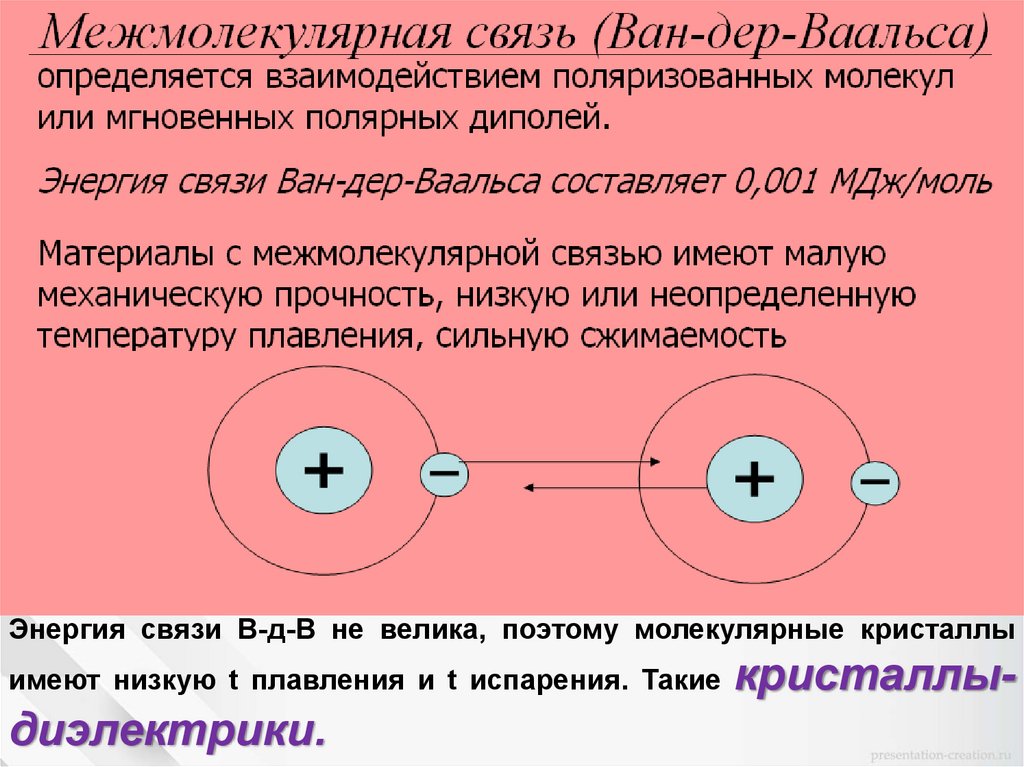
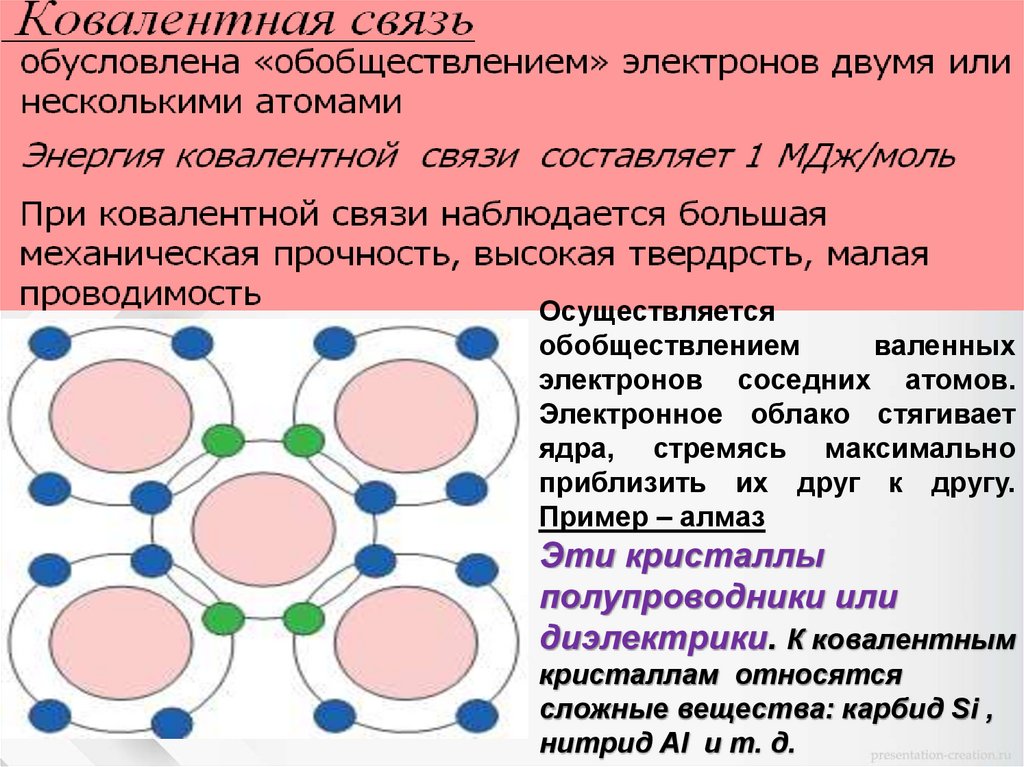
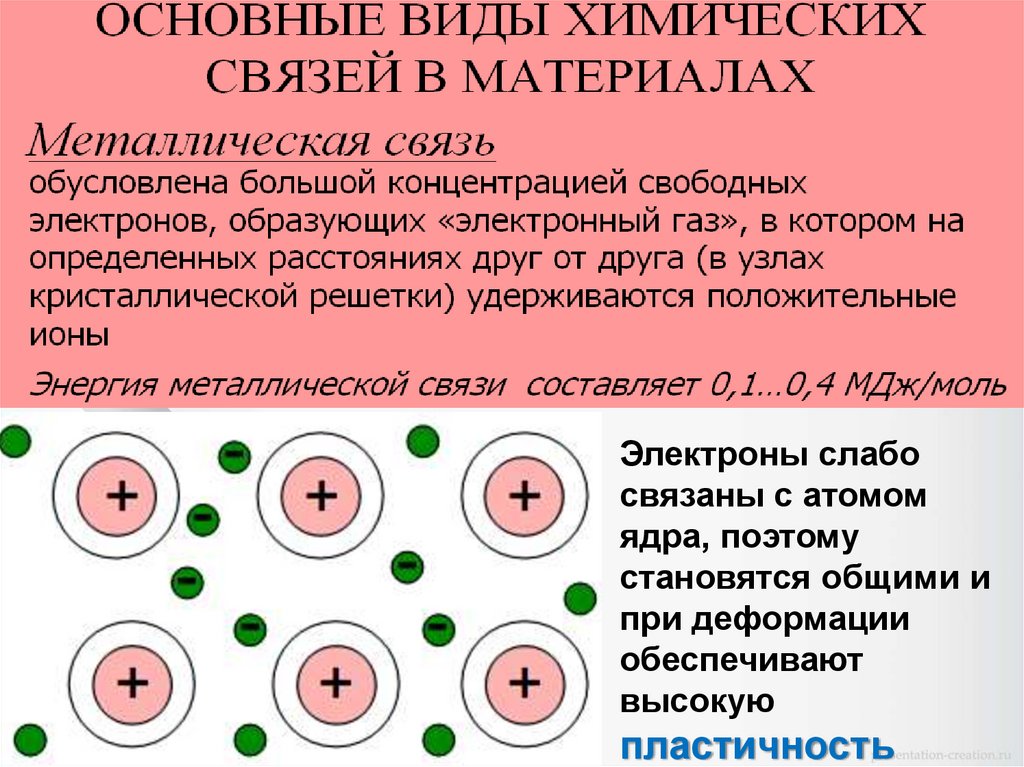
Типы межатомных связей в кристаллах1. Молекулярная связь.
2. Ионная связь.
3. Ковалентная связь.
4. Металлическая связь.
14.
Энергия связи В-д-В не велика, поэтому молекулярные кристаллыимеют низкую t плавления и t испарения. Такие
диэлектрики.
кристаллы-
15.
Атом Na имеет один «лишний» валентныйэлектрон. Атому Cl, имеющему 7 валентных
электронов для образования устойчивой
оболочки не хватает одного. Атом Na отдает
свой электрон Cl, в результате образуется
положительный ион Na+ и отрицательный Cl-,
которые притягиваются создают ионную
связь.
Энергия связи велика высокие t пл. и t исп.,
высокие
модуль
упругости
и
низкие
коэффициенты
сжимаемости
и
линейного
Диэлектрики (соли,
окислы) или полупроводники.
расширения.
16.
Осуществляетсяобобществлением
валенных
электронов соседних атомов.
Электронное облако стягивает
ядра, стремясь максимально
приблизить их друг к другу.
Пример – алмаз
Эти кристаллы
полупроводники или
диэлектрики. К ковалентным
кристаллам относятся
сложные вещества: карбид Si ,
нитрид Аl и т. д.
17.
Электроны слабосвязаны с атомом
ядра, поэтому
становятся общими и
при деформации
обеспечивают
высокую
пластичность
18.
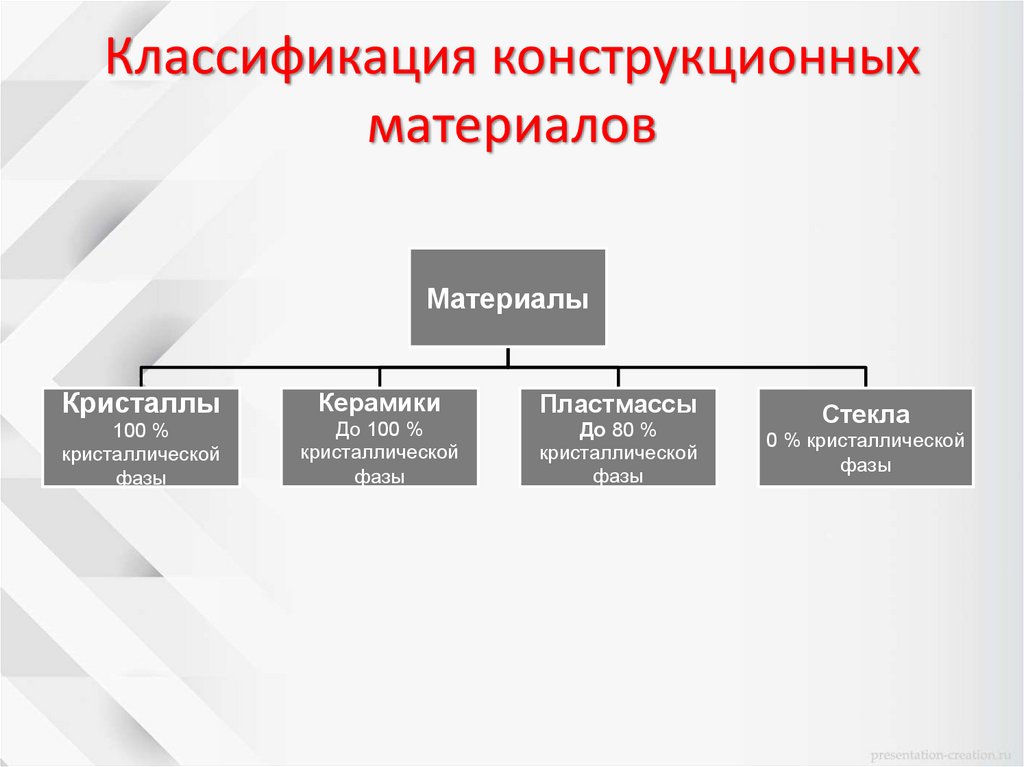
Классификация конструкционныхматериалов
Материалы
Кристаллы
100 %
кристаллической
фазы
Керамики
До 100 %
кристаллической
фазы
Пластмассы
До 80 %
кристаллической
фазы
Стекла
0 % кристаллической
фазы
19.
ВИДЫ И СТРОЕНИЯ ТВЕРДЫХ ТЕЛ20.
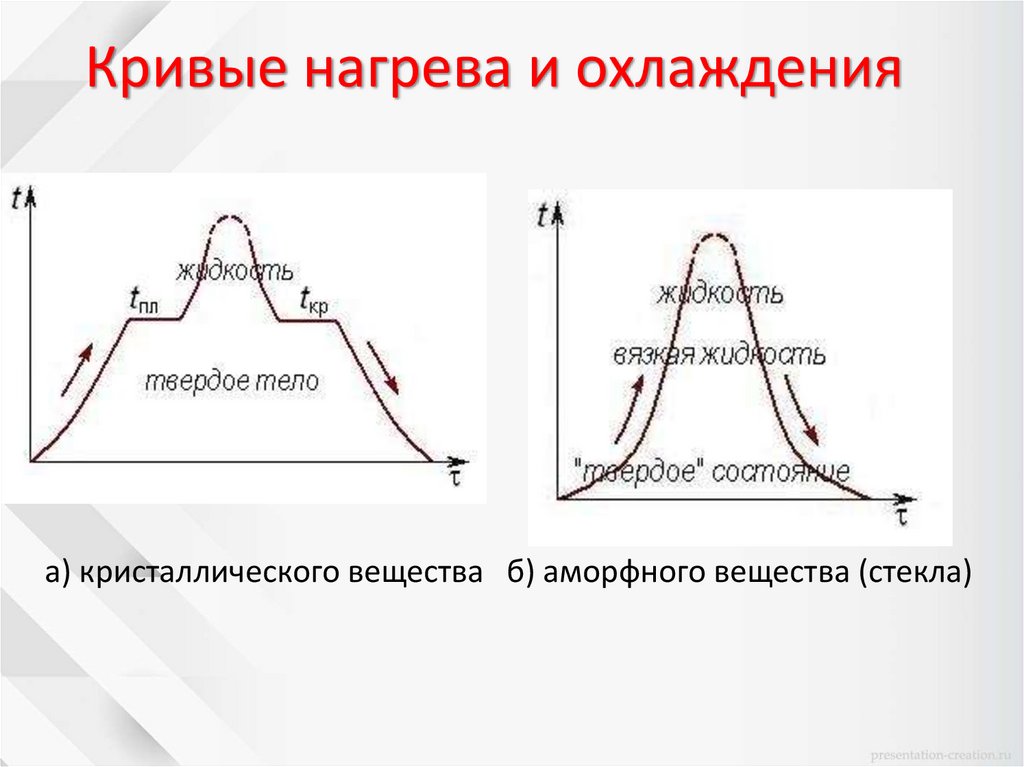
Кривые нагрева и охлажденияа) кристаллического вещества б) аморфного вещества (стекла)
21.
Аморфные тела22.
Аморфные тела• Примером аморфных тел могут
служить куски затвердевшей
смолы- янтарь, изделия из стекла.
• Аморфные тела изотропны, т. е.
их физические свойства
одинаковы по всем направлениям.
23.
24.
Металлы, особенности атомнокристаллического строенияМеталлы – один из классов
конструкционных материалов,
характеризующийся
определённым набором
свойств.
25.
Признаки металловПластичность
Электропроводность
Теплопроводность
Металлический блеск
26.
КРИСТАЛЛИЧЕСКИЕ ВЕЩЕСТВАКристаллы - трехмерные
образования,
характеризующиеся строгой
повторяемостью одного и того
же элемента структуры
(элементарной ячейки) во всех
направлениях.
27.
Кристаллическое строение металловМеталлические изделия являются поликристаллами
28.
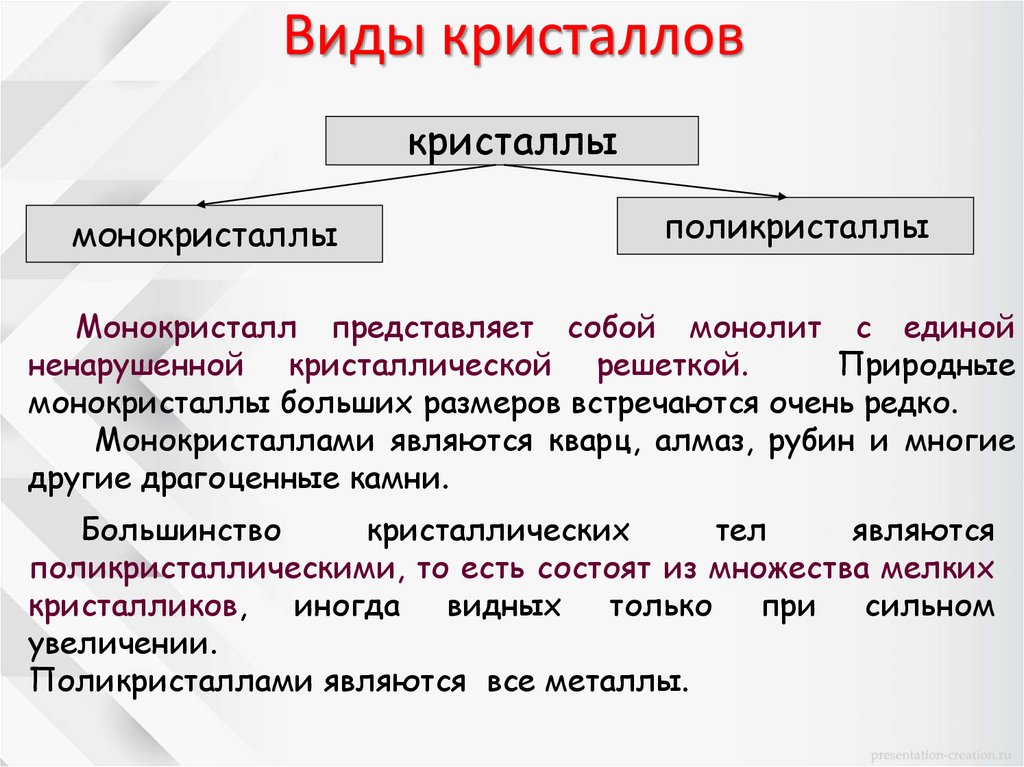
Виды кристалловкристаллы
монокристаллы
поликристаллы
Монокристалл представляет собой монолит с единой
ненарушенной кристаллической решеткой.
Природные
монокристаллы больших размеров встречаются очень редко.
Монокристаллами являются кварц, алмаз, рубин и многие
другие драгоценные камни.
Большинство
кристаллических
тел
являются
поликристаллическими, то есть состоят из множества мелких
кристалликов,
иногда
видных
только
при
сильном
увеличении.
Поликристаллами являются все металлы.
29.
Монокристаллы30.
Монокристаллы• К монокристаллам относятся
природные кристаллы (кварц,
алмаз, турмалин), крупинки соли,
сахара, соды.
31.
Поликристаллы32.
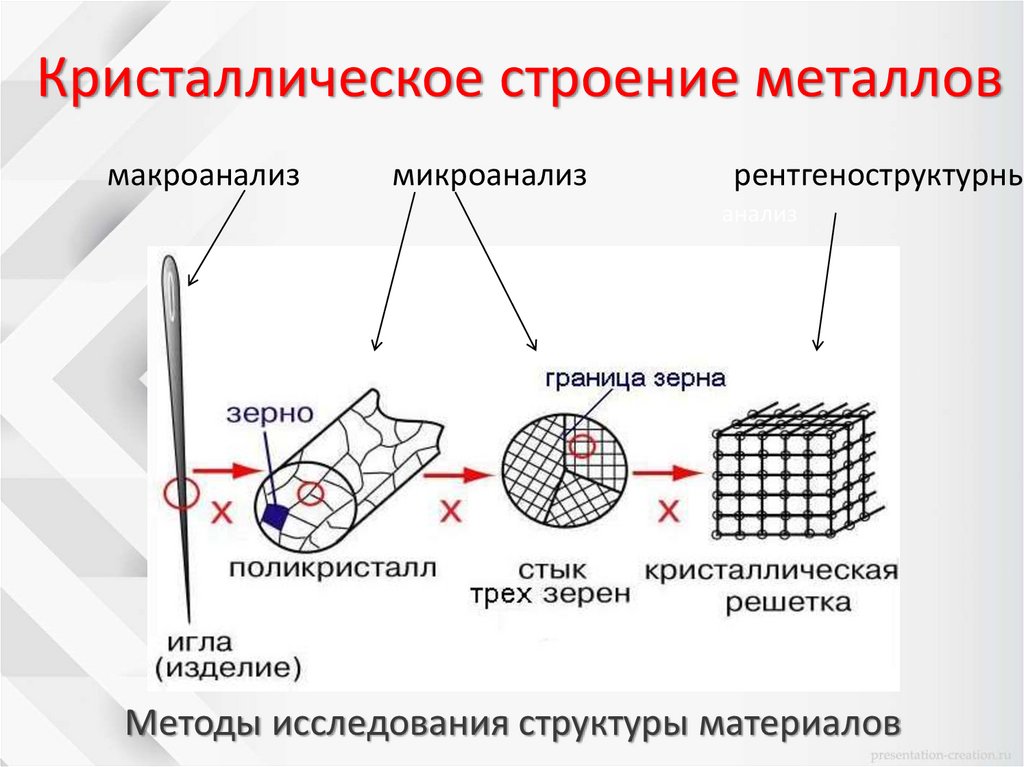
Кристаллическое строение металловмакроанализ
микроанализ
рентгеноструктурны
анализ
Методы исследования структуры материалов
33.
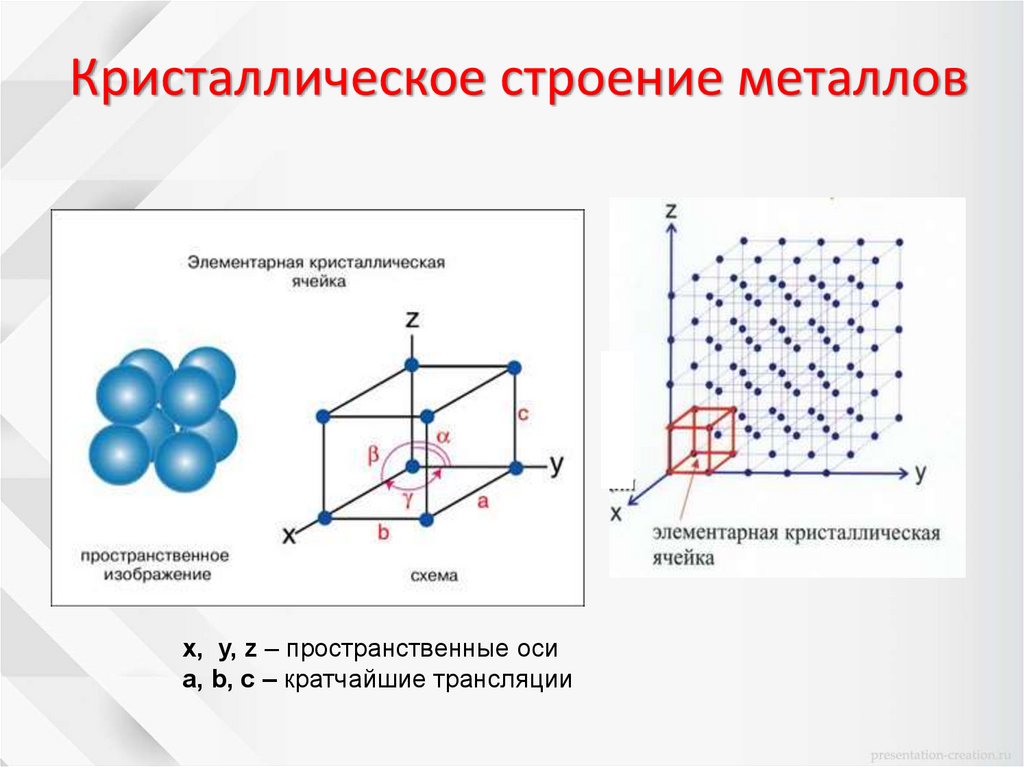
Кристаллическое строение металловх, у, z – пространственные оси
a, b, c – кратчайшие трансляции
34.
• аквамарин35.
Основные характеристики кристаллической решетки1. Важнейшей характеристикой кристаллической
решётки является а – величина ребра.
2. Кратчайшее расстояние между частицами в ячейке – d.
3. Координационное число – k – число одинаковых
частиц, расположенных на кратчайшем расстоянии от
данной частицы.
4. Число частиц, необходимое для построения
элементарной ячейки – n.
5. Эффективный (кажущийся) радиус rэф=d/2.
6. коэффициент компактности ρ, равный доле объема
ячейки, занятой атомами.
36.
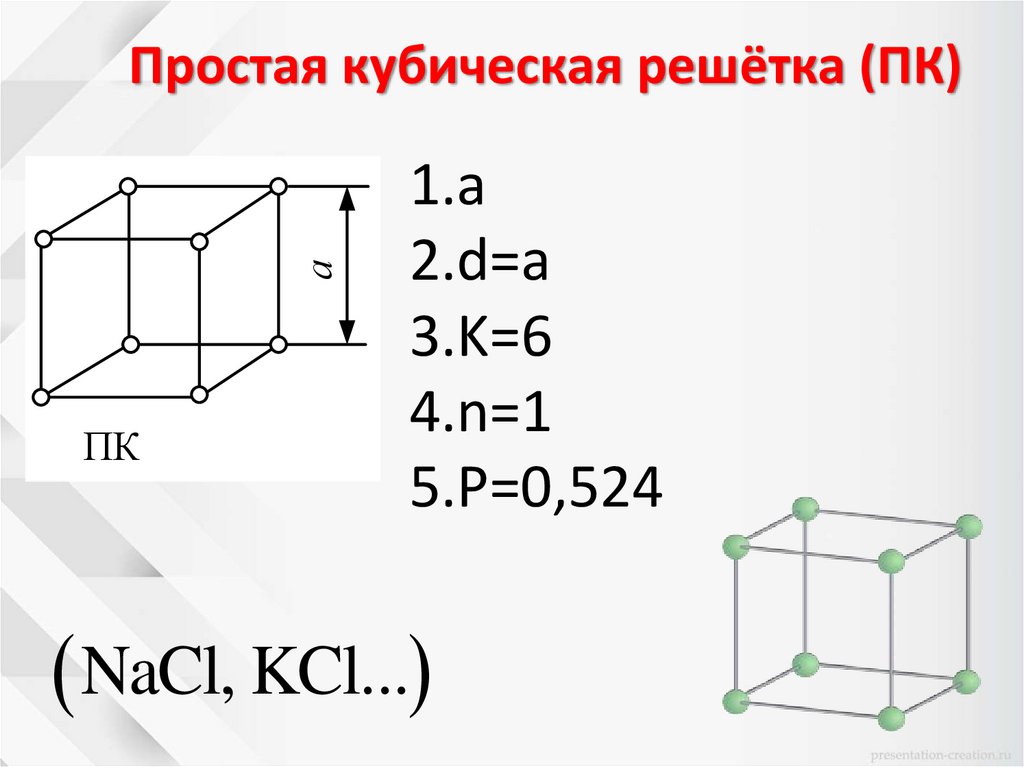
аПростая кубическая решётка (ПК)
ПК
1.a
2.d=a
3.K=6
4.n=1
5.Ρ=0,524
NaCl, KCl...
37.
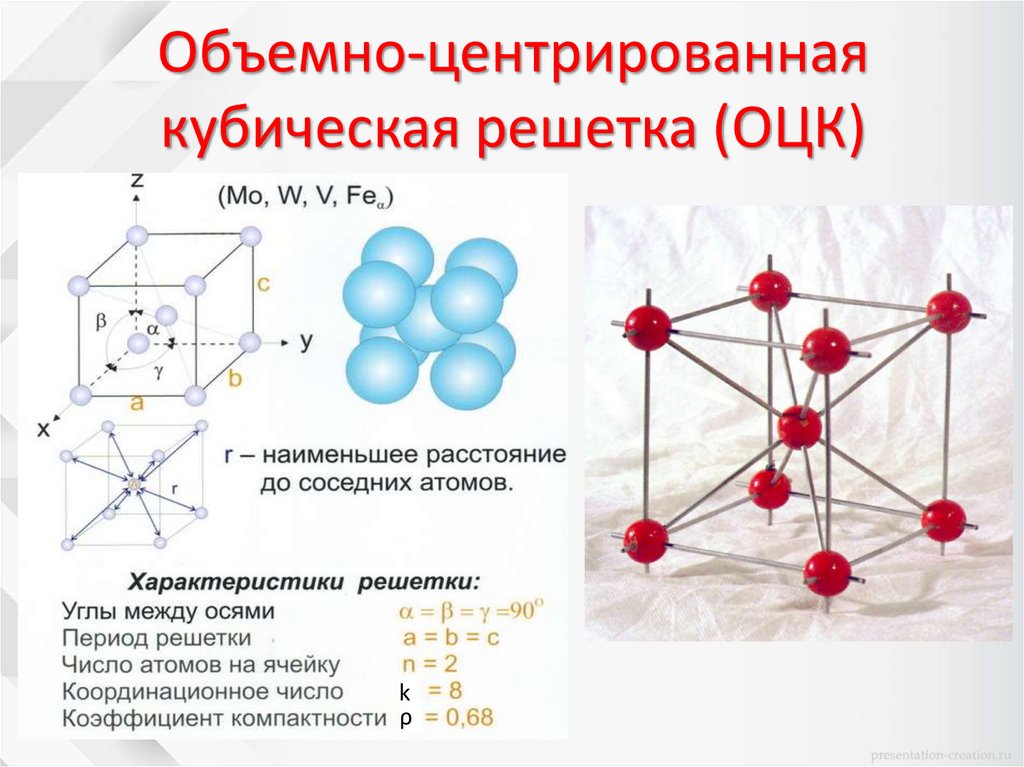
Объемно-центрированнаякубическая решетка (ОЦК)
k
ρ
38.
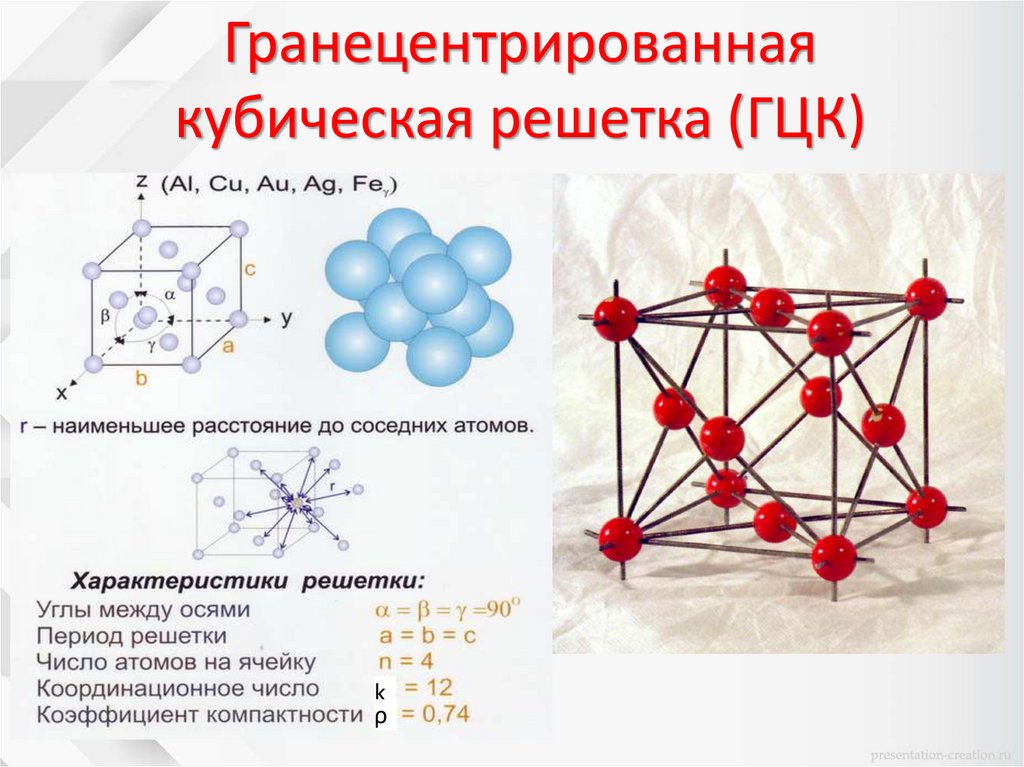
Гранецентрированнаякубическая решетка (ГЦК)
k
ρ
39.
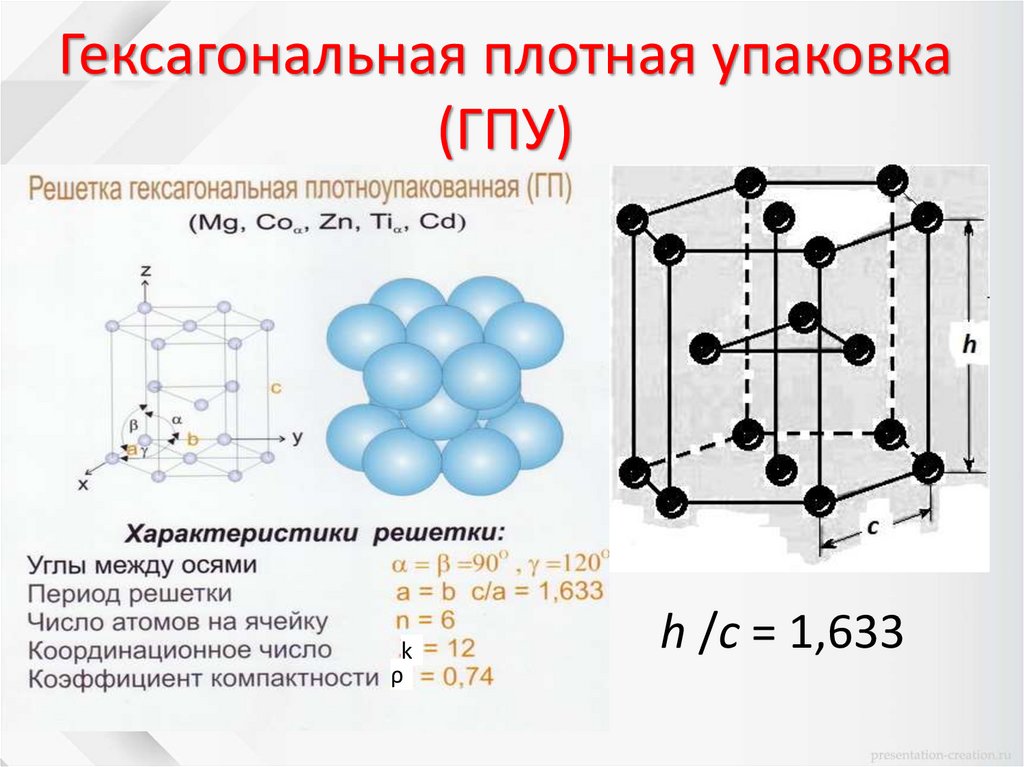
Гексагональная плотная упаковка(ГПУ)
k
ρ
h /c = 1,633
40.
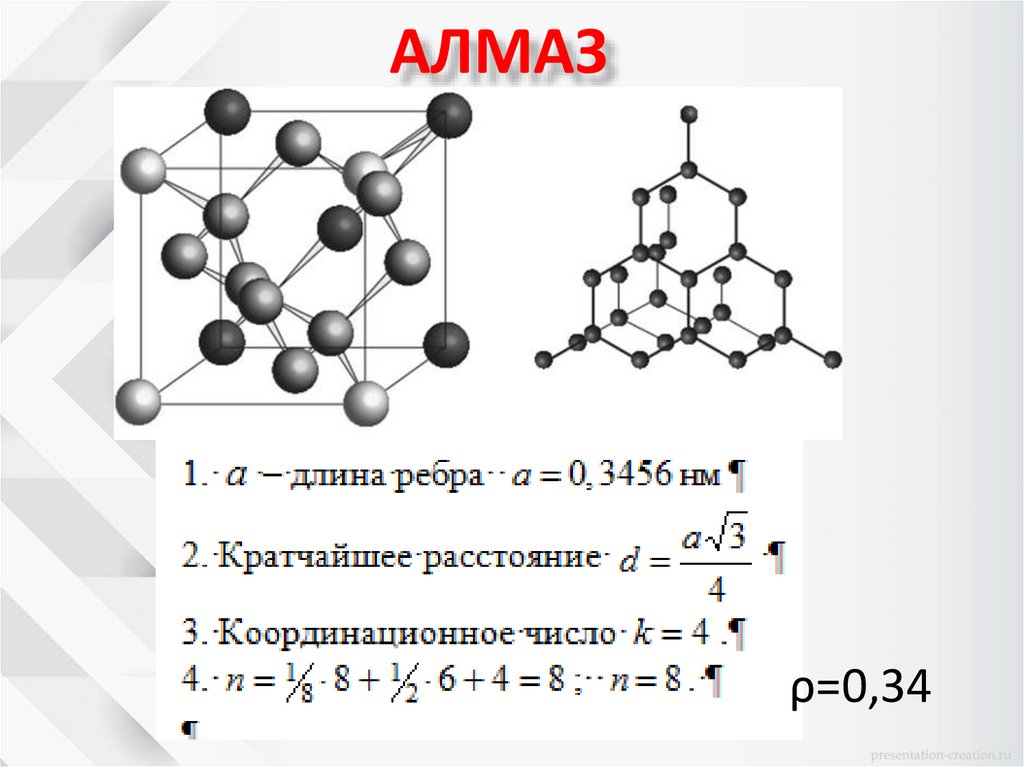
АЛМАЗρ=0,34
41.
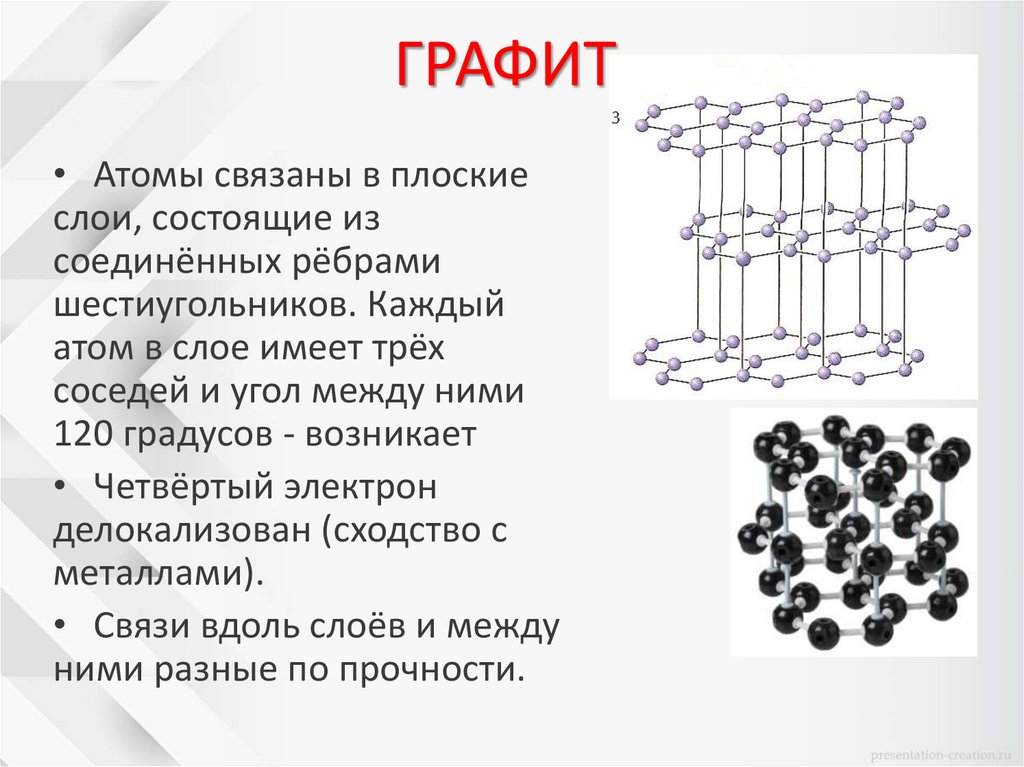
ГРАФИТ• Атомы связаны в плоские
слои, состоящие из
соединённых рёбрами
шестиугольников. Каждый
атом в слое имеет трёх
соседей и угол между ними
120 градусов - возникает
• Четвёртый электрон
делокализован (сходство с
металлами).
• Связи вдоль слоёв и между
ними разные по прочности.
42.
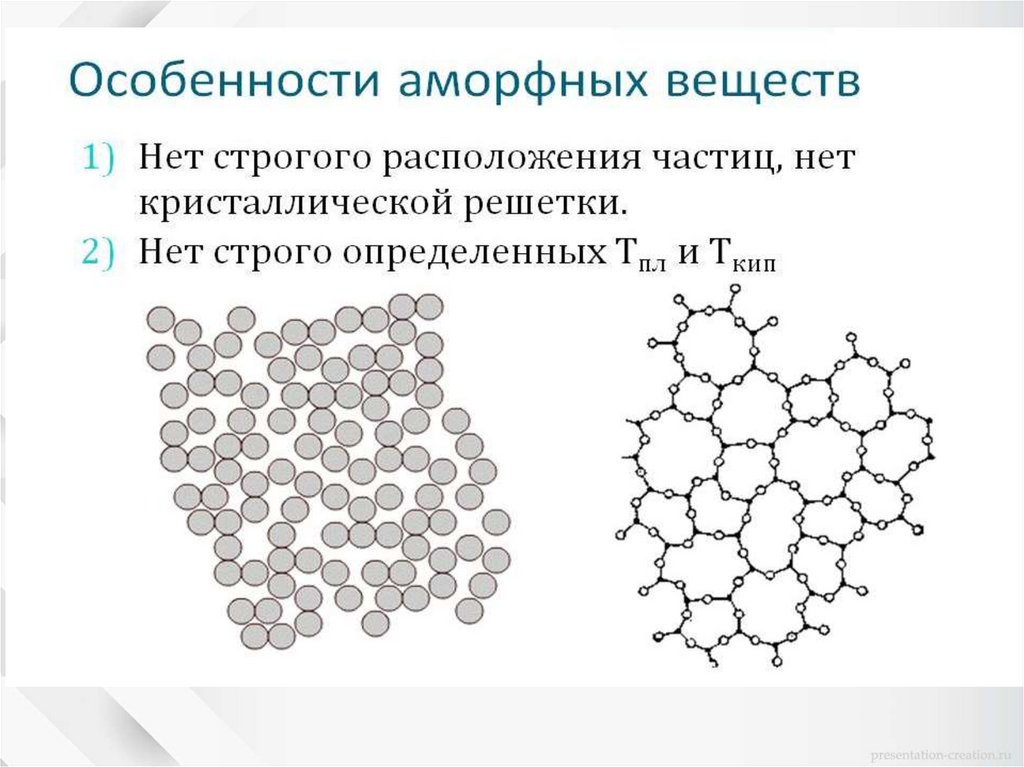
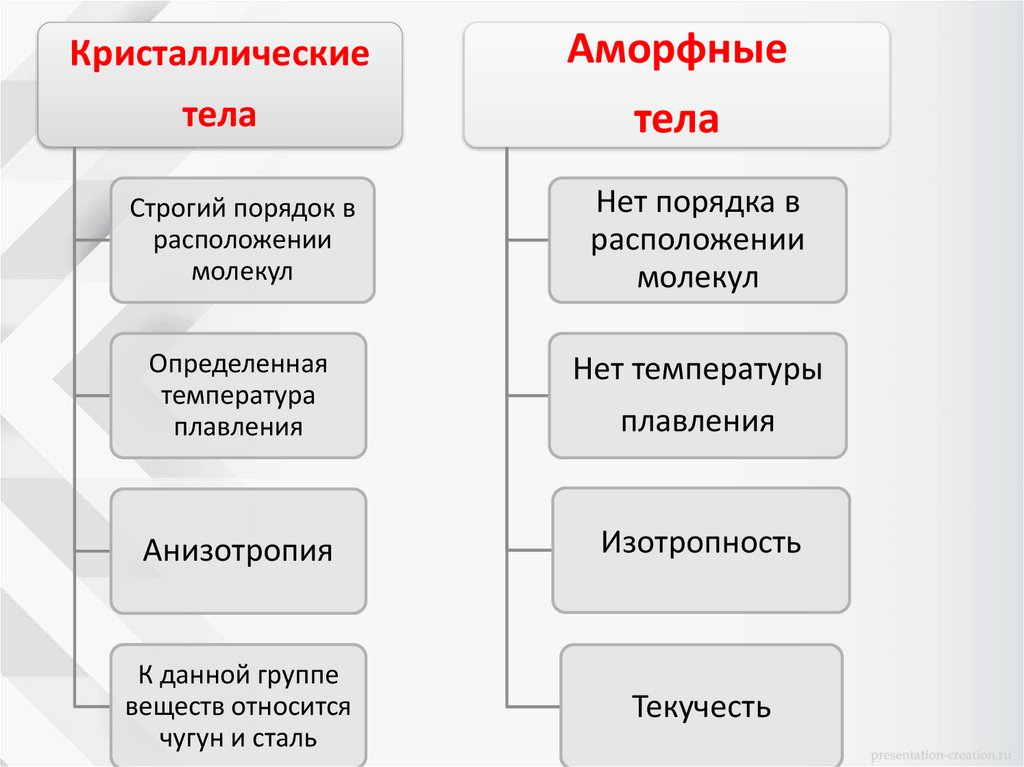
КристаллическиеАморфные
тела
тела
Строгий порядок в
расположении
молекул
Нет порядка в
расположении
молекул
Определенная
температура
плавления
Нет температуры
Анизотропия
Изотропность
К данной группе
веществ относится
чугун и сталь
Текучесть
плавления
43.
НИТЕВИДНЫЕ КРИСТАЛЛЫНитевидные кристаллы (или «усы») — это
монокристаллы в форме иголок и волокон, имеющие
диаметр от нескольких мкм и большое отношение
длины к диаметру обычно более 100.
Наиболее важное свойство нитевидных кристаллов
уникально высокая прочность, в несколько раз превосходящая
прочность массивных моно- и поликристаллов
Известно несколько методов получения таких структур:
• физическое испарение с последующей конденсацией,
• осаждение из газовой фазы при участии химических
реакций,
• кристаллизация из растворов,
• направленная кристаллизация эвтектических сплавов,
• выращивание на пористых мембранах и др.
44.
Изоморфизм и полиморфизмИзоморфизм заключается в
способности атомов, ионов
или молекул замещать друг
друга в кристаллических
структурах.
Например: попарно являются
изоморфными Si и Ge, Au и Ag.
45.
Изоморфизм и полиморфизмПолиморфизм - способность
твердых веществ и жидких
кристаллов существовать в двух
или нескольких формах с различной
кристаллической структурой и
свойствами при одном и том же
химическом составе.
46.
Сущность полиморфизма• Многие металлы в зависимости от температуры
могут существовать в разных кристаллических
формах или, как их называют, в разных
полиморфных модификациях.
• В результате полиморфного превращения атомы
кристаллического тела, имеющие решетку одного
типа, перестраиваются таким образом, что
образуется кристаллическая решетка другого типа.
• Полиморфную модификацию, устойчивую при
более низкой температуре, для большинства
металлов принято обозначать α, при более высокой
– β, затем γ и т.д.
47.
Основное свойство кристалловОсновным свойством кристаллических
тел является зависимость физических
свойств кристалла от направления.
Это свойство называется
анизотропия.
(Зависимость свойств от направления называется
анизотропией.)
Например, неодинаковая прочность
кристаллов по различным направлениям.
48.
Изотропия и анизотропияВ аморфных телах с хаотическим расположением
атомов в пространстве расстояния между атомами в
различных направлениях равны, следовательно,
свойства будут одинаковые, то есть аморфные тела
изотропны.
В кристаллических телах атомы правильно
располагаются в пространстве, причем по разным
направлениям расстояния между атомами
неодинаковы, что предопределяет существенные
различия в силах взаимодействия между ними и, в
конечном результате, разные свойства. Зависимость
свойств от направления и есть анизотропия.
49.
КвазиизотропияКвазиизотропия – явление, при
котором свойства поликристаллов
одинаковы во всех направлениях, хотя
свойства каждого кристалла, который
составляет данный поликристалл,
зависят от направления.
Кваиизотропность сохраняется в
литом состоянии, при обработке
давлением (прокатке, ковке).
50.
Параметры граниZ
Z
X
X
Y
Y
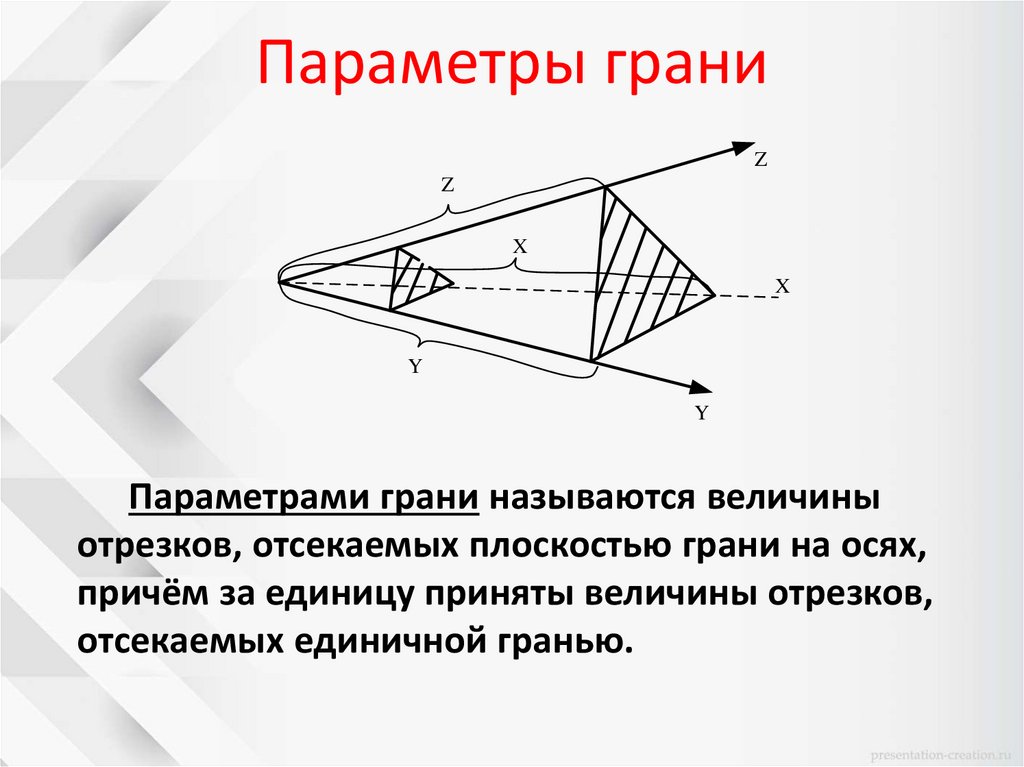
Параметрами грани называются величины
отрезков, отсекаемых плоскостью грани на осях,
причём за единицу приняты величины отрезков,
отсекаемых единичной гранью.
51.
Индексы граниИндексы грани – это величины, обратно
пропорциональные параметрам грани x, y, z
Следовательно, если плоскость
отсекает на осях отрезки x, y, z, то
вместо отношения отрезков x : y : z
берут отношение:
1/x : 1/y : 1/z = h : k : ℓ.
52.
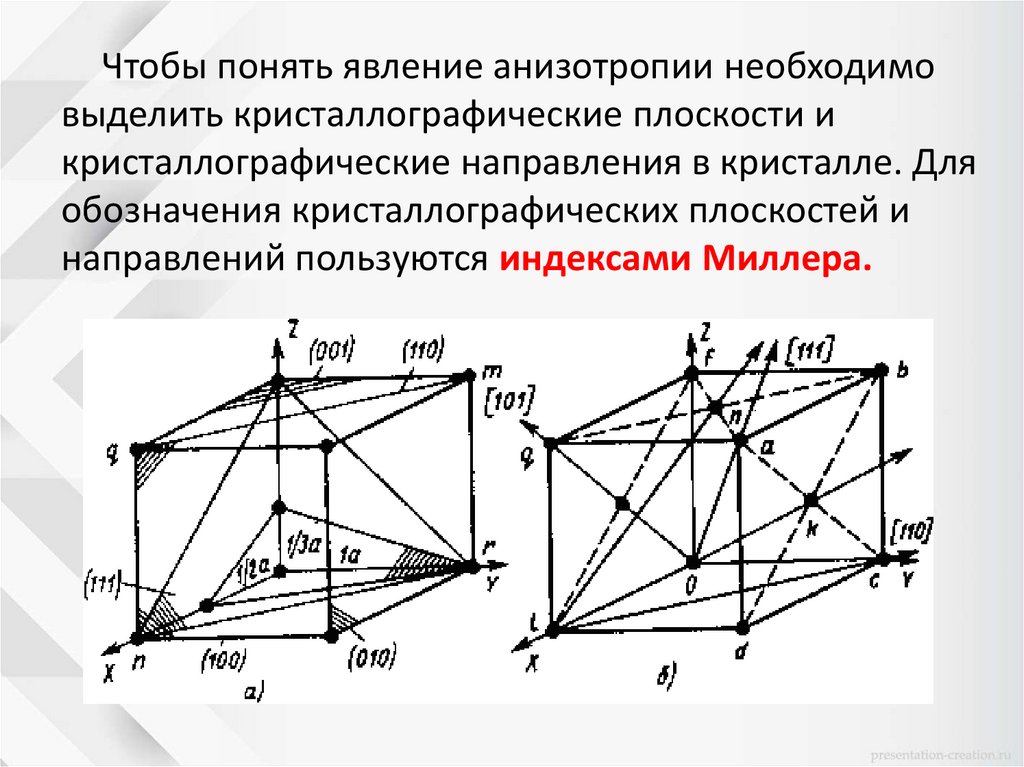
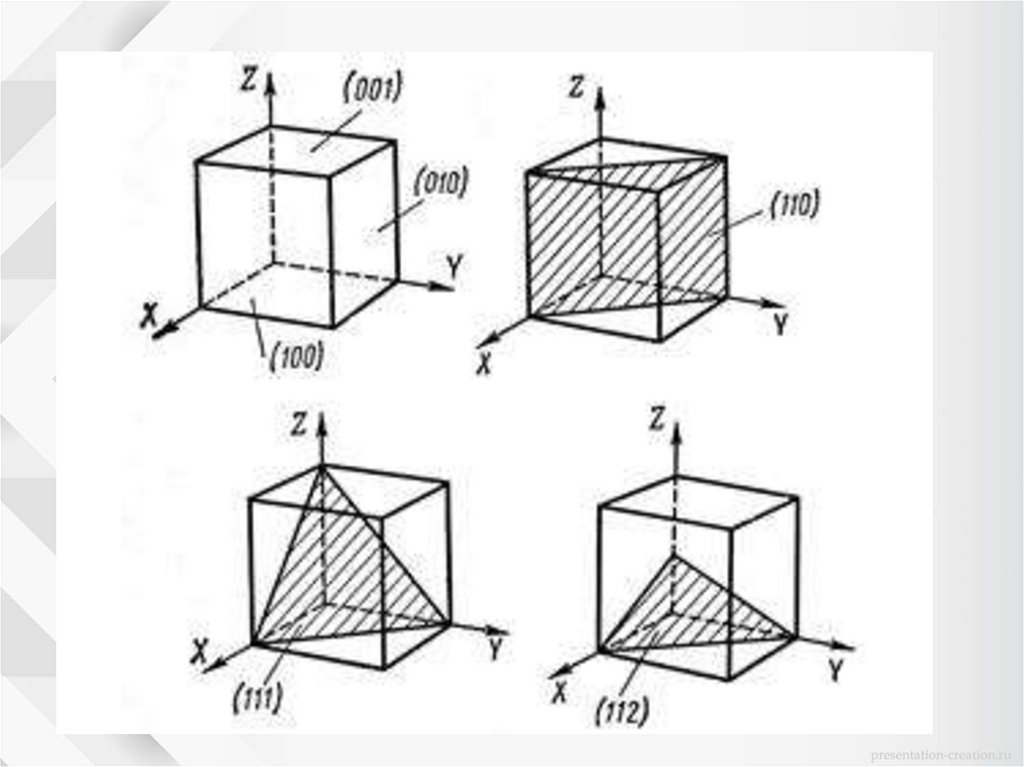
Чтобы понять явление анизотропии необходимовыделить кристаллографические плоскости и
кристаллографические направления в кристалле. Для
обозначения кристаллографических плоскостей и
направлений пользуются индексами Миллера.
53.
1. Если плоскость параллельна оси, тоточка пересечения плоскости с осью
находится в бесконечности.
Обратное значение: 1/∞=0.
2. Символ h k l обозначает семейство
всех равнозначных кристаллографических
плоскостей.
3. Символ h k l — направление в решетке.
4. Символ [[h k l]] – обозначает узел.
5. Если плоскость пересекает ось в области отрицательных значений
координат, то соответствующий индекс будет отрицательным и знак минус
ставится над индексом
1; 2;1
54.
55.
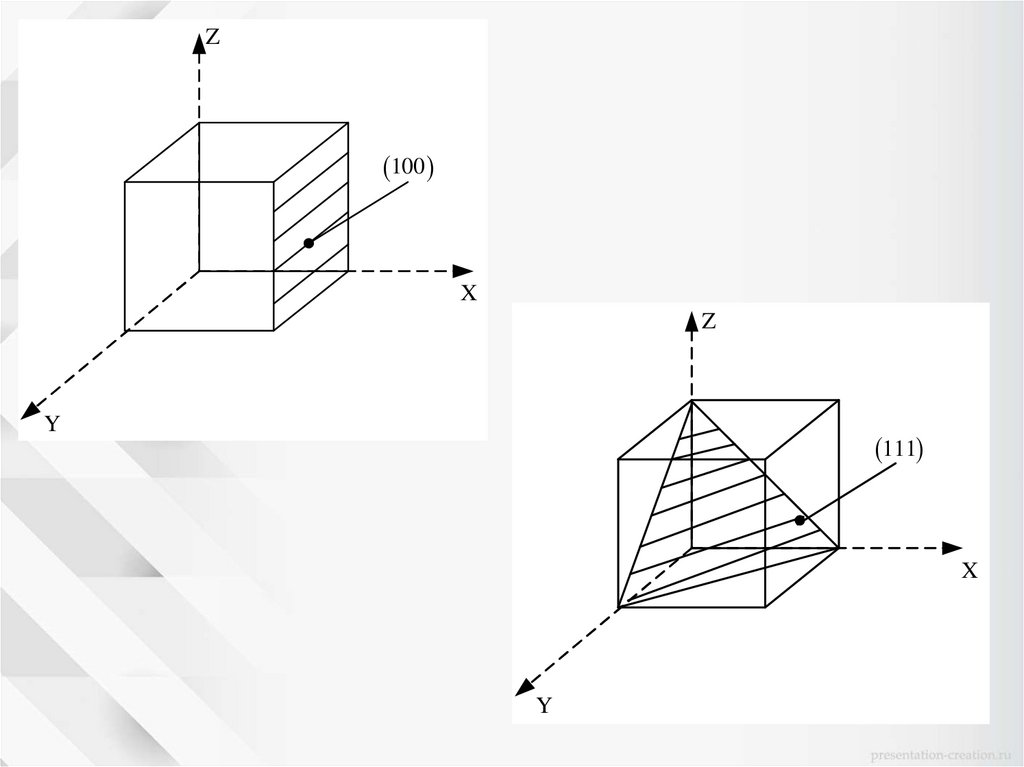
Z100
X
Z
Y
111
X
Y

































 chemistry
chemistry








