Similar presentations:
Атмосфера
1.
ЛекцияАтмосфера
2.
Строение атмосферы.Озоновый слой
3.
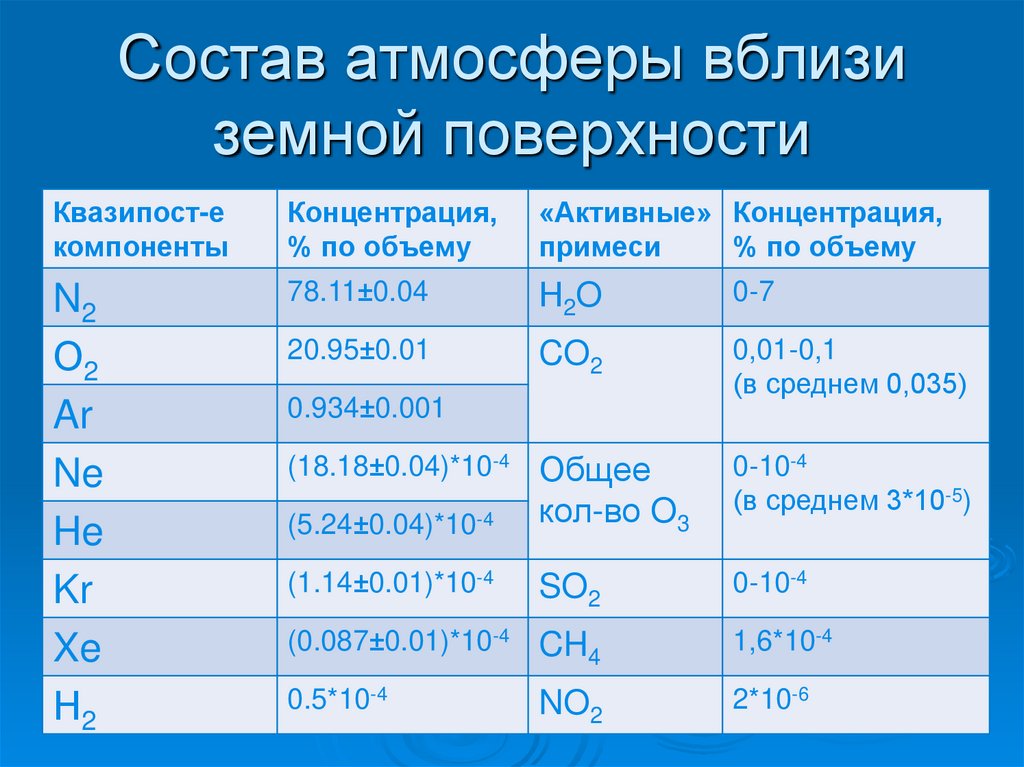
Состав атмосферы вблизиземной поверхности
Квазипост-е
компоненты
Концентрация,
% по объему
«Активные» Концентрация,
примеси
% по объему
N2
О2
Ar
Ne
He
Kr
Xe
Н2
78.11±0.04
Н2O
0-7
20.95±0.01
CO2
0,01-0,1
(в среднем 0,035)
(5.24±0.04)*10-4
Общее
кол-во O3
0-10-4
(в среднем 3*10-5)
(1.14±0.01)*10-4
SO2
0-10-4
(0.087±0.01)*10-4
CH4
1,6*10-4
0.5*10-4
NO2
2*10-6
0.934±0.001
(18.18±0.04)*10-4
4.
Состав атмосферы планетСолнечной системы
Содержание
газов в
атмосфере,
%
Марс
Венера
Земля без
жизни
Земля
Двуокись
углерода
95
98
98
0,03
Азот
2,7
1,9
1,9
79
Кислород
0,13
следы
следы
21
-53
477
290
13
Температура
поверхности,
°С
5.
Строение атмосферы6.
7.
Основная масса озона сосредоточенав слое 15 - 55 км
с максимумом концентрации в слое
20 - 25 км
Даже в самом озоновом слое только одна
молекула из 100 000 является молекулой
озона.
Ультрафиолетовое излучение (УФ)
–это невидимое глазом
электромагнитное излучение, занимающее
спектральную область между видимым и
рентгеновским излучением в пределах 400
≤ ≤ 10 нм.
8.
НаименованиеАббревиатура
Длина волны
( ) в нм
Ближний
NUV
400 нм – 300 нм
Средний
MUV
300 нм – 200 нм
Дальний
FUV
200 нм – 122 нм
Экстремальный
EUV, XUV
121 нм – 10 нм
Вакуумный
VUV
100 нм – 10 нм
Ультрафиолет А
VUA
400 нм – 315 нм
Ультрафиолет В
VUB
280 нм – 315 нм
Ультрафиолет С
VUC
280 нм – 100 нм
БАУ
биол.
активный УФ
поглощается
О2 , не
достигая
высоты 50 км
9.
Озон – система жизнеподдержания наЗемле!
Стратосферный озон поглощает УФизлучение в диапазоне волн 200–320 нм.
В результате при истощении озонового
слоя возрастает УФ-излучение.
Поглощающая способность
слоя О3 толщиной 2 мм эквивалентна
поглощающей способности
слоя О2 толщиной 1 км.
10.
УльтрафиолетПОЛЬЗА
Под воздействием солнечного света в
организме человека вырабатывается
витамин D и «гормон счастья»
серотонин. При недостатке первого
могут возникнуть такие недуги, как
рахит, остеопороз, остеохондроз.
Доказано, что нехватка этого важного
витамина
способствует
развитию
гипертонии и рассеянного склероза.
Трудно переоценить роль серотонина в
деятельности нервной системы и
головного мозга человека. Этот гормон
не зря называют «гормоном счастья»:
аппетит, сон, эмоции и настроение – все
зависит от серотонина. При его
нехватке недалеко до депрессии и
других
расстройств
нервной
системы.
ВРЕД
(от биологически активного
ультрафиолета)
деградация молекул белка;
канцерогенное действие (рак кожи);
ослабление иммунной системы
(аллергические и инфекционные
заболевания);
ожоги кожи (загар);
глазные заболевания (катаракта,
«снежная слепота») .
Недостаток
солнечного
света
способствует усиленной выработке в
организме гормона сна мелатонина,
можно понять, почему в зимнее время
года даже днем возникают сонливость
и депрессия.
10
11.
Уменьшение плотности озоновогослоя на 10%
приводит к увеличению
опасного (200–320 нм)
УФ-излучения на 13%,
что в свою очередь
провоцирует рост числа
заболеваний раком
кожи разного типа на 20
– 30% (теоретически).
определяет загар,
вызывает рак кожи,
ухудшение зрения.
12.
А поскольку молекулы ДНКпоглощают излучение в том же
диапазоне длин волн, что и
озон, рост УФ-излучения
повреждает эти молекулы,
снижает скорость деления и, в
конце концов, приводит к их
гибели.
Повышение УФ-излучения
пагубно для всего живого
мира и прежде всего –
океанического
фитопланктона, который
составляет начальное звено
в природной цепи питания.
13.
Озонв стратосфере образуется в
результате фотохимической диссоциации
молекулярного кислорода под
воздействием солнечной радиации
где
M* - любая молекула (обычно азота
или кислорода), уносящая из реакции
избыток энергии.
14.
Еслисолнечное излучение отсутствует или
слабо (ночь, зима), то реакции (4.1) и (4.2) не
идут и разрушение озона происходит только
по реакции (5).
Эта схема была предложена в 1930 году
Чепменом. Реакции, описывающие процессы
возникновения и естественной гибели озона,
называются циклом Чепмена.
14
15.
Разрушение озонового слояЦиклы разрушения озона
(цепные реакции)
Причины возникновения
“озоновой дыры”, т.е.
уменьшение концентрации
озона, носят как естественный,
так и антропогенный характер.
Длина цепи может достигать
104 – 107 (количество молекул
озона, разрушенных одним
атомом хлора или другой
частицей) в зависимости от
типа цикла разрушения.
15
16.
На высоте около 25 км вследствиевысокой интенсивности солнечной
радиации происходит разрушение ХФУ
(фреонов) с выделением атомов хлора
(Cl) и молекул монооксида хлора (ClO),
которые являются более сильными
катализаторами процесса разрушения
молекул озона, чем оксиды азота.
17.
Запоследние десятилетия смертность от
меланомы в Англии возросла в 15 раз.
По
прогнозам число дополнительных
случаев заболевания катарактой в
ближайшие десятилетия составит
3 /100 000 человек,
а раком кожи – 7 /100 000.
18.
Способы представления концентрацииозона в атмосфере
Если собрать весь распределенный по высоте
озон в сферический слой вблизи поверхности
Земли при нормальных условиях , то толщина
этого слоя составит всего около 3 мм.
В качестве единицы измерения общего
содержания озона принята так называемая
единица Добсона (еД или DU), которая
соответствует толщине озонового слоя,
собранного отдельно и приведенного к
нормальному атмосферному давлению (101325
Па = 1 атм = 760 мм рт. ст.) и температуре
273К (0°С).
http://woudc.ec.gc.ca/ozone/images/graphs/gl/current.gif
Одна единица Добсона соответствует
0.01 мм толщины этого слоя.
100 е.Д. соответствуют толщине озонового
слоя в 1 мм.
Величина содержания озона в атмосфере
испытывает суточные, сезонные, годовые и
многолетние колебания.
При среднем глобальном общем содержании
озона в 290 е.Д. толщина озонового слоя
изменяется в широких пределах – от 90 до
600 е.Д.
18
19.
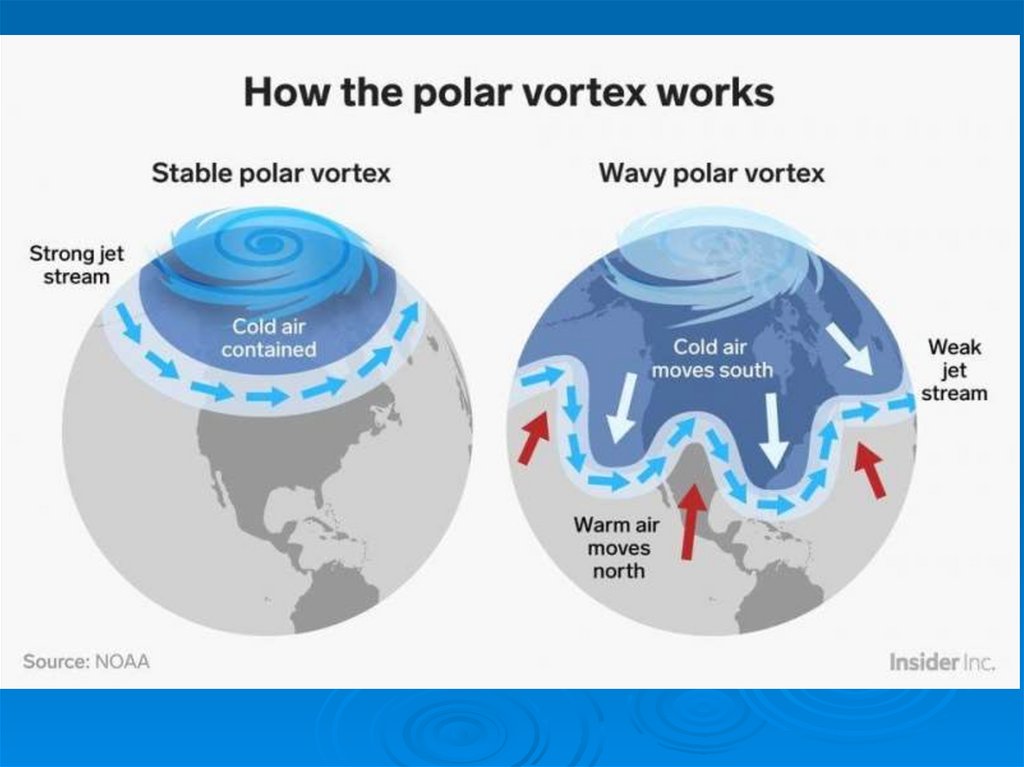
То, что между тропосферой и стратосферой не существуетперемешивания, - это полуправда.
Когда наступает полярная зима, то воздушные массы на
полюсах выхолаживаются. Как следствие, изменяется
давление и плотность воздуха и возникает полярный вихрь
(вортекс) - внутрь него поступает поток воздуха со всего
земного шара. Движение воздуха в полярном вихре
направлено в тропосферу.
Впервые вортекс был зафиксирован английскими и
американскими учеными в 1984 году над Антарктидой.
Как было обнаружено позднее, это сезонное явление
наблюдается ежегодно над полюсами, но над
Антарктидой полярный вихрь имеет большие размеры,
т.к. там есть материк.
Естественные причины уменьшения количества озона были
вызваны тем, что он выводился в тропосферу.
Летом эта воронка затягивалась. Так происходило
“самоочищение” стратосферы раньше. Вместе с озоном из
стратосферы выводились такие соединения как HCl, ClONO2
(резервуары хлора). Наличие в стратосфере пониженного
содержания озона было связано только с чисто физическим
удалением озона из стратосферы.
19
20.
21.
22.
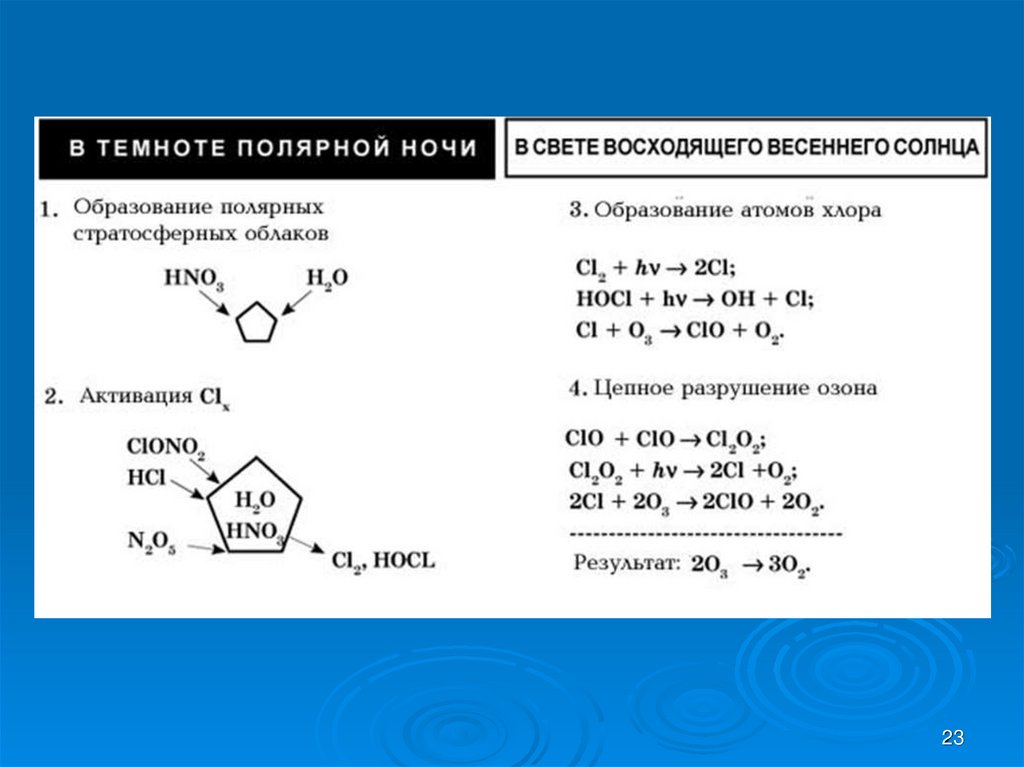
Температура воздуха внутри вихря резко снижается до -700 C или-800 С.В стратосфере появляются устойчивые аэрозольные образования –
“серебристые” облака, состоящие из кристалликов льда и капель
переохлажденной жидкости. В состав этих аэрозолей входят димеры
оксида хлора, хлористый нитрозил (ClONO2) и другие соединения азота
(HNO3, HNO2).
В зимний период эти соединения, связанные с аэрозолями, не
взаимодействуют с озоном.
Весной полярный вихрь распадается, и при повышении температуры, на
поверхности кристалликов льда начинают протекать гетерогенные
химические процессы:
ClONO2 + H2O = НОCl + HNO3
или ClONO2 + HCl = Cl2 + HNO3
Образующиеся молекулы хлора и HOCl неустойчивы и, в отличие от HCl и
ClONO2, при появлении первых солнечных лучей распадаются даже под
воздействием видимого излучения:
Cl2 + h = 2Cl
HOCl + h = OH + Cl
Таким образом, с наступлением весны в стратосфере над Антарктидой
появляется ряд озоноразрушающих веществ и начинаются цепные
процессы разрушения озона на фоне природного дефицита озона ,
содержание которого не успевает восстановиться после окончания
полярной ночи и разрушения вортекса.
22
23.
2324.
ФРЕОНЫ - СxClyFzФреоны — галогеноалканы, фторсодержащие производные
насыщенных углеводородов.
В 1974 году химики Роланд и Молина предположили, что
хлорфторуглероды (фреоны), которые были изобретены
еще в 1930 году, понижают среднюю концентрацию озона
в стратосфере.
Эти вещества являются источниками радикалов •Cl.
Выбросы фреонов казались незначительными.
Основными источниками фреонов до недавнего времени
являлись - холодильные установки, аэрозольные
баллончики.
Основная опасность - большое время жизни фреонов в
атмосфере.
24
25.
В 1987 году представители 24 стран вМонреале подписали соглашение, по которому
обязались сократить вдвое использование
озоноразрушающих ХФУ к 1999-му году.
Однако в связи с ухудшающейся ситуацией в
1990-м году в Лондоне были приняты поправки
к Монреальскому протоколу.
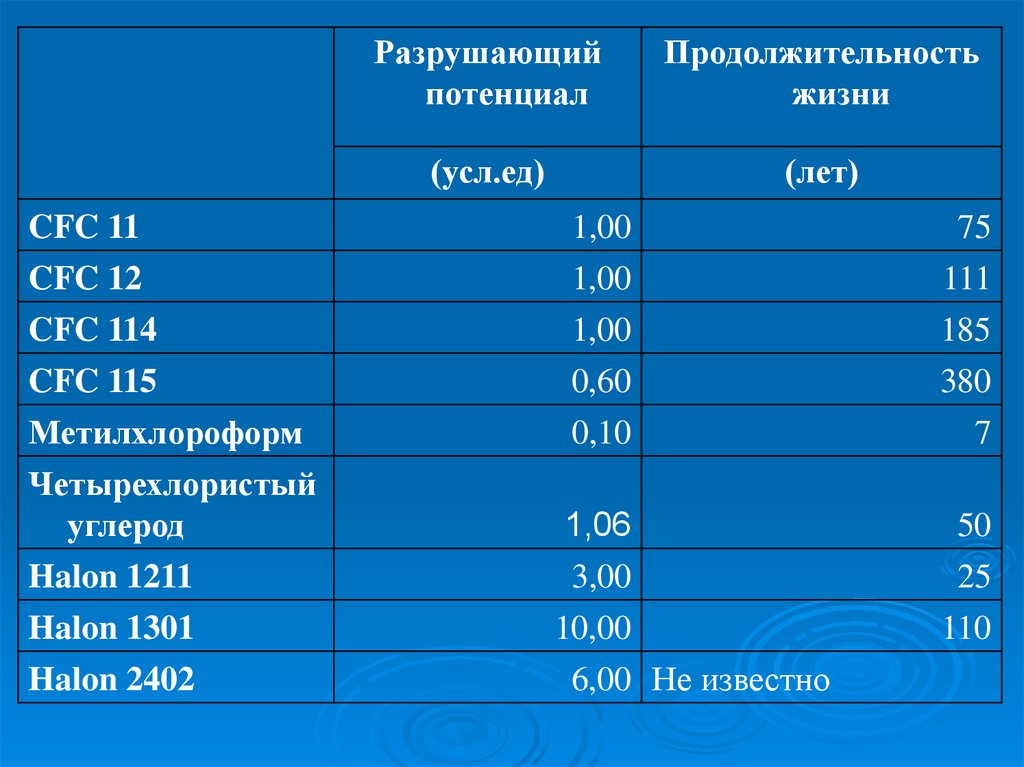
В Монреале была принята система, по которой
озоноразрушающие вещества подразделялись по
следующим критериям:
• способность разрушать озон
• продолжительность их жизни
26.
CFC 11CFC 12
CFC 114
CFC 115
Метилхлороформ
Четырехлористый
углерод
Halon 1211
Halon 1301
Halon 2402
Разрушающий
потенциал
Продолжительность
жизни
(усл.ед)
(лет)
1,00
1,00
1,00
0,60
0,10
75
111
185
380
7
1,06
3,00
50
25
10,00
6,00 Не известно
110
27.
Атмосфера.Влияние деятельности
человека
на атмосферу и климат
28.
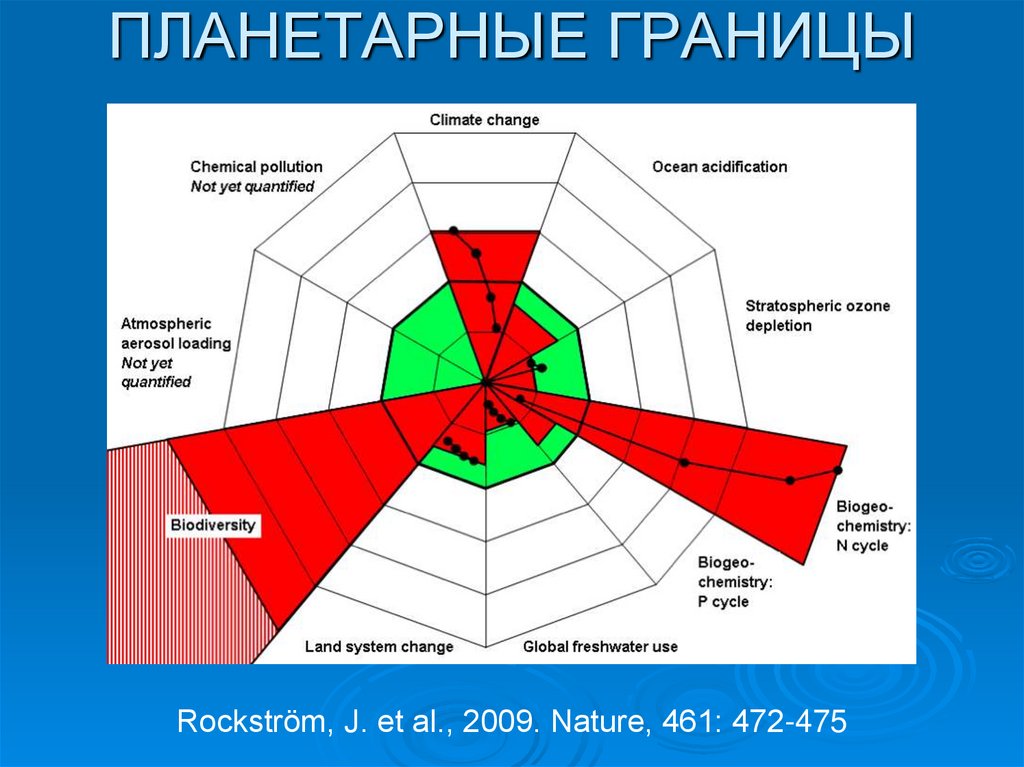
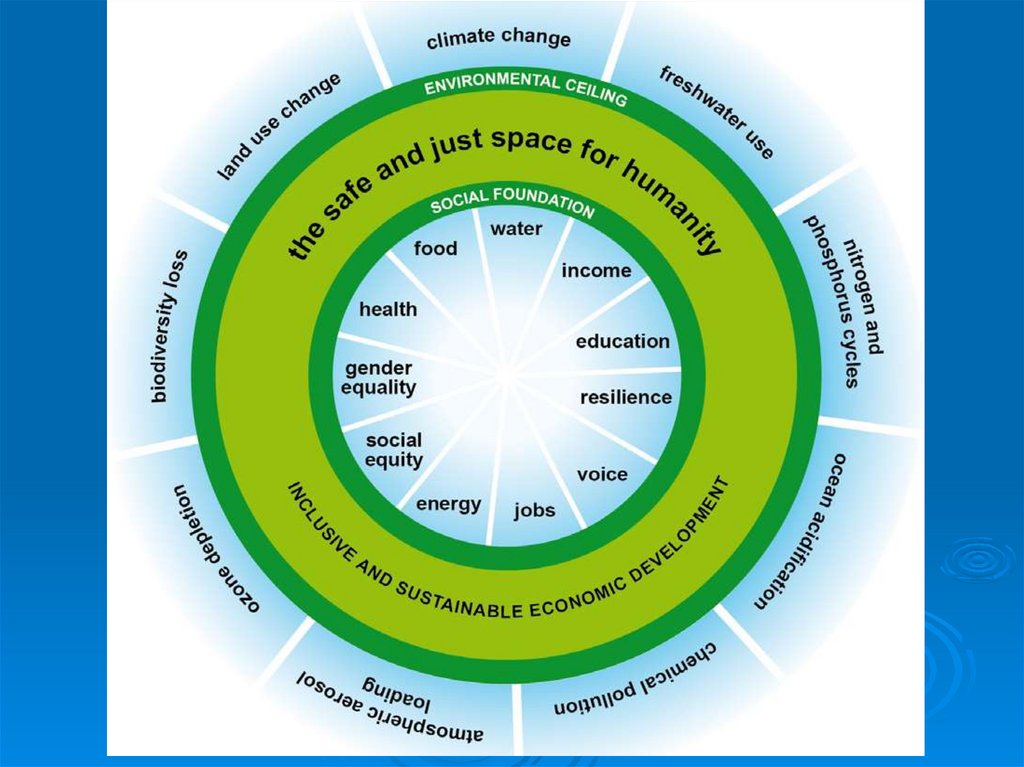
ПЛАНЕТАРНЫЕ ГРАНИЦЫRockström, J. et al., 2009. Nature, 461: 472-475
29.
Planetary boundariesClimate
350 ppm СО2
+1 W/m2
Ozone depletion
276 DU
Atmospheric aerosol loading
Biogeochemical loading
TBD
35 MT N/yr
11 MT P/yr
Ocean
acidification
Biodiversity loss
10 E/MSY
Aragonite saturation
ratio > 2.75
Agricultural
land use
15%
Freshwater use
Chemical pollution
TBD
4000 km3/yr
30.
31.
Парниковый эффектСредняя глобальная Земли
288 К (+ 15оС),
без парникового эффекта она
была бы 255 К (- 18оС).
Парниковый эффект - один из
механизмов жизнеобеспечения на
Земле.
32.
Атмосфераслабо поглощает
солнечную радиацию в видимой части
спектра, большая часть которой
достигает земной поверхности, но
задерживает длинноволновое тепловое
ИК излучение, исходящее от ее
поверхности, что приводит к
значительному повышению
температуры ее нижних слоев.
33.
Парниковый эффектПарниковый эффект – разогревание
нижних слоев атмосферы, возникающее
за счет поглощения теплового излучения
поверхности Земли молекулами
следующих газов:
водяной пар, находящийся в атмосфере
углекислый газ (диоксид углерода) (СО2),
метан (СН4),
оксиды азота, в особенности N2O
озон (О3)
хлорфторуглероды .
Парниковым может считаться любой газ,
поглощающий в ИК-области и содержащийся в
сколь угодно малых количествах в атмосфере.
34.
35.
Парниковый эффект каждого из таких газов зависит оттрех основных факторов:
1. ожидаемого парникового эффекта на протяжении
ближайших десятилетий или веков (например, 20,
100 или 500 лет), вызываемого единичным объемом
газа, уже поступившим в атмосферу, по сравнению с
эффектом от углекислого газа, принимаемым за
единицу;
2. типичной продолжительности его пребывания в
атмосфере
3. объема эмиссии газа.
36.
Основные особенности газов спарниковым эффектом
Концентрация,
частей на
млрд
Относительный
парниковый
потенциал газа
на ближайшие
20 лет
СО2
358000
1
50–200
СН4
1720
12
16
N2O
312
290
120
0,1-0,3
300-8000
от 7 до 400
CFC
(ХФУ)
Продолж-ть
существования
в атмосфере, гг.
37.
Вклад парниковых газов визменение радиационного
баланса (2000 г.)
ХФУ; 13,8
Оксид азота;
7,1
Метан; 19,8
Диоксид
углерода;
59,3
38.
1992 г. в Рио-де Жанейро принятарамочная конвенция ООН об изменении
климата, далее к ней разработан и
подписан Киотский протокол (1997).
16 февраля 2005 г. вступил в силу
Киотский протокол,
по которому предусмотрено
сокращение эмиссии
парниковых газов.
39.
Цель Рамочной Конвенции по изменению климатадостичь стабилизации
концентрации парниковых
газов в атмосфере
на достаточно низком
в сроки
уровне,
достаточные
позволяющем не
для того,
допустить
чтобы
“опасного
антропогенного
вмешательства” в
климатическую систему
• экосистемы могли
адаптироваться
естественным образом
к изменениям климата;
• производство
продовольствия
не было поставлено
под угрозу, и
• экономическое
развитие продолжалось
устойчивыми темпами
РКИК ООН подписана 192 Сторонами – глобальный охват
39
40.
Альтернатива КиотоЛетом
2005 г. США, Китай, Австралия,
Индия, Южная Корея и др. страны
региона подписали соглашение
«Азиатско-Тихоокеанское партнерство
по экологическому развитию и климату»
41.
существует несколько главных позицийСоединенные Штаты
• Изменение климата –
проблема долгосрочная
• Акцент на технологиях
дающих сокращения в
течение 20-30 лет, а не
обязательных для
выполнения целевых
показателях и сроках
Азиатско- Тихоокеанское партнерство
(2006 г.)
Европейский Союз
Изменение климата - насущный вопрос
Шанс избежать опасного вмешательства
может быть упущен в ближайшие 10-20
лет
Необходимы обязательные целевые
показатели и сроки
Развивающиеся страны (Г 77)
• Изменение климата- насущный вопрос
• Развитые страны несут ответственность и
должны действовать первыми
• Приоритет – развитие, борьба с нищетой
• Нужны дружественные климату технологии
США, Австралия, Индия, Япония,
Китай, Южная Корея
41
42.
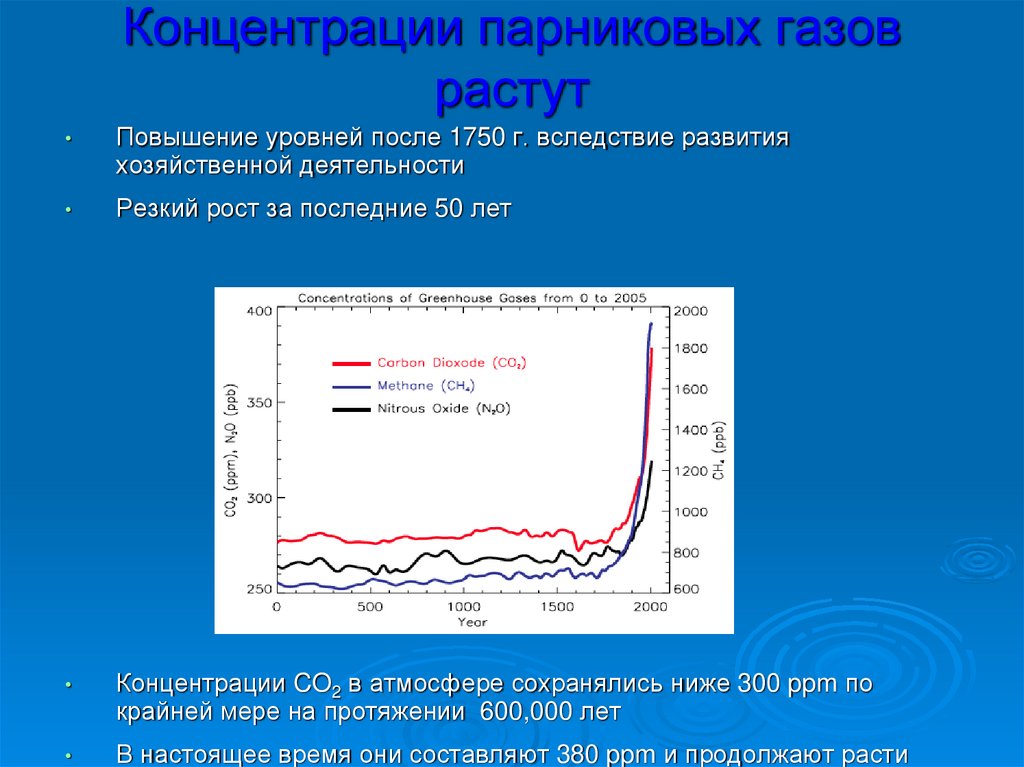
Концентрации парниковых газоврастут
Повышение уровней после 1750 г. вследствие развития
хозяйственной деятельности
Резкий рост за последние 50 лет
Концентрации CO2 в атмосфере сохранялись ниже 300 ppm по
крайней мере на протяжении 600,000 лет
В настоящее время они составляют 380 ppm и продолжают расти
43.
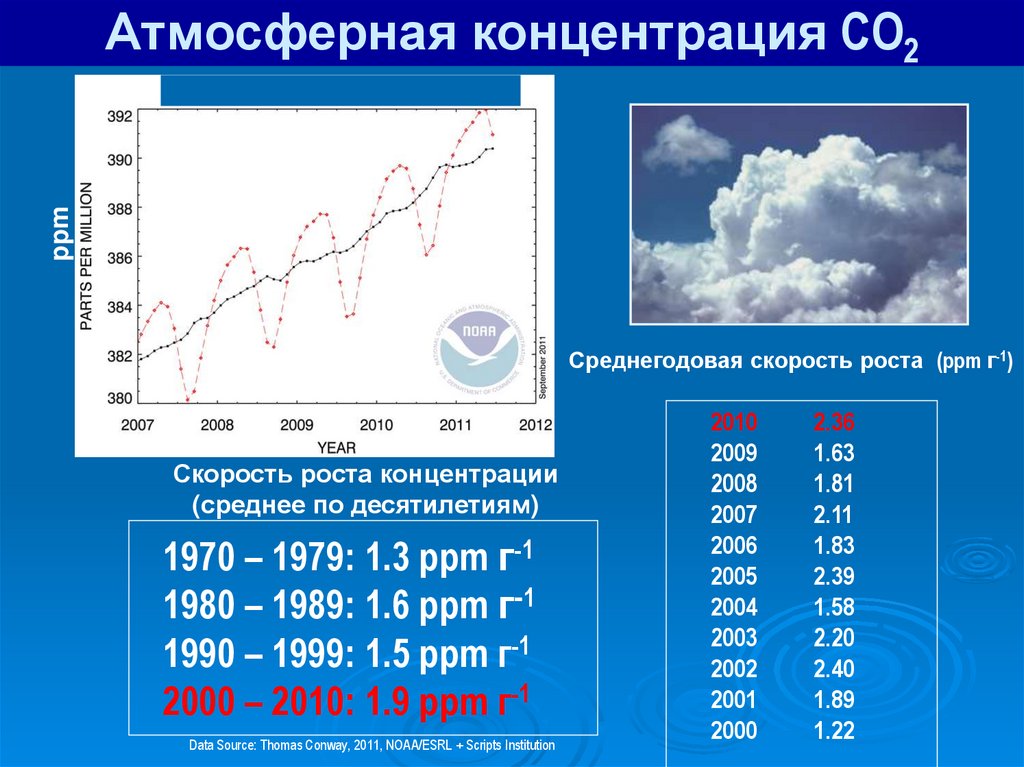
Атмосферная концентрация CO2ppm
Конец 2010: 389.6 ppm
Среднегодовая скорость роста (ppm г-1)
Скорость роста концентрации
(среднее по десятилетиям)
1970 – 1979: 1.3 ppm г-1
1980 – 1989: 1.6 ppm г-1
1990 – 1999: 1.5 ppm г-1
2000 – 2010: 1.9 ppm г-1
Data Source: Thomas Conway, 2011, NOAA/ESRL + Scripts Institution
2010
2009
2008
2007
2006
2005
2004
2003
2002
2001
2000
2.36
1.63
1.81
2.11
1.83
2.39
1.58
2.20
2.40
1.89
1.22
44.
25006
2000
5
2500000
2000000
1500
4
1500000
3
1000
1000000
2
500
500000
00
1
Эмиссия на 1
человека в т С/год
Общая эмиссия С-СО2,
млн. т/год
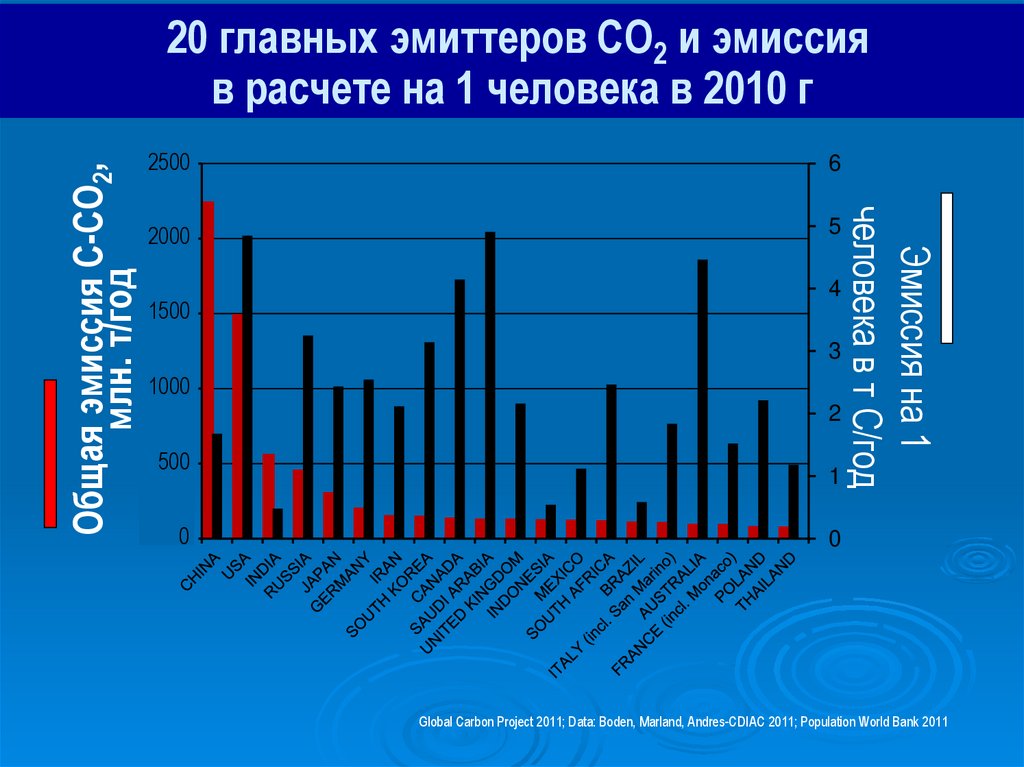
20 главных эмиттеров CO2 и эмиссия
в расчете на 1 человека в 2010 г
0
Global Carbon Project 2011; Data: Boden, Marland, Andres-CDIAC 2011; Population World Bank 2011
45.
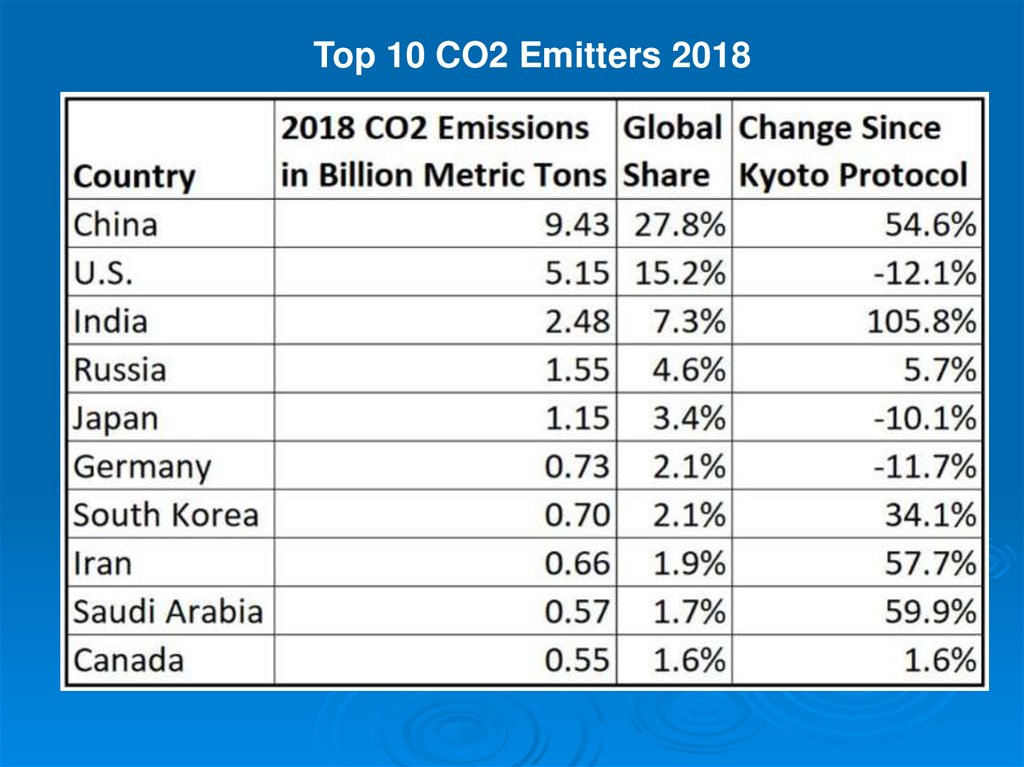
Top 10 CO2 Emitters 201846.
Антропогенная эмиссия СО2 относительно ееприродных источников на Земле (%)
4
25
41
30
Дыхание наземной
биоты
25
дыхание
наземной
биоты
дыхание
океанической
биоты
Дыхание океанической
биоты
дыхание
Дыхание почвы
почв 30
антропогенная
Антропогенная деятельность
эмиссия
47.
Судьба эмитированного CO2 (2010)9.1±0.5 Гт C г-1
5.0±0.2 Гт C г-1
50%
0.9±0.7 Гт C г-1
+
2.6±1.0 Гт C г-1
26%
NPP
24%
2.4±0.5 Гт C г-1
Среднее по 5 моделям
Global Carbon Project 2010; Updated from Le Quéré et al. 2009, Nature Geoscience; Canadell et al. 2007, PNAS
48.
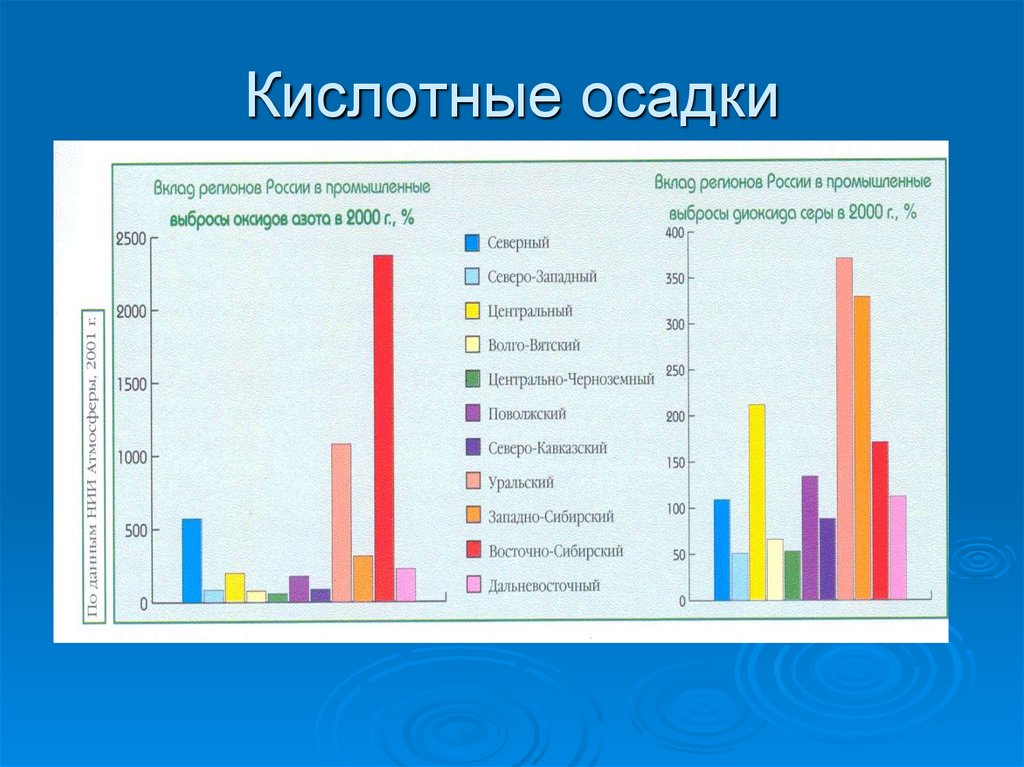
Кислотные осадки49.
В естественных условиях атмосферныеосадки обычно имеют нейтральную или
слабо кислую реакцию, то есть показатель их
кислотности/ щелочности обычно меньше 7,0:
рН < 7
В присутствии углекислого газа и при
температуре 20о С дождевая вода имеет
рН = 5,6
В присутствии других природных газов рН
дождевой воды снижается примерно до
рН = 5,0
Кислотные осадки (или “кислотные дожди”)
это осадки с рН<5.
50.
Краткая история кислотныхосадков
1852 год - впервые открывают серную кислоту в дождевых
осадках в промышленных районах Манчестера и Лондона
(Англия);
1870 год, - спонтанная конденсация водяного пара облегчается
в присутствии частичек пыли и крупинок соли;
1914 год - П. Коссович впервые в России проводит анализ
химического состава осадков, отобранных в различных
районах, и выявляет значимость антропогенных выбросов
соединений серы;
51.
1930 год - в Англии пускается первая промышленная установкасероочистки дымовых выбросных газов тепловой
электростанции;
1939 год - в США впервые проведены измерения кислотности
дождевых осадков;
1952 год - знаменитый лондонский смог, унесший тысячи
жизней;
1950-е и 1960-е годы - шведские ученые обнаруживают
значительное закисление осадков в Скандинавии
(pH<4,0) ;
52.
1957 год - в СССР создана сеть станций мониторингахимического состава осадков;
1960-е и 1970-е годы - наблюдаются первые последствия
кислотных осадков в Скандинавии, Канаде и США,
проявляющиеся в закислении озер и рек, сокращении
популяций различных видов рыб и повреждении хвойных лесов;
1972 год - в СССР создана Общегосударственная служба
наблюдений и контроля загрязнения природной среды (в
настоящее время - государственная система наблюдений за
состоянием окружающей природной среды), отслеживающая,
в частности, концентрации кислотообразующих веществ в
атмосфере и в осадках;
53.
Краткая «биография»кислотных осадков
1979 год - в Женеве подписывается <·Конвенция о
трансграничном загрязнении воздуха на большие расстояния).
Для реализации Конвенции действует Совместная программа
наблюдения и оценки распространения загрязнителей воздуха
на большие расстояния в Европе отслеживающая, в частности,
состояние кислотного загрязнения европейского региона;
1990 год - Конгресс США принимает «Закон о чистом воздухе»
(Clean Air Act Amendments);
54.
1990-е годы - в России происходит значительное сокращениевыбросов основных кислотообразующих веществ, связанное
со спадам промышленного производства;
1991 год - начала действовать международная Программа
Арктического Мониторинга и Оценки (АМАР), отслеживающая, в
частности, состояние кислотного загрязнения арктического
региона;
1998 год - организована сеть мониторинга кислотных осадков в
Восточной Азии (ЕАНЕ1).
55.
Кислотные осадки бывают двухтипов:
сухие,
обычно выпадающие невдалеке
от источника их поступления в
атмосферу,
влажные
(дождь, снег и пр.),
распространяющиеся на большие
расстояния, соизмеримые с размерами
континентов.
56.
Основные компоненты кислотныхосадков:
•аэрозоли оксидов серы и азота (SOх и
NОx), которые при взаимодействии с
атмосферной, гидросферной или
почвенной влагой образуют серную,
азотную и другие кислоты.
57.
Источникиприродные
извержения
вулканов, лесные
пожары, эрозия
почв и др
антропогенные
- процессы
сжигания горючих
ископаемых
- сельское
хозяйство
58.
Кислотные осадки59.
60.
Основные пути сниженияэмиссии оксидов азота и серы
промывка измельченного угля перед
его сжиганием
Понижение температуры сжигания угля
Извлечение серы из отходящих газов и
т.п.
Экономия использования энергии
61.
Виды ущерба от кислых осадковДеградация
водных систем
Гибель лесов
Возрастание заболеваемость людей
Ущерб зданиям, сооружениям из
мрамора
CaCO3+H2SO4→CaSO4+H2O
Мрамор превращается в гипс
62.
Историческиепамятники Греции и
Рима, простояв тысячелетия, в
последние годы разрушаются прямо на
глазах.
63.
Такая же судьба грозит и Тадж-Махалу —шедевру индийской архитектуры периода
Великих Моголов, в Лондоне — Тауэру и
Вестминстерскому аббатству.
64.
На соборе Св. Павла в Риме слойпортлендского известняка разъеден на 2,5 см.
В Голландии статуи на соборе Св. Иоанна
тают, как леденцы. Черными отложениями
изъеден королевский дворец на площади Дам в
Амстердаме.
65.
Такая же судьба грозит и Тадж-Махалу —шедевру индийской архитектуры периода
Великих Моголов, в Лондоне — Тауэру и
Вестминстерскому аббатству.
66.
СМОГаэрозоль, состоящий из дыма, тумана
и пыли. Английское слово «smog» —
производное от «smoke» — дым и «fog» —
туман.
Именно жители английской столицы первыми
столкнулись с проблемами, связанными
с загрязнением городского воздуха.
67.
Лондонский (влажный) смог- сочетание газообразных и твердых
примесей с туманом,
как результат сжигания большого
количества угля или мазута при
высокой влажности.
Токсичность определяется исходными
загрязнителями
68.
Лондонский (влажный) смог•1948 г. - первый из официально зарегистрированных случаев
загрязнения атмосферы, имевшим серьезные последствия,
стал смог в г. Донора (США). В течение 36 часов было
зарегистрировано два десятка смертей, сотни жителей
чувствовали себя очень плохо.
• декабрь 1952
г в течении пяти дней в Лондоне от смога
умерло более 4000 человек.
•Хотя в последующие годы сильный смог в Лондоне и других
городах наблюдался неоднократно, таких катастрофических
последствий, к счастью, больше не было.
69.
Фотохимический смогРазновидность вторичного загрязнения
атмосферы, когда из первичных
загрязнителей образуются гораздо более
высокотоксичные соединения.
Автомобильные выхлопы +Солнечный свет +
О2 →О3 + NOx + пероксиды,
пероксинитриты+ CО2 + H2O
70.
ТЕМПЕРАТУРНАЯ ИНВЕРСИЯ-аномальное возрастаниеТЕМПЕРАТУРЫ с высотой
Нормально температура воздуха уменьшается с ростом
высоты над уровнем земли. Средняя норма понижения 1 °С на каждые 160 м. При определенных
метеоусловиях наблюдается обратная ситуация. В
ясную, тихую ночь при антициклоне холодный воздух
может скатываться вниз по склонам и собираться в
долинах, и температура воздуха будет ниже около дна
долины, чем на 100 или 200 м выше.
Над холодным слоем там будет более теплый воздух,
который, вероятно, образует облако или легкий туман.
Если эта ситуация создается в больших масштабах,
пыль и грязь, поднимающиеся в атмосферу, остаются
там и, накапливаясь, приводят к серьезному
загрязнению.
71.
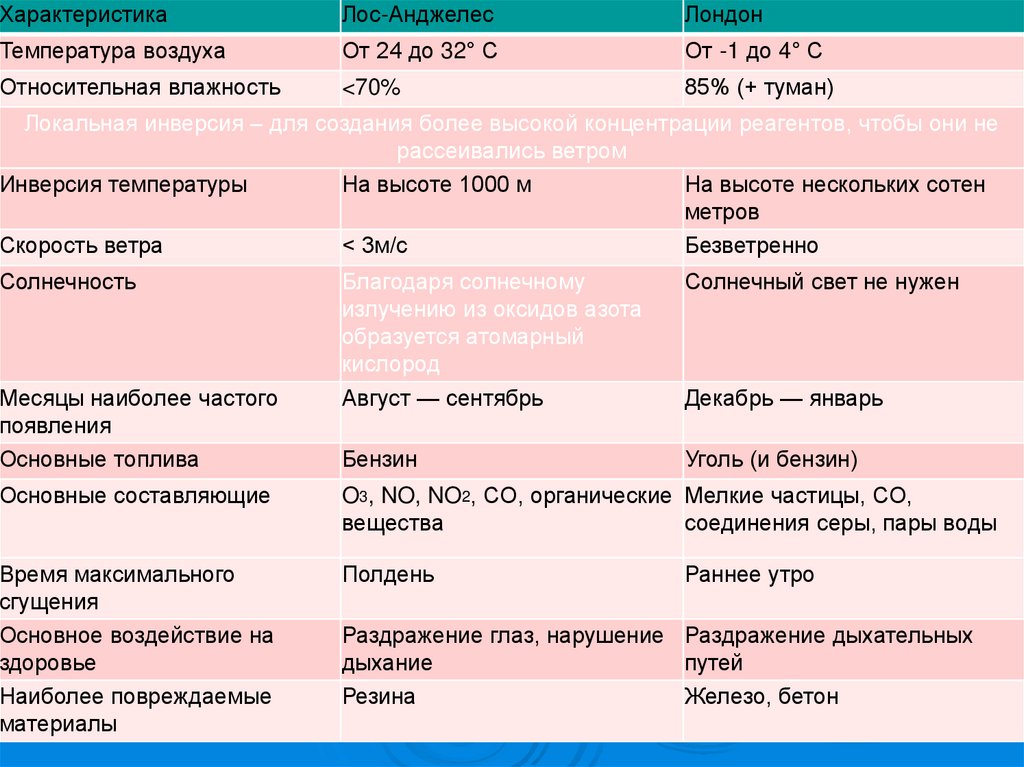
ХарактеристикаЛос-Анджелес
Лондон
Температура воздуха
От 24 до 32° С
От -1 до 4° С
Относительная влажность
<70%
85% (+ туман)
СРАВНЕНИЕ СМОГОВ
ЛОС-АНДЖЕЛЕСА
И ЛОНДОНА
Локальная инверсия – для создания более высокой концентрации реагентов, чтобы они не
рассеивались ветром
Инверсия температуры
На высоте 1000 м
На высоте нескольких сотен
метров
Скорость ветра
< 3м/с
Безветренно
Солнечность
Месяцы наиболее частого
появления
Основные топлива
Благодаря солнечному
излучению из оксидов азота
образуется атомарный
кислород
Август — сентябрь
Солнечный свет не нужен
Бензин
Уголь (и бензин)
Декабрь — январь
Основные составляющие
O3, NO, NO2, CO, органические Мелкие частицы, СО,
вещества
соединения серы, пары воды
Время максимального
сгущения
Основное воздействие на
здоровье
Наиболее повреждаемые
материалы
Полдень
Раннее утро
Раздражение глаз, нарушение Раздражение дыхательных
дыхание
путей
Резина
Железо, бетон
72.
Смог над Москвой-рекой73.
Смог на Невском74.
Изменение концентраций компонентовфотохимического смога в разное время
суток
75.
Основные загрязнители атмосферы иисточники их поступления
Оксид углерода (СО) –
► дымовые
газы любой установки сжигания
органического топлива;
► выхлопные
газы транспорта с двигателем
внутреннего сгорания
76.
Основные загрязнители атмосферы иисточники их поступления
► Углеводороды (CnHm )► дымовые
газы теплоэнергетических установок
из хранилищ жидкого и газообразного топлива
► выхлопные
газы транспорта
77.
Основные загрязнители атмосферы иисточники их поступления
► Сероводород
► Скважины
► Нефте-
(H2S) –
добычи газа
и газоперерабатывающие заводы
► Химические
предприятия
► Целлюлозно-бумажные
комбинаты
78.
Основные загрязнители атмосферы иисточники их поступления
► Аэрозоли,
► Результат
тяжелые металлы-
сжигания топлива
► Отходящие
газы промышленных
производств, в т.ч. дым плавильных печей
при производстве сталей и сплавов цветных
металлов.
79.
Особо опасные вещества, искусственносозданные человеком ксенобиотики, экотоксиканты
КСЕНОБИОТИКИ – любое чужеродное для
данного организма или их сообщества
вещество, могущее вызвать нарушение
биотических процессов, в том числе –
заболевание и гибель живых организмов
Экотоксиканты
– высокотоксичный особый
класс загрязняющих веществ
80.
Пестицидывещества, обладающие токсичными
свойствами по отношению к тем или иным
живым организмам – от бактерий и грибов до
растений и теплокровных животных.
Пестициды – химические препараты,
уничтожающие вредителей сельского
хозяйства. Такие вещества применялись в
небольших масштабах и сотни лет назад,
причем первые пестициды включали
соединения мышьяка, известково-серные
смеси, соли меди.
81.
Диоксины-гетероциклическиеполихлорированные соединения
ДДТ –хлоорганические пестициды, в
структуре которых присутствуют
ароматические ядра
Полихлорированные бифенилы (ПХБ)
82.
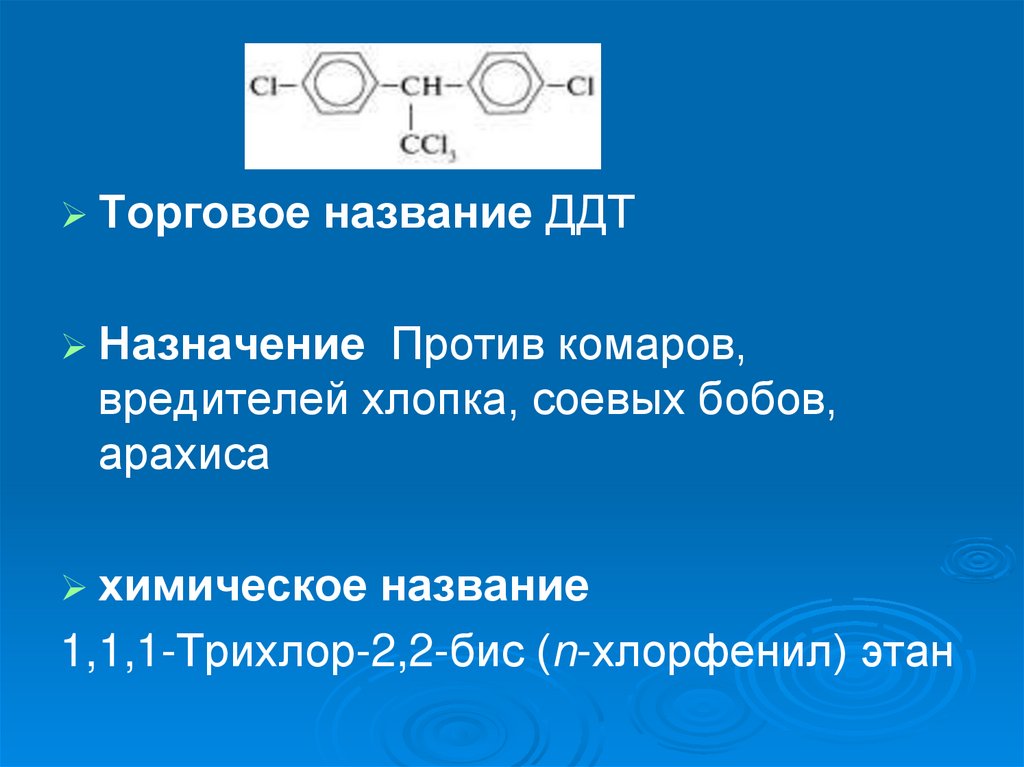
Торговоеназвание ДДТ
Назначение
Против комаров,
вредителей хлопка, соевых бобов,
арахиса
химическое
название
1,1,1-Трихлор-2,2-бис (n-хлорфенил) этан
83.
26 мая 1971 г. в небольшом американскомгородке Таймз Бич (штат Миссури) на грунт
ипподрома разбрызгали примерно 10 м3
технического масла, чтобы не поднималась
пыль во время скачек. Через несколько дней
ипподром был усеян трупами птиц, еще через
день заболели наездник и три лошади, а в
течение июня погибли 29 лошадей, 11 кошек
и четыре собаки. В августе заболели еще
несколько взрослых и детей.
84.
Виной оказались диоксины и фураны, концентрациякоторых в грунте ипподрома достигала 30-53 ppm
(долей на миллион). Техническое же масло
представляло собой химические отходы
производства 2,4,5-трихлорфенола - промежуточного
продукта при производстве 2,4,5трихлорфеноксиуксусной кислоты. Это вещество
применялось во время войны во Вьетнаме в качестве
дефолианта (гербицида, вызывающего опадание
листьев), известного под торговой маркой 2,4,5-Т
("Оранжевый реагент").
85.
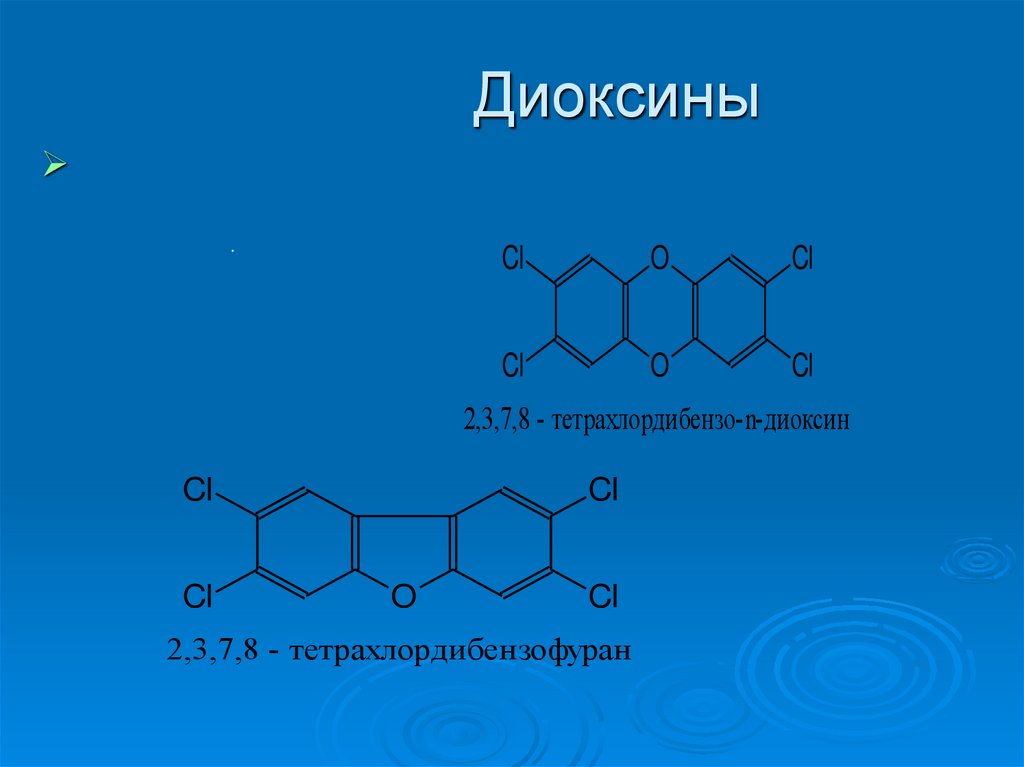
Диоксины.
Cl
O
Cl
Cl
O
Cl
2,3,7,8 - тетрахлордибензо-n-диоксин
Cl
Cl
Cl
O
Cl
2,3,7,8 - тетрахлордибензофуран
86.
Уровень загрязненности женскогомолока (пикограмм на литр).
в Иордании - 48,
в Японии -30,
в США - 20,
в России - 16,
в Швеции - 22,
в Австрии и на Украине по 12 пикограмм на литр,
в Нидерландах - 30,
в Таиланде всего 3.
87.
Полихлорированныебифенилы (ПХБ)
88.
Использование ПХБдиэлектрические жидкости в
трансформаторах и конденсаторах,
хладагентах, смазках, стабилизируя добавки
в гибких поливинилхлоридных (ПВХ)
покрытиях электрического телеграфирования
и электронных компонентов,
гидравлические жидкости, изоляторы
(используемый в затыкании, и т.д),
пластырях, деревянных концах этажа, краски
89.
Полихлорированные бифенилы ядовитыПроизводство
ПХБ было запрещено в
1970-ых из-за высокой токсичности
большинства родственных ПХБ и
смесей.
Они классифицируются как постоянные
органические загрязнители, которые
биоаккумулируются в животных
90.
ГПБУ «Мосэкомониторинг»https://mosecom.mos.ru/













































































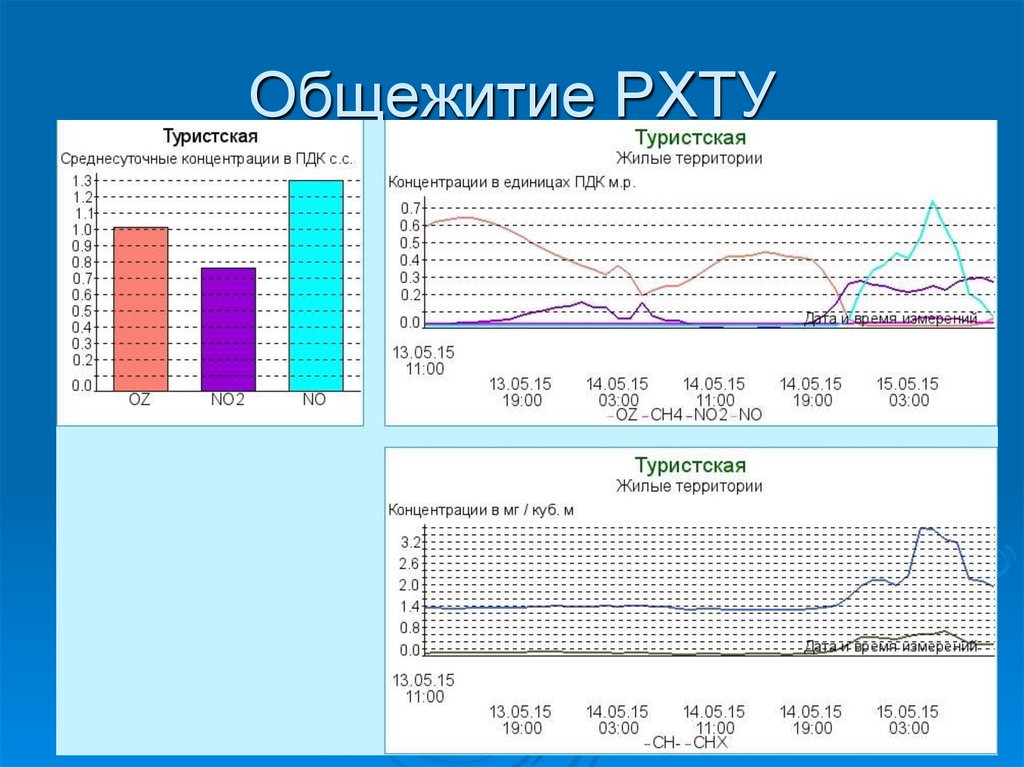
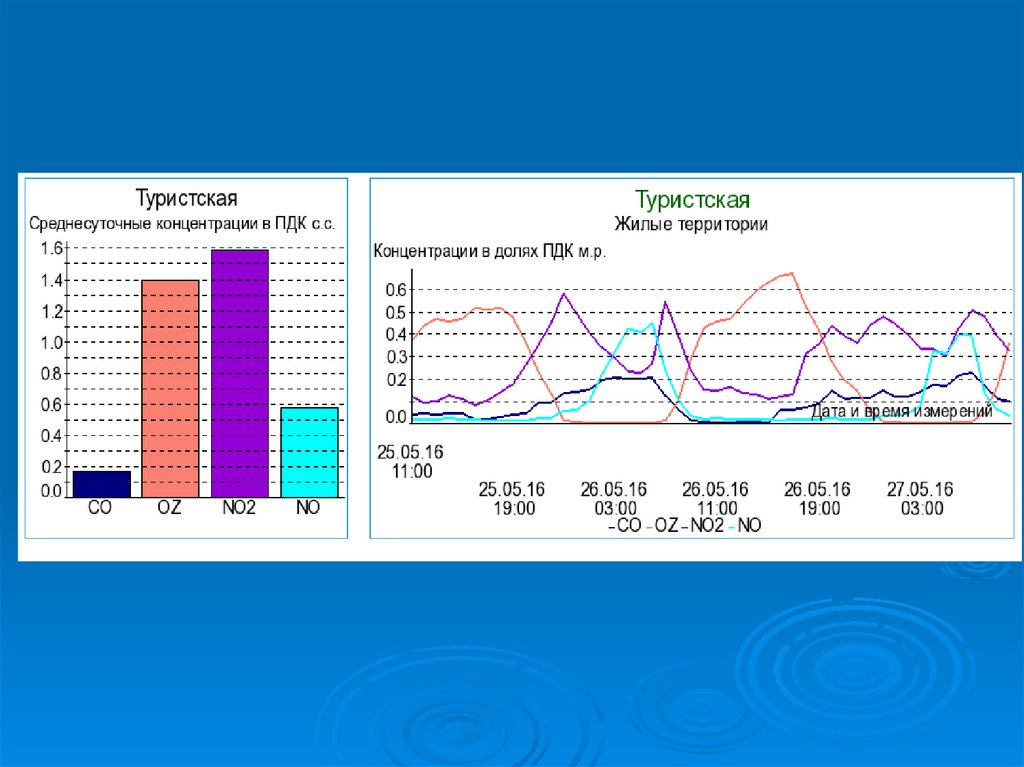
 ecology
ecology








