Similar presentations:
Сера и его соединения
1.
2.
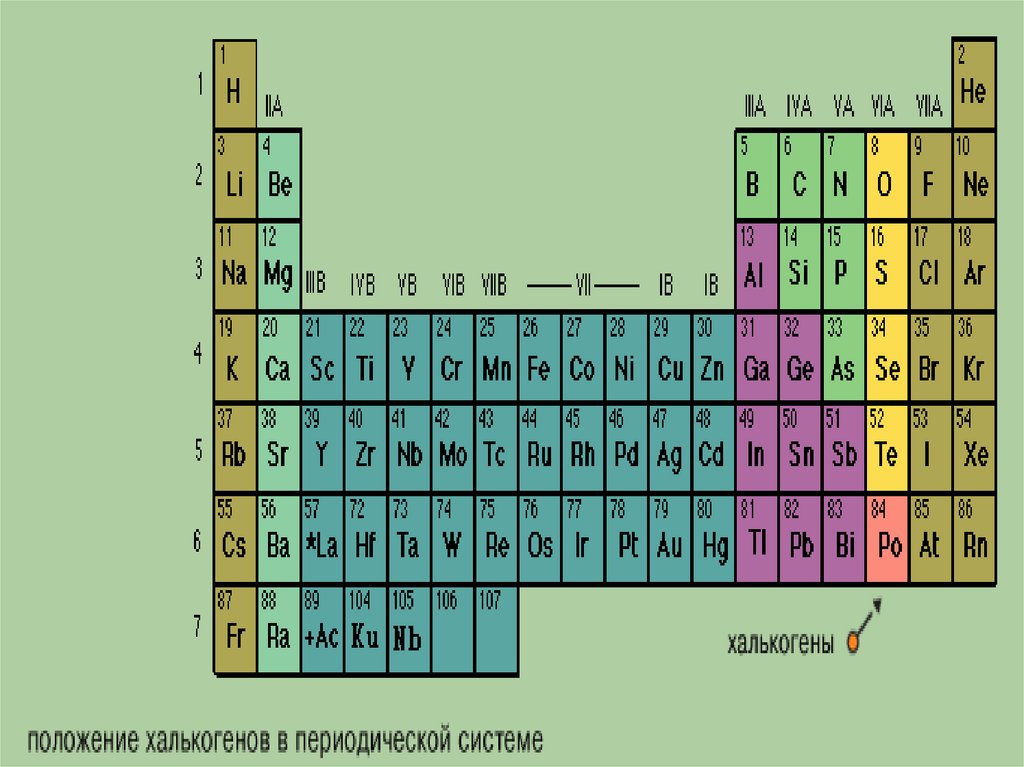
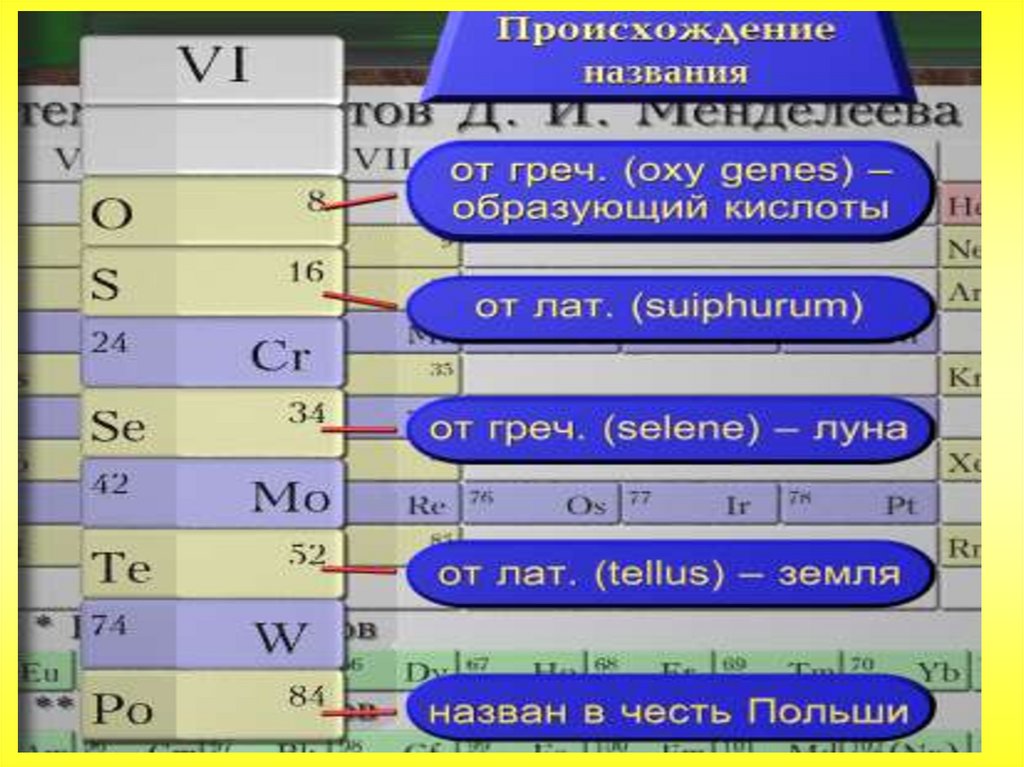
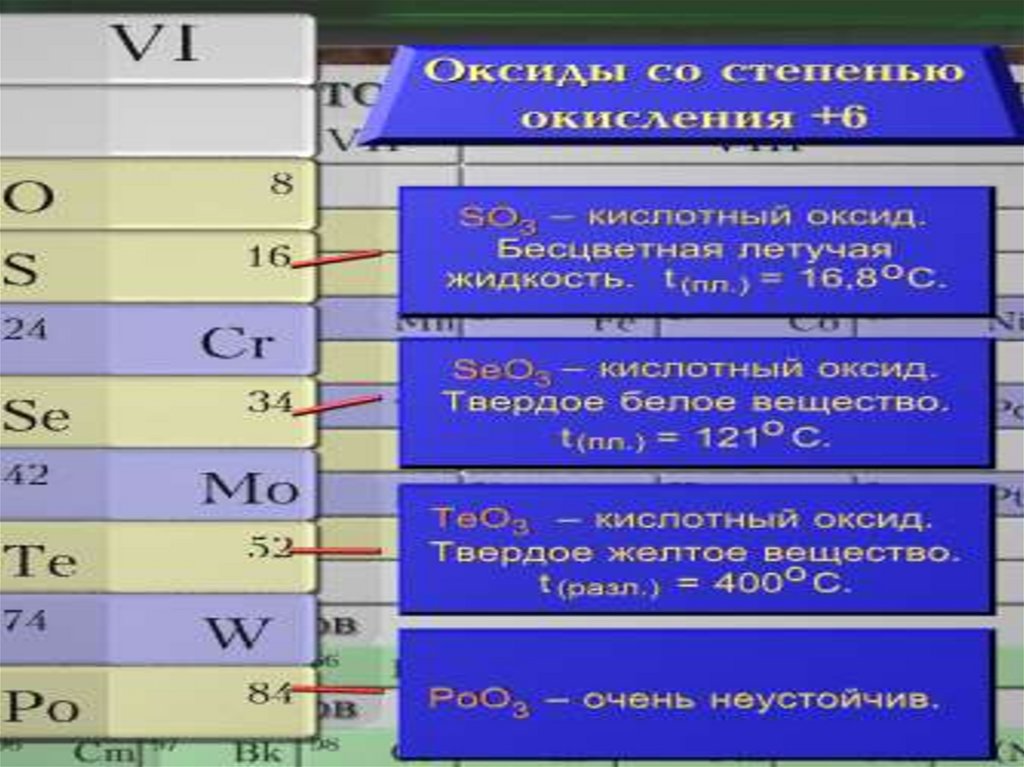
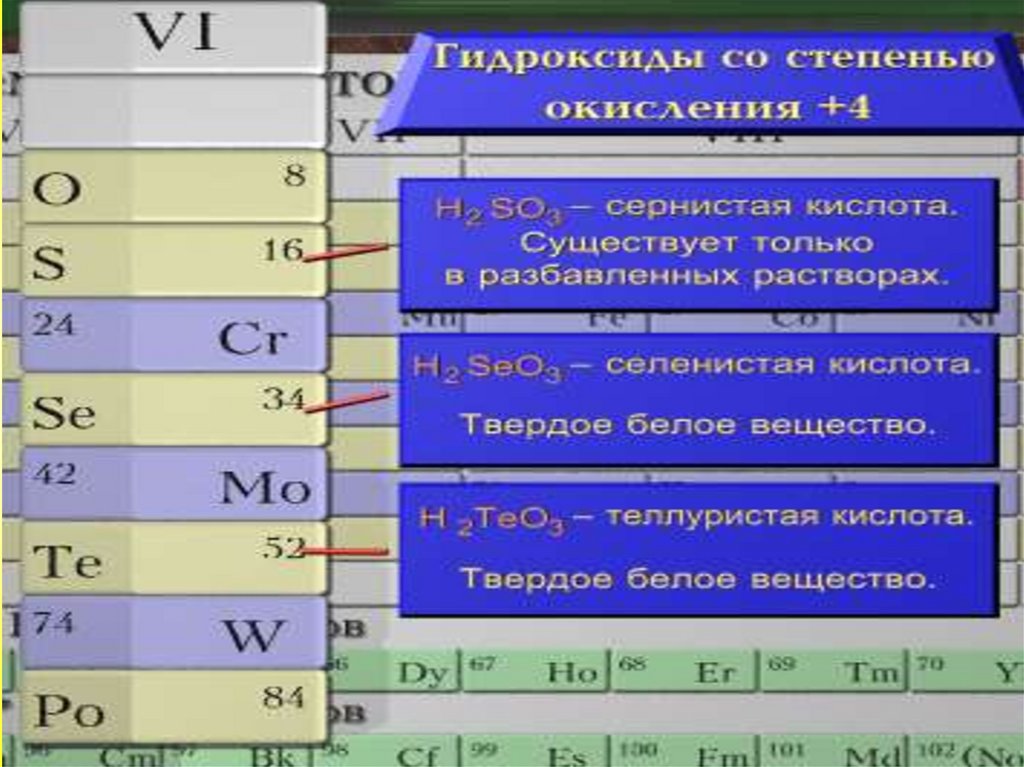
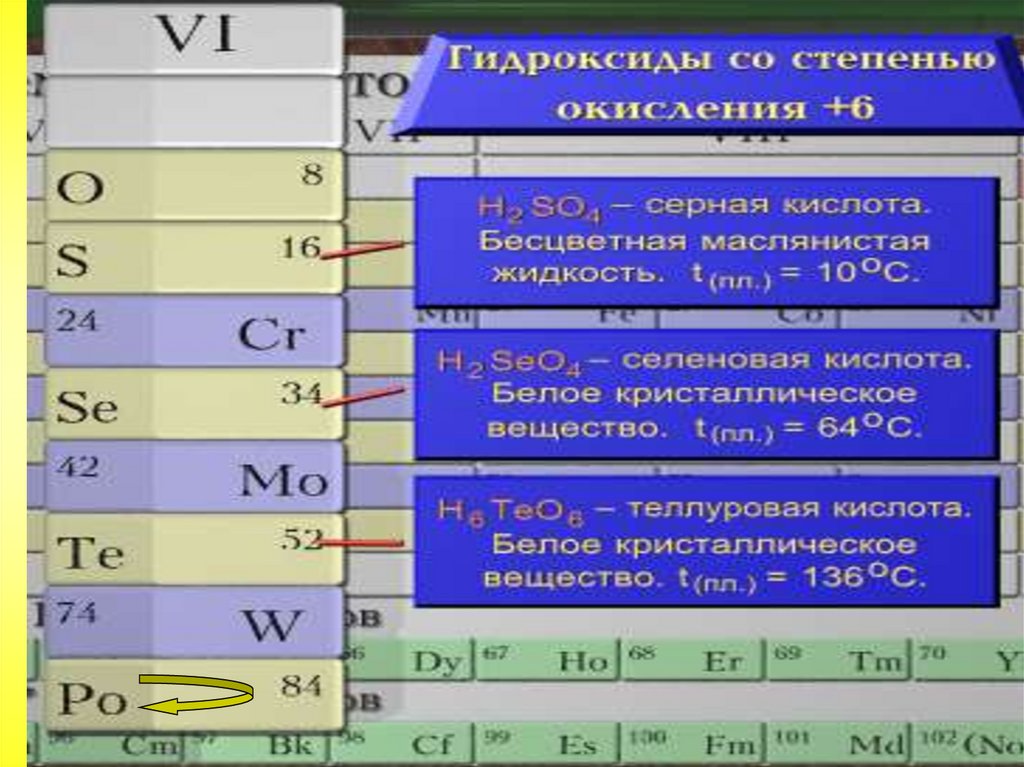
Общая характеристика VI-а подгруппыСера
Сероводород и сульфиды
Оксиды серы
Оксид серы (IV)
Оксид серы (VI)
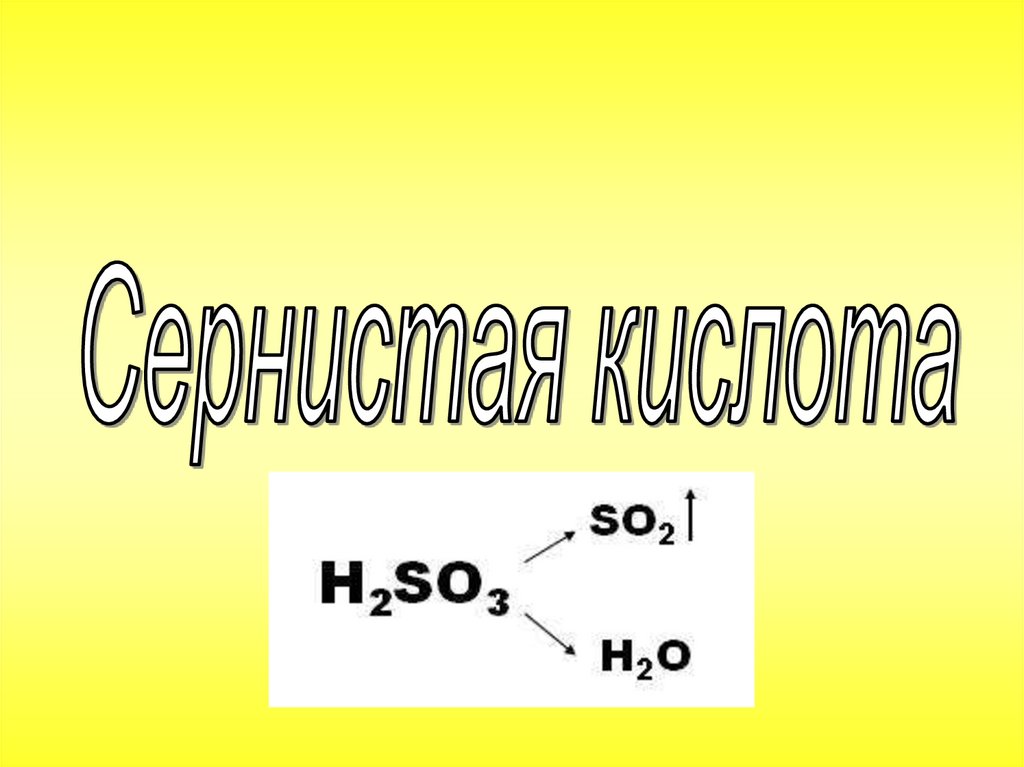
Сернистая кислота
Серная кислота
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
Немало сера знаменита,И в древности ее Гомер воспел,
С ней много тысяч лет прожито,
И человек в ней пользу разглядел.
15.
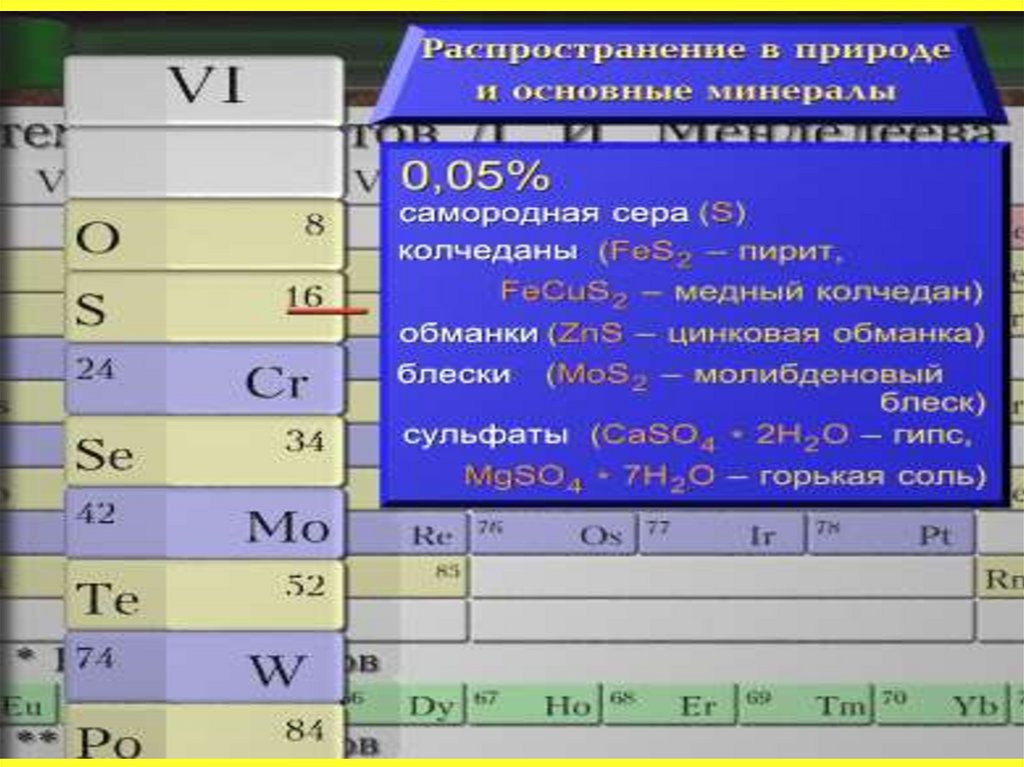
Сера известна с давних времен. В природе встречаетсяв свободном и связанном виде. Общее содержание серы
по массе в земной коре составляет около 0,1 % или 0,7 %
массы планеты. Главная масса серы в виде сульфидов
металлов находится в мантии Земли на глубине
1100–1400 км.
16.
17.
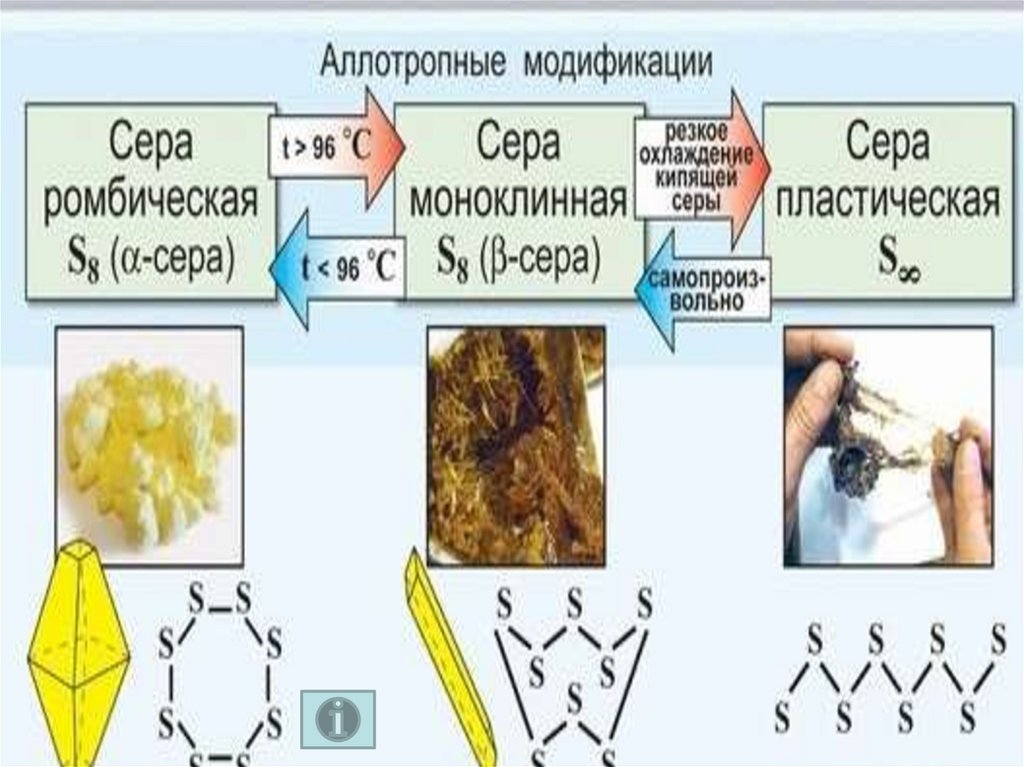
В воде сера не растворяется (всплывает),она растворима в органических растворителях.
Сера – диэлектрик.
18.
19.
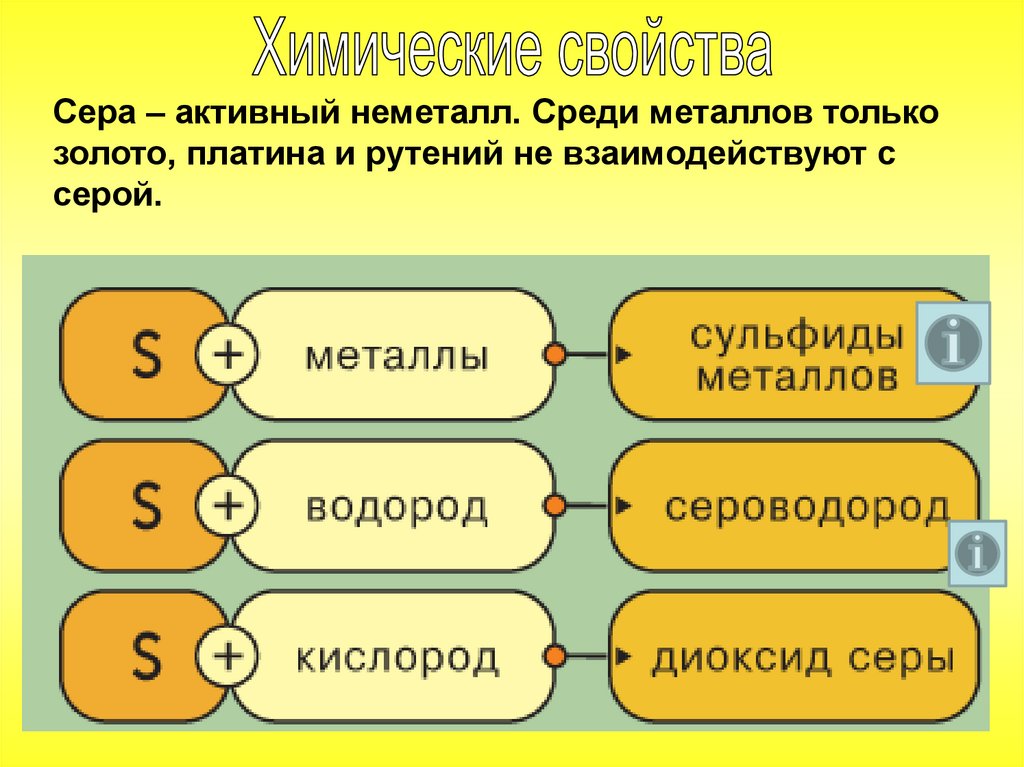
Сера – активный неметалл. Среди металлов толькозолото, платина и рутений не взаимодействуют с
серой.
20.
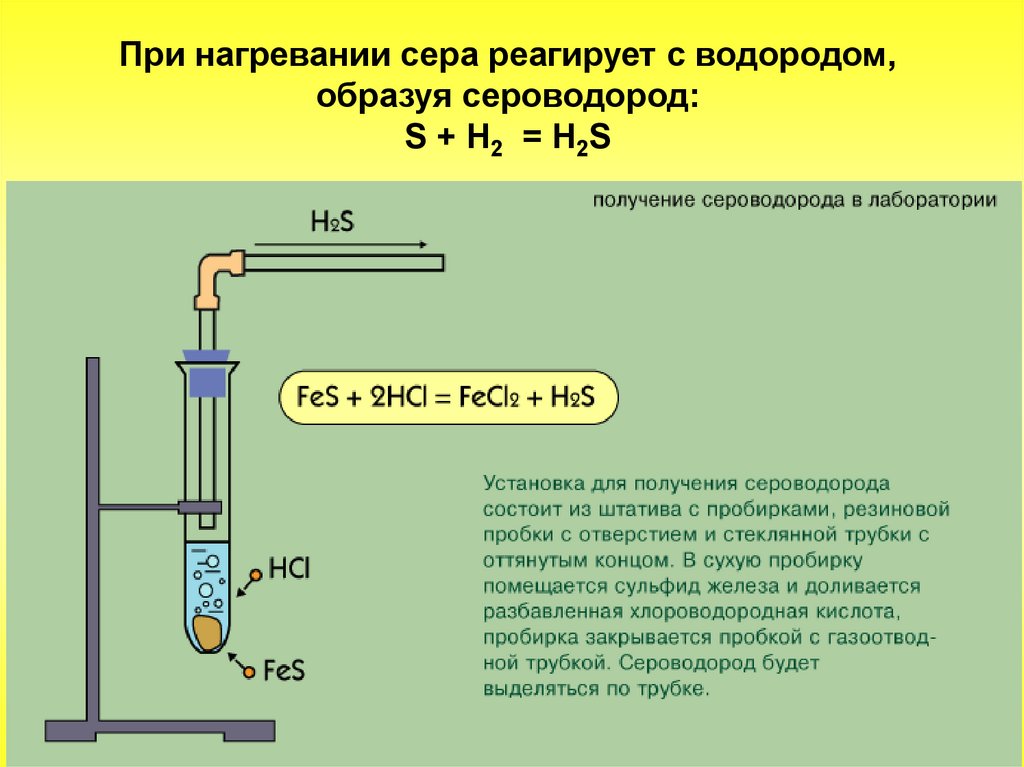
При нагревании сера реагирует с водородом,образуя сероводород:
S + Н2 = H2S
21.
Из металлов сера наиболее легко реагируетс ртутью, что используется для обезвреживания
мест, загрязненных ею (демеркуризация). При
нагревании может взаимодействовать с достаточно
большим количеством металлов, образуя
сульфиды.
Hg0 + S0 = Hg+2 S–2
Hg0 – 2e ––> Hg+2
S0 + 2e ––> S–2
22.
Сера взаимодействует со многими металлами,образуя сульфиды:
S + Fe = FeS
2Al + 3S = Al2S3
23.
Из неметаллов только азот и иод не соединяютсяс серой. Сжигание серы в струе кислорода приводит
к образованию сернистого газа или сернистого
ангидрида SO2:
S + O2 = SO2
24. 3. Взаимодействие серы со сложными веществами
Решить задачу: Упр. 2 (стр.194)2КСl O3 + 3S = 2КСl + 3SО2
• Такая реакция, в частности, лежит в основе «работы» спичек.
В них красный фосфор и сульфид сурьмы (III) Sb2S3 с помощью клея
наносится на боковую поверхность спичечного коробка, а головка
спички готовится обычно из бертолетовой соли, серы, стеклянного
порошка и клея. Под действием теплоты трения мельчайшие частички
красного фосфора превращаются в белый фосфор, который
воспламеняется на воздухе и поджигает головку спички
25.
Сера используется при вулканизации каучука,приготовления черного пороха, спичек,
ядохимикатов, для получения серной кислоты.
26.
27.
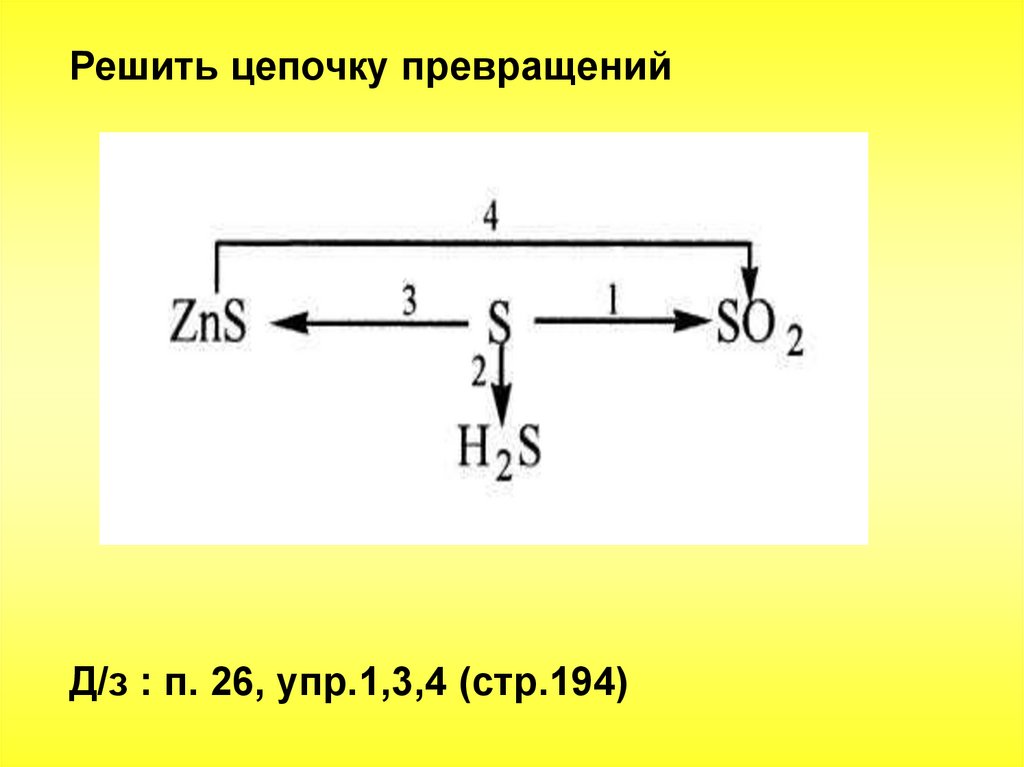
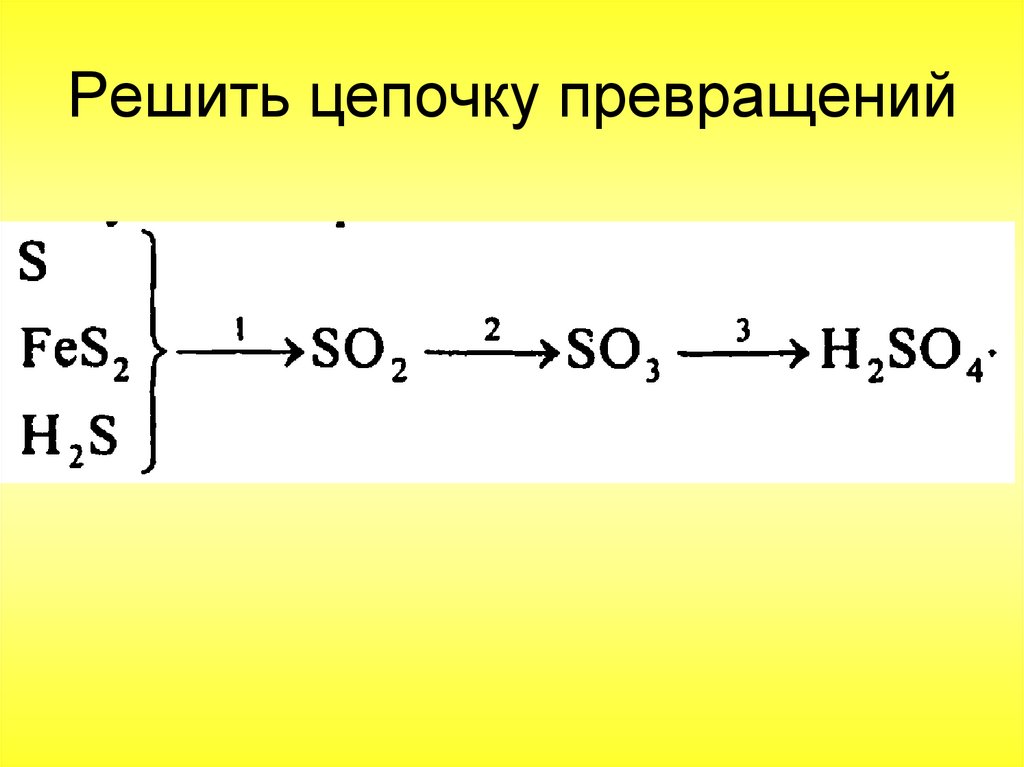
Решить цепочку превращенийД/з : п. 26, упр.1,3,4 (стр.194)
28.
29.
30.
31.
Сероводород – сильный восстановитель.Горит голубым пламенем с образованием сернистого
газа. В недостатке кислорода из-за неполного сгорания
образуется сера.
32.
33.
Сероводород взаимодействует с солями, если приэтом выделяется газ или образуется осадок.
Качественная
реакция на
сульфид-ион.
34.
Синтез из простых веществ:Из сульфидов:
35.
Раствор сероводорода в воде представляет собойслабую кислоту. Ступенчатая диссоциация идёт
преимущественно по первой ступени.
36.
При взаимодействии сероводородной кислотысо щелочами образует кислые и средние соли
(гидросульфиды и сульфиды).
37.
38.
SO2SO3
39.
40.
Как кислотный оксид взаимодействует с основнымиоксидами, основаниями, водой:
С солями более слабых кислот:
41.
Проявляет как восстановительные свойства:так и окислительные:
42.
Бесцветная, легкокипящаяжидкость.
Кислотный оксид.
Сильный окислитель.
Экзотермически реагирует с водой, образуя серную
кислоту.
43.
Как кислотный оксид взаимодействует с основнымиоксидами, щелочами, солями более слабых кислот.
Сильный окислитель
44.
45.
46.
47.
48.
49.
50.
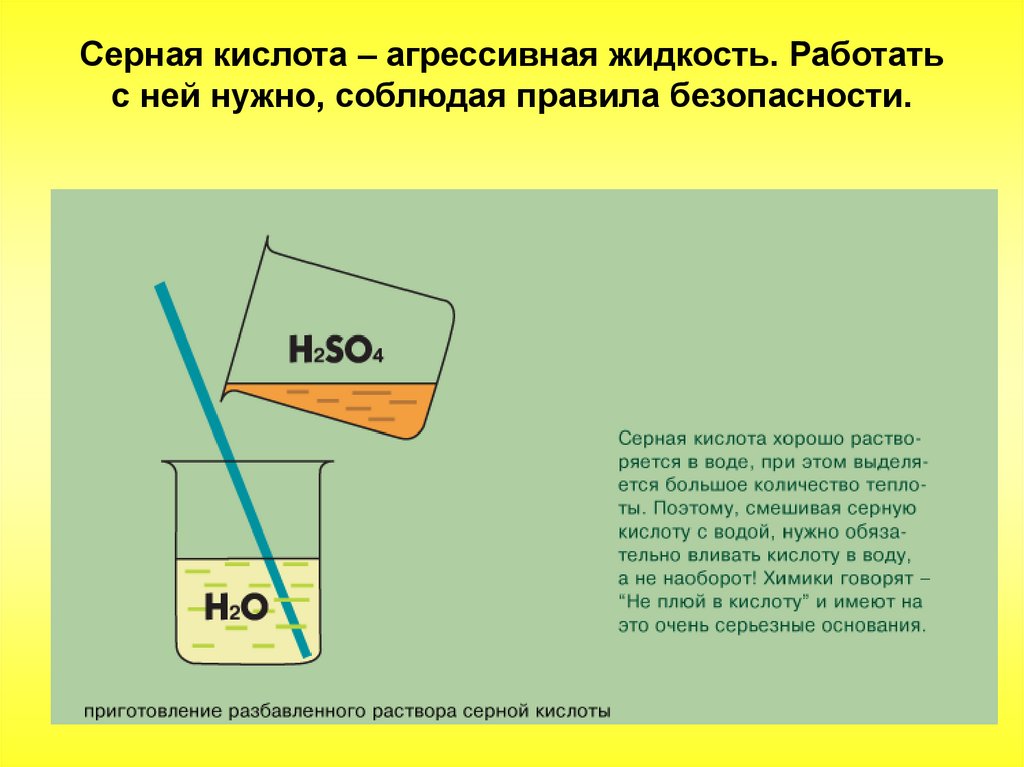
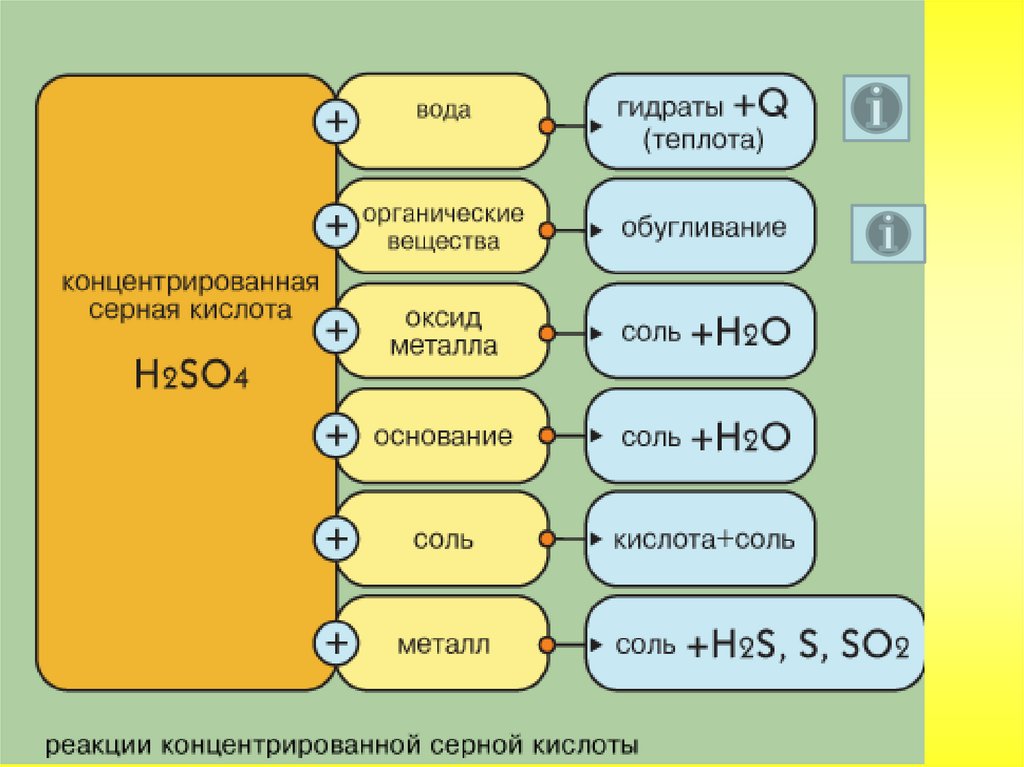
В обычных условиях серная кислота – тяжёлаябесцветная маслянистая жидкость. Очень
гигроскопична. Растворяясь в воде, выделяет
большое количество тепла.
51.
Серная кислота – агрессивная жидкость. Работатьс ней нужно, соблюдая правила безопасности.
52.
53.
54.
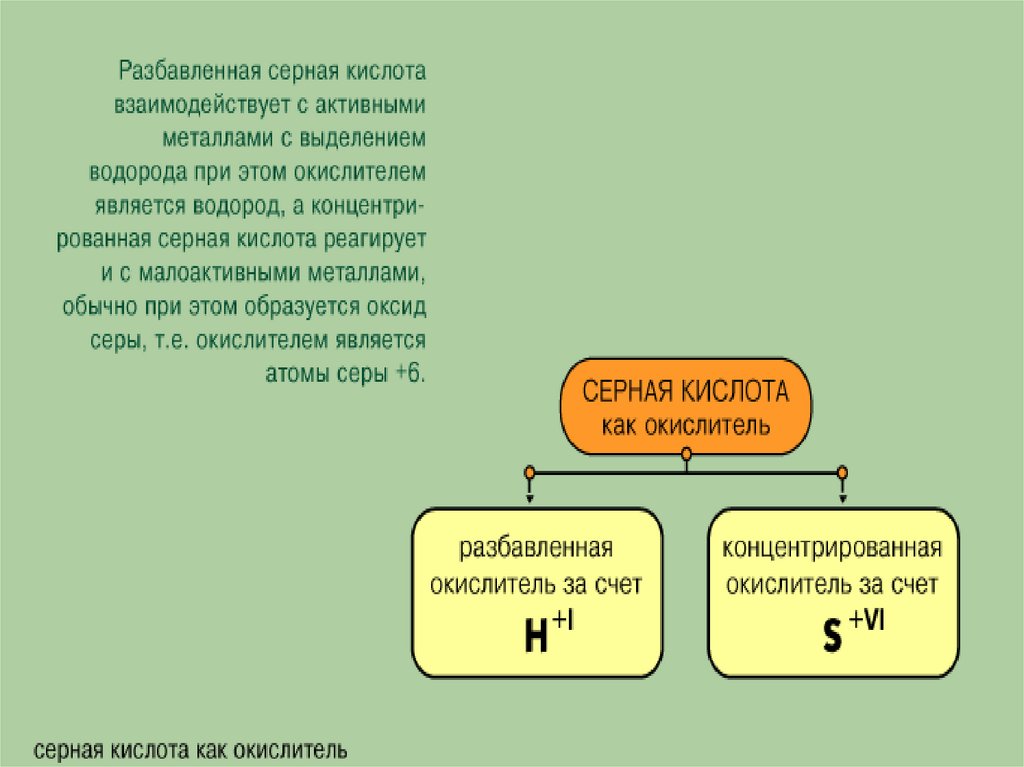
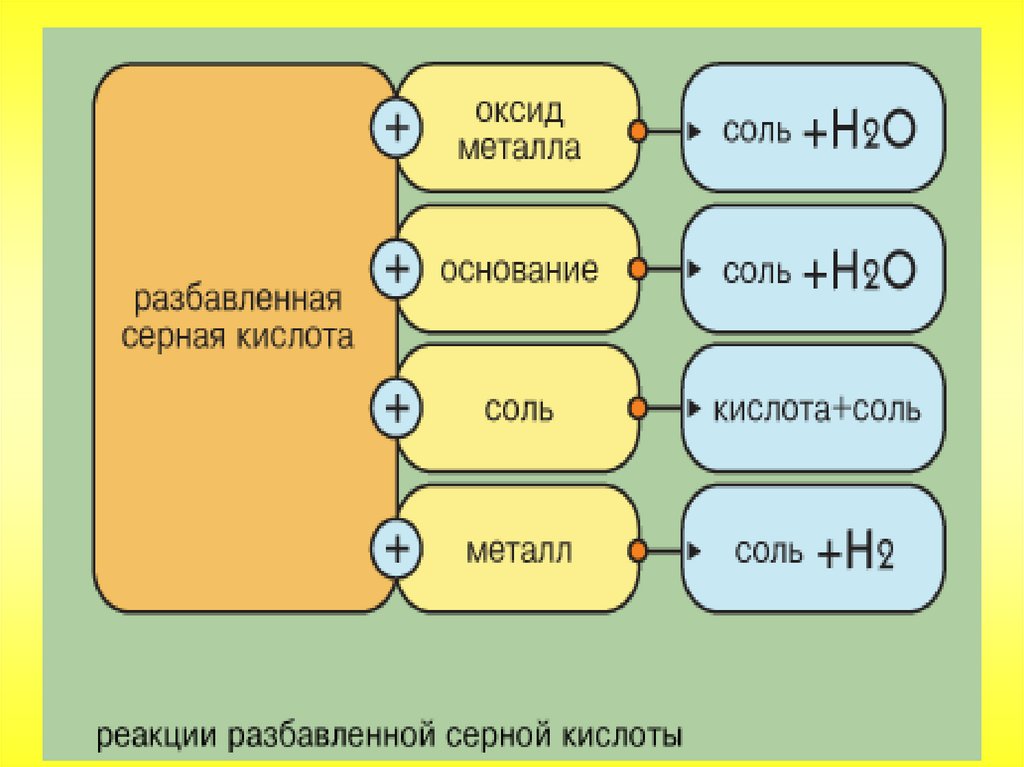
Разбавленная серная кислота проявляет свойствасильных электролитов. Диссоциирует ступенчато.
55.
56.
57.
58.
59.
60.
61.
62. Решить цепочку превращений
63.
64.
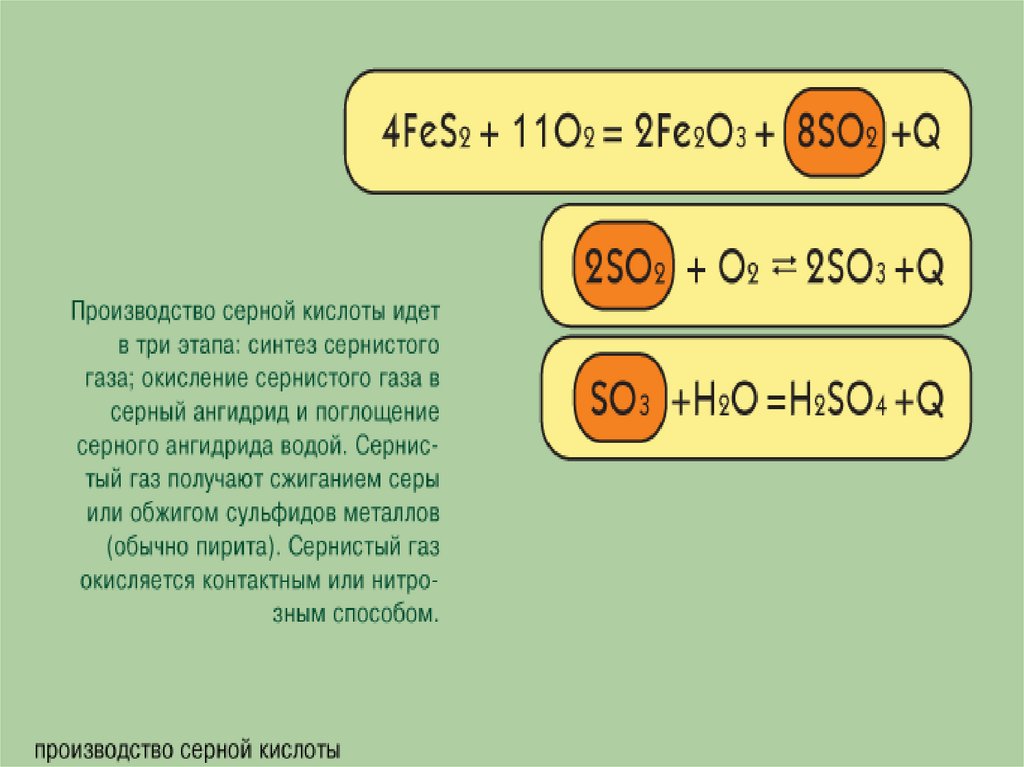
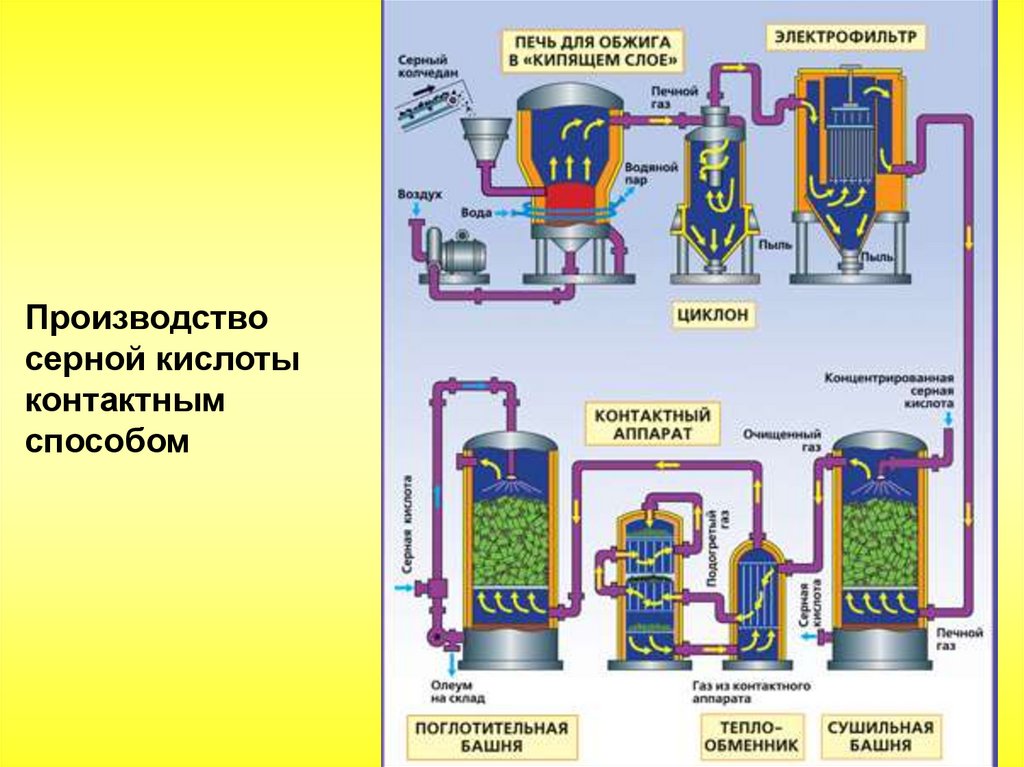
Производствосерной кислоты
контактным
способом
65.
66.
Соли серной кислоты – сульфаты.67. Домашнее задание
• П.22. упр. 2, 3 (стр.134)• П.23 упр. 3, 4 (стр.141)






































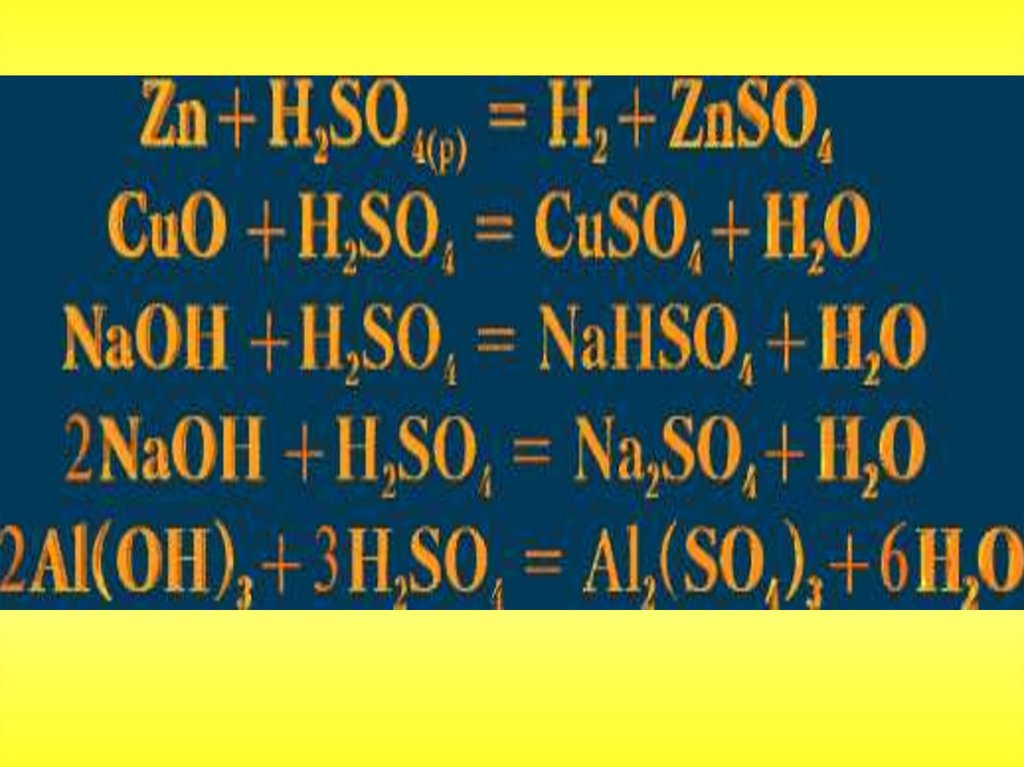







 chemistry
chemistry








