Similar presentations:
Объекты биотехнологии и их промышленное использование
1. ОБЪЕКТЫ БИОТЕХНОЛОГИИ И ИХ ПРОМЫШЛЕННОЕ ИСПОЛЬЗОВАНИЕ
2.
• Биотехнологические объекты находятсяна разных ступенях организации:
• а) субклеточные структуры (вирусы,
плазмиды, ДНК митохондрий и
хлоропластов, ядерная ДНК);
• б) бактерии и цианобактерии;
• в) грибы;
• г) водоросли;
• д) простейшие;
• е) культуры клеток растений и животных;
• ж) растения.
3.
• Биотехнологическое производство• Выделяют 5 стадий, этапов, или операций,
биотехнологического производства.
• Две начальные стадии включают подготовку
необходимой биологически действующего начала
и сырья. При осуществлении биологического
синтеза необходимы стадии приготовления
питательной среды и поддержания чистой
культуры, которая могла бы постоянно или по
мере необходимости использоваться в процессе.
Третья стадия - стадия ферментации, на
которой происходит образование целевого
продукта. На этой стадии идет превращение
компонентов питательной среды сначала в
биомассу, затем, если это необходимо, в целевой
метаболит.
4.
• На четвертом этапе из культуральной жидкостивыделяют и очищают целевые продукты.
Процессы
выделения
и
очистки,
часто
занимающие
важное
место
среди
др.
технологических
операций,
определяются
химической природой получаемого вещества и
могут
включать
экстракционные
и
хроматографические методы, кристаллизацию,
фильтрацию, осаждение и др. Заключительная
стадия
промышленного
производства
приготовление товарных форм продуктов. Общим
свойством
большинства
продуктов
биологического
синтеза
является
их
недостаточная
стойкость
к
хранению,
следовательно, на заключительной стадии
производства
крайне
важны
способы
стабилизации и консервации целевых продуктов.
5.
Выбор биотехнологических объектовПринципы подбора биотехнологических объектов
Штамм-продуцент должен характеризоваться
следующими свойствами:
1) способностью расти в чистой культуре и генетической
стабильностью;
2) отсутствием патогенности и токсичности;
3) высокой
скоростью
роста
при
массовом
культивировании и способностью синтезировать
продукт в большом количестве и за короткий
промежуток времени (до 3 суток);
4) устойчивостью к контаминации (например, за счет
изменения физико-химических условий среды,
способности к росту при повышенных температурах
или к синтезу антибиотиков);
5) способности расти на простых и дешевых
питательных средах.
6.
Биотехнологическое использование микроорганизмовусловно можно разбить на несколько основных групп:
1) получение живой или инактивированной микробной
биомассы;
2) получение продуктов метаболизма микроорганизмов
(антибиотики, гормоны, аминокислоты, витамины,
органические кислоты и т.д.);
3) получение ферментов микробного происхождения;
4) получение рекомбинантных продуктов;
5) биотрансформация веществ;
6) утилизация неприродных соединений.
7.
Бактерии и цианобактерииБактерии используются при производстве пищевых
продуктов (уксуса, молочнокислых продуктов и др.);
биоинсектицидов; белка; витаминов; растворителей и
органических кислот; биогаза и фотоводорода
(Halobacterium halobium). Уксуснокислые бактерии,
представленные родами Gluconobacter и Acetobacter,
превращают этанол в уксусную кислоту, а уксусную
кислоту в углекислый газ и воду. Сlostridium
acetobutylicum сбраживает сахара в ацетон, этанол,
изопропанол и n-бутанол; другие виды могут также
сбраживать
крахмал,
пектин
и
различные
азотсодержащие соединения.
8.
Гетероферментативные молочнокислые бактериирода Leuconostoc превращают углеводы в молочную
кислоту,
этанол
и
углекислый
газ.
Гомоферментативные молочнокислые бактерии рода
Streptococcus продуцируют только молочную кислоту,
а брожение, осуществляемое представителями рода
Lactobacillus, позволяет получить наряду с молочной
кислотой ряд разнообразных продуктов.
Corynebacterium glutamicum служит источником
аминокислот. Коринебактерии используются также
для микробного выщелачивания руд и утилизации
горнорудных отходов. Виды родов Streptomyces,
Bacillus и Micromonospora продуцируют широко
применяемые антибиотики.
9.
Многиебактериальные
полисахариды
обладают
выраженной
биологической
активностью,
обусловливающей
их
использование в медицине в качестве
лечебных и профилактических препаратов
(декстраны,
продигиозин
–
Serratia
marcescens, полисахариды бактерий родов
Alcaligenes, Agrobacterium и др.). Микробные
полисахариды могут быть основой для
создания
искусственных
вакцин
после
изменения их конфигурации или путем
конъюгации с синтетическими электролитами.
10.
Нейтральные декстраны с молекулярной массой около 75000(Leuconostoc mesenteroides) широко используются в качестве
заменителей плазмы крови. В фармацевтике полисахариды
используются как основа для лекарственных форм
(разрыхлители, стабилизаторы, эмульгаторы).
• Витамин B12 получают практически только путем микробного
синтеза. Основными продуцентами при этом служат
пропионовокислые бактерии, используются также Nocardia
rugosa,
виды
родов
Micromonospora,
Pseudomonas,
Clostridium, некоторые актиномицеты, а также комплекс
метанобразующих
бактерий,
использующих
отходы
бродильной промышленности.
• Некоторые бактерии способны к сверхсинтезу витамина B2 с
активным выделением его в среду, но в качестве
промышленных продуцентов используют, главным образом,
виды рода Nocardia, некоторые актиномицеты, микобактерии.
Штаммы рода Flavobacterium способны к продукции
зеаксантина, получаемого только путем микробного синтеза.
11.
• Все цианобактерии обладают способностью казотфиксации, что делает их весьма перспективными
продуцентами
белка.
Такие
представители
цианобактерий,
как
носток,
спирулина,
триходесмиум
съедобны
и
непосредственно
употребляются в пищу.
• В клетках Spirulina содержится 65% белков (больше,
чем в соевых бобах), 19% углеводов, 6% пигментов,
4% липидов, 3% волокон и 3% золы. Для белков этих
бпактерий характерно сбалансированное содержание
аминокислот.
Клеточная
стенка
хорошо
переваривается.
• Растет спирулина в щелочной среде при рН вплоть
до 11, в щелочных озерах она практически
доминирует. Урожайность очень высокая: расчеты на
год показали, что она превысит выход пшеницы
примерно в 10 раз.
12. Грибы
• используют для получения таких продуктов, как:• - антибиотики (Penicillium spp.);
• - гиббереллины и цитокинины (Fusarium spp., Botrytis
spp.);
• - каротиноиды (астаксантин – Rhaffia rhodozima,);
• - белок (Candida spp., Saccharomycopsis lipolytica);
• - спирты (Saccharomyces cerevisiae, Kluyveromyces
fragilis);
• - сыры типа рокфор и камамбер (Penicillium spp.);
• - соевый соус (Aspergillus oryzae);
• - токсины - афлатоксины В1, В2, G1, G2, М1 (Aspergillus
spp.), трихотеценовые микотоксины дезоксиниваленол и
зеараленон (Fusarium spp.), охратоксины, цитринин,
цитреовиридин (Aspergillus spp. и Penicillium spp.),
алкалоиды спорыньи, в т.ч. лизергиновая кислота и
агроклавин.
13.
• Из 500 известных видов дрожжей первымлюди научились использовать Saccharomyces
cerevisiae, этот вид наиболее интенсивно
культивируется. К дрожжам, сбраживающим
лактозу, относится Kluyveromyces fragilis,
который используют для получения спирта из
сыворотки.
Saccharomycopsis
lipolytica
деградирует углеводороды и употребляется для
получения белковой массы. Промышленные
дрожжи обычно не размножаются половым
путем, не образуют спор и полиплоидны, чем
объясняется
их
сила
и
способность
адаптироваться
к
изменениям
среды
культивирования.
14.
• Плесневые грибы в юго-восточной Азиииспользуют при гидролизе рисового крахмала в
производстве сакэ, гидролизе соевых бобов, риса
и солода. Пищевые продукты на основе
сброженных плесневыми грибами Rhizopus
oligosporus соевых бобов или пшеницы содержат
в 5 - 7 раз больше таких витаминов, как
рибофлавин, никотиновая кислота и отличаются
повышенным в несколько раз содержанием белка.
Грибы
также
продуцируют
ферменты,
используемые в промышленности (амилазы,
пектиназы и т.д.), органические кислоты и
антибиотики. Их применяют и в производстве
сыров, например, камамбера и рокфора.
15.
• «Жировые дрожжи», относящиеся к родамCryptococcus,
Rhodotorula,
Lipomyces,
Sporobolomyces, Trichosporon, как типичные
липидообразователи в нормальных условиях
синтезируют до 40% и более липидов. Среди
микроскопических
грибов
значительные
количества липидов (40-70%) способны
накапливать представители родов Penicillium,
Rhizopus, Fusarium, однако пока они не
получили
широкого
промышленного
распространения, хотя жир грибов по своему
составу близок к растительному.
16.
• Многие грибы способны к сверхсинтезу витаминаB2 с активным выделением его в среду, но в
качестве промышленных продуцентов употребляют,
главным образом, грибы Eremothecium ashbyii и
Ashbya gossipii. Среди грибов активными
продуцентами рибофлавина также являются
Aspergillus spр. Помимо свободного витамина, при
помощи Е. ashbyii получают также его
коферментные формы ФМН и ФАД, также широко
используемые в медицине при лечении дистрофии
сетчатки глаза и заболеваниях печени и
поджеледочной железы. Недостатком культуры Е.
ashbyii является ее нестабильность.
17.
• Культура мукоровых грибов Blakeslea trispora - самыйактивный синтетик, используемый в качестве продуцента
при промышленном биосинтезе β-каротина - провитамина
витамина А. Продуцентами β-каротина также являются
дрожжи рода Rhodotorula, грибы семейства Mucoraceae и
др.
• Эргостерин - провитамин витамина D2 - содержится в
клетках многих дрожжей и его количество в некоторых
случаях может достигать 10 % от сухой биомассы;
основным источником его промышленного получения
служат пекарские и пивные дрожжи, дрожжи
Rhodotorula, Candida и мицелиальные грибы аспергиллы
и пенициллы, в мицелии которых содержание стеринов
может достигать 2 % в расчете на сухую массу.
18. Гетеротрофные протисты
- противоопухолевые препараты круцин и трепаноза(Trypanosoma cruzi (Schizotrypanum
cruzi)),
астазилид (Astasia longa), парамилон (Astasia spp.,
Euglena spp.);
- продуценты белка и биологически активных веществ.
• Относятся к числу нетрадиционных объектов
биотехнологического использования. До недавнего
времени они применялись лишь как компонент
активного ила при биологической очистке сточных
вод. В настоящее время они привлекли внимание
исследователей как продуценты биологически
активных веществ.
19.
• Характерной особенностью протистовявляется высокое содержание в клетках
ненасыщенных
жирных
кислот,
составляющее у трипаносом 70-80 %, а у
Astasia
longa
(свободноживущий
жгутиконосец) – 60 % от количества всех
жирных
кислот.
У
жгутиконосцев
фосфолипиды
и
полиненасыщенные
жирные кислоты имеют такой же состав и
строение, как в организме человека и
животных.
20.
• Другой группой биологически активных веществпростейших являются полисахариды. Особый интерес
представляет парамилон, характерный для эвгленовых
жгутиконосцев. Представители родов Astasia и Euglena
способны к сверхсинтезу парамилона, составляющему
свыше 50 % сухого остатка клеток. Парамилон возможно
использовать как стимулятор иммунной системы
млекопитающих,
обладающий
выраженным
противоопухолевым, иммуномодулирующим действием и
низкой токсичностью.
• Биомасса простейших содержит до 50% белка. Его высокая
биологическая ценность заключается в том, что он
содержит все незаменимые аминокислоты, причем
содержание свободных аминокислот на порядок выше, чем
в биомассе микроводорослей, бактерий и в мясе. Это
свидетельствует о широких возможностях применения
свободноживущих протистов в качестве источника
кормового белка.
21. Водоросли
• - кормовой и пищевой белок (Chlorella spp.,Scenedesmus spp);
• - пищевые и витаминные добавки (Ulva spp.,
Porfira spp., Undaria spp., Rhodimenia spp.,
Alaria spp.);
• - глицерол (Dunaliella bardawil)
Среди
биотехнологических
штаммов
водорослей, широко используемых во всем
мире для получения ценных медицинских
препаратов, пищевых и кормовых добавок,
наибольший интерес представляют 3 рода Dunaliella, Chlorella и Scenedesmus.
22.
• Dunaliella–
одноклеточная
зеленая
водоросль
—
объект
массового
промышленного
культивирования
для
получения витаминов, липидов, спиртов (в
частности,
этанола)
и
антибиотиков.
Особенно
интенсивно
эта
водоросль
используется
для
получения
в
промышленных
масштабах
глицерола,
каротина и полиненасыщенных жирных
кислот, являющихся предшественниками
простагландина и препятствующих развитию
атеросклероза и других заболеваний.
• Для роста этим водорослям необходимы: морская
вода, углекислый газ и солнечный свет.
23.
• Chlorella (С. vulgaris, С. ellipsoidea, С.руrenoidosa и др.) –одноклеточная зеленая водоросль – активный продуцент
белков, углеводов, липидов, витаминов с легко регулируемым
соотношением этих соединений при изменении условий
культивирования. По качеству продуцируемого белка хлорелла
превосходит все известные кормовые и пищевые продукты: в
нем имеются все необходимые аминокислоты, в том числе
незаменимые. В клетках хлореллы присутствуют каротин,
витамины B1, В2, В3, В6, B12, С, D, К, РР, Е, пантотеновая
кислота, фолиевая кислота, биотин. По содержанию витаминов
хлорелла превосходит дрожжи. Хлорелла рекомендуется как
терапевтическое и общеукрепляющее средство, повышающее
иммунный статус организма.
Гидролизаты белка зеленой водоросли Scenedesmus
используются в медицине и косметической промышленности.
Их биомасса после соответствующей обработки используется
в качестве добавки в рационы скота, а также в пищевых целях
24.
• Ширококультивируются
ламинария
и
порфира
дальневосточных или северных морей. Ламинария наряду с
хлореллой является самой популярной съедобной и кормовой
водорослью.
• Известны и другие съедобные макрофитные водоросли —
ульва, из которой делают разные зеленые салаты, а также
алария, родимения, хондрус, ундария и др.
• Одним из самых ценных продуктов, получаемых из красных
водорослей, является агар – полисахарид, присутствующий в
их оболочках и состоящий из агарозы и агаропектина.
Количество его доходит до 30-40 % от веса водорослей
(водоросли анфельция, лауренция, грацилярия, гелидиум).
• Бурые водоросли являются единственным источником
получения одних из самых ценных веществ водорослей –
солей альгиновой кислоты – альгинатов, широко
используемых в различных областях народного хозяйства.
• Бурые водоросли богаты также весьма полезным соединением
— шестиатомным спиртом маннитом, который с успехом
применяют в пищевой промышленности, фармацевтике, при
производстве бумаги, красок, взрывчатки и др.
25.
• Выбор процесса ферментации зависит не только отпотребностей организма, но и от того, для чего будет
использована культура, то есть, от конечной цели
эксперимента.
• 1) по состоянию питательной среды или по основной
фазе (поверхностные и глубинные);
• 2) по наличию или отсутствию перемешивания
(динамические или статические);
• 3) по содержанию кислорода (на аэробные или
анаэробные);
• 4) по способу действия (закрытые, чаще периодические,
и открытые, чаще непрерывные);
• 5) по количеству ферментеров (одно-, дву- и
многостадийные);
• 6) по способу управления (хемостатные, турбидостатные,
оксистатные, рН-статные и другие);
• 7) по степени защищенности от посторонней микрофлоры;
• 8) по числу видов микроорганизмов.
26.
27.
Твердофазное культивирование
Используется в основном для выращивания грибов. В
качестве твердой фазы могут выступать различные виды
растительного сырья.
Дешевое производство и возможность использования
субстратов, которые непригодны для других способов
культивирования.
Некоторые
процессы
протекают
значительно
интенсивнее.
Варианты твердофазного культивирования:
1. Поверхностное («тонкий слой»),
2. Глубинное в неперемешиваемом слое («высокий
слой»),
3. Культивирование в перемешиваемой и аэрируемой
массе.
28.
• Преимуществами такого способа культивированияявляются простота конструкций биореакторов
(растильных, или бродильных, камер), систем
подачи воздуха и регулирования температурновлажностного режима.
• К недостатком относят низкую эффективность
использования субстрата и продуктивность;
сложность
механизации
и
автоматизации
процесса
культивирования,
стерилизации,
загрузки-разгрузки
лотков
и
кювет;
нестерильность процесса.
29.
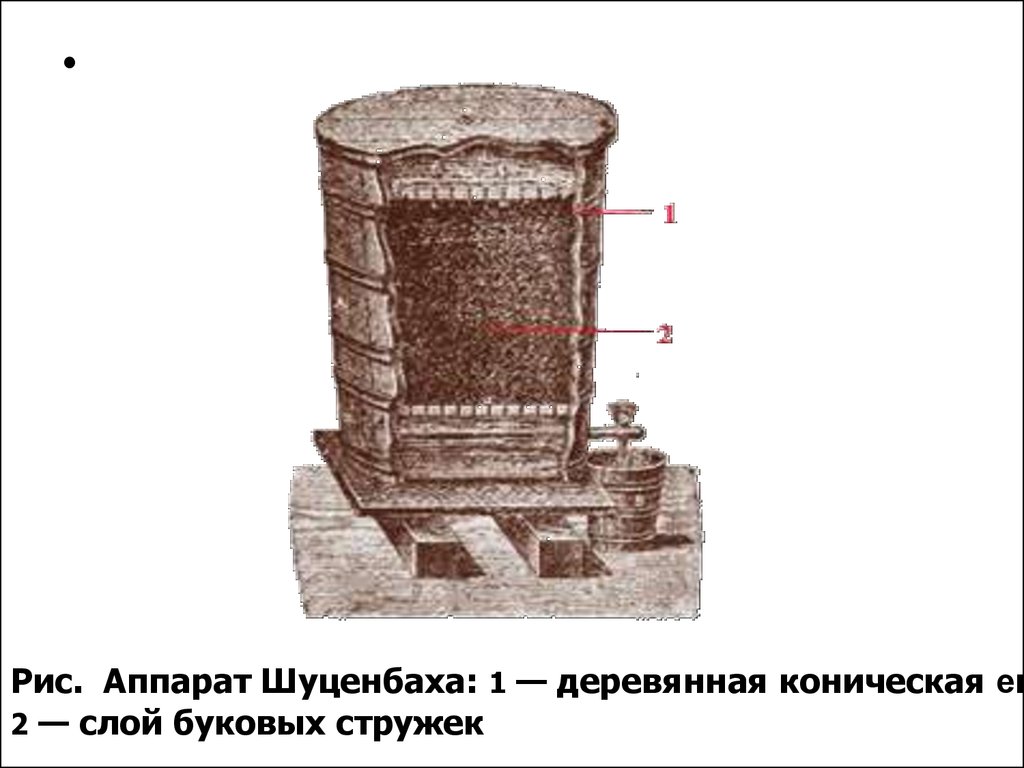
Рис. Аппарат Шуценбаха: 1 — деревянная коническая ем
2 — слой буковых стружек
30.
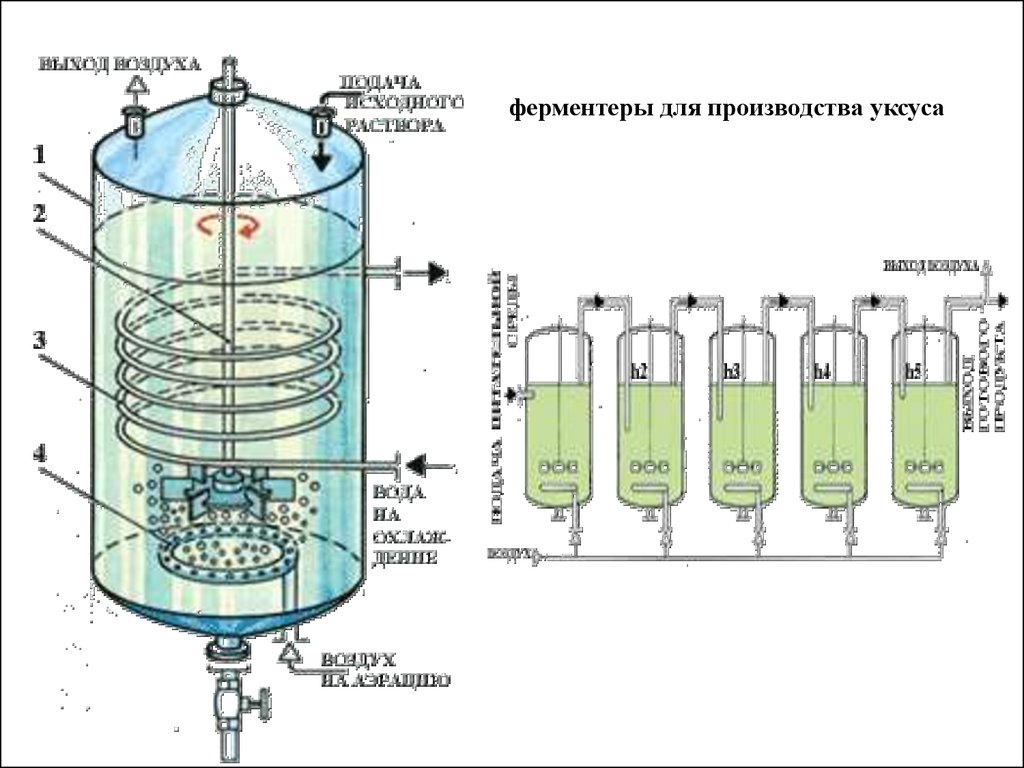
• Рис. 2. Аппарат Фрингса:
• 1 — корпус; 2 — ложное перфорированное днище; 3 —
слой буковых стружек; 4 — циркуляционный насос; 5 —
змеевик
системы
термостатирования;
6
—
распределительное устройство стружек.
31.
ферментеры для производства уксуса32.
• В поверхностных твердофазных процессах рольбиореакторов выполняют большие, площадью до
нескольких кв. метров, лотки, или подносы, из
алюминия или культивационные камеры. При
твердофазной ферментации процесс протекает в
вентилируемых растильных камерах, в которых на
стеллажах размещают лотки с твердой средой. Для
лучшей аэрации среды подаваемый в камеру воздух
проходит через перфорированное днище лотков.
• В большинстве твердофазных процессов отсутствует
перемешивание, рост микроорганизмов происходит
по принципу колонизации: по мере размножения они
распространяются из точек внесения в субстрат по
всему его объему. При этом отдельные зоны в толще
субстрата избыточно населяются клетками и
возникает локальная нехватка питательных ресурсов,
значительная часть субстрата остается незатронутой.
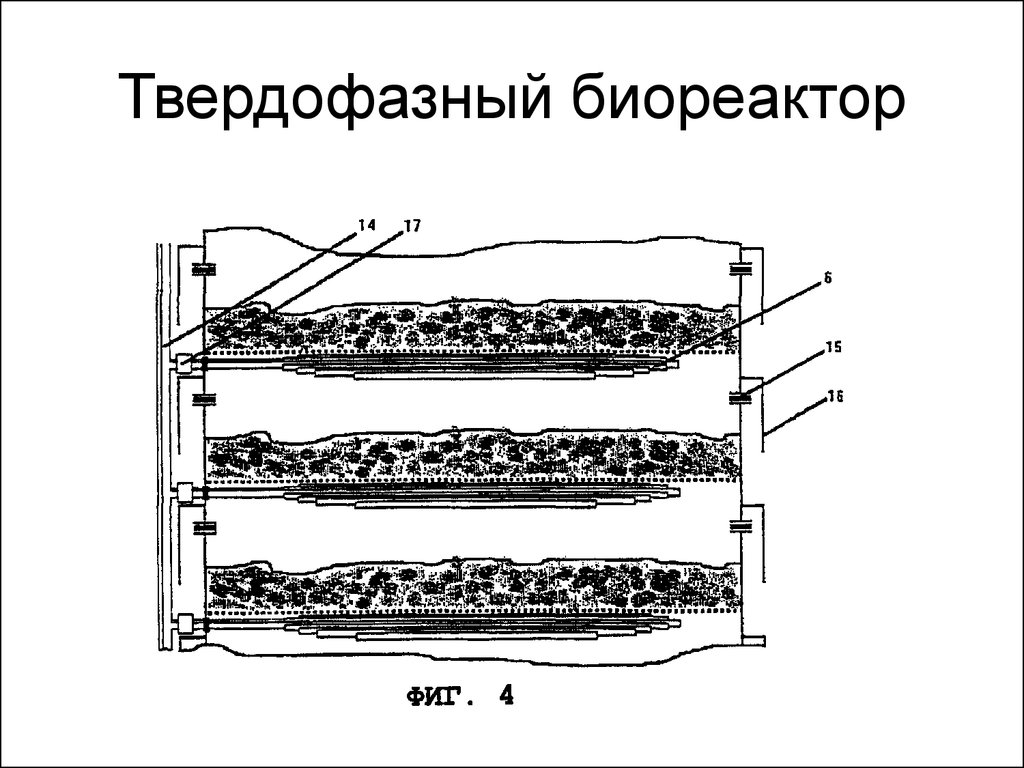
33. Твердофазный биореактор
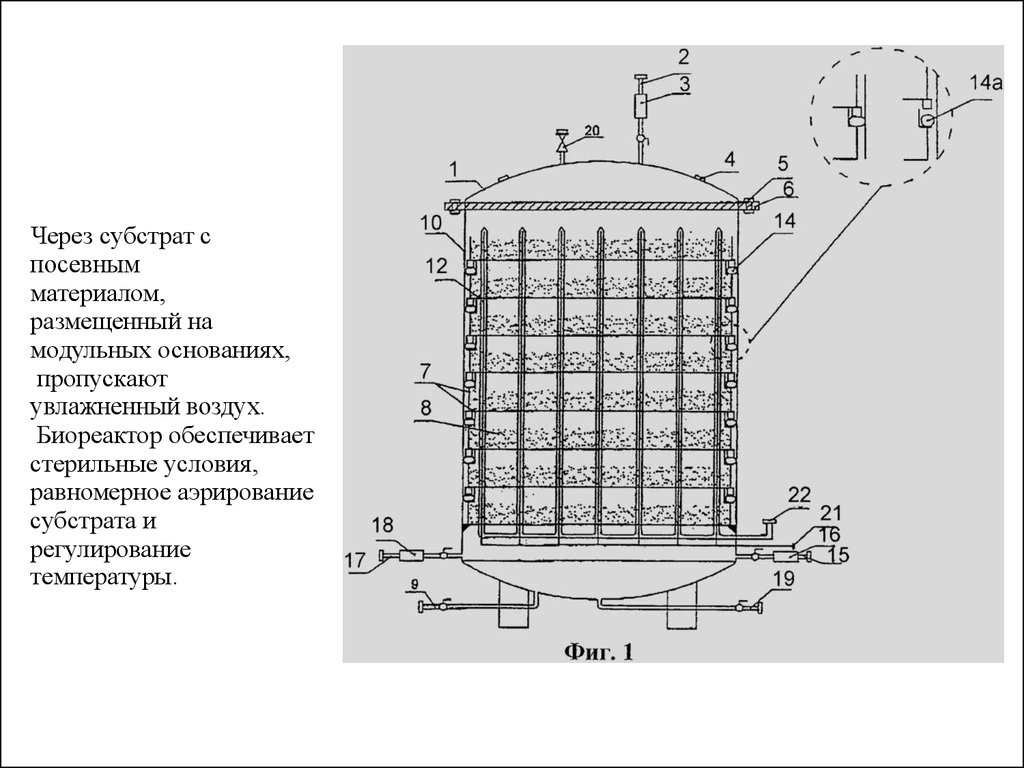
34. Через субстрат с посевным материалом, размещенный на модульных основаниях, пропускают увлажненный воздух. Биореактор обеспечивает стерил
Через субстрат спосевным
материалом,
размещенный на
модульных основаниях,
пропускают
увлажненный воздух.
Биореактор обеспечивает
стерильные условия,
равномерное аэрирование
субстрата и
регулирование
температуры.
35. Жидкофазное поверхностное культивирование
• Поверхностныежидкофазные
процессы
в
биотехнологических
производствах
используют
для
культивирования мицелиальных грибов при получении
органических кислот, ферментных препаратов, кормовой
биомассы. Для этих целей применяется кюветный способ
культивирования. Среда загружается в стерильные кюветы,
размещаемые на открытых стеллажах в растильных камерах с
регулируемым
температурно-влажностным
режимом.
Вентиляцию помещений осуществляют очищенным и
стерильным воздухом, который одновременно выполняет
функцию теплового агента.
• Микроорганизмы растут в виде пленки биомассы на
поверхности жидкой питательной среды.
• После завершения процесса культуральная жидкость сливается
из кювет через вмонтированные в днища штуцеры и поступает
на обработку.
36.
• Процессы суспензионного или глубинногокультивирования
• Простейшая классификация процессов суспензионного или
глубинного культивирования:
• 1)периодическое культивирование;
• 2)продленное оптимизированное периодическое
культивирование с подпиткой или без нее;
• 3)многоциклическое культивирование;
• 4)полунепрерывное культивирование;
• 5) непрерывное культивирование.
37.
• Периодическое культивирование• Периодический метод культивирования предусматривает
внесение посевного материала в питательную среду
(инокуляция клетками среды) в начале процесса и
получение культуры по достижении заданной фазы
развития популяции.
• Концентрация
микроорганизмов
в
периодической
культуре нарастает и останавливается либо из-за
лимитирования субстратом, либо из-за ингибирования
токсичными продуктами жизнедеятельности.
• Практически
все
системы
периодического
культивирования
являются
закрытыми,
поскольку
микроорганизмы в них размножаются и проходят все фазы
развития без притока питательной среды и оттока
культуральной жидкости.
38. Многоциклическое культивирование
• Многоциклическимипроцессами
культивирования называют такие, в которых цикл
выращивания культуры повторяется многократно
без многократной стерилизации емкости.
• Зависимость концентрации микроорганизмов и
удельной скорости роста от времени в каждом
цикле многоциклического процесса имеет
характер, аналогичный таковому в периодическом
процессе.
39. Продленное периодическое оптимизированное культивирование
• Продленныйпериодический
процесс
культивирования,
как
и
периодический,
предусматривает
одноразовую
загрузку
и
разгрузку ферментера. Однако цикл развития
микроорганизмов в продленном периодическом
процессе удлиняется либо за счет подпитки
(периодической или непрерывной), либо за счет
длительного удержания клеток в системе
(диализ).
40. Культивирование с подпиткой
• Если зависимость удельной скорости роста отколичества субстрата имеет насыщение, то исходную
концентрацию субстрата можно задать сразу
побольше в пределах плато, где влияние субстрата на
скорость роста биомассы невелико или вообще
отсутствует. В этом случае пока концентрация
субстрата не снизится до критического уровня
подпитку можно не производить.
• Если зависимость удельной скорости роста биомассы
от концентрации субстрата имеет экстремум, то
подпитка требуется уже с самого начала процесса для
поддержания его на оптимальном уровне.
• Подпитка может осуществляться импульсно или по
каплям на протяжении всего процесса.
41.
• Варианты способ управления подпиткой:• 1. Заранее рассчитывается программа
изменения подпитки во времени, и субстрат
подается в аппарат без информации о том, с
какой скоростью его потребляет культура.
Это может привести как к избытку, так и к
недостатку субстрата в среде.
• 2. Субстрат подается по одному из
косвенных параметров, связанных с ростом
культуры.
• Культивирование
подпитками.
с
повторяющимися
42. Диализные системы
• Диализ – исторический первый метод очистки –был предложен Т. Грэхемом в 1861 г. для удаления
из системы низкомолекулярных веществ.
• Суть этого метода заключается в том, что культура
развивается в пространстве, ограниченном
полупроницаемой мембраной, а продукты
диффундируют во внешний раствор.
43. Диализные мембраны
• Диализные мембраны задерживают клетки имакромолекулы, но проницаемы для таких мелких
молекул, как основные питательные компоненты,
требующиеся микроорганизмам для их роста.
• Диализные
мембраны
изготавливают
из
пергамента, целлофана,
ацетатцеллюлозы,
полиамида, поликарбоната, кремния и др.
• Для
микробиологических
целей
следует
принимать во внимание такие факторы, как
автоклавируемость мембран, размер их пор,
высокий
уровень
отсечки,
химическая
инертность и проницаемость (которая в свою
очередь определяется пористостью, емкостью и
толщиной мембраны), а также наибольший
экономический коэффициент.
44.
• Диализные культуры применяются в основном в трех случаях:• 1) для концентрирования недиффундирующего продукта,
• 2) для уменьшения концентрации диффундирующего
продукта, ингибирующего рост клеток, и повышения выхода
биомассы,
• 3) для накопления и отделения от клеток диффундирующего
продукта.
• Преимущества процесса диализа: 1) работа в мягких
условиях температуры и рН; 2) отсутствие органических
растворителей; 3) возможность высокой степени очистки
клеток от примесей низкомолекулярных соединений, солей и
металлов.
• Недостатки: 1) низкая скорость диализа, определяемая
молекулярной диффузией; 2) возможность обрастания
диализных мембран и забивания их пор.
45.
• Для повышения эффективности диффузионного способакультивирования объем диализной жидкости должен быть
значительно больше объема диализуемой культуры, или
же диализную жидкость следует менять.
• Кроме того, мембраны должны иметь достаточную
площадь, чтобы обеспечивалась удовлетворительная
скорость диффузии.
• К специфическим преимуществам использования диализа
при культивировании микроорганизмов относятся: 1)
удлинение экспоненциальной фазы роста в периодической
культуре, что позволяет получать высокие плотности живых
клеток; 2) увеличение стационарной фазы роста культур,
что позволяет увеличить выход метаболитов, связанных с
этой фазой; 3) удаление или разведение ингибирующих
продуктов метаболизма; 4) получение метаболитов,
свободных от клеток, и, наоборот, клеток, свободных от
макромолекул среды.
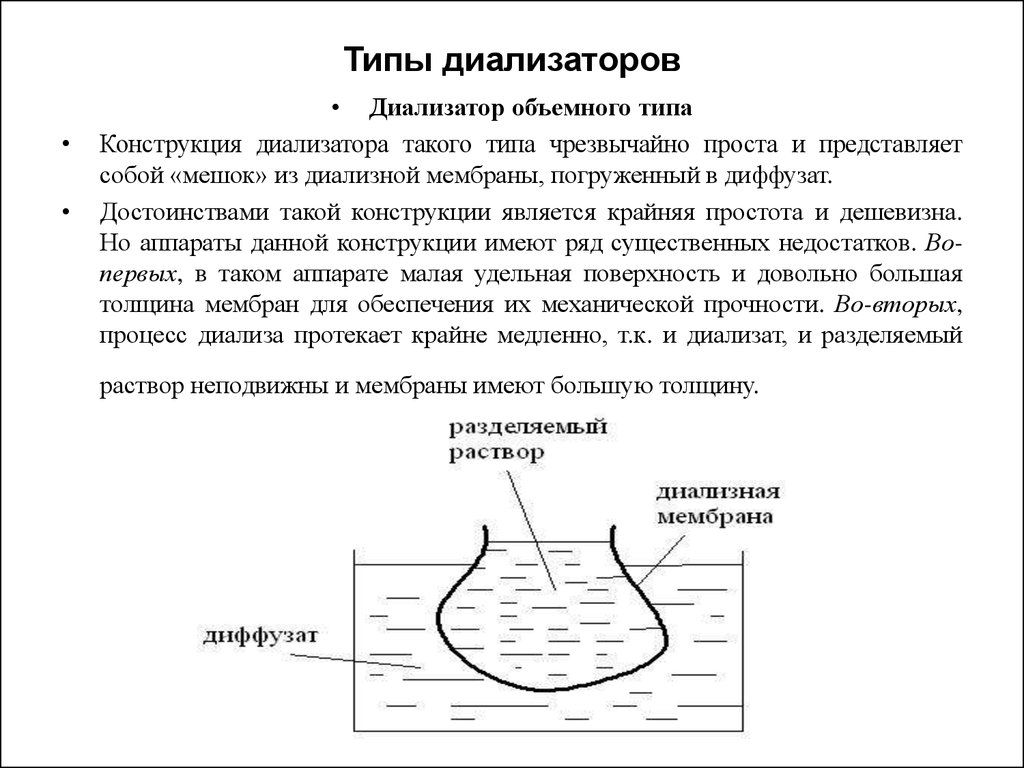
46. Типы диализаторов
• Диализатор объемного типа
Конструкция диализатора такого типа чрезвычайно проста и представляет
собой «мешок» из диализной мембраны, погруженный в диффузат.
Достоинствами такой конструкции является крайняя простота и дешевизна.
Но аппараты данной конструкции имеют ряд существенных недостатков. Вопервых, в таком аппарате малая удельная поверхность и довольно большая
толщина мембран для обеспечения их механической прочности. Во-вторых,
процесс диализа протекает крайне медленно, т.к. и диализат, и разделяемый
раствор неподвижны и мембраны имеют большую толщину.
47. Аппарат этого типа включает мембрану в виде трубки, свернутой в спираль (змеевик), погруженную в емкость с диализатом. За счет конструктивн
• Конструкция диализатора змеевикового типаАппарат этого типа включает мембрану в виде трубки, свернутой в спираль
(змеевик),
погруженную
в
емкость
с
диализатом.
За счет конструктивных особенностей увеличивается площадь мембраны, а за
счет прокачивания разделяемого раствора внутри змеевика, интенсифицируется
массообмен (возрастает коэффициент массоотдачи).
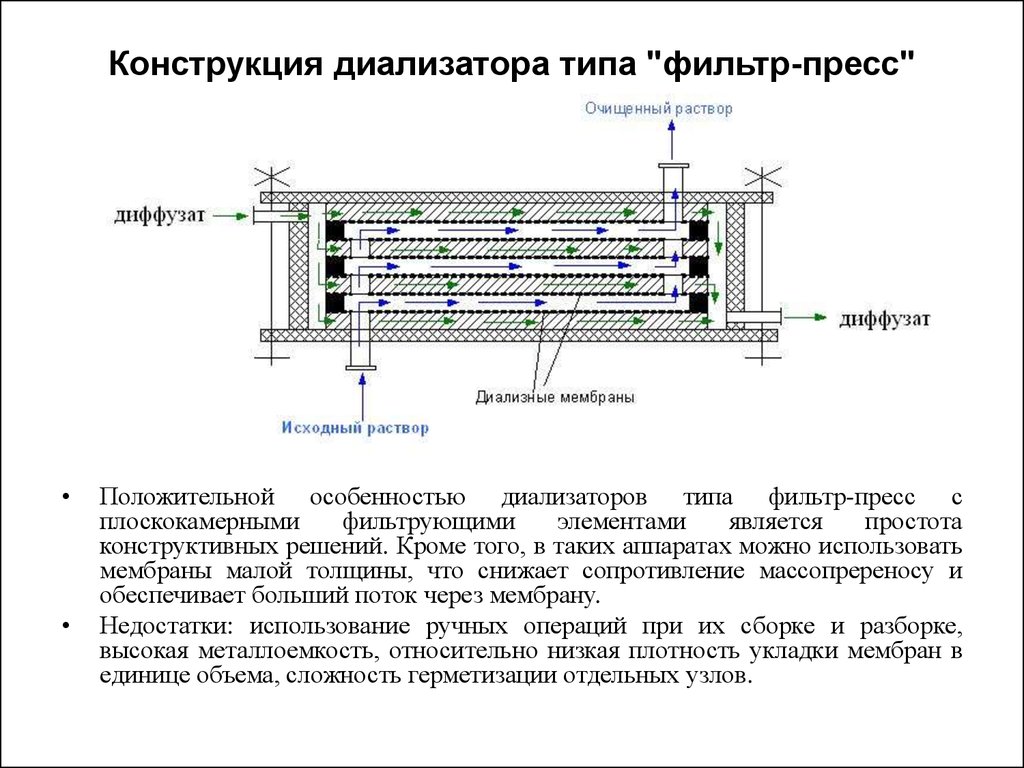
48. Конструкция диализатора типа "фильтр-пресс"
Конструкция диализатора типа "фильтр-пресс"Положительной особенностью диализаторов типа фильтр-пресс с
плоскокамерными
фильтрующими
элементами
является
простота
конструктивных решений. Кроме того, в таких аппаратах можно использовать
мембраны малой толщины, что снижает сопротивление массопререносу и
обеспечивает больший поток через мембрану.
Недостатки: использование ручных операций при их сборке и разборке,
высокая металлоемкость, относительно низкая плотность укладки мембран в
единице объема, сложность герметизации отдельных узлов.
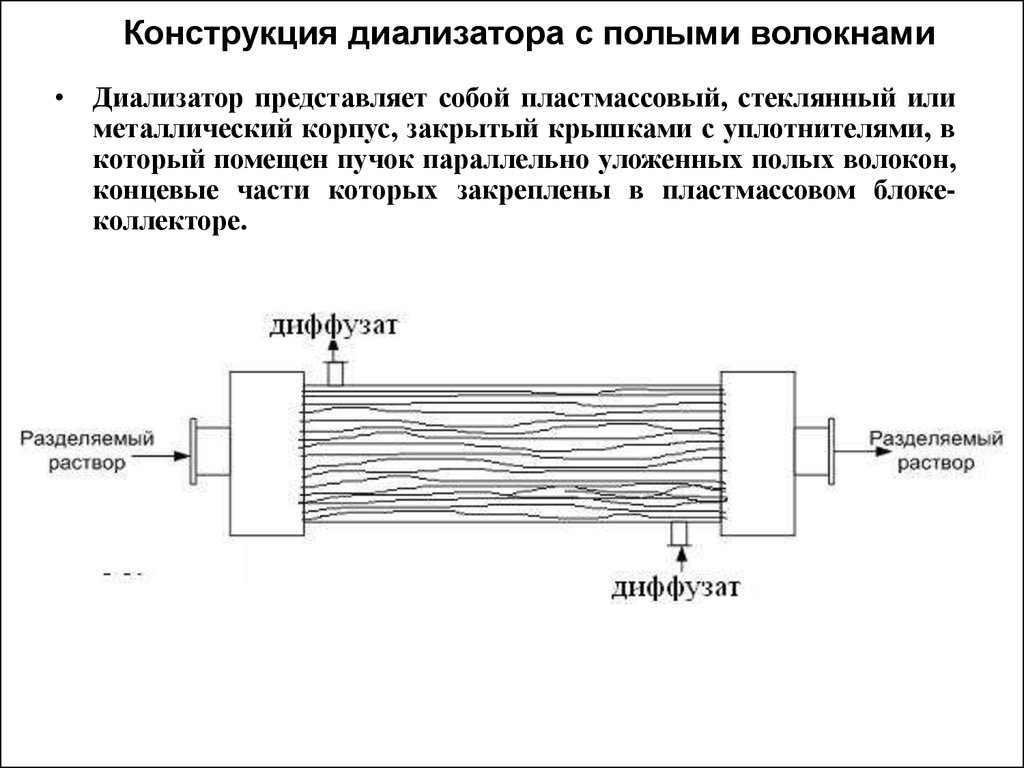
49. Конструкция диализатора с полыми волокнами
• Диализатор представляет собой пластмассовый, стеклянный илиметаллический корпус, закрытый крышками с уплотнителями, в
который помещен пучок параллельно уложенных полых волокон,
концевые части которых закреплены в пластмассовом блокеколлекторе.
50. Электродиализ
• Некоторых недостатков диализа удается избежать за счет примененияэлектродиализа (Доре, 1910). В этом случае параллельно мембранам
и диализуемой жидкости накладывается электрическое поле, в
результате чего анионы и катионы из раствора диффундируют через
диализные мембраны к аноду и катоду, а клетки остаются в растворе.
В простейшем случае электродиализатор состоит из 3 камер,
отделенных друг от друга полупроницаемыми мембранами –
центральной для обрабатываемого раствора, а также для пермеата в
зоне анода и пермеата в зоне катода по обеим сторонам от
центральной камеры. Мембраны при катоде и при аноде могут быть
выполнены из разного материала, селективного для катионов и
анионов.
• Недостатком электродиализа является выделение при высоком
напряжении большого количества тепла, что может привести к
необратимым изменениям в системам с биологическими
компонентами.
51. Полунепрерывное культивирование
• В полунепрерывных системах полная загрузка и разгрузкаферментера осуществляются однократно, однако в
процессе роста культуры часть ее сливается, а
освободившийся объем заливается свежей питательной
средой, т.е. функционирует отъемно-доливная или
сливно-доливная система.
• Следовательно,
полунепрерывное
культивирование
характеризуется частотой и объемом сливаемой выросшей
культуры и добавлением свежей питательной среды в
рабочую емкость ферментера.
• Установившиеся
режимы
полунепрерывного
культивирования
характеризуются
колебанием
концентрации микроорганизмов около одной и той же
постоянной величины и относительным постоянством
средней удельной скорости роста популяции.
• Различные
варианты
полунепрерывных
систем
используются в производстве дрожжей, водорослей,
антибиотиков, лимонной кислоты и других.
52. Непрерывное культивирование
• В отличие от периодического культивирования внепрерывных процессах питательная среда подается
непрерывно, удаление биомассы и продуктов ее
жизнедеятельности также осуществляется непрерывно.
• По такому принципу организуются 2 разновидности
процессов непрерывного культивирования: процессы
полного (идеального) смешения или хемостатные
процессы и процессы полного вытеснения или
тубулярные процессы.
• Установившиеся режимы непрерывного культивирования
характеризуются
постоянством
концентрации
микроорганизмов и удельной скорости роста популяции.
• Непрерывное культивирование проводится в открытой
динамической системе, которая может быть как
гомогенной, так и гетерогенной. Эта система способна к
длительной работе в постоянном установившемся режиме.
53.
• Хемостатные процессы непрерывногокультивирования
• Гомогенные системы идеального смешения
• Если в процессе непрерывной ферментации плотность
популяции клеток определяется химическим составом среды
(концентрацией лимитирующего рост фактора), его
называют хемостатным культивированием. Изменяя
концентрацию лимитирующего рост фактора, можно
изменять плотность популяции, т.е. изменяя скорость
разбавления, можно получать режимы, обеспечивающие
различную скорость роста популяции.
• В системе идеального смешения микроорганизмы растут в
биореакторе
при
интенсивном
перемешивании
в
культуральной среде, постоянной по своему составу, и,
следовательно, в каждый данный момент времени находятся
в одном и том же физиологическом состоянии, т.е. в
состоянии установившегося динамического равновесия.
54.
• В установившемся режиме скорость протока среды, отнесенная кединице объема
культуры
в
ферментере,
называется
коэффициентом разбавления (D) и равняется удельной скорости
роста. При этом культура находится в устойчивом стационарном
состоянии динамического равновесия и обладает способностью
самопроизвольно автоматически подстраиваться к изменениям
условий.
• В хемостате практически можно только приблизиться к
максимальной удельной скорости роста, но не достичь ее, потому
что такая скорость роста соответствует критической скорости
разбавления, при которой биомасса вымывается из ферментера,
что является одним из существенных недостатков хемостата.
• Для борьбы с данным явлением возможно использовать комплекс
«ферментер-сепаратор». В этом комплексе выходящая из
ферментера жидкость сгущается на сепараторе, и часть
сгущенного потока непрерывно возвращается в ферментер,
остальная часть идет как товарный продукт. Основными
направлениями
использования
рециркуляции
являются:
повышение
производительности
системы
непрерывного
культивирования и более полное потребление субстрата из среды.
55.
• Одностадийный хемостат применяется при необходимостивоспроизвести любую скорость роста клеток, кроме максимальной.
Двухстадийный позволяет создавать культуры при скорости роста,
близкой к максимальной, и определять условия ее повышения. Для
этого в первом ферментере ведется культивирование при скорости
разбавления, меньшей чем удельная скорость роста, а во второй
подается культура из первого.
• Особенности двухстадийного хемостата:
• 1. Вымывания культуры во втором ферментере не происходит из-за
непрерывного поступления культуры из первого. Следовательно,
концентрация биомассы никогда не сможет стать равной нулю при
любой скорости разбавления. Будет возрастать удельная скорость
роста клеток и экономический коэффициент.
• 2. Концентрация субстрата во втором аппарате меньше, чем в
первом. Субстрат расходуется из запаса входящего потока. Это имеет
значение в тех случаях, когда важен не только выход биомассы, но и
ее чистота.
• 3. Концентрация биомассы во втором аппарате всегда выше, чем в
первом (учитывается прирост биомассы).
• 4. Двухстадийный хемостат часто оказывается удобным для тех
процессов, в которых целевым продуктом является не биомасса, а
метаболиты.
56.
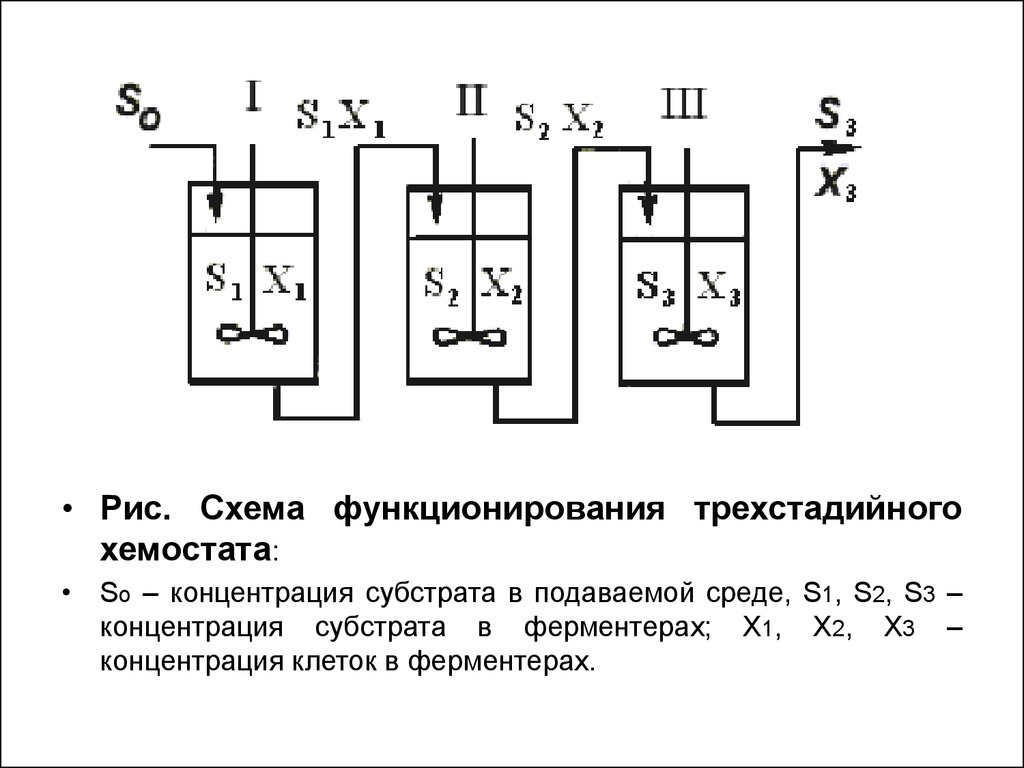
57.
• Рис. Схема функционирования трехстадийногохемостата:
• So – концентрация субстрата в подаваемой среде, S1, S2, S3 –
концентрация субстрата в ферментерах; Х1, Х2, Х3 –
концентрация клеток в ферментерах.
58.
• Другой широко известный принцип управленияпроцессом – турбидостат. В нем подача питательной
среды осуществляется по команде фотоэлектрического
элемента, регистрирующего оптическую плотность
культуры. Скорость разбавления сама устанавливается
в соответствии с заданной плотностью популяции.
• Этим турбидостат отличается от хемостата, в котором
фиксируется скорость разбавления, соответственно
которой устанавливается концентрация биомассы.
• Турбидостат позволяет получать максимальные
скорости
роста,
которые
применяются
при
культивировании клеточных культур, фиксированных в
стадии экспоненциального роста. Хемостаты же
применяют при скоростях разбавления от самой низкой
до только приближающейся к максимальной удельной
скорости роста.
59.
• Рис. Схема работы турбидостата:• So – концентрация субстрата в подаваемой среде,
• S1 – концентрация субстрата в вытекающей культуре,
• Х – концентрация клеток.
60.
• В настоящее время разработаны различныеварианты
непрерывного
культивирования
микроорганизмов, работающие по принципу
турбидостата – pH-стат, оксистат, СО2-стат,
теплостат, респиростат, вискозистат и т. д.,
названия которых соответствуют задаваемому
параметру. Любой параметр, который изменяется
в периодической культуре и на который
существует датчик, может быть использован для
управления ростом по типу турбидостата.
• Управляющими
параметрами
могут
быть
комплексные параметры, например, содержание
кислорода и углекислоты в отходящем воздухе,
характеризующие дыхательный коэффициент.
61. Тубулярные процессы непрерывного культивирования
• Системы культивирования полного вытесненияЭтот
способ
культивирования
используется
для
анаэробных условий. Открытая система полного
вытеснения отличается от системы идеального смешения
тем, что культура в ней не перемешивается и представляет
собой поток жидкости через трубку. Наиболее
распространенным аппаратом является трубчатый реактор,
который может иметь различную форму (прямую, Sобразную, спиральную) и устанавливается горизонтально
или вертикально. Питательная среда и посевной материал
смешиваются на входе и непрерывно поступают в аппарат
без обратного смешения. В аппарате башенного типа
жидкость движется снизу вверх.
62.
• В момент подачи среды и посевного материала навходе в трубчатый реактор, популяция клеток
находится в начале цикла развития. По ходу трубки
культура
стареет,
субстрат
исчерпывается,
накапливаются продукты метаболизма, и вытекающая
культура находится в состоянии, аналогичном
стационарной фазе роста периодической культуры.
Следовательно,
система
полного
вытеснения
представляет собой пространственный, проточный
вариант периодической культуры. Такая культура за
время от посева до выгрузки проходит через все
стадии периодической культуры, т. е. фазы роста
распределены не во времени, а в пространстве,
причем каждой части ферментера в установившемся
режиме
соответствует
определенный
отрезок
ростовой кривой.
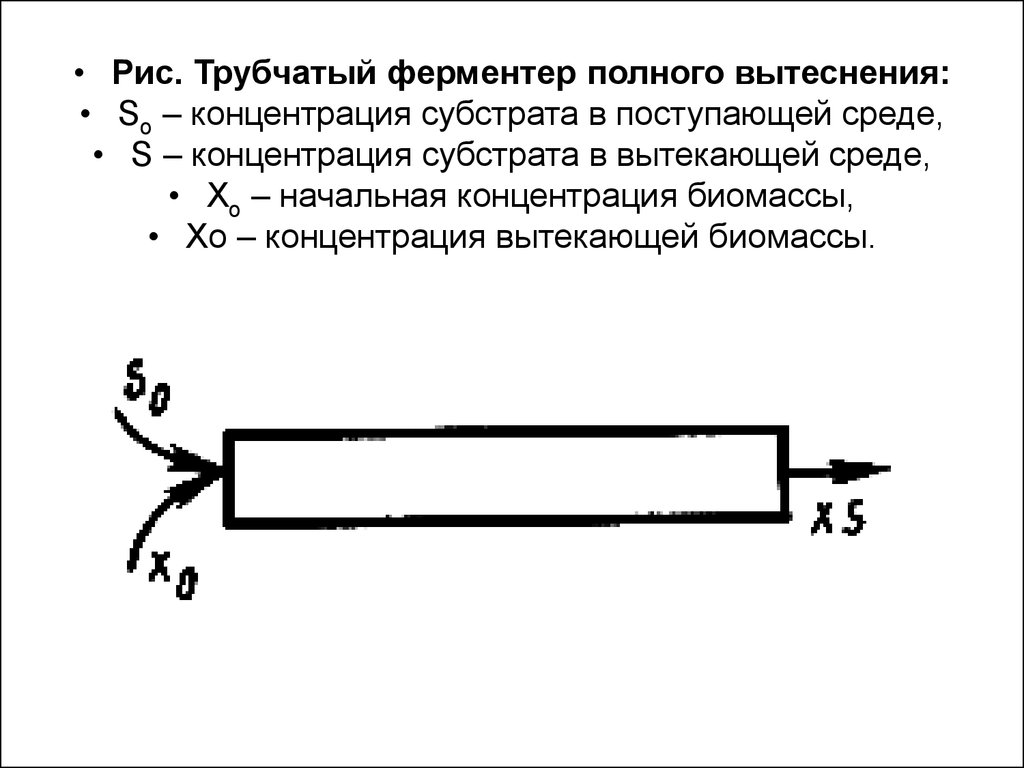
63.
• Рис. Трубчатый ферментер полного вытеснения:• So – концентрация субстрата в поступающей среде,
• S – концентрация субстрата в вытекающей среде,
• Хо – начальная концентрация биомассы,
• Хо – концентрация вытекающей биомассы.
64.
• Преимуществом тубулярного процесса являетсявозможность более полного исчерпания субстрата
(как и в периодическом процессе), недостатком
– большая склонность к контаминации и
невозможность организовать аэрацию по всей
длине аппарата.
65.
• Культуры клеток высших растений• Можно назвать несколько направлений создания
современных биотехнологий на основе культивируемых
клеток растений:
• 1.
Получение
биологически
активных
веществ
растительного
происхождения:
- традиционных продуктов вторичного метаболизма
(токсинов, гербицидов, регуляторов роста, алкалоидов,
стероидов,
терпеноидов,
имеющих
медицинское
применение);
• - новых необычных соединений, что возможно благодаря
исходной
неоднородности
клеточной
популяции,
генетической изменчивости культивируемых клеток и
селективному отбору клеточных линий со стойкими
модификациями, а в некоторых случаях и направленному
мутагенезу.
66.
• Кроме того, суспензионные культуры могутприменяться как мультиферментные системы,
способные
к
широкому
спектру
биотрансформаций химических веществ, в
результате
чего
получают
уникальные
биологически активные продукты на основе
синтетических соединений или веществ
промежуточного обмена растений.
• 2. Ускоренное клональное микроразмножение
растений, позволяющее из одного экпланта
получать от 10000 до 1000000 генетически
идентичных растений в год.
• 3. Получение безвирусных растений.
67.
• 4.Использование
эмбриокультуры
и
оплодотворения in vitro для преодоления
постгамной несовместимости или щуплости
зародыша при получения растений после
отдаленной гибридизации.
• 5. Антерные культуры – культуры пыльников и
пыльцы – используются для получения гаплоидов
и дигаплоидов.
• 6. Клеточный мутагенез и селекция. Тканевые
культуры
в
результате
сомаклонального
варьирования позволяют получать регенеранты,
фенотипически и генотипически отличающиеся
от исходного материала, даже без мутагенной
обработки.
68.
• 7. Криоконсервация и другие методы сохранениягенофонда.
• 8. Иммобилизация растительных клеток.
• 9. Соматическая гибридизация на основе слияния
растительных протопластов.
• 10. Конструирование клеток путем введения
различных клеточных органелл.
• 11. Генетическая трансформация на хромосомном
и генном уровнях.
• 12. Изучение системы «хозяин – паразит» с
использованием вирусов, бактерий, грибов и
насекомых).
69.
• Культуры клеток высших растений• Методы создания клеточных культур растений
• Методы культивирования изолированных фрагментов
растений основаны на исследовании такого важного
свойства растительной клетки, как тотипотентность
(свойство
клетки
реализовывать
генетическую
информацию, обеспечивающую ее дифференцировку и
развитие до целого организма). В экспериментальных
условиях при выращивании эксплантов возможна
реализация
супрессированной
в
естественных
условиях
тотипотентности
под
действием
фитогормонов.
• Следует отметить, что в отличие от животной,
растительная клетка предъявляет менее жесткие
требования к условиям культивирования.
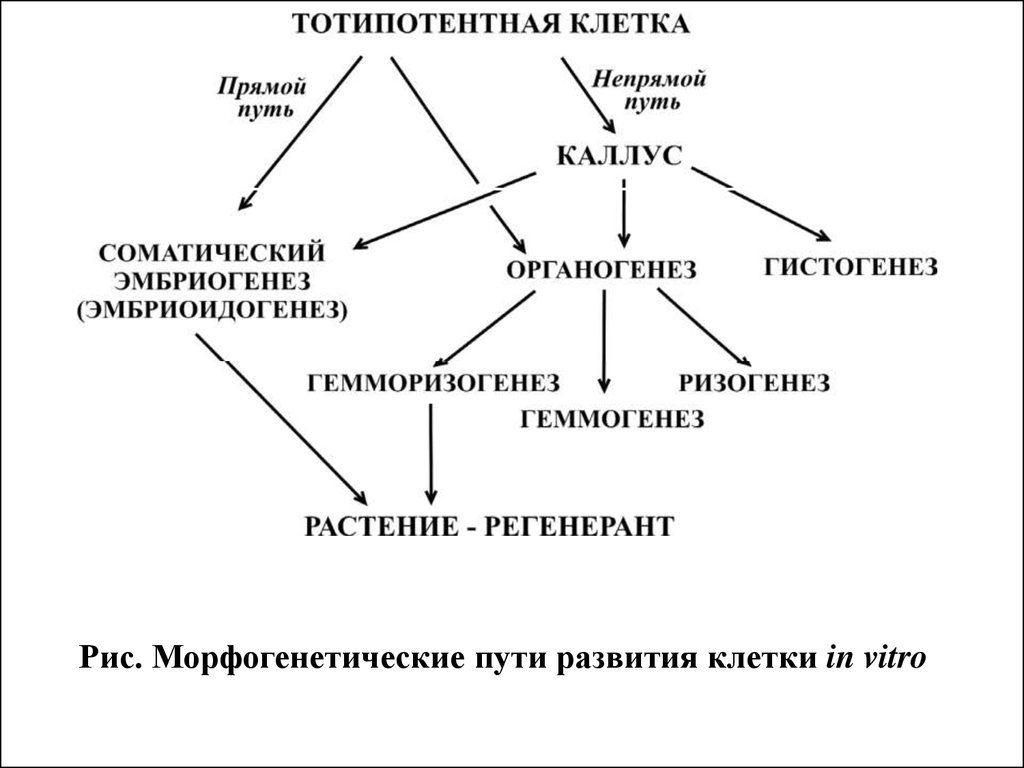
70.
Рис. Морфогенетические пути развития клетки in vitro71.
Основным типом культивируемой растительной клеткиявляется каллусная.
• Каллусная клетка, в результате деления которой
возникает каллусная ткань или каллус, представляет
один из типов клеточной дифференцировки, присущей
высшему растению. Для растения каллус является
тканью, возникающей под действием «раневых
гормонов» путем неорганизованной пролиферации
дедифференцированных клеток при исключительных
обстоятельствах
(обычно
при
травмах)
и
функционирующей непродолжительное время. Эта
ткань защищает травмированное место, накапливает
питательные вещества для анатомической регенерации
или генерации утраченного органа.
72.
• Каллус на травмированнойвиноградной лозе
73.
74.
• Культура каллусных клеток – это неорганизованнаяпролиферирующая
ткань,
состоящая
из
дедифференцированных клеток. В дальнейшем они
специализируются
как
каллусные,
т.е.
дифференцируются.
• Значительно реже культивируют клетки опухолей
растений различного происхождения (растительные –
бактериальной или вирусной этиологии; генетические,
возникающие на межвидовых гибридах). Культуры
опухолевых
клеток
независимо
от
способа
культивирования на уровне морфологии мало отличаются
от культур каллусных клеток. Значительным их
физиологическим отличием является гормононезависимость, позволяющая им делиться и расти на
питательных средах без добавок фитогормонов или их
аналогов.
Однако
опухолевые
клетки
лишены
способности давать начало нормально организованным
структурам. В некоторых случаях они способны
образовывать тератомы.
75.
76.
• Каллусные клетки способны делиться только приналичии в питательной среде фитогормонов. Однако
при длительном культивировании в некоторых
случаях они могут утрачивать зависимость от
наличия в среде ауксинов и цитокининов.
• Природа такой независимости к фитогормонам может
быть генетической (результат мутации) или
эпигенетической (результат экспрессии генов,
определяющих гормононезависимость клетки). Такие
клетки принято называть «привыкшими». В них
также как и в опухолевых клетках идет интенсивный
синтез собственных гормонов. Часто ткани,
образованные «привыкшими» клетками, называют
химическими опухолями. Подобно опухолевым,
такие ткани не способны к нормальной регенерации и
образуют тератомы.
77.
• Для получения культивируемых каллусныхклеток фрагменты тканей различных
органов высших растений - корней,
листьев, стеблей, пыльников, зародышей
(экспланты) помещают на искусственную
среду, содержащую ауксины, в пробирки,
колбы, чашки Петри.
78. Экспланты
79.
• Процесс получения первичного каллуса и поддержаниепересадочной культуры требует строго стерильных
условий.
• До
извлечения
экспланта
часть
растения
предварительно промывают водой с детергентом, а
затем ополаскивают стерильной водой. Затем
выделенные экспланты помещают в стерильные
растворы, содержащие хлор или ртуть, к которым для
лучшего смачивания добавлены детергенты. После
выдерживания
эксплантов
в
дезинфицирующем
растворе их несколько раз промывают стерильной
дистиллированной водой и скальпелем стерильно
удаляют на срезах несколько слоев клеток.
• В случае внутреннего инфицирования тканей принято
использовать антибиотики, хотя это и не всегда
позволяет получить стерильный эксплант.
80.
• Основным условием превращения растительнойклетки в каллусную является присутствие в
питательной среде фитогормонов. Ауксины вызывают
процессы дедифференцировки клетки, готовящие ее к
делению,
а
цитокинины
–
пролиферацию
дедифференцированных клеток.
• Если эксплант, состоящий из дифференцированых
клеток, поместить в питательную среду без гормонов,
деление клеток не произойдет, и каллус не
образуется.
• Таким образом, превращение специализированной
клетки в каллусную связано с возобновлением под
влиянием фитогормонов клеточного деления.
81.
• В качестве ауксинов используют 2,4дихлорфеноксиуксусную кислоту (2,4-Д), άнафтилуксуснуюкислоту
(НУК),
индолилмасляную
кислоту
(ИМК),
индолилуксусную
кислоту
(ИУК)
в
концентрации 0,5 - 10 мг/л в зависимости от
вида экспланта.
• В качестве цитокининов применяют зеатин,
кинетин и др.
82.
• Процесс перехода к каллусному ростуначинается с остановки клеточных делений.
Лаг-фаза продолжается 24-48 часов, в
течение которых клетки увеличиваются в
размерах и ткань экспланта разрыхляется.
Далее клетки начинают быстро делиться,
образуя каллусную ткань.
• В
каллусных
клетках
появляются
специфические белки и одновременно
исчезают
белки,
характерные
для
фотосинтезирующих клеток.
83.
• Характерной особенностью каллусной тканиявляется выраженные гетерогенность по
возрасту и генетическая гетерогенность
(клетки различаются по числу хромосом, что
связано с неорганизованным, несинхронным,
анархичным
развитием).
Встречают
диплоидные, полиплоидные и анеуплоидные
клетки, причем, чем длительнее процесс
культивирования, тем сильнее различие
клеток по плоидности.
Клетки потребляют меньше кислорода по
сравнению с нормальными клетками, что
свидетельствует о снижение эффекта Пастера.
84.
• Одной из причин гетерогенности культурыкаллусной ткани является различное
тканевое
происхождение
первичных
каллусных клеток.
85.
• Первичный каллус, возникший на эксплантахчерез 4-6 недель (в зависимости от скорости
роста клеток) переносится на свежую
питательную
среду
(пассируется
или
субкультивируется). Размер транспланта
(переносимого
фрагмента)
при
культивировании
на
агаризованной
питательной среде обычно составляет от 60
до 100 мг массы ткани на 30-40 мл
питательной среды.
• В процессе субкультивирования формируется
штамм,
характеризующийся
индивидуальными
генетическими
и
физиологическими особенностями.
86.
• Большинство каллусных клеток могут расти в условияхсильного освещения или в темноте, поскольку не способны
фотосинтезировать. Однако свет может выступать как
фактор, обеспечивающий морфогенез и активирующий
процессы вторичного синтеза. Для достижения оптимизации
процесса
культивирования
часто
используют
люминесцентные лампы с интенсивностью около 1000 люкс
и непрерывным «холодным белым» светом.
• Для роста и развития большинства каллусных культур
оптимальной является температура 26 °С. Однако индукция
процессов морфогенеза требует более низких температур
(18-20 °С).
• Оптимальная влажность в культуральной лаборатории
должна составлять 60-70 %. Большое значение для
успешного культивирования каллусных клеток также имеет
аэрация.
87.
• При культивировании растительных клеток и привыращивании культуры тканей применяются
среды Мурасиге-Скуга, Нагата-Такебе, Хеллера,
Нича-Нича, Кнудсона и другие в различных
модификациях.
• Основными компонентами питательных сред для
культуры клеток и тканей растений являются
минеральные соли (макро- и микроэлементы),
источник углеродного питания (обычно сахароза
или глюкоза), витамины, регуляторы роста.
Иногда в состав питательных сред включают
комплексные органические добавки (гидролизат
казеина или смесь аминокислот, дрожжевой
экстракт, экстракты из разных органов растения).
88.
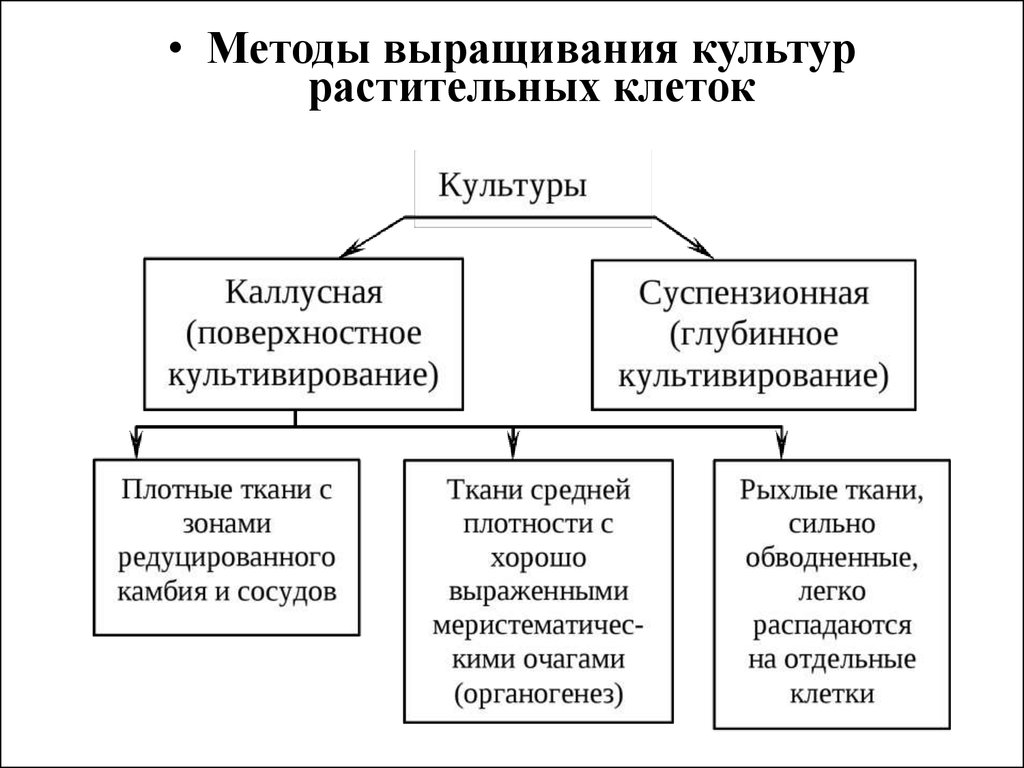
• Методы выращивания культуррастительных клеток
89.
• Поверхностное культивирование• Культура каллусных тканей выращивается
поверхностным способом на полужидкой
агаризованной среде (концентрация агарагара 0,6-1%), среде с применением других
желирующих полимеров либо на мостиках
из фильтровальной бумаги или дисках из
пенополиуретана, погруженных в жидкую
питательную среду.
90.
• Каллуснаяткань,
выращиваемая
поверхностным способом, представляет собой
аморфную массу тонкостенных паренхимных
клеток, не имеющую строго определенной
анатомической структуры. Цвет массы может
быть белым, желтоватым, зеленым, красным –
пигментированным полностью или зонально.
Темно-коричневая окраска каллуса возникает
чаще при старении каллусных клеток или
неоптимальных условиях выращивания и
связана с накоплением в них фенолов,
окисляющихся до хинонов. Для избавления от
них
в
питательные
среды
вводятся
антиоксиданты.
91.
92.
Каллус Nicotiana tabacum93.
94.
• Неорганизованно растущая каллусная тканьхарактеризуется тремя типами клеток:
• мелкими,
• средними,
• крупными.
• При пассировании ткани на среду,
содержащую индукторы органогенеза,
мелкие клетки приступают к делению и
формируют
меристематические
очаги.
Деление клеток меристематического очага
приводит либо к формированию почек и
последующему развитию из них побегов
(геммогенез), либо к ризогенезу.
95.
• Каллусы с высоким морфогенетическимпотенциалом обычно матовые, компактные,
структурированные,
имеют
зеленые
хлорофиллсодержащие участки, которые
представляют собой зоны морфогенеза.
Рыхлые каллусы, не имеющие глобулярного
характера, либо совсем не способны к
органогенезу, либо формируют только
корни. Эти каллусы могут остаться
ризогенными, и регенерировать из них
растения не удастся. Неморфогенные
каллусы могут быть переведены в
суспензионную культуру для получения
вторичных метаболитов.
96.
• В отношении гормональной регуляции органогенезаСкугом и Миллером в 1957 г. была выдвинута
концепция, которая в настоящее время известна как
«гипотеза гормонального баланса, или правило
Скуга-Миллера».
• Согласно данной концепции можно получить
образование
стеблей,
корней
или
недифференцированный рост каллуса, изменяя
относительное содержание ауксинов и цитокининов.
В самом простом случае индукция и образование
каллуса
наблюдается
при
сбалансированном
отношении ауксинов к цитокининам, стеблевые почки
образуются при повышении уровня цитокининов по
отношению к ауксинам, корни формируются при
высоком содержании ауксинов в среде.
97.
• Ризогенный каллус98.
• Геммогенный каллус99.
• гемморизогенный каллус100.
• Суспензионное культивирование• Культуры клеток растений, выращиваемые
в жидкой питательной среде, обычно
называют суспензионными культурами.
Получено еще сравнительно мало культур
клеток высших растений, по своим
параметрам полностью удовлетворяющих
требованиям суспензионного (глубинного)
культивирования. В значительной мере это
объясняется
трудностями
получения
культуры
клеток,
состоящей
преимущественно из отдельных клеток или
небольших их агрегатов.
101.
• Обычно для получения суспензионнойкультуры
используются
рыхлые
обводненные
каллусные
ткани.
Оптимальными подходами для получения
суспензии являются выращивание каллусов
на среде с 2,4-Д, исключение из среды
ионов кальция, обработка пектиназой
транспланта,
предназначенного
для
выращивания в суспензионной культуре.
102.
• Для получения культуры клеток берется наиболеежизнеспособная
(пролифелирующая)
часть
каллусной ткани, а ее количество должно быть в 1520 раз больше в расчете на объем питательной
среды, чем при серийном культивировании на агаре
(примерно 2-3 г свежей массы каллусной ткани на
60-100 мл жидкой питательной среды или примерно
0,5-2,5х105 кл/мл).
• При этом может использоваться питательная среда
того же состава, что и для поверхностного
культивирования, но в некоторых случаях
увеличивают количество ауксинов и (или)
уменьшают количество цитокининов.
103.
• Режим перемешивания и аэрации как приинициации культуры клеток, так и при
дальнейших
серийных
субкультивированиях
обеспечивается
выращиванием на роллерах и качалках
(круговая качалка – 10-12 об/мин). Часто
интенсивность
перемешивания
повышается до 100-120 об/мин.
104. Суспезионная культура
105.
• Образованиепервичной
суспензии
растительных
клеток
можно
считать
результатом трех процессов:
• 1) распадение каллусной ткани на клетки и
небольшие клеточные агрегаты в момент
внесения в жидкую питательную среду;
• 2) отделение клеток и клеточных агрегатов с
поверхности кусочков ткани в течение первых
субкультивирований;
106.
• 3) деления и роста клеток, образовавшихсяпо первым двум способам, и распадения
разрастающихся клеточных агрегатов на
более мелкие агрегаты и клетки. Последний
процесс является типичным для роста
стабилизировавшейся
перевиваемой
культуры клеток высших растений.
107.
• Первичную суспензию перед субкультивированиемлибо в специальном цилиндре разделяют на фракции
по скорости седиментации (используют верхнюю
фракцию), либо фильтруют через 1-2 слоя марли,
нейлоновые или металлические сита, чтобы
избавиться от крупных плотных кусков каллусной
ткани, остатков экспланта и очень крупных
агрегатов.
• Фильтрование рекомендуется и в нескольких
последующих субкультивированиях до приобретения
клеточной
суспензией
желательных
характеристик. Однако агрегированность суспензии
зависит не только от характеристик начальной линии,
но и от условий культивирования.
108.
• По степени агрегированности выделяют:• мелкоагрегированную
культуру
(40%
одиночные клетки, 60% - мелкие агрегаты);
• среднеагрегированную культуру (40% одиночные клетки, 40% - мелкие агрегаты,
20% - крупные агрегаты);
• крупноагрегированную культуру (40% мелкие агрегаты, 60% - крупные агрегаты
агрегаты).
109.
• Дляглубинного
культивирования
растительных клеток применяются способы,
разработанные
для
микробиологических
целей. Используются закрытые или открытые
системы в периодическом или проточном
режимах. Однако при глубинном выращивании
растительных клеток принцип турбидостата
практически не применяется. Выращивание
суспензии клеток растений в установках
непрерывного культивирования по принципу
хемостата применяется при промышленном
выращивании клеточной биомассы с целью
получения экономически важных продуктов.
110.
• Признакамикачественной
суспензионной
культуры служат способность клеток к
перестройке метаболизма и высокая скорость
размножения
в
конкретных
условиях
культивирования.
• Морфологические характеристики такой
культуры:
• высокая степень дезагрегации (5-10 клеток в
группе);
• морфологическая
выравненность
клеток
(небольшие
размеры,
сферическая
или
овальная форма, плотная цитоплазма);
• отсутствие трахеидоподобных элементов.
111.
• Клетки растений в десятки, сотни раз крупнееклеток бактерий, кроме того, их размеры
меняются в процессе онтогенеза. Если в начале
экспоненциальной фазы роста они мелкие и
плотные, то в стационарной фазе роста они
сильно
увеличиваются
в размерах и
вакуолизируются.
• Чем крупнее становится клетка, тем больше
возрастает опасность ее механического
повреждения в процессе перемешивания. В то
же время клетки растений, крупные и тяжелые,
требуют эффективного перемешивания.
112.
• На культуры некоторых типов клеток отрицательноевлияние может оказывать механический стресс при
выращивании в ферментере с турбинными мешалками
при скоростях перемешивания свыше 100 об/мин. Для
таких культур целесообразнее использовать мягкое
перемешивание и аэрацию пневматическим способом
потоком сжатого стерильного воздуха, подаваемого в
ферментер. К сожалению, и этот способ имеет свой
недостаток, потому что в культуральной среде
возникает
избыток
воздуха,
приводящий
к
кислородному голоданию, а от концентрации
кислорода в среде зависят рост и вторичный
метаболизм клеток. Высокая степень аэрации также
может оказывать негативное действие на рост и
синтез продуктов вторичного метаболизма.
113.
• Отличительная особенность суспензионныхкультур клеток растений — высокая плотность,
необходимая для роста. Поэтому другим
осложнением при культивировании клеток
растений является увеличение вязкости,
сопровождающее рост биомассы. Это ведет к
адгезии клеток друг к другу и к поверхностям
культурального сосуда. С увеличением
биомассы клеток снижается интенсивность
перемешивания, что в конце концов может
привести культуру к гибели.
114.
• Клетки растений обладают меньшейфизиологической
и
метаболической
активностью
по
сравнению
с
микроорганизмами.
• Время генерации растительной клетки в 60100 раз превосходит время генерации
микробной клетки.
• Пул
пролиферирующих
клеток
не
превышает 50-60%, многие клетки быстро
прекращают деление и переходят в фазу
покоя.
115.
• Суспензионные культуры наиболее частоиспользуют для промышленного получения
вторичных
метаболитов.
Вещества,
продуцируемые растительными клетками,
применяются в медицине, парфюмерной
промышленности, растениеводстве и других
отраслях промышленности. К ним относятся:
алкалоиды,
терпеноиды,
гликозиды,
полифенолы,
полисахариды,
эфирные
масла,
пигменты,
антиканцерогены
(птотецин,
харрингтонин),
пептиды
(ингибиторы фитовирусов).






































































































 industry
industry








