Similar presentations:
Recettori
1.
RecettoriI recettori fisiologici sono delle macromolecole proteiche
presenti in tutti i tessuti, che hanno il compito di raccogliere i
segnali portati da molecole messaggere (dette mediatori
biologici) e di iniziare una sequenza di modificazioni biochimiche
che portano ad una risposta biologica.
I mediatori noti, e quindi i relativi recettori dell’organismo, sono
moltissimi: ci sono recettori per i neurotrasmettitori, gli ormoni, i
fattori di crescita, le sostanze attive localmente (autacoidi), gli
stimoli sensoriali, ecc.
Molti farmaci esercitano la loro azione sostituendosi al mediatore
endogeno o alterando la risposta recettoriale.
2.
La segnalazione intercellulare• L’evoluzione degli organismi multicellulari dipende dalla
capacità delle cellule di comunicare una con l’altra.
• La comunicazione intercellulare regola lo sviluppo e
l’organizzazione dei tessuti, controlla la crescita e la
divisione cellulare, la loro sopravvivenza e coordina le
diverse attività cellulari.
• La comunicazione intercellulare negli animali superiori è
complessa, suggerendo che in questi organismi siano molti
i mediatori coinvolti nel suo controllo e coordinazione.
3.
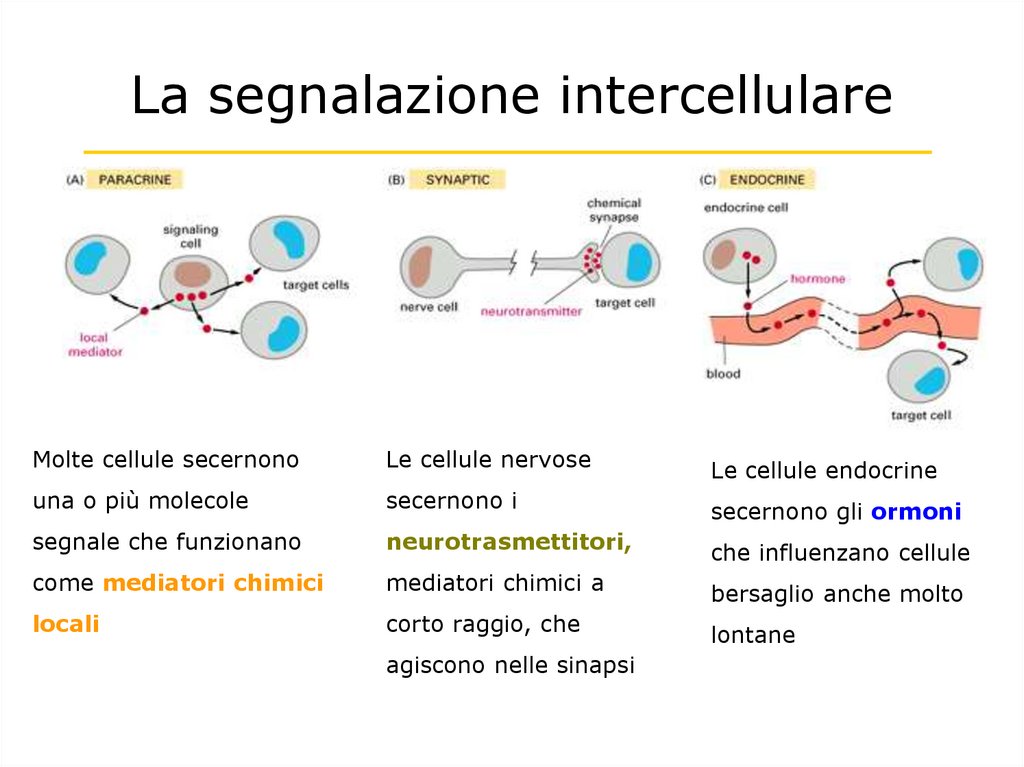
La segnalazione intercellulareMolte cellule secernono
Le cellule nervose
Le cellule endocrine
una o più molecole
secernono i
secernono gli ormoni
segnale che funzionano
neurotrasmettitori,
che influenzano cellule
come mediatori chimici
mediatori chimici a
bersaglio anche molto
locali
corto raggio, che
lontane
agiscono nelle sinapsi
4.
MEDIATORI ENDOGENIMediatori a basso peso molecolare:
•Aminoacidi: glutammato, glicina, acido gamma-amino-butirrico (GABA)
•Monoamine: catecolamine (dopamina, noradrenalina, adrenalina) e indolamine
(serotonina)
•Acetilcolina
•Gas solubili: ossido nitrico (NO), solfuro di idrogeno (H2S)
•Ormoni non peptidici
Mediatori ad alto peso molecolare:
•Neuropeptidi o neuromodulatori: endorfine, sostanza P, neuropeptide Y.
•Ormoni peptidici
•Citochine
5.
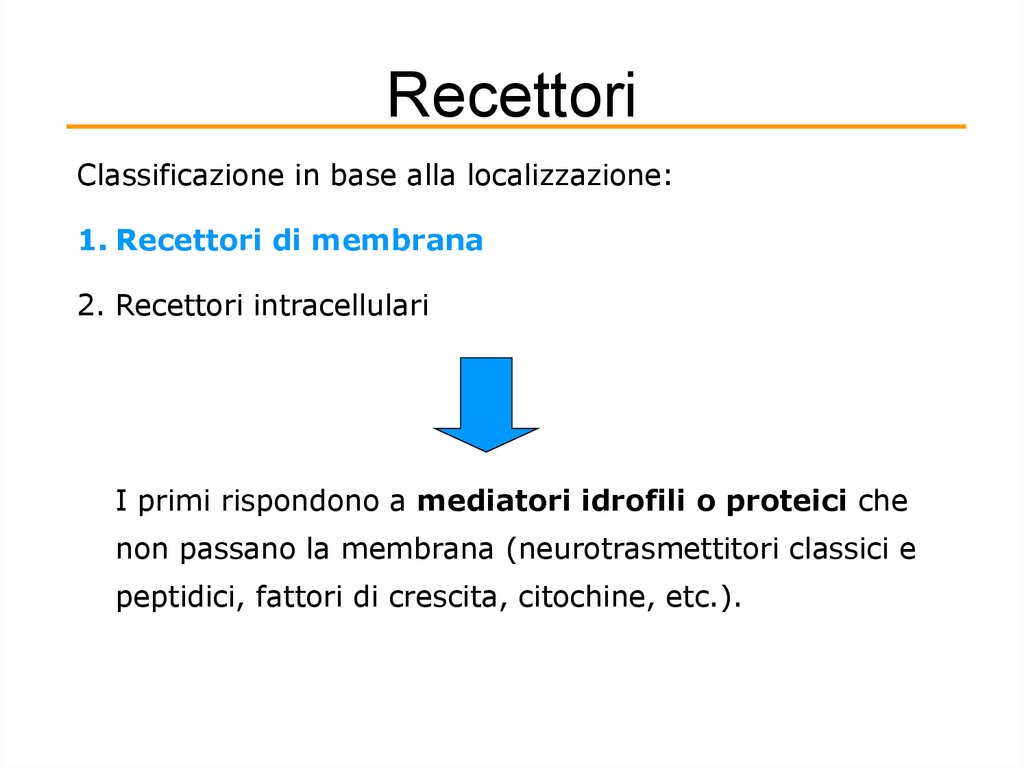
RecettoriClassificazione in base alla localizzazione:
1. Recettori di membrana
2. Recettori intracellulari
I primi rispondono a mediatori idrofili o proteici che
non passano la membrana (neurotrasmettitori classici e
peptidici, fattori di crescita, citochine, etc.).
6.
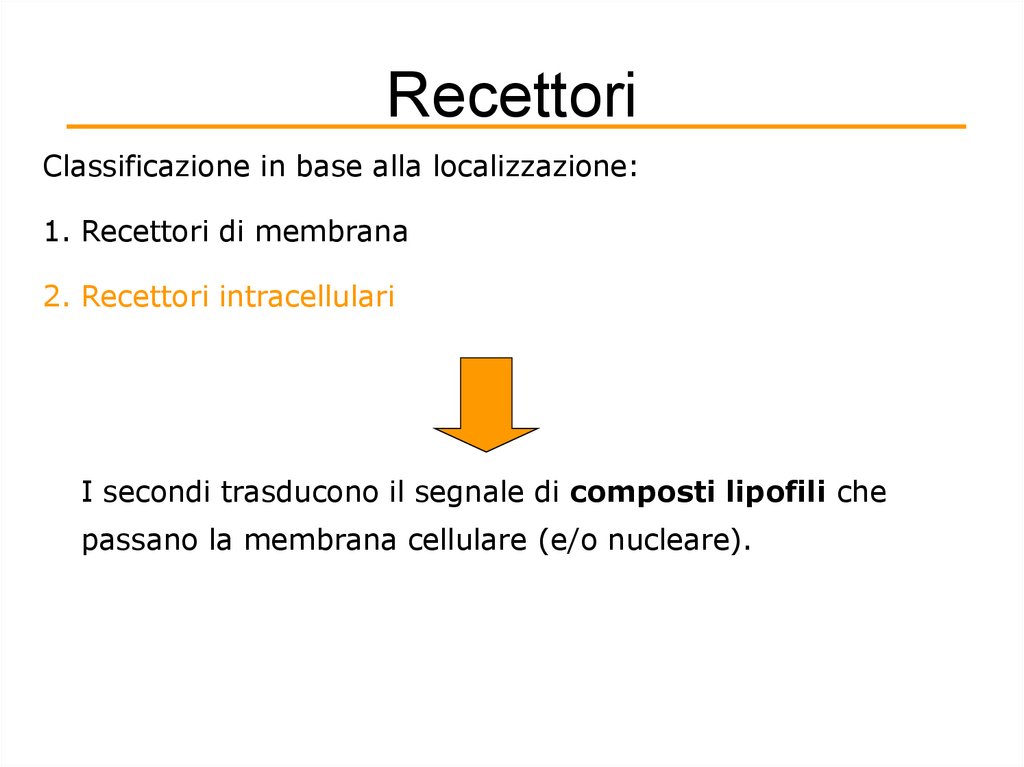
RecettoriClassificazione in base alla localizzazione:
1. Recettori di membrana
2. Recettori intracellulari
I secondi trasducono il segnale di composti lipofili che
passano la membrana cellulare (e/o nucleare).
7.
Recettori intracellulariDivisi in due classi:
• I) citoplasmatici, formano omodimeri o dimeri con il ligando. Ne
fanno parte i recettori per gli ormoni steroidei (glucocorticoidi,
mineralcorticoidi, progesterone, estrogeni);
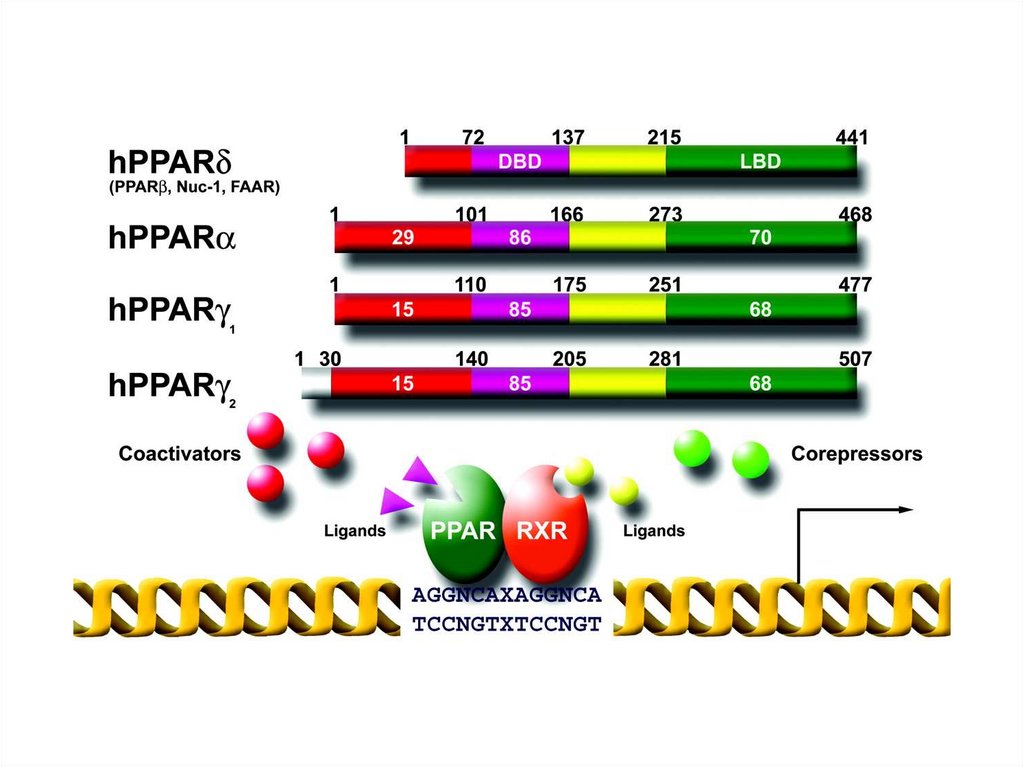
• II) nucleari, costitutivamente presenti nel nucleo, formano
eterodimeri con il recettore dell’acido retinoico (RXR). Ne fanno
parte, ad esempio, il recettore di proliferazione dei
perossisomi (PPAR) che riconosce gli acidi grassi e il recettore
per l’ormone tiroideo.
8.
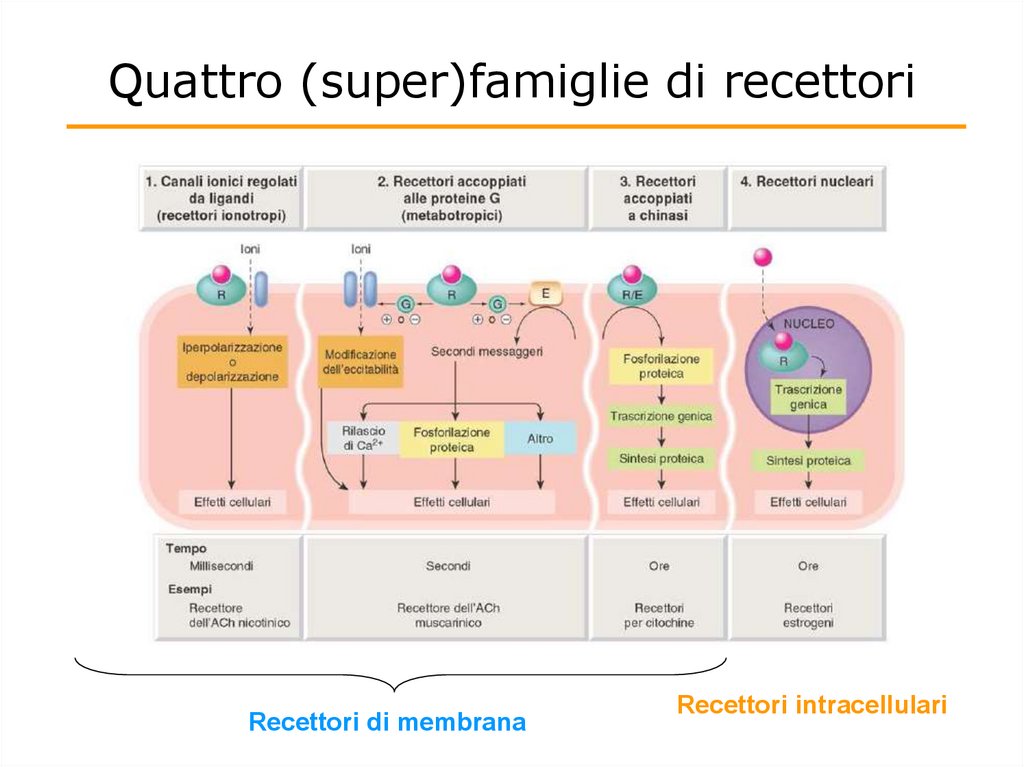
Quattro (super)famiglie di recettoriRecettori di membrana
Recettori intracellulari
9.
Aspetti quantitativi delle risposte ai farmaci:analisi delle curve
La relazione fra CONCENTRAZIONE di un FARMACO e il grado di risposta
che si ottiene prende il nome di curva concentrazione-risposta
Quando la sperimentazione viene condotta in vivo, l’effetto è messo in
relazione con la dose di farmaco somministrata e la relativa curva prende
il nome di curva dose-risposta
L’analisi di curve di questo tipo consente di ottenere informazioni
sull’interazione FARMACO - RECETTORE
10.
In molti modelli sperimentali la risposta che si misura ègraduabile e direttamente correlabile con la dose
somministrata o la concentrazione impiegata.
Esempi:
preparato muscolare che si contrae più o meno a seconda della dose di
farmaco;
preparato enzimatico progressivamente inibito da concentrazioni crescenti di
farmaco.
La risposta si misura con le unità proprie della tecnica utilizzata (es.
ampiezza della contrazione, assorbimento spettrofotometrico,
secondi di latenza dello stimolo, ecc.) anche se spesso si
preferisce esprimerle come percentuale dell’effetto massimo
ottenibile con quel preparato.
11.
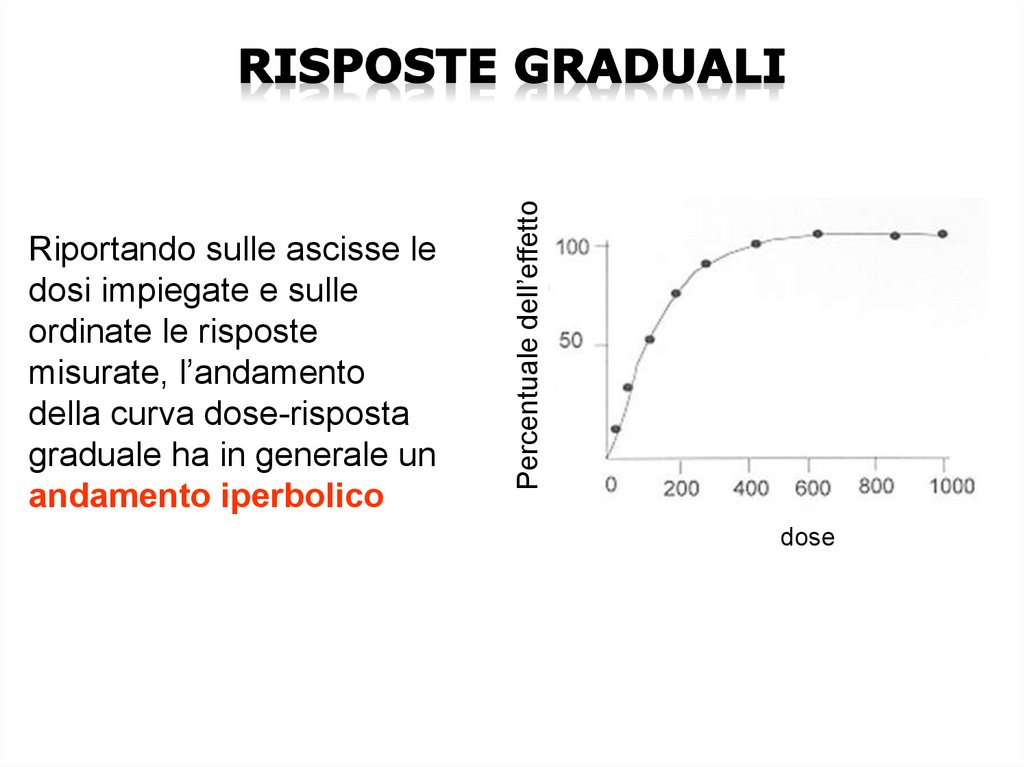
Percentuale dell’effettoRiportando sulle ascisse le
dosi impiegate e sulle
ordinate le risposte
misurate, l’andamento
della curva dose-risposta
graduale ha in generale un
andamento iperbolico
dose
12.
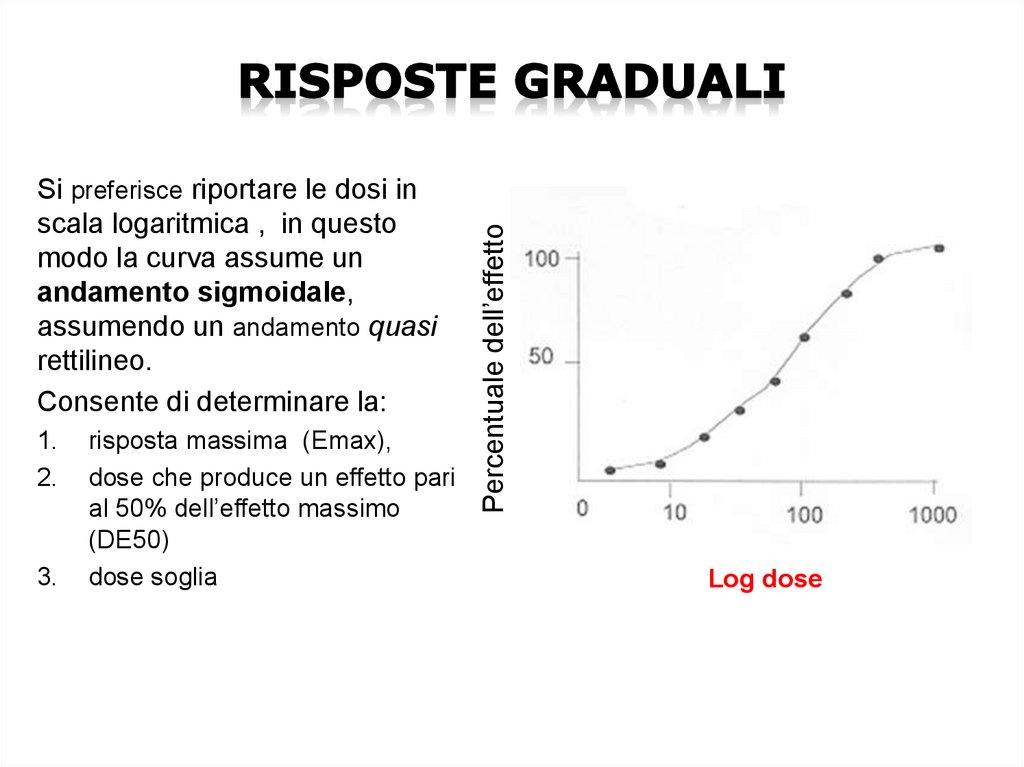
1.2.
3.
risposta massima (Emax),
dose che produce un effetto pari
al 50% dell’effetto massimo
(DE50)
dose soglia
Percentuale dell’effetto
Si preferisce riportare le dosi in
scala logaritmica , in questo
modo la curva assume un
andamento sigmoidale,
assumendo un andamento quasi
rettilineo.
Consente di determinare la:
Log dose
13.
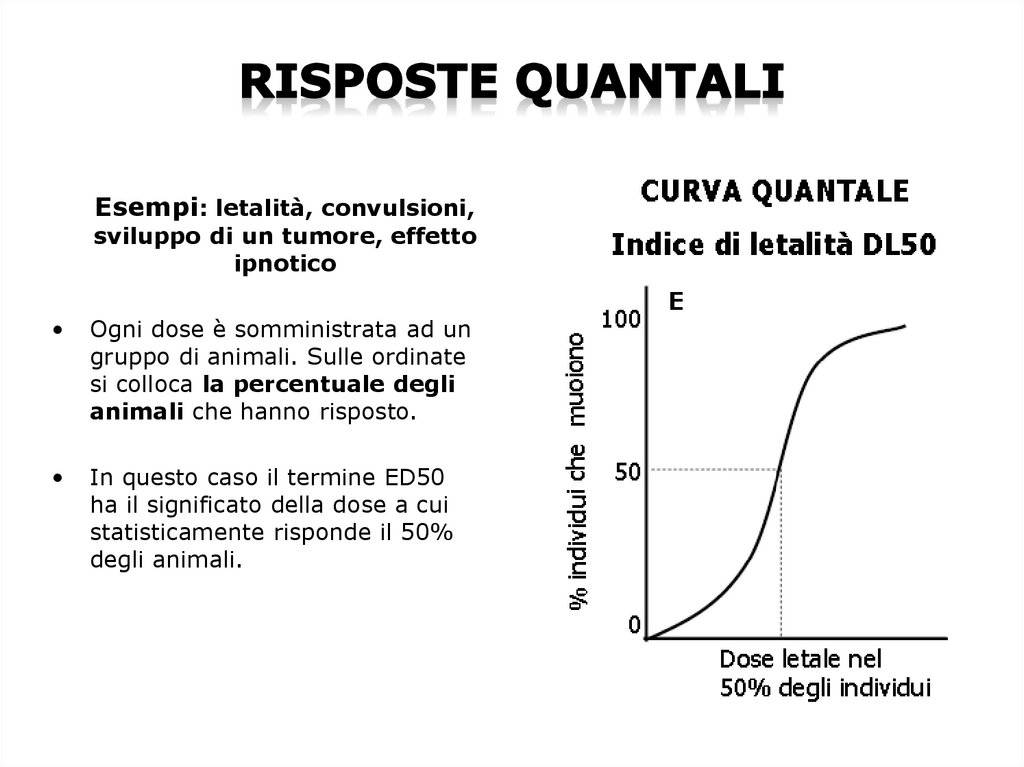
Esempi: letalità, convulsioni,sviluppo di un tumore, effetto
ipnotico
Ogni dose è somministrata ad un
gruppo di animali. Sulle ordinate
si colloca la percentuale degli
animali che hanno risposto.
In questo caso il termine ED50
ha il significato della dose a cui
statisticamente risponde il 50%
degli animali.
14.
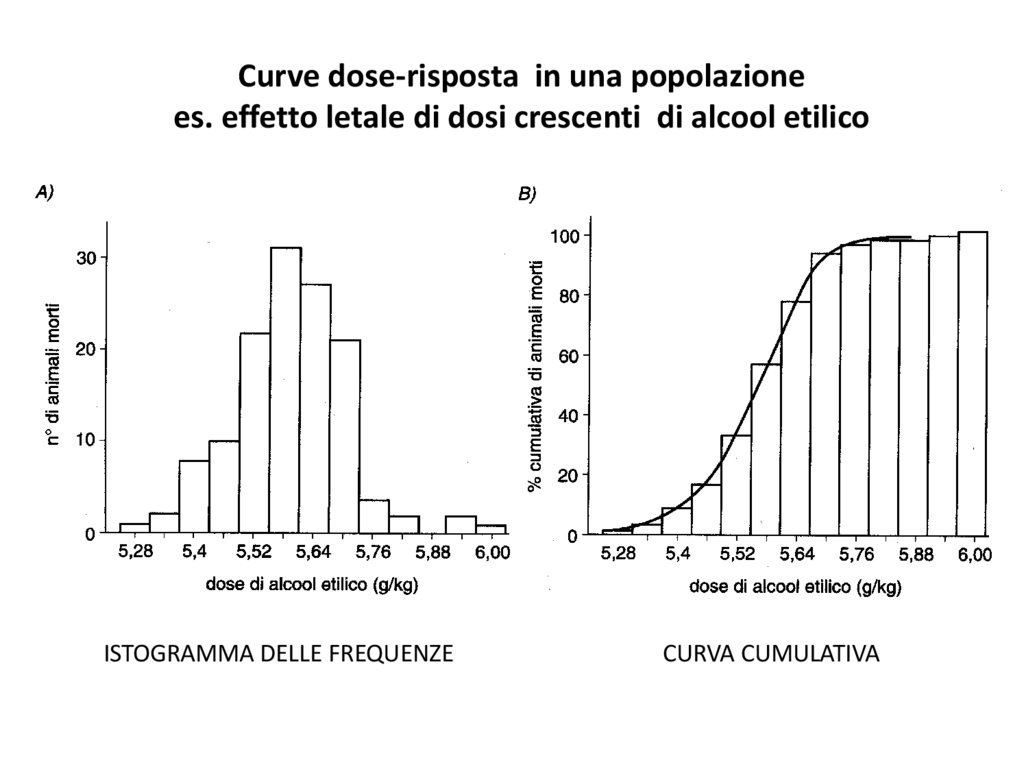
Curve dose-risposta in una popolazionees. effetto letale di dosi crescenti di alcool etilico
ISTOGRAMMA DELLE FREQUENZE
CURVA CUMULATIVA
15.
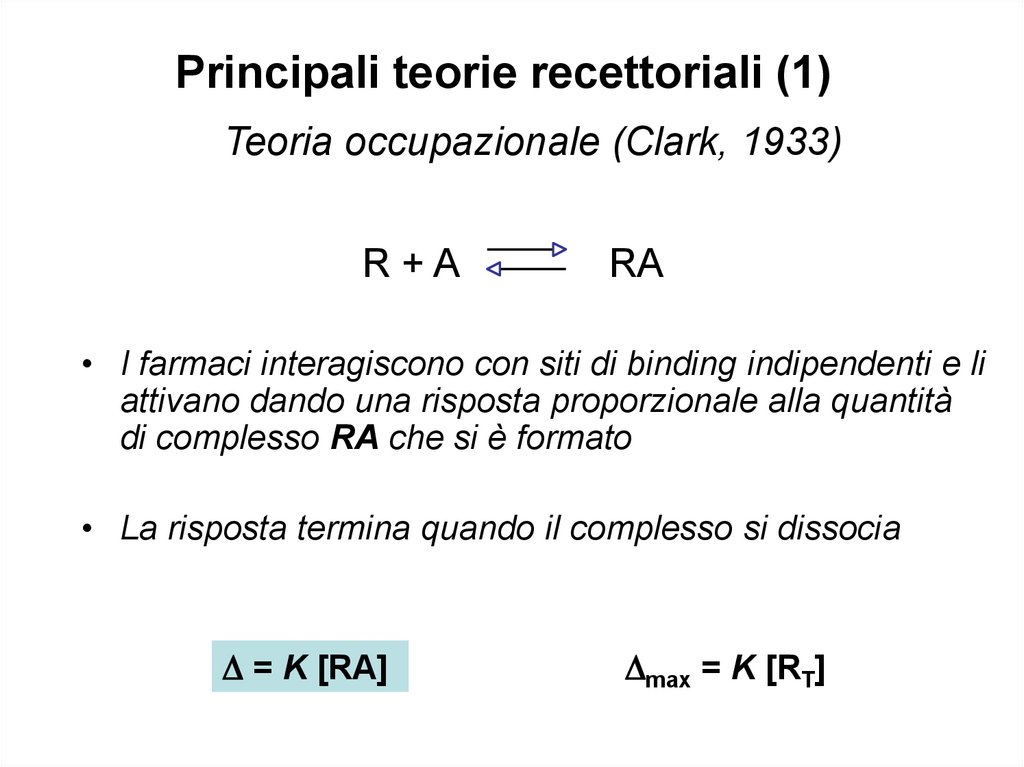
Principali teorie recettoriali (1)Teoria occupazionale (Clark, 1933)
R+A
RA
• I farmaci interagiscono con siti di binding indipendenti e li
attivano dando una risposta proporzionale alla quantità
di complesso RA che si è formato
• La risposta termina quando il complesso si dissocia
= K [RA]
max = K [RT]
16.
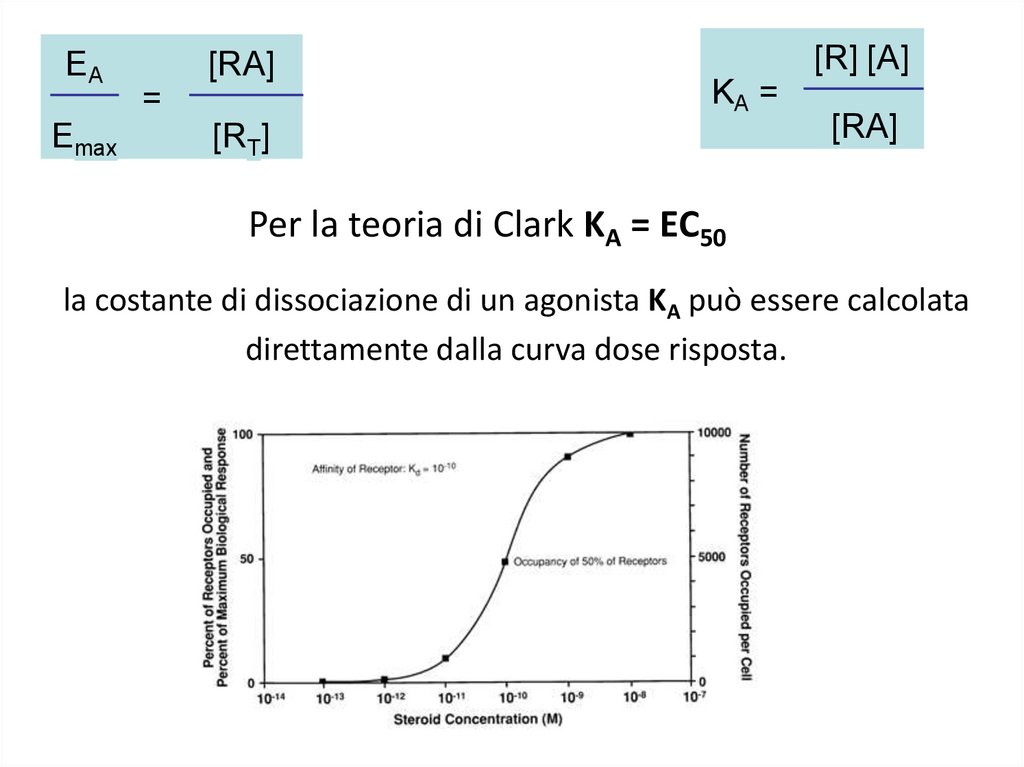
EAEmax
[RA]
=
[R] [A]
KA =
[RT]
[RA]
Per la teoria di Clark KA = EC50
la costante di dissociazione di un agonista KA può essere calcolata
direttamente dalla curva dose risposta.
17.
Principali teorie recettoriali (2)Il contributo di Ariens (1954)
Non tutti gli agonisti producono la stessa risposta massimale
Secondo Ariens, la risposta al binding di un agonista dipende
sia dall’affinità (KA) che dall’attività intrinseca (α)
18.
AffinitàE’ la capacità di un farmaco di legarsi al recettore ed è
espressa dalla costante di dissociazione KA
Attività intrinseca
E’ la capacità del farmaco di indurre
una risposta biologica (a)
La risposta biologica allora sarà:
EA
[A]
=
Emax
a [A]
EA
=
KA + [A]
Emax
KA + [A]
19.
Agonisti, antagonisti eo gli agonisti si legano ai recettori producendo effetti
di vario tipo
o
o
gli antagonisti si legano ai recettori senza evocare
effetti cellulari
20.
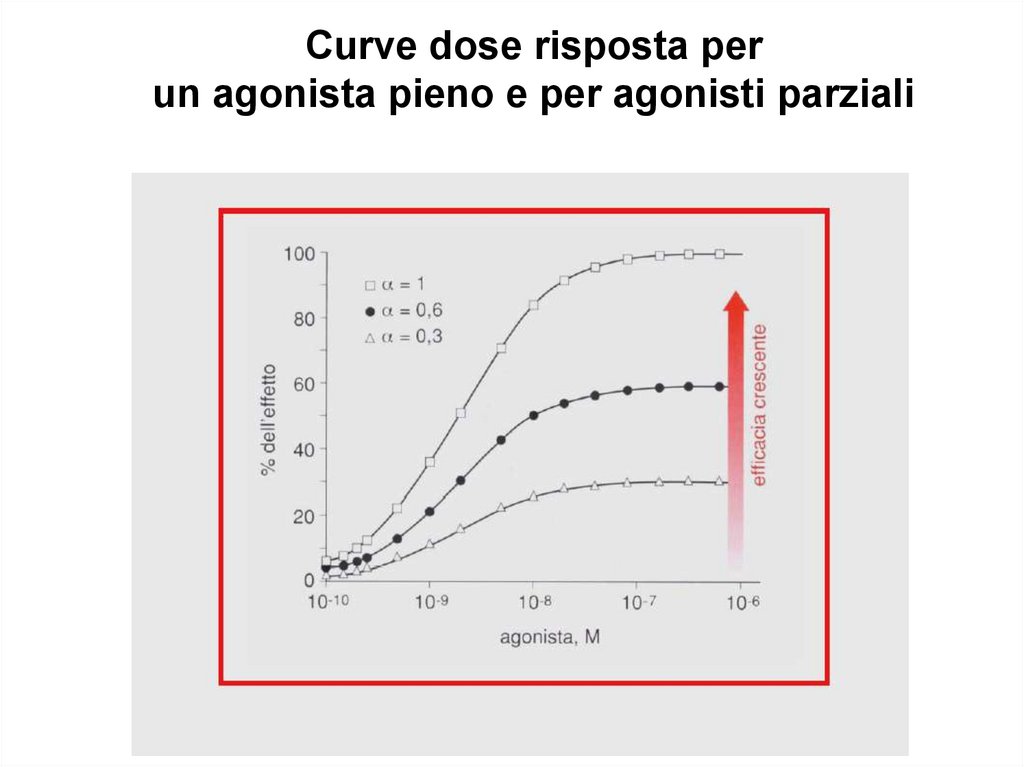
Farmaci agonistiGeneralmente un agonista riproduce gli effetti
dei ligandi endogeni.
• agonista pieno (a = 1)
• agonista parziale (0 < a < 1)
• agonista inverso (a = -1)
ATTIVITA’ INTRINSECA (a)
21.
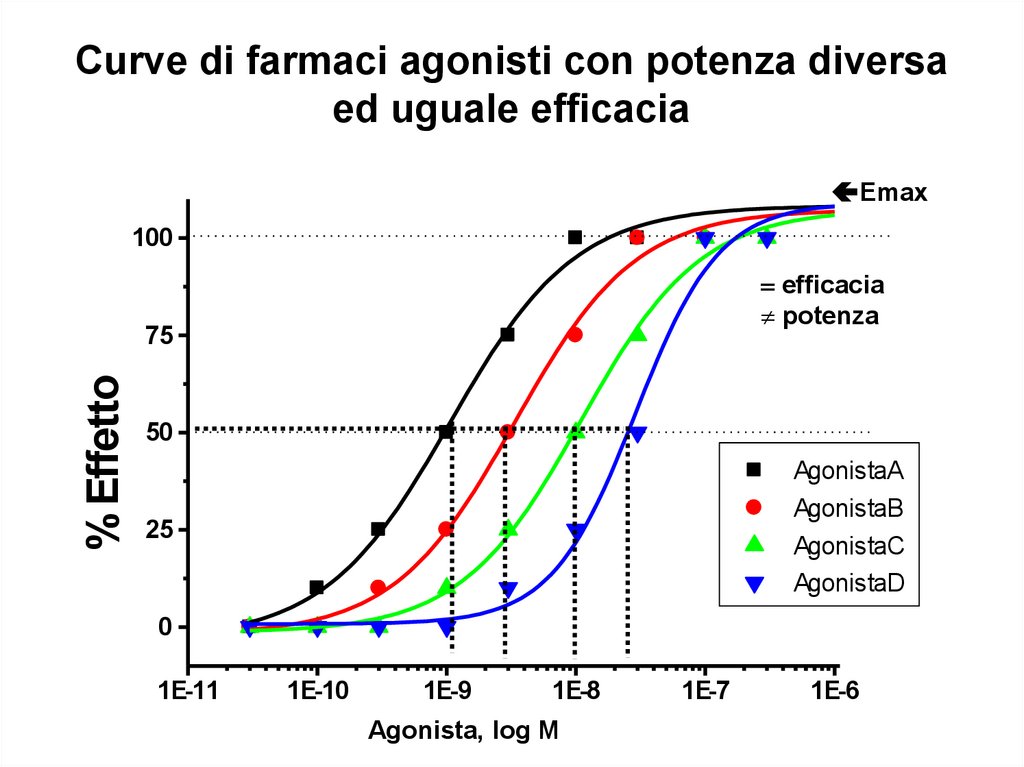
Curve di farmaci agonisti con potenza diversaed uguale efficacia
Emax
100
efficacia
potenza
% Effetto
75
50
AgonistaA
AgonistaB
AgonistaC
AgonistaD
25
0
1E-11
1E-10
1E-9
1E-8
Agonista, log[Log
M
Agonista
M]
1E-7
1E-6
22.
Curve dose risposta perun agonista pieno e per agonisti parziali
23.
Farmaci antagonistiSi legano con alta affinità ai recettori, ma non sono in
grado di indurre di per se una risposta biologica.
L’ effetto farmacologico è quello di inibire l’azione
dell’agonista endogeno.
• antagonista competitivo reversibile
• antagonista non competitivo
• antagonista competitivo irreversibile
24.
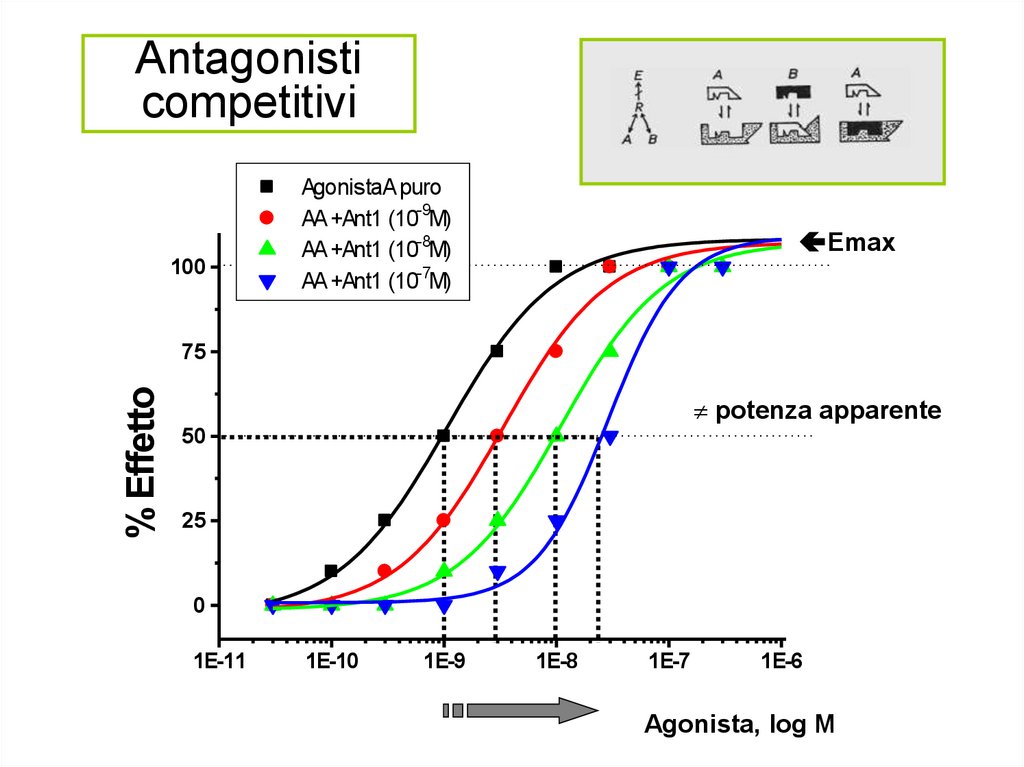
Antagonisticompetitivi
100
AgonistaA puro
AA +Ant1 (10-9M)
AA +Ant1 (10-8M)
AA +Ant1 (10-7M)
Emax
% Effetto
75
potenza apparente
50
25
0
1E-11
1E-10
1E-9
1E-8
Agonista [Log M]
1E-7
1E-6
Agonista, log M
25.
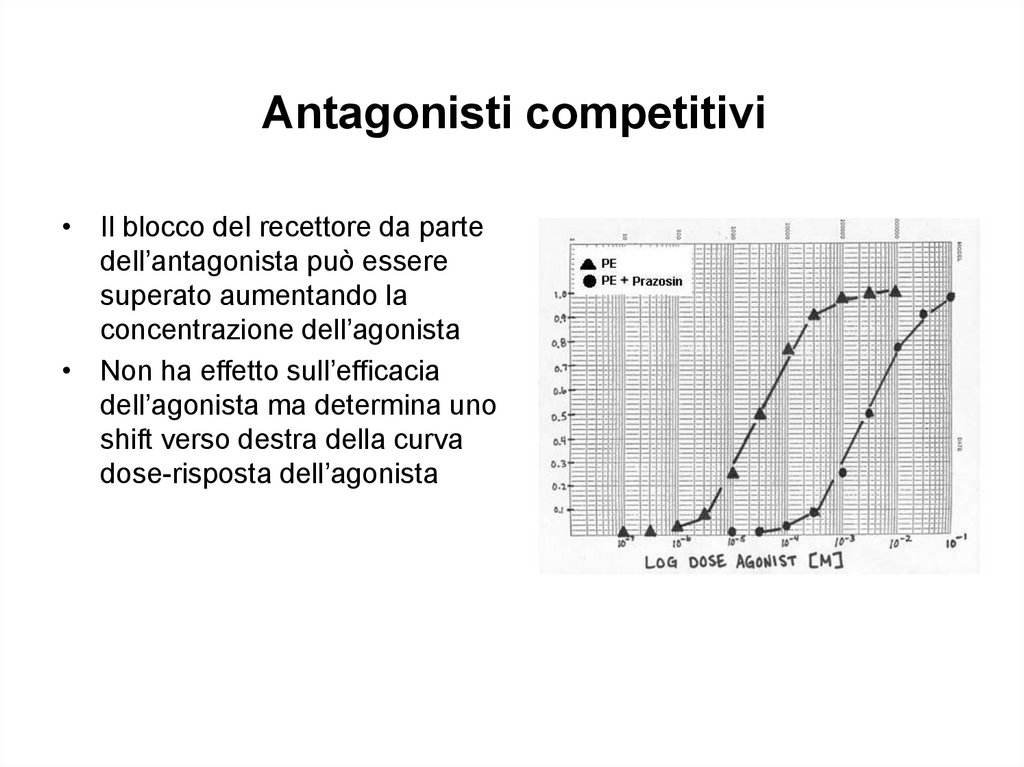
Antagonisti competitivi• Il blocco del recettore da parte
dell’antagonista può essere
superato aumentando la
concentrazione dell’agonista
• Non ha effetto sull’efficacia
dell’agonista ma determina uno
shift verso destra della curva
dose-risposta dell’agonista
26.
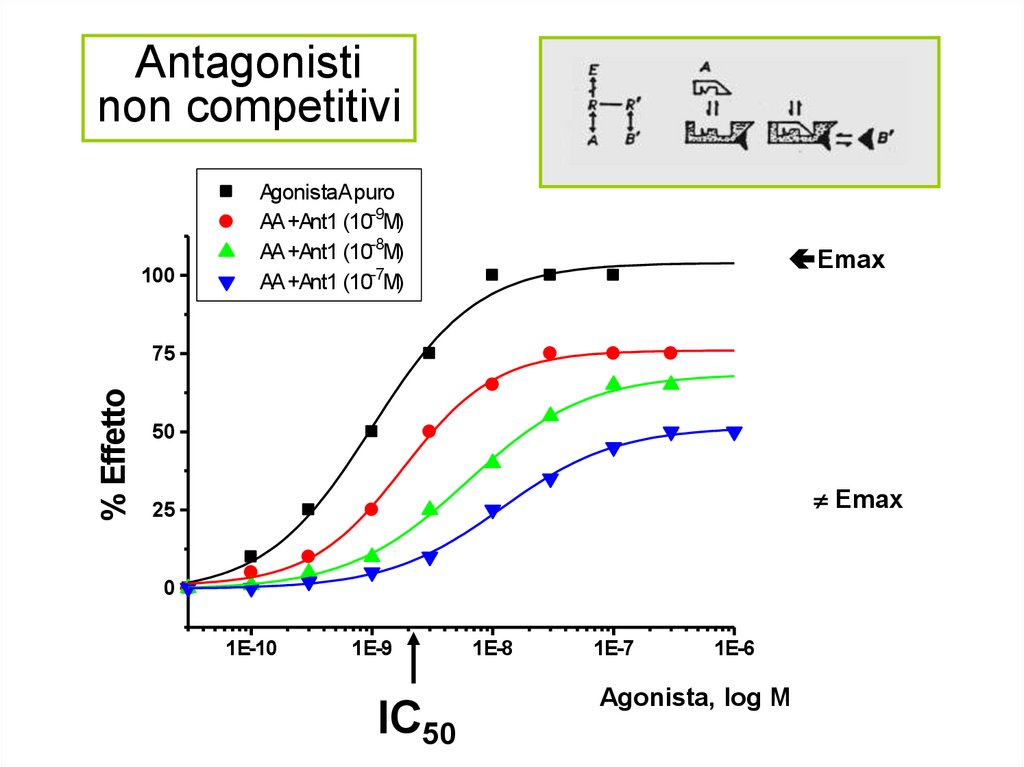
Antagonistinon competitivi
100
AgonistaA puro
AA +Ant1 (10-9M)
AA +Ant1 (10-8M)
AA +Ant1 (10-7M)
Emax
% Effetto
75
50
Emax
25
0
1E-10
1E-9
1E-8
1E-7
1E-6
Agonista [Log M] Agonista, log M
IC50
27.
Antagonisti non competitivi o irreversibili• Un antagonista non competitivo sposta la curva
dell’agonista verso destra in modo non parallelo,
riducendo l’effetto massimo ottenibile anche con
concentrazioni elevate dell’agonista.
• L’antagonista non competitivo si lega ad un sito diverso
da quello dell’agonista (sito allosterico) o interagisce in
maniera irreversibile con lo stesso sito recettoriale
dell’agonista.
28.
Principali teorie recettoriali (3)Il contributo di Stephenson (1954)
• La risposta farmacologica non è linearmente
proporzionale al numero di recettori occupati.
• L’effetto massimo può essere ottenuto anche occupando
una frazione di recettori
• Farmaci differenti possono dare la stessa risposta pur
occupando un numero differente di recettori.
29.
Principali teorie recettoriali (4)Il contributo di Furchgott (1966)
• Fornì l’evidenza sperimentale dell’esistenza degli spare
receptors
• Introdusse l’efficacia intrinseca (ε) come capacità propria
di un farmaco di evocare un effetto da un recettore
30.
Caratteristiche dell’interazionedi un farmaco con il suo recettore
• AFFINITA’: esprime la forza con cui il farmaco si lega al recettore; si riflette
nella posizione della curva sull’asse delle ascisse.
• ATTIVITA’ INTRINSECA (a): capacità di evocare una risposta cellulare, è la
misura della risposta massima che il farmaco può produrre, esprime
l'efficacia del farmaco.
• EFFICACIA INTRINSECA (e): relazione tra l’occupazione del recettore e la
risposta cellulare, non dipende dalla dose ma è indice della attività intrinseca
del farmaco nell’indurre un determinato effetto; si riflette nell’estensione della
curva sull’asse delle ordinate
• POTENZA: abilità a dare origine ad un cambiamento funzionale misurabile;
influenza la dose necessaria per ottenere un determinato effetto
La POTENZA risulta dalla combinazione di affinità ed efficacia
31.
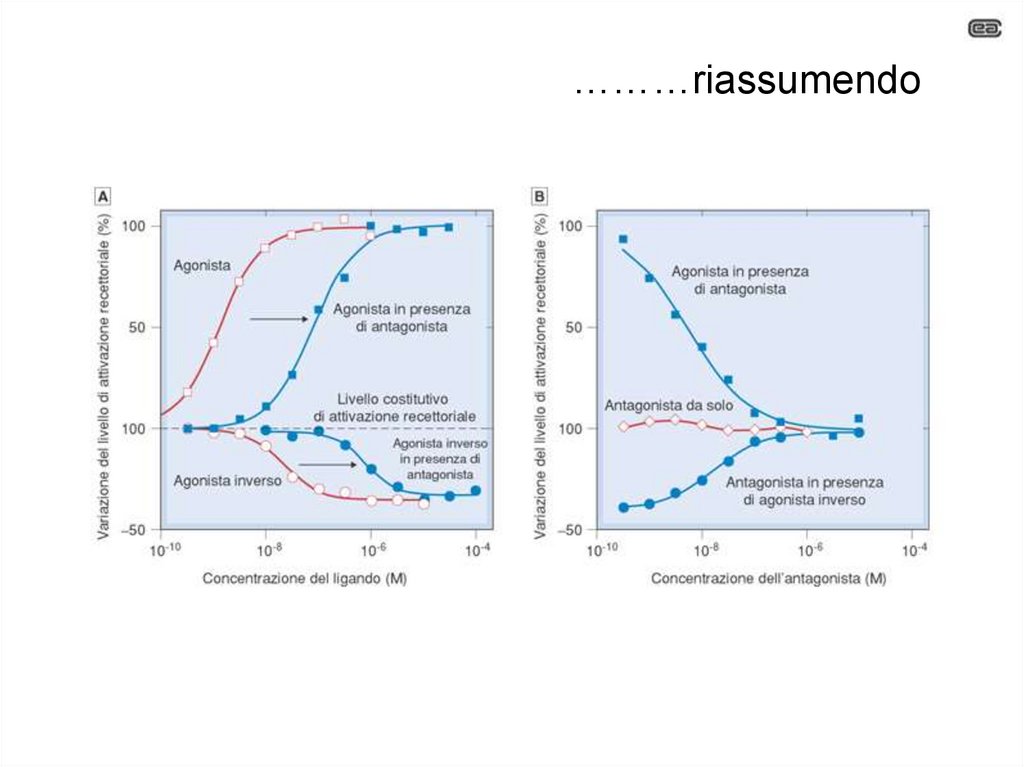
………riassumendo31
32.
La tecnica del binding recettoriale• Metodi semplici e rapidi per lo screening farmacologico di
numerose molecole.
• Non dà indicazioni sul profilo farmacologico di un prodotto:
per ottenere questo tipo di informazione è necessario
saggiare il prodotto in test funzionali e costruire curve doserisposta.
• Il binding è spesso usato per testare preventivamente le
larghe serie di prodotti ottenute dalla sintesi farmaceutica.
Solo i più attivi tra questi prodotti sono poi sottoposti ai test
funzionali, generalmente più complessi e costosi.
33.
Binding recettoriale• Si procede incubando un omogenato di tessuto
opportunamente diluito e di cui si dovrà determinare la
concentrazione proteica, con un ligando radioattivo.
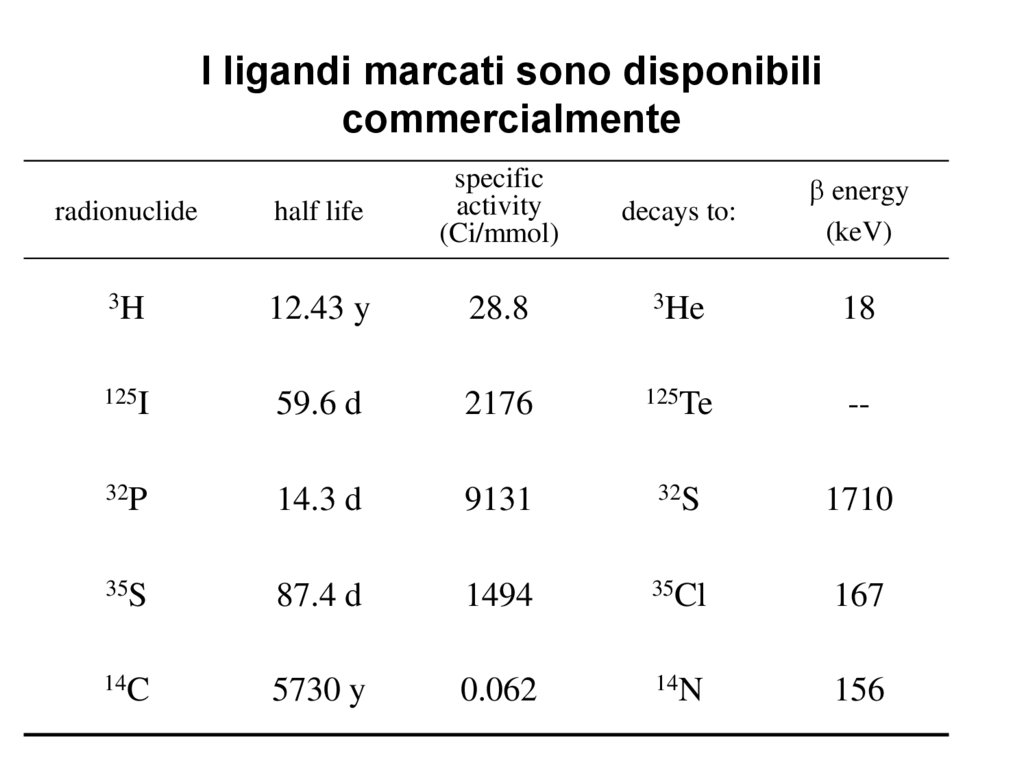
• L’ isotopo più comunemente utilizzato nella metodica del
binding è il 3H.
• L’incubazione deve essere eseguita ad una temperatura e per
un tempo ottimali, in presenza (legame non specifico) e in
assenza (legame totale) di un eccesso di composto non
marcato, che compete con il ligando radioattivo per il sito
recettoriale in esame: questa procedura si rende necessaria in
quanto le sostanze radioattive si legano non solo al loro sito
specifico, ma anche ad altre strutture cellulari in modo non
specifico.
34.
Preparazione del tessuto• Semplice omogenato (es. di cervello)
• Frazione subcellulare arricchita della componente
rappresentata dalle membrane
• Cellule
35.
I ligandi marcati sono disponibilicommercialmente
radionuclide
half life
specific
activity
(Ci/mmol)
3H
12.43 y
28.8
3He
18
125I
59.6 d
2176
125Te
--
32P
14.3 d
9131
32S
1710
35S
87.4 d
1494
35Cl
167
14C
5730 y
0.062
14N
156
decays to:
energy
(keV)
36.
Binding recettorialeDurante l’incubazione si forma il complesso ligando-recettore, che segue la
legge d’azione di massa.
Tale reazione raggiunge, dopo un periodo di tempo variabile da pochi minuti a
qualche ora (periodo di incubazione), la fase di equilibrio (steady-state) in cui il
binding specifico raggiunge il suo massimo.
Al momento dell’equilibrio si avrà:
K1[L][R]= K2[RL]
K2/K1=[L][R] (1/[RL]) = Kd
Kd è definita come la costante di dissociazione all’equilibrio, il cui valore
esprime l’affinità del recettore R per il ligando L e rappresenta la
concentrazione di un ligando che occupa il 50% dei recettori totali al momento
dell’equilibrio della reazione.
37.
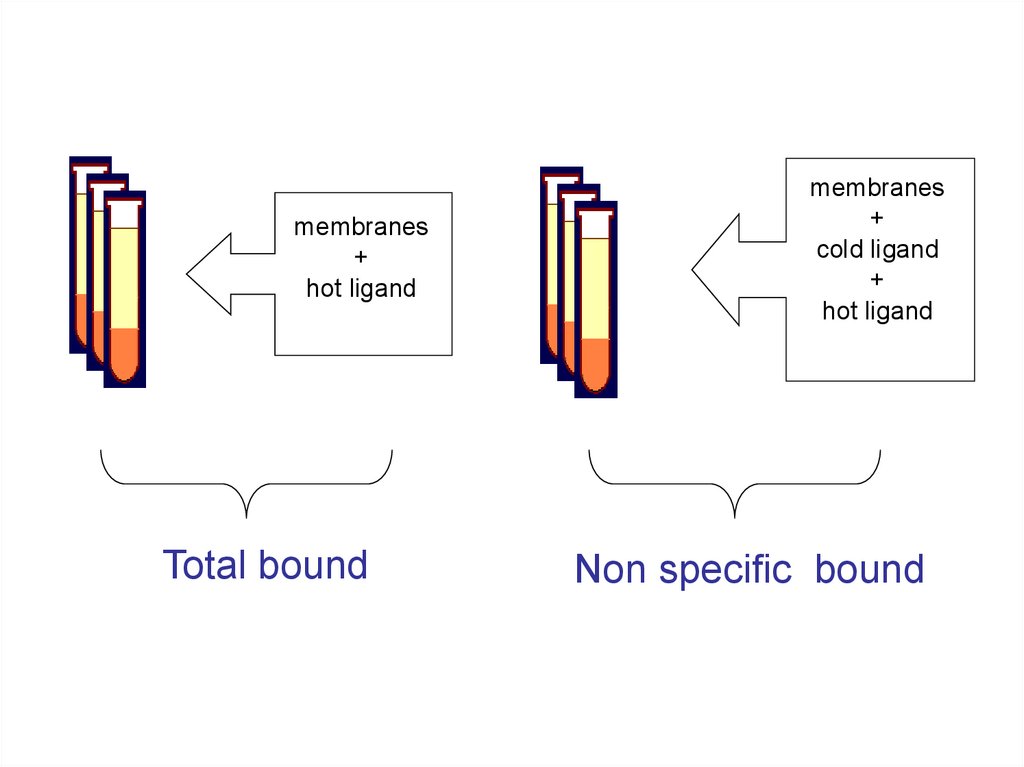
Binding recettorialeSi termina l’incubazione con una procedura che permetta di separare il ligando
legato al recettore dal ligando libero presente nel mezzo di incubazione:
1. Filtrazione
Consiste nel filtrare il mezzo di incubazione contenente il complesso [LR] e [L]
in eccesso, sotto vuoto attraverso filtri su cui si deposita il tessuto con il ligando
legato ai recettori.
2. Centrifugazione
Il medium di incubazione viene centrifugato ad alta velocità e successivamente
il pellet viene lavato senza che venga risospeso.
3. Dialisi
Questo metodo, sebbene sia un metodo molto appropriato dal punto di vista
teorico, può provocare una degradazione sia del recettore che del ligando. Altri
problemi di aspecificità sono poi dovuti al legame del ligando con le membrane
dializzatrici.
38.
Binding recettorialeAl termine dell’esperimento, la radioattività legata ai filtri o presente nel pellet
viene quantificata mediante spettrofotometria in liquido scintillante mediante
un beta-counter.
Il saggio del binding può essere condotto con protocolli differenti e in esso si
possono distinguere tre diversi tipi di studi:
1. esperimenti di saturazione
2. esperimenti di inibizione
3. esperimenti di cinetica
39.
Curve di saturazione• Binding misurato per concentrazioni crescenti di legante radioattivo fino alla
saturazione dei siti di binding.
• Es. misura del binding sul recettore muscarinico usando 3H-atropina,
membrane di cervello di ratto come tessuto ricco di recettori muscarinici ed
acetilcolina per la misura del binding aspecifico.
• La radioattività in presenza di solo tampone rappresenta il binding totale
del legante mentre il binding misurato in presenza di una concentrazione
saturante di acetilcolina rappresenta solo il binding aspecifico, in quanto
quello specifico è spiazzato dalla acetilcolina. Sottraendo dal binding totale
quello aspecifico si ottiene il binding specifico.
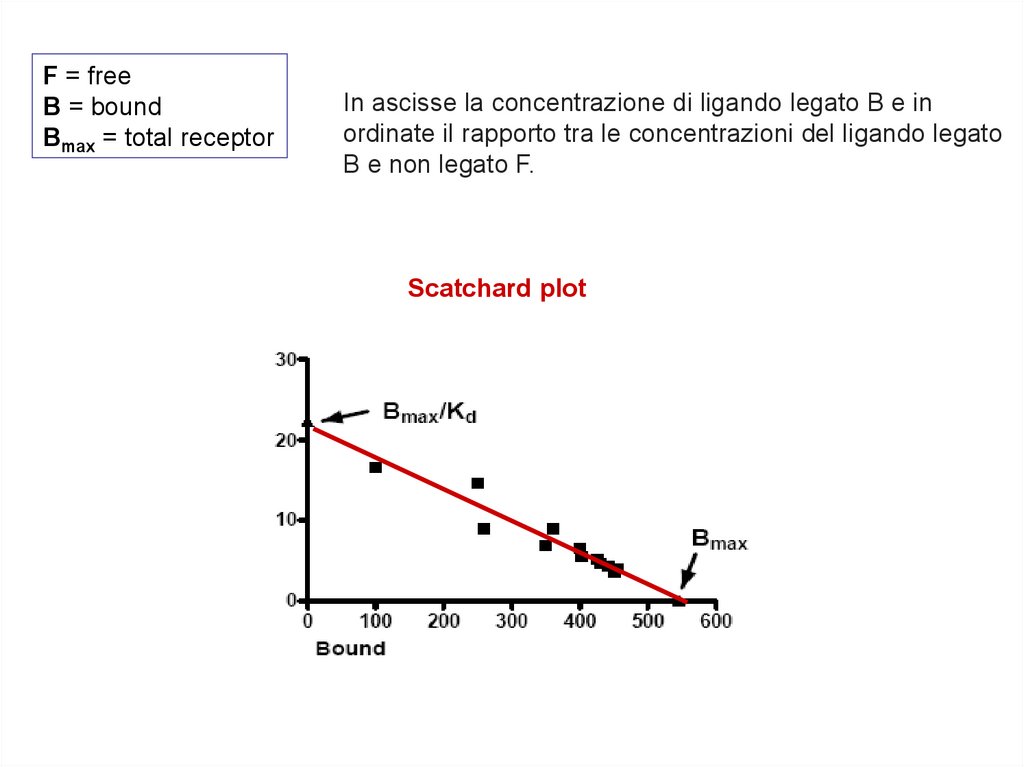
Le curve di saturazione servono principalmente per misurare la costante di
dissociazione del complesso legante-recettore ed il numero dei siti recettoriali
presenti nel preparato.
40.
membranes+
hot ligand
Total bound
membranes
+
cold ligand
+
hot ligand
Non specific bound
41.
F = freeB = bound
Bmax = total receptor
In ascisse la concentrazione di ligando legato B e in
ordinate il rapporto tra le concentrazioni del ligando legato
B e non legato F.
Scatchard plot
42.
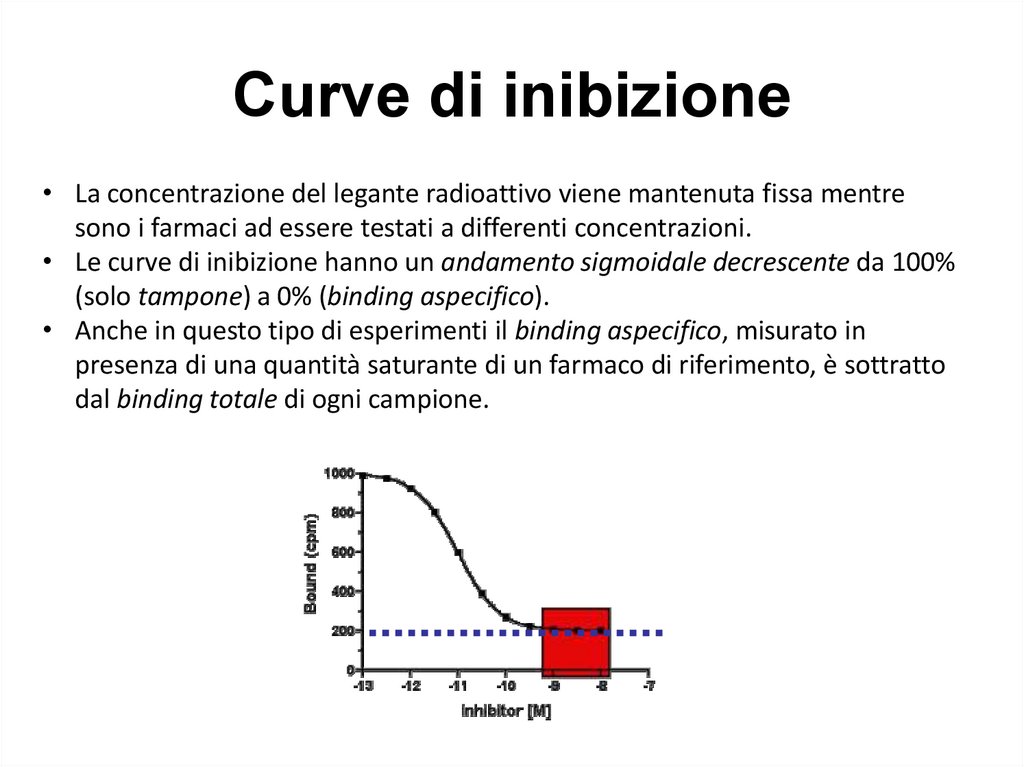
Curve di inibizione• La concentrazione del legante radioattivo viene mantenuta fissa mentre
sono i farmaci ad essere testati a differenti concentrazioni.
• Le curve di inibizione hanno un andamento sigmoidale decrescente da 100%
(solo tampone) a 0% (binding aspecifico).
• Anche in questo tipo di esperimenti il binding aspecifico, misurato in
presenza di una quantità saturante di un farmaco di riferimento, è sottratto
dal binding totale di ogni campione.
43.
Curve di inibizione• In questi esperimenti, il binding di un legante marcato è misurato in
presenza di concentrazioni crescenti di molecole che si pensa potrebbero
interagire con il recettore.
• Se questo è il caso, ci si aspetta una diminuzione del binding specifico in
quanto il legante marcato è spiazzato dal legame con il recettore dal
farmaco sperimentale che compete per lo stesso sito recettoriale.
• Viceversa, se il binding non è inibito dal prodotto in esame, neppure a
concentrazioni elevate, dobbiamo dedurre che questo non ha affinità per il
recettore marcato dal legante. Dalla costante di inibizione si ricava poi la Kd
dei vari prodotti.
Equazione di Cheng-Prusoff
D è la concetrazione del
radioligando
44.
Proprietà dei recettoriSaturabilità – il numero di recettori è finito
Reversibilità – il legame ligando-recettore non è covalente ma
deriva da interazioni deboli (legami a ponte di H, forze di van der
Waal).
Stereoselectività – I recettori mostrano diversa affinità nei confronti
di isomeri diversi (+ o -, d o l, S o R).
Specificità degli agonisti – molecule strutturalmente simili
mostrano affinità di legame simile
Specificità tissutale – il legame farmaco-recettore è misurabile in
tessuti che rispondono al ligando endogeno di quel recettore e a
concentrazioni fisiologiche.
In un esperimento di binding se non vengono soddisfatte tutte
queste condizioni, questo è indicativo della presenza di interazioni
aspecifiche
45.
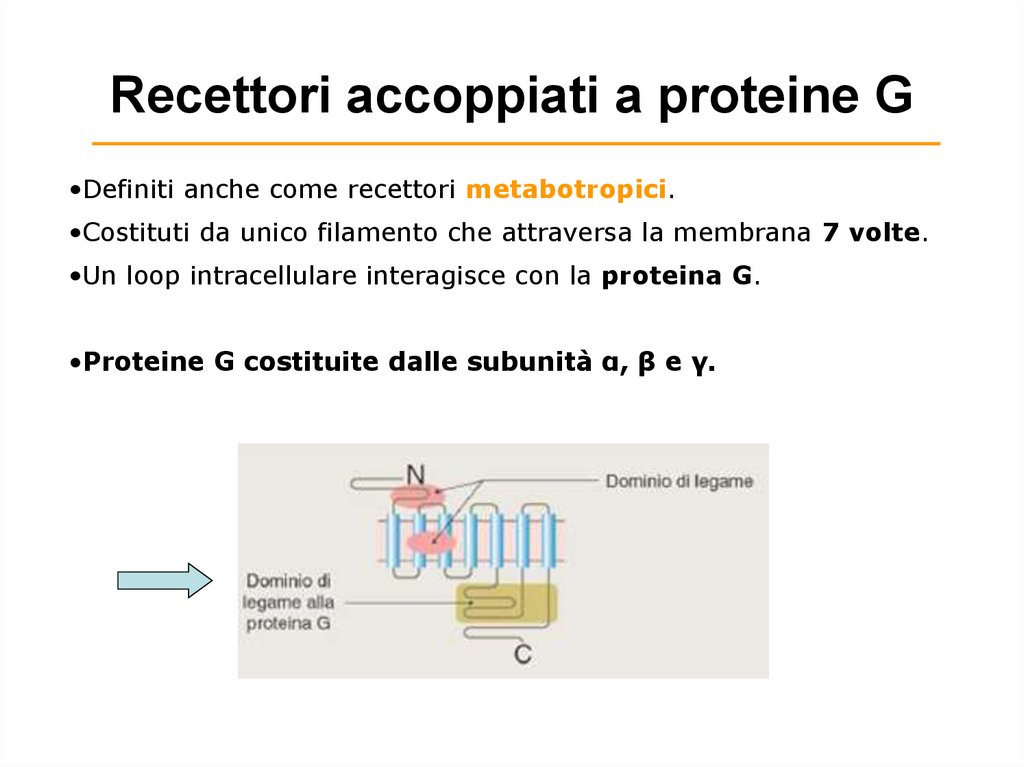
Recettori accoppiati a proteine G•Definiti anche come recettori metabotropici.
•Costituti da unico filamento che attraversa la membrana 7 volte.
•Un loop intracellulare interagisce con la proteina G.
•Proteine G costituite dalle subunità α, β e γ.
46.
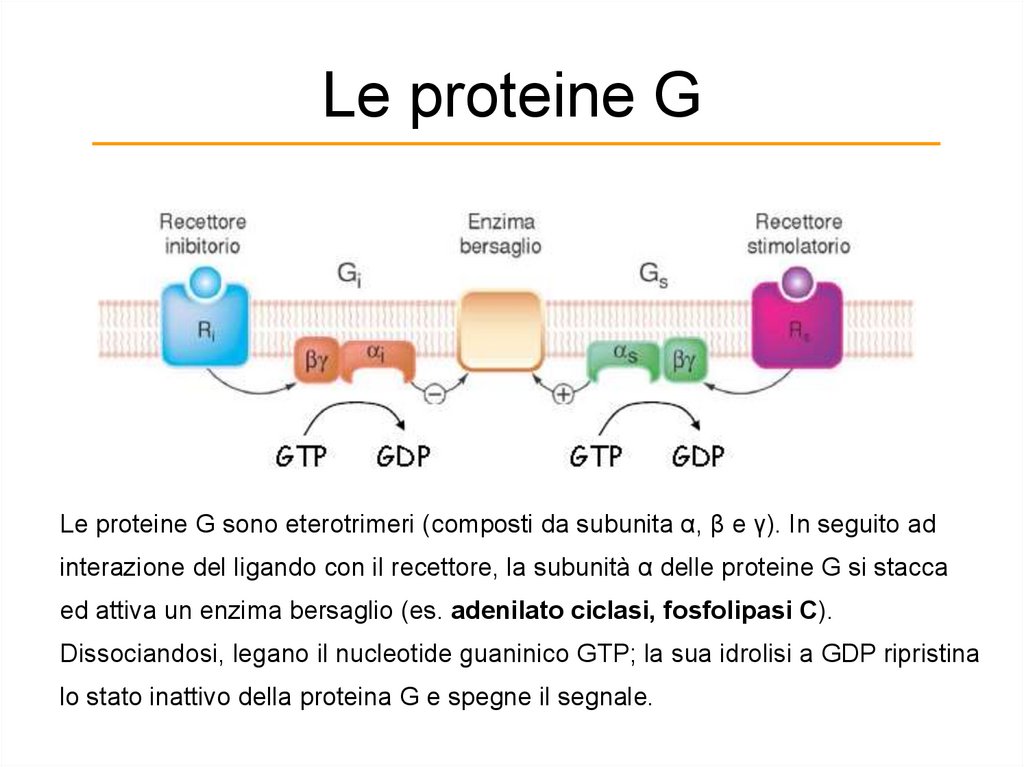
Le proteine GLe proteine G sono eterotrimeri (composti da subunita α, β e γ). In seguito ad
interazione del ligando con il recettore, la subunità α delle proteine G si stacca
ed attiva un enzima bersaglio (es. adenilato ciclasi, fosfolipasi C).
Dissociandosi, legano il nucleotide guaninico GTP; la sua idrolisi a GDP ripristina
lo stato inattivo della proteina G e spegne il segnale.
47.
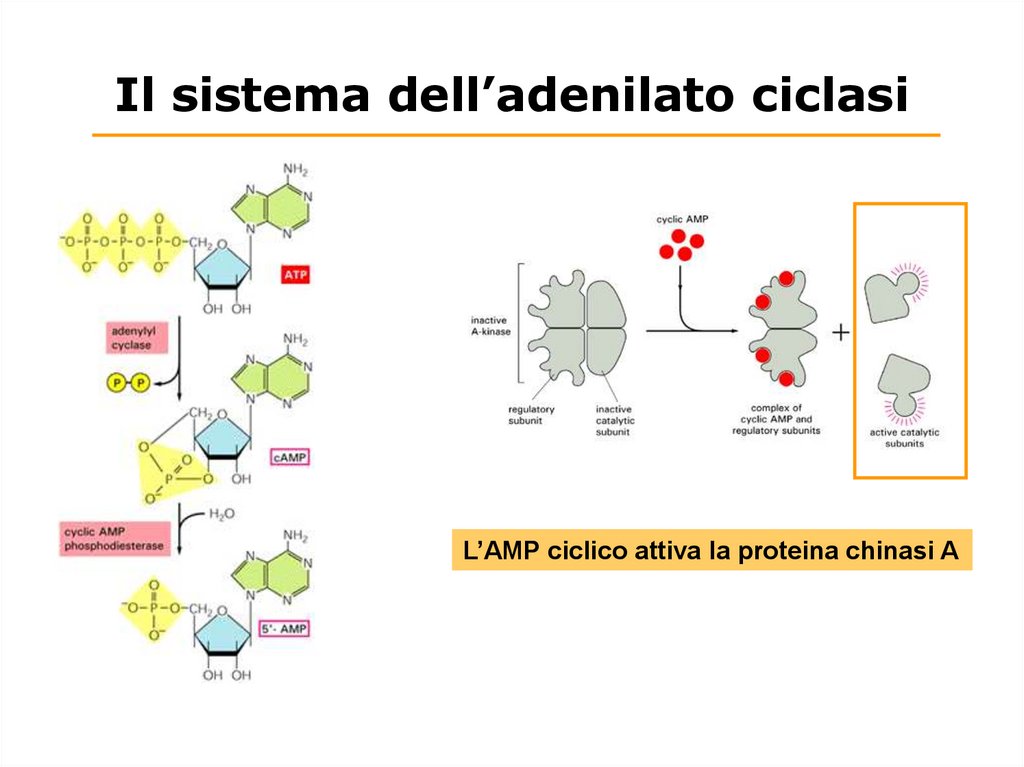
Il sistema dell’adenilato ciclasiL’AMP ciclico attiva la proteina chinasi A
48.
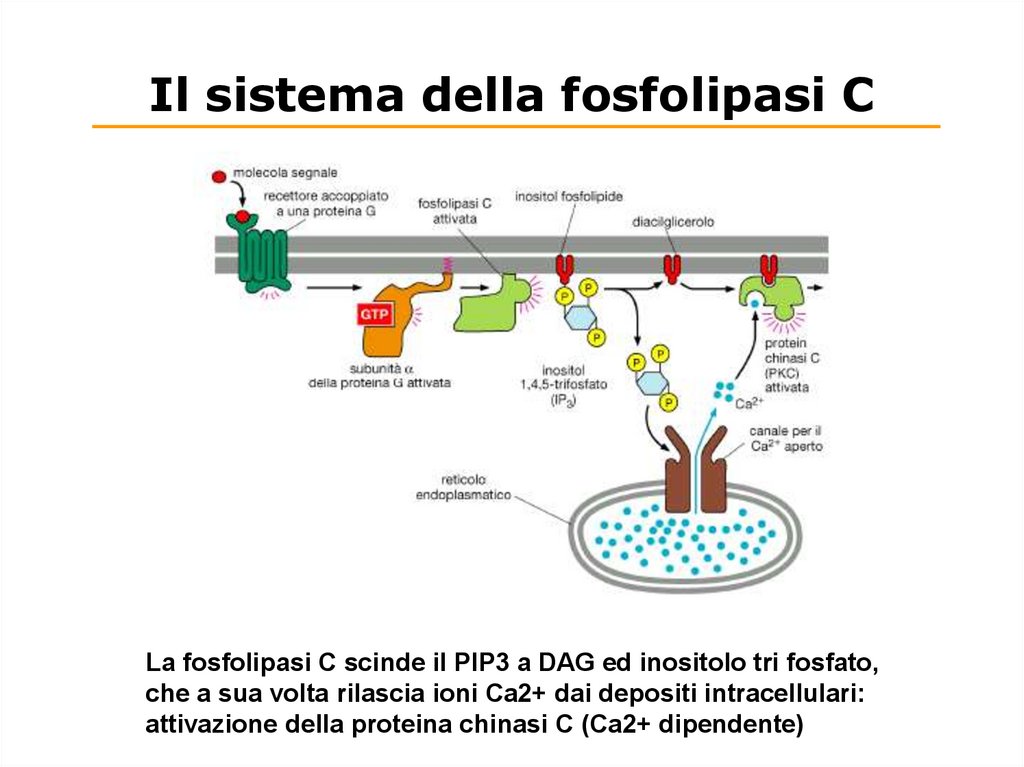
Il sistema della fosfolipasi CLa fosfolipasi C scinde il PIP3 a DAG ed inositolo tri fosfato,
che a sua volta rilascia ioni Ca2+ dai depositi intracellulari:
attivazione della proteina chinasi C (Ca2+ dipendente)