Similar presentations:
Окислительно-восстановительные реакции. Лекция №7
1.
ГОУ ВПО «Донбасская Национальная академия строительства иархитектуры»,
кафедра «Прикладная химия»
Курс лекций по дисциплине «Химия»
для студентов 1 курса
Направление подготовки – 23.03.03 «Эксплуатация
транспортно-технологических машин и комплексов»
Составил:
Ташкинов Ю.А.
Макеевка, 2019
1
2.
Правила определения степени окисленияатомов в химическом соединении:
1. Степень окисления атомов в простых веществах равна нулю
(например О3, S, Zn и др.).
2. Металлы всегда имеют положительную степень окисления.
Для элементов главных подгрупп абсолютное значение
степени окисления = номеру группы.
3. Водород во всех соединениях, кроме гидридов металлов
(NaН, ВаН2 и др.), имеет степень окисления +1; в гидридах
металлов - -1.
4. Степень окисления кислорода равна –2. Исключение
составляют пероксиды – соединения, содержащие группу –
О-О- (Н2О2, К2О2 и др.) и некоторые другие вещества (ОF2
O+1).
2
3.
+2-2
+2 -2
0
+4 -2
CuO + CO → Cu + CO2
Химические реакции, протекающие c изменением
степеней окисления химических элементов,
относятся к окислительно-восстановительным
реакциям.
3
4.
45.
56.
Влияние степени окисления наокислительные и
восстановительные свойства
элементов.
1.
2.
3.
В высшей положительной степени окисления
элемент проявляет только окислительные
свойства
В промежуточной степени окисления и
окислительные и восстановительные
свойства.
В высшей отрицательной степени окисления
только восстановительные степени
окисления.
6
7.
00
2 Al + 3 S →
0
Al
0
S
→
Al
-2
+ 2e →
S
-2
Al 2S3
0
+3
– 3e
+3
2
6
Al – восстановитель,
процесс окисления
0
3
S
– окислитель,
процесс восстановления
7
8.
89.
910.
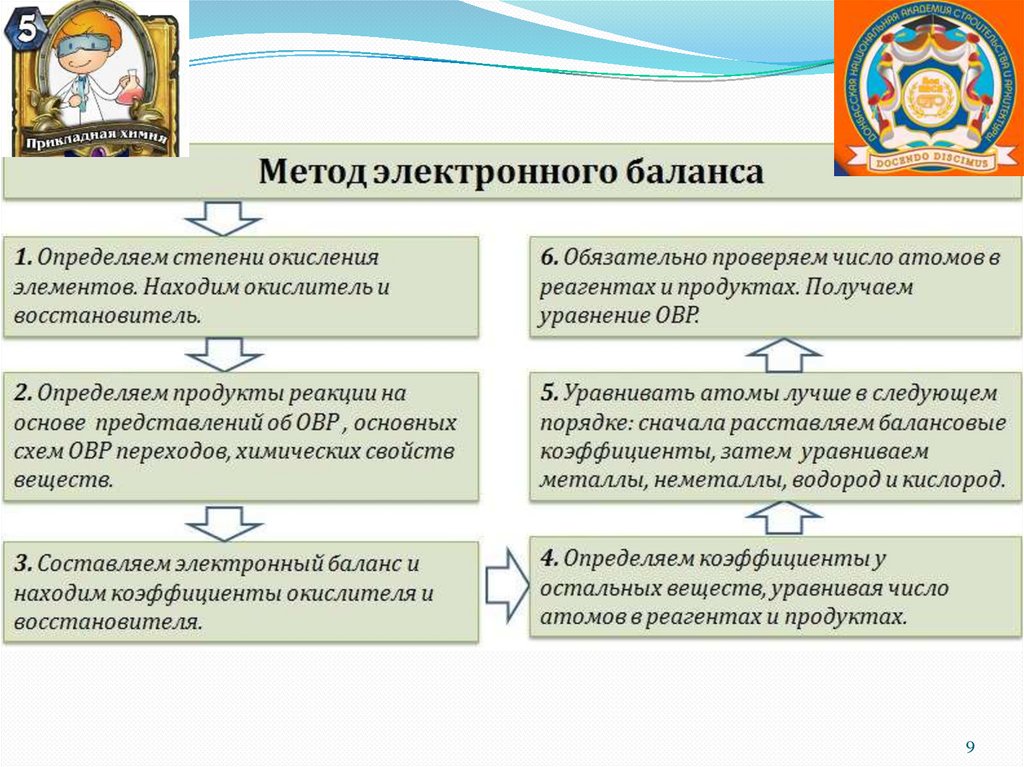
Классификация ОВР1. Межмолекулярные
Fe + CuSO4 → Cu + FeSO4
2. Внутримолекулярные
(NH4)2Cr2O7 = Cr2O3 + N2 + 4H2O
3. Самоокисления-самовосстановления
(диспропорционирования)
Cl2 + H2O ↔ HCl + HClO
10










 chemistry
chemistry