Similar presentations:
Влияние алкоголя на белковый обмен
1.
ФГБОУ ВО «КУРСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙУНИВЕРСИТЕТ» МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ
РОССИЙСКОЙ ФЕДЕРАЦИИ
КАФЕДРА БИОЛОГИЧЕСКОЙ ХИМИИ
Влияние алкоголя на
белковый обмен
Подготовила: Хаустова Лариса Владимировна, студентка 14 группы, 2 лечебного факультета
Научный руководитель: к.б.н., старший преподаватель кафедры биологической химии Бушмина
Ольга Николаевна
2.
ЭтанолЭтиловый спирт (этанол,
метилкарбинол, винный
спирт) С2Н5ОН – бесцветная
жидкость с характерным
запахом и жгучим вкусом.
Этанол растворим и в воде, и
в жирах, поэтому может
беспрепятственно проникать
через клеточные мембраны,
уменьшая её проницаемость.
3.
В медицине этиловыйспирт применяют для
дезинфекции, как поверхностное
сосудорасширяющее средство,
коагулянт белка, при лечении
ожогов.
Этиловый спирт чрезвычайно
гигроскопичен. При приёме
внутрь угнетает центры
торможения мозга, вызывает
опьянение, при многократном
употреблении – алкоголизм.
4.
АлкогольдегидрогеназаМетаболизм этанола осуществляется преимущественно печенью.
Алкогольдегидрогеназная (АДГ) система - наиболее существенная, она
метаболизирует 80-85% этанола, содержащегося в цитозоле, катализирует
окисление спиртов в присутствии коферментов НАД и НАДН.
5.
В настоящее время различают три класса АДГ (I-III), полипептидные цепикоторых (α; β 1-3; j 1-2; p; x) являются продуктами экспрессии 5
генетических локусов (АДГ 1-5).
Алкогольдегидрогеназа в организме человека представлена 5
изоферментными формами.
АДГ-I - является основным ферментом печени, обусловливающим при
алкогольной интоксикации окисление большей части поступившего в
организм этанола.
АДГ-II - гомодимер, состоящий из полипептидных цепей «p». Он
характеризуется низким сродством к этанолу, не окисляет метанол,
этиленгликоль, циклогексанол. Наиболее вероятным физиологическим
субстратом АДГ-II являются альдегиды, продукты обмена норадреналина.
АДГ-III состоит из двух одинаковых субъединиц типа «x». Имеет низкое
сродство к короткоцепочечным спиртам. Роль этого фермента в окислении
этанола незначительна, физиологические функции пока не известны.
6.
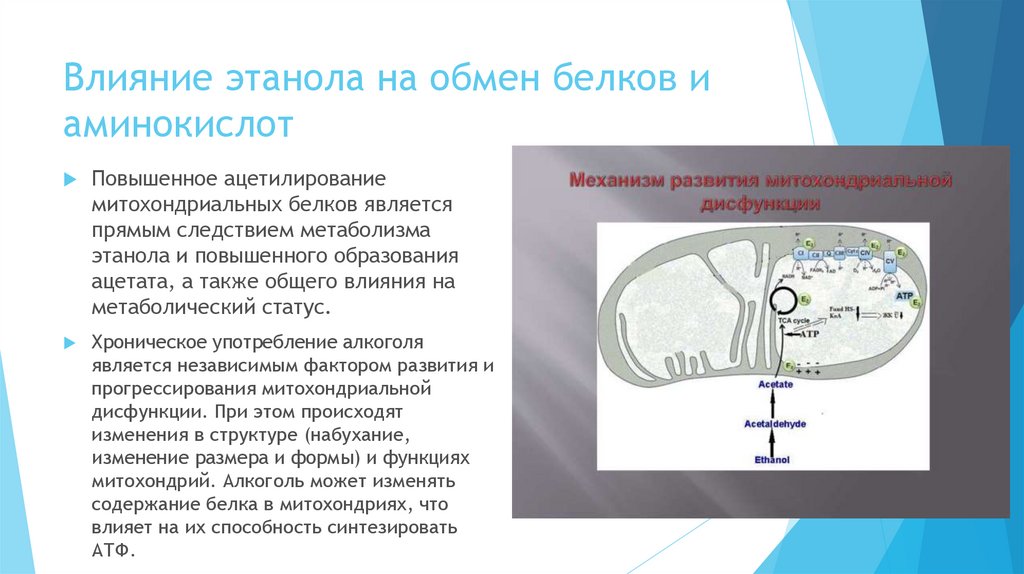
Влияние этанола на обмен белков иаминокислот
Повышенное ацетилирование
митохондриальных белков является
прямым следствием метаболизма
этанола и повышенного образования
ацетата, а также общего влияния на
метаболический статус.
Хроническое употребление алкоголя
является независимым фактором развития и
прогрессирования митохондриальной
дисфункции. При этом происходят
изменения в структуре (набухание,
изменение размера и формы) и функциях
митохондрий. Алкоголь может изменять
содержание белка в митохондриях, что
влияет на их способность синтезировать
АТФ.
7.
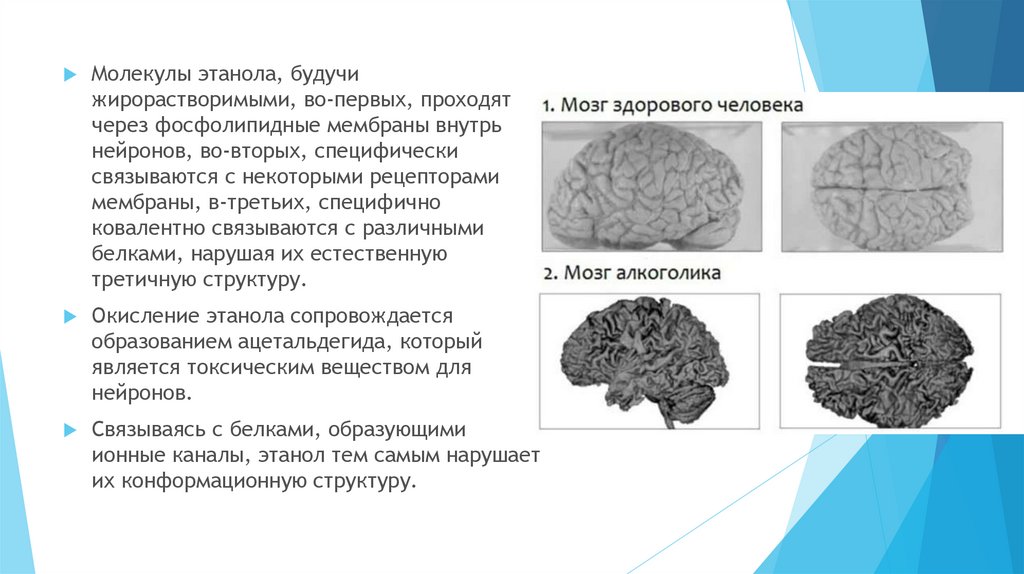
Молекулы этанола, будучижирорастворимыми, во-первых, проходят
через фосфолипидные мембраны внутрь
нейронов, во-вторых, специфически
связываются с некоторыми рецепторами
мембраны, в-третьих, специфично
ковалентно связываются с различными
белками, нарушая их естественную
третичную структуру.
Окисление этанола сопровождается
образованием ацетальдегида, который
является токсическим веществом для
нейронов.
Связываясь с белками, образующими
ионные каналы, этанол тем самым нарушает
их конформационную структуру.
8.
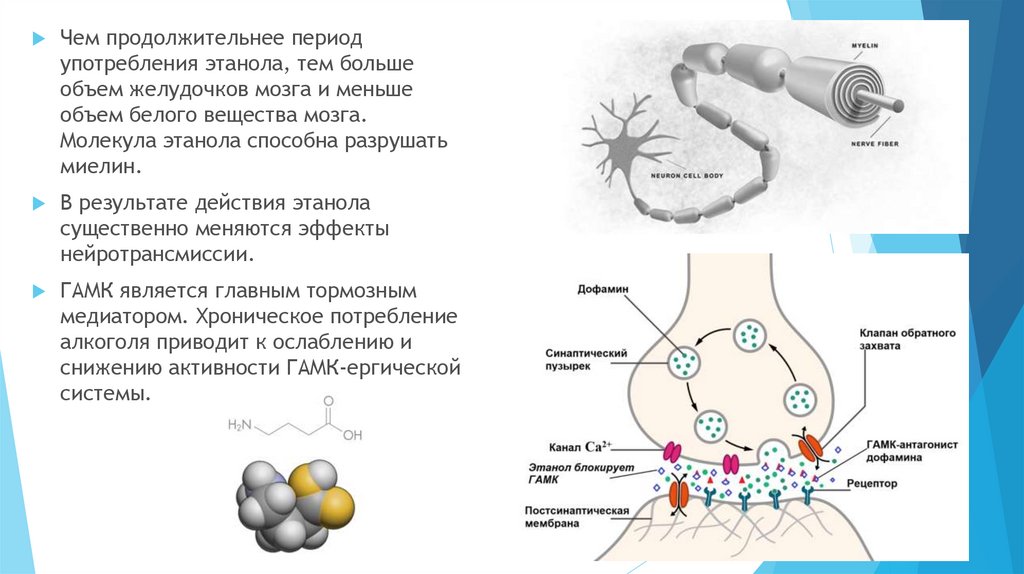
Чем продолжительнее периодупотребления этанола, тем больше
объем желудочков мозга и меньше
объем белого вещества мозга.
Молекула этанола способна разрушать
миелин.
В результате действия этанола
существенно меняются эффекты
нейротрансмиссии.
ГАМК является главным тормозным
медиатором. Хроническое потребление
алкоголя приводит к ослаблению и
снижению активности ГАМК-ергической
системы.
9.
Прихроническом поступлении этанола в
организм происходят незначительные
колебания суммарного уровня аминокислот,
что может быть обусловлено
формированием метаболической адаптации
при периодическом воздействии алкоголя.
В
том числе алкогольная интоксикация
сопровождается дисбалансом пула
свободных аминокислот – как плазменного,
так и висцерального.
10.
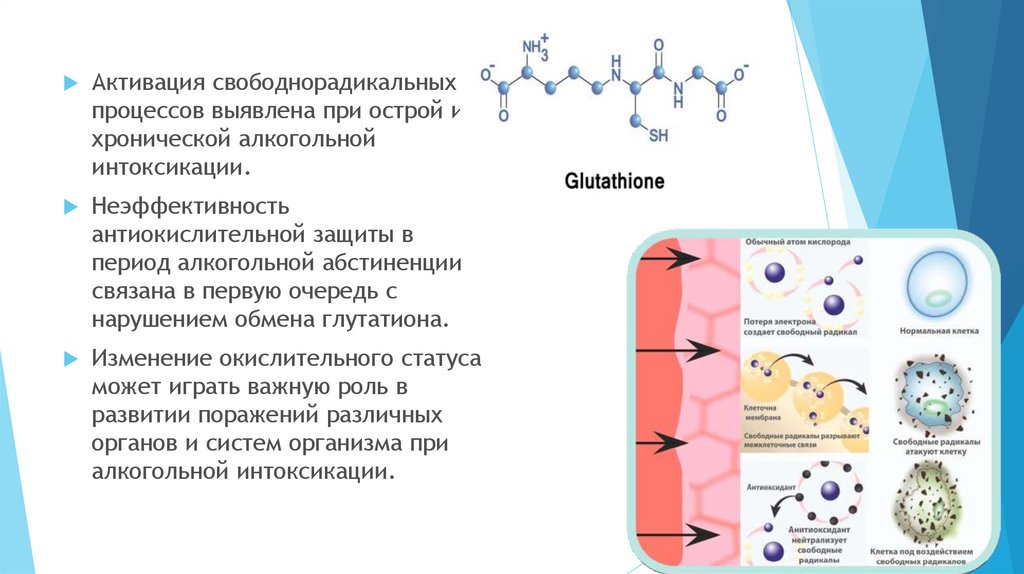
Активация свободнорадикальныхпроцессов выявлена при острой и
хронической алкогольной
интоксикации.
Неэффективность
антиокислительной защиты в
период алкогольной абстиненции
связана в первую очередь с
нарушением обмена глутатиона.
Изменение окислительного статуса
может играть важную роль в
развитии поражений различных
органов и систем организма при
алкогольной интоксикации.
11.
Выводы:Наиболее чувствительными к усилению процессов
свободно-радикального окисления и основными
акцепторами активных форм кислорода являются
белки.
Этанол вызывает конформационное повреждение
белков. В результате белки инактивируются и не могут
выполнять свои специфические функции (ферменты,
рецепторы, каналы, ионные каналы, транспортные
белки и пр.).
12.
Список литературы:1.
Этанол – судебная медицина [Электронный ресурс]. Режим доступа: URL: https://forensicmedicine.ru/wiki/Этанол (дата обращения: 20.01.21).
2.
Биотрансформация этанола. Метаболизм этанола в организме [Электронный ресурс]. Режим доступа: URL: https://www.alcoclinic.ru/poleznajainformacija/biotransformacija-etanola/ (дата обращения: 20.01.21).
3.
Этанол [Электронный ресурс]. Режим доступа: URL: https://info-farm.ru/alphabet_index/eh/ehtanol.html (дата обращения: 20.01.21).
4.
Этиловый спирт. Химико-токсикологический анализ [Электронный ресурс]. Режим доступа: URL: https://farmf.ru/lekcii/etilovyj-spirt-ximikotoksikologicheskij-analiz/#:~:text=Этиловый%20спирт%20(этанол%2C%20метилкарбинол%2C%20винный,и%20жгучим%20вкусом%3B%20т.%20кип (дата
обращения: 20.01.21).
5.
Бутвиловский, А.В. Алкогольдегидрогеназы хордовых животных / А. В. Бутвиловский, Е. В. Барковский, В. Э. Бутвиловский // Белорусский
государственный медицинский университет. – Минск, 2007. – 146 с.
6.
Зимин, Ю.В. Алкогольдегидрогеназа. Молекулярная и надмолекулярная регуляция / Ю.В. Зимин, А.А. Уланова, А.Г. Соловьева // Нижний Новгород. –
Фундаментальные исследования. – 2012. - №3. –С.527-530.
7.
Бортникова, А.К. Патофизиологические механизмы нарушений промежуточного углеводного обмена головного мозга при формировании стойкого
влечения к этанолу: дисс. канд. мед. наук: 14.03.03 / Бортникова Анна Константиновна. – Донецк, 2021. – 156 с.
8.
Бородкина, Л.Е. Хроническая алкоголизация и ГАМК-ергическая система / Л.Е. Бородкина, И.Н. Тюренков, В.В. Ковтун // Волгоградская медицинская
академия.- Волгоград, 2002. - №3. – С. 75-79.
9.
Ali HR, Assiri MA, Harris PS, et al. Quantifying Competition among Mitochondrial Protein Acylation Events Induced by Ethanol Metabolism. J Proteome Res.
2019;18(4):1513-1531.
10.
Лелевич, В. В. Состояние пула свободных аминокислот крови и печени при хронической алкогольной интоксикации / В. В. Лелевич, О. В. Артемова //
Журнал Гродненского государственного медицинского университета. – 2010. – № 2(30). – С. 16-19.
11.
Rodriguez FD, Coveñas R. Biochemical Mechanisms Associating Alcohol Use Disorders with Cancers. Cancers (Basel). 2021;13(14):3548. Published 2021 Jul 15.
12.
Нарушение обмена глутатиона при алкоголизме / В. Е. Высокогорский, Е. С. Ефременко, Д. Е. Быков [и др.] // Омский научный вестник. – 2011. – №
1(104). – С. 9-12.
13.
Артемова, О. В. Свободные аминокислоты печени крыс в условиях прерывистой алкогольной интоксикации / О. В. Артемова, В. В. Лелевич // Журнал
Гродненского государственного медицинского университета. – 2007. – № 3(19). – С. 25-28.
14.
Можейко Лариса Андреевна Механизмы воздействия панкреатит-провоцирующих факторов на ацинарные и звездчатые клетки поджелудочной железы
// Вестник Смоленской государственной медицинской академии. 2019. №2. URL: https://cyberleninka.ru/article/n/mehanizmy-vozdeystviya-pankreatitprovotsiruyuschih-faktorov-na-atsinarnye-i-zvezdchatye-kletki-podzheludochnoy-zhelezy (дата обращения: 20.12.2021).








 medicine
medicine








