Similar presentations:
Ионная связь. Взаимная поляризация ионов
1.
ИОННАЯ СВЯЗЬ.ВЗАИМНАЯ ПОЛЯРИЗАЦИЯ ИОНОВ
2.
ИОННАЯ СВЯЗЬ.ВЗАИМНАЯ ПОЛЯРИЗАЦИЯ ИОНОВ
Свойства ионных соединений во многом определяются
взаимной поляризацией входящих в их состав ионов.
Поляризация иона выражается в относительном
смещении ядра и окружающих его электронов
внешней электронной оболочки под действием
электрического поля соседнего иона;
При этом валентные электроны смещаются в
сторону
катионов.
Подобная
деформация
электрон-ной оболочки ведет к понижению степени
ионности связи и к превращению ее в полярную
ковалентную связь.
3.
ПОЛЯРИЗУЕМОСТЬ ИОНОВПоляризуемость ионов (т. е. их способность
деформироваться под действием внешнего электрического
поля)
характеризуется
следующими
особенностями:
1. При одинаковом абсолютном значении заряда и
равных радиусах ионов поляризуемость анионов
больше поляризуемости катионов.
2. Поляризуемость ионов с аналогичным электронным строением возрастает с ростом ионного
радиуса (т. е. с увеличением числа электронных
слоев). Так, по возрастанию поляризуемости ионы
можно расположить в следующие ряды:
F‾ < Сl‾ < Вr‾ < I‾;
Li+ < Na+ < K+ < Rb+ < Cs+
4.
ВЗАИМНАЯ ПОЛЯРИЗАЦИЯ ИОНОВПОЛЯРИЗУЕМОСТЬ ИОНОВ
3. При одном и том же заряде и одинаковом ра
диусе ионов поляризуемость ионов с 18-электронной
оболочкой (например, Cu+, Cd2+) выше, чем ионов с
электронной структурой благородного газа (Na+,
Са2+ и т. п.).
8 ē < (8+n) ē < 18 ē
или
… ns2np6 < … (n – 1) d1–9 < … (n – 1) d10
8ē
Be2+, Mg2+, Al3+, Ti4+, Zr4+, Hf4+ и т.п.
(8+n)ē
Mn2+; Fe2+; Fe3+; Cr3+; Co2+ и т.п.
18 ē
Zn2+; Cd2+; Hg2+; Sn4+; Pb4+ и т.п.
5.
ИОННАЯ СВЯЗЬ.ВЗАИМНАЯ ПОЛЯРИЗАЦИЯ ИОНОВ
Поляризующее действие иона (т. е. его способность деформировать, поляризовать другой, ион)
возрастает с увеличением заряда и уменьшением
радиуса иона и сильно зависит от его электронной
структуры.
Ионы с благородногазовой электронной конфигурацией
(например, Са2+, Ва2+) оказывают более слабое
поляризующее действие, чем ионы с незавершенным
электронным слоем (Ti2+, Fe2+, Pb2+ и т. п.).
Наиболее сильное поляризующее действие (при одном
и том же заряде иона) проявляют ионы с 18электронной структурой внешнего слоя (Cu+, Ag+, Zn2+
Cd2+, Hg2+).
6.
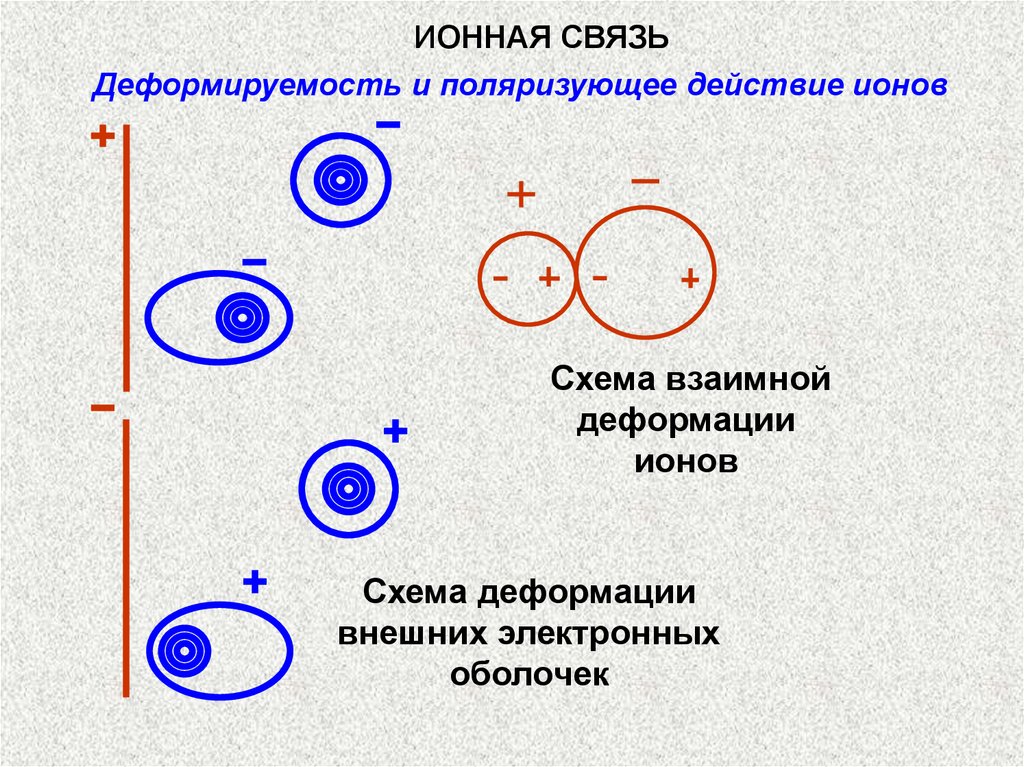
ИОННАЯ СВЯЗЬДеформируемость и поляризующее действие ионов
Схема взаимной
деформации
ионов
Схема деформации
внешних электронных
оболочек
7.
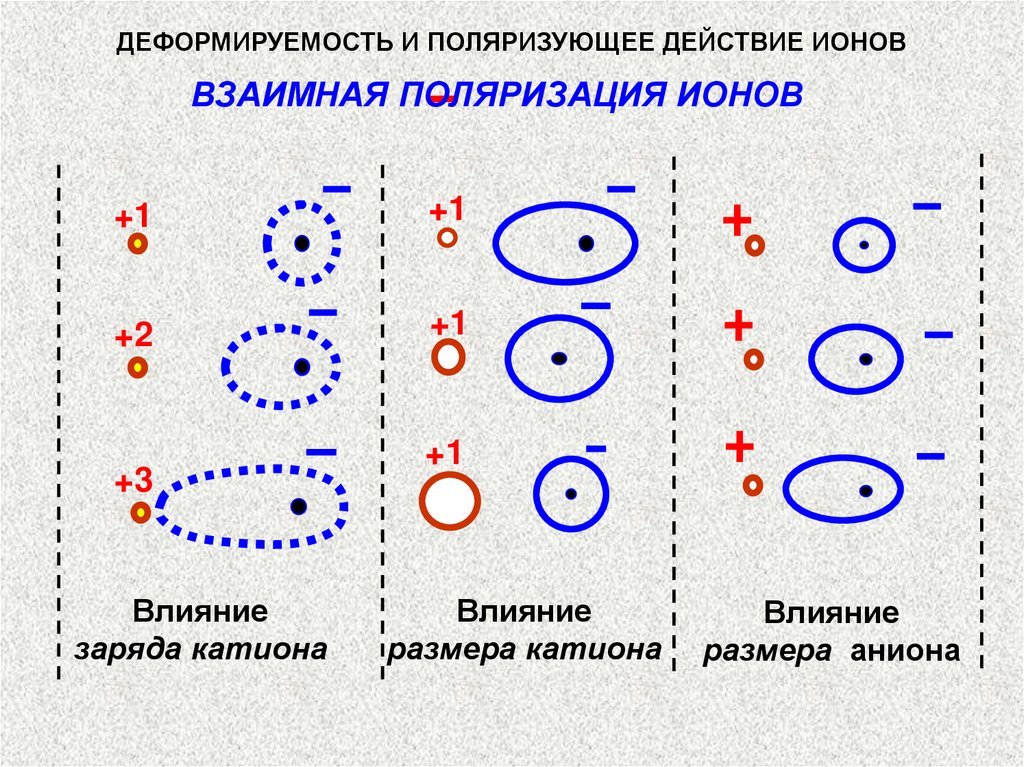
ДЕФОРМИРУЕМОСТЬ И ПОЛЯРИЗУЮЩЕЕ ДЕЙСТВИЕ ИОНОВВЗАИМНАЯ ПОЛЯРИЗАЦИЯ ИОНОВ
+1
+1
+2
+1
+3
Влияние
заряда катиона
+1
Влияние
размера катиона
Влияние
размера аниона
8.
ИОННАЯ СВЯЗЬ.ВЗАИМНАЯ ПОЛЯРИЗАЦИЯ ИОНОВ
Поскольку размеры анионов, как правило, больше
размеров катионов, то анионы обладают большей
поляризуемостью и меньшей поляризующей
способностью, чем катионы.
Поэтому при взаимодействии катиона с анионом
поляризации подвергается преимущественно анион;
поляризацией катиона в большинстве случаев можно
пренебречь!
9.
ИОННАЯ СВЯЗЬ.ВЗАИМНАЯ ПОЛЯРИЗАЦИЯ ИОНОВ
Пример 1. Радиусы ионов Na+ и Сu+ одинаковы
(0,098 нм). Объяснить различия температур
плавления хлорида натрия (801 °С) и хлорида
меди(I) (430 °С).
10.
ИОННАЯ СВЯЗЬ.ВЗАИМНАЯ ПОЛЯРИЗАЦИЯ ИОНОВ
Пример 1. Радиусы ионов Na+ и Сu+ одинаковы
(0,098 нм). Сравните температуры плавления
хлорида натрия NaCl и хлорида меди (I) CuCl.
Какое соединение будет иметь более высокую
температуру плавления. Дать объяснение.
11.
ВЗАИМНАЯ ПОЛЯРИЗАЦИЯ ИОНОВРешение.
Сравним валентные электронные конфигурации ионов
Na+ и Сu+.
Na+ … 2s22p6
Сu+ … 3s23p63d10
Ион Сu+ имеет 18-электронную внешнюю оболочку и
сильнее поляризует анион Сl‾, чем ион Na+,
обладающий 8-электронной структурой.
Поэтому в хлориде меди(I) в результате поляризации с
аниона на катион переносится более значительная
часть электронного заряда, чем в хлориде натрия.
Эффективные заряды ионов в кристалле CuCl
оказываются меньше, чем в кристалле NaCl, а
электростатическое взаимодействие между ними —
более слабым. Поэтому NaCl будет иметь более
высокую т. пл. (801 °С), чем CuCl (430 °С).
12.
ВЗАИМНАЯ ПОЛЯРИЗАЦИЯ ИОНОВРешение.
Ион Сu+ имеет 18-электронную (…3s23p63d10) внешнюю
оболочку и более сильно поляризует анион Сl‾, чем ион
Na+,
обладающий
благородногазовой
(…2s22p6)
электронной структурой.
Поэтому в хлориде меди(I) в результате поляризации с
аниона на катион переносится более значительная
часть электронного заряда, чем в хлориде натрия.
Эффективные заряды ионов в кристалле CuCl
оказываются меньше, чем в кристалле NaCl, а
электростатическое взаимодействие между ними —
более слабым.
Этим и объясняется более низкая температура
плавления CuCl в сравнении с NaCl, кристаллическая
решетка которого близка к чисто ионному типу.
13.
ИОННАЯ СВЯЗЬ.ВЗАИМНАЯ ПОЛЯРИЗАЦИЯ ИОНОВ
Задачи
1. Исходя из представлений о природе ионной связи,
объяснить, почему при обычных условиях ионные
соединения существуют в виде ионных кристаллов,
а не в виде отдельных молекул.
2. Температура плавления СаСl2 780°С, CdCl2 — 560
°С; радиус иона Са2+ равен 0,104 нм, иона Cd2+ —
0,099 нм. Объяснить различие температур
плавления.
3. При переходе от CsF к Csl температура плавления
кристаллов уменьшается. Объяснить наблюдаемый ход изменения температур плавления.
14.
ИОННАЯ СВЯЗЬ.ВЗАИМНАЯ ПОЛЯРИЗАЦИЯ ИОНОВ
Задачи
5. Объяснить неустойчивость гидроксидов меди (I) и
серебра (I).
6. Объяснить с позиций представлений о поляризации ионов меньшую устойчивость АuСl3 в
сравнении с AuCl и PbCl4 в сравнении с РbСl2.
К2С03 плавится при 890°С без разложения, Ag2C03
разлагается уже при 220 °С. Объяснить указанное
различие.
7. ВаСl2 в водных растворах диссоциирует полностью, a HgCl2 почти не диссоциирует. Объяснить
это различие в свойствах солей.
15.
ИОННАЯ СВЯЗЬ.ВЗАИМНАЯ ПОЛЯРИЗАЦИЯ ИОНОВ
Вопросы для самоконтроля
1. Какой из перечисленных ионов обладает
большим поляризующим действием:
a)Na+;
б) Са2+
в) Mg2+;
г) Аl3+?
2. У какого из соединений — SrF2 или PbF2 —
температура плавления выше:
а) у SrF2;
б) у PbF2
в) примерно одинаковы?
Потому что: 1) радиусы ионов Sr2+ и РЬ2+ имеют
близкие значения; 2) степень ионности связи Sr—F
выше, чем связи Pb—F.
16.
ИОННАЯ СВЯЗЬ.ВЗАИМНАЯ ПОЛЯРИЗАЦИЯ ИОНОВ
Вопросы для самоконтроля
3. Какое из соединений — MgCO3 или ZnCO3
термически более устойчиво: a) MgCO3; б)
ZnCO3?
Потому что:
1) гидроксид магния проявляет только основные
свойства, а гидроксид цинка амфотерен;
2) катион с благородногазовой электронной конфигурацией оказывает меньшее поляризующее
действие на анион, чем катион того же размера и
заряда с 18-электронной структурой внешнего
слоя.
17.
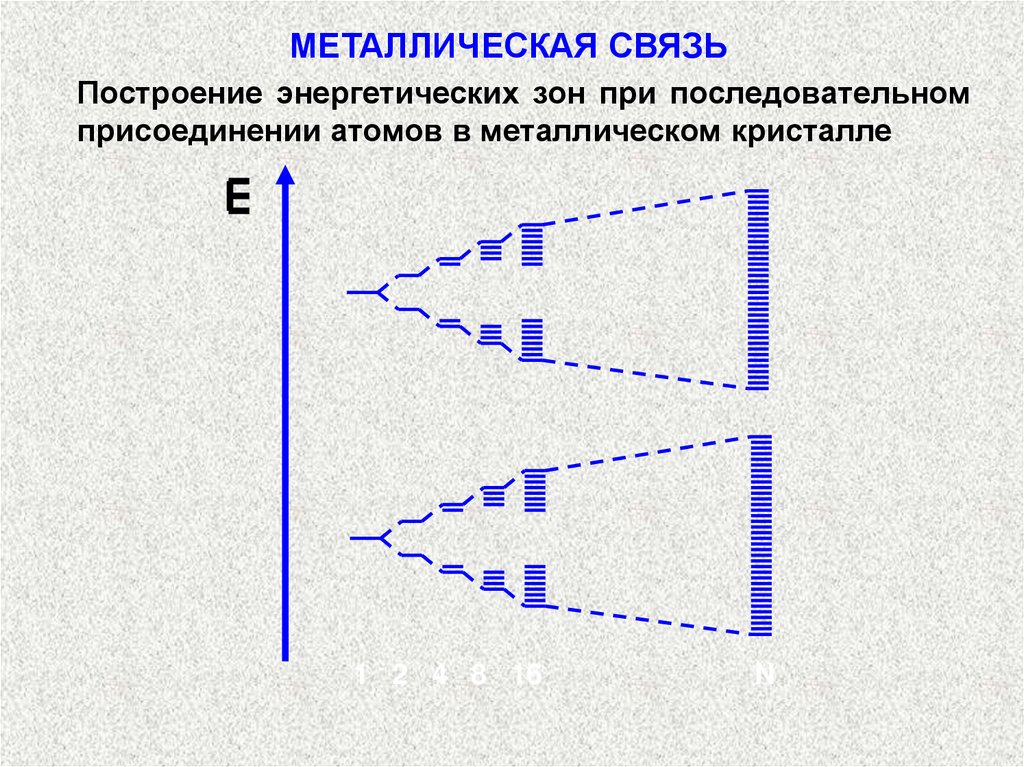
МЕТАЛЛИЧЕСКАЯ СВЯЗЬПостроение энергетических зон при последовательном
присоединении атомов в металлическом кристалле
1 2 4 8 16
N














 chemistry
chemistry