Similar presentations:
Сера. Историческая справка
1.
2.
С этим веществом человечествознакомо еще с глубокой древности.
Оно использовалось в религиозных
обрядах - поджигали при различных
церемониях, ритуалах, для изгнания
злых духов, этим веществом чернили
оружие.
Применялось в Древнем Египте для приготовления красок,
беления тканей, изготовления косметических средств, для
лечения кожных заболеваний, для дезинфекции, изготовления
пороха.
В переводе с древне индусского сера означает светло-желтая.
3.
Практическое значение серы резковозросло после того, как изобрели
черный порох
(в состав которого обязательно
входит сера).
Византийцы в 673 г., защищая
Константинополь,
сожгли флот неприятеля с помощью так
называемого греческого огня — смеси селитры, серы,
смолы и других веществ — пламя которого не гасилось
водой.
4. Сера – химический элемент
Положение в ПСХЭ:порядковый номер 16,
период 3,
VI группа,
подгруппа главная
5.
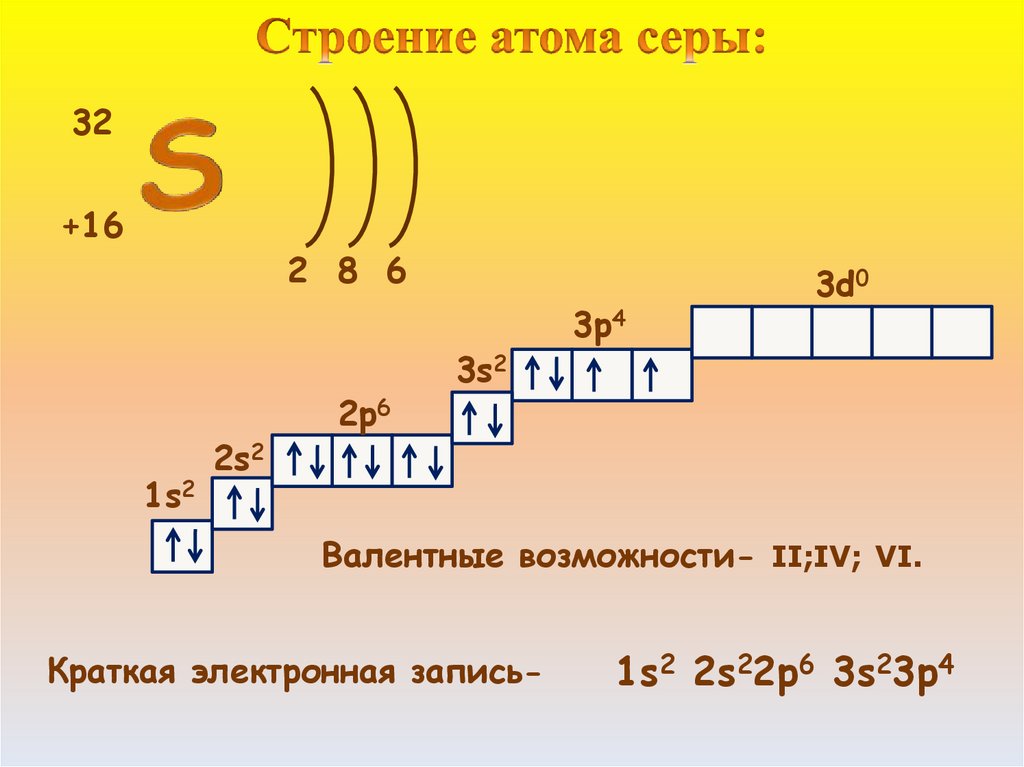
32+16
2 8 6
1s2
2s2
2p6
3s2
3p4
3d0
Валентные возможности- II;IV; VI.
Краткая электронная запись-
1s2 2s22p6 3s23p4
6.
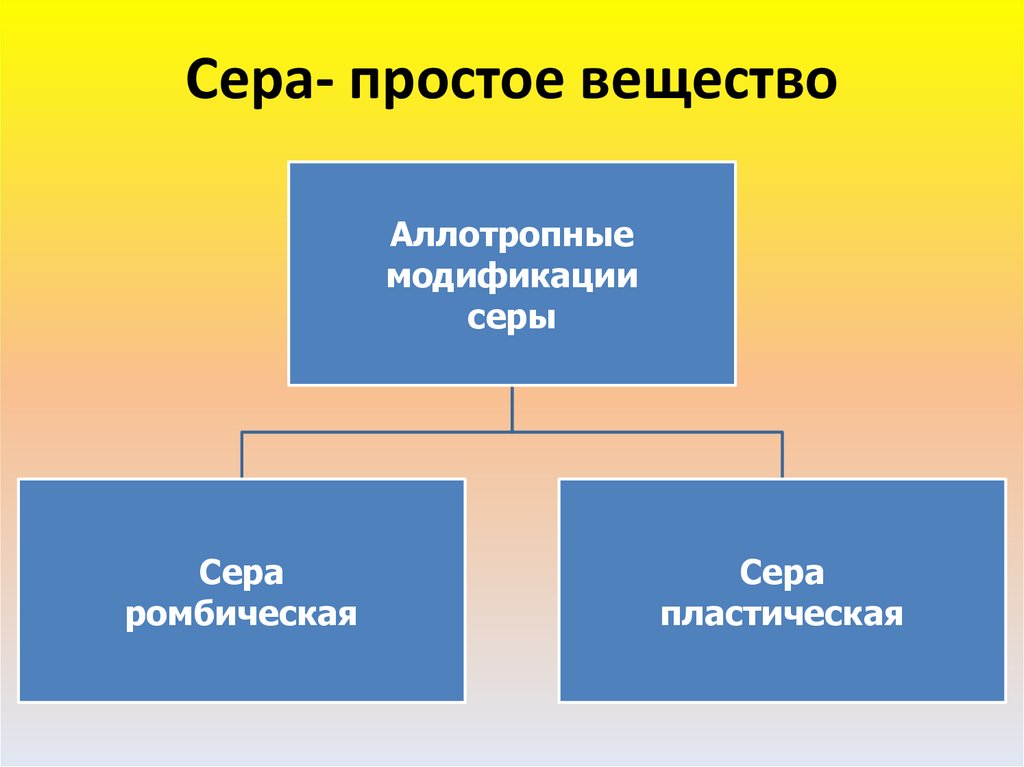
Аллотропия – явление, когда один химический элементобразует несколько простых веществ.
Сами простые вещества, образованные одним химическим
элементом называются
аллотропными модификациями
или аллотропными видоизменениями.
Для серы характерно явление аллотропии.
7. Сера- простое вещество
Аллотропныемодификации
серы
Сера
ромбическая
Сера
пластическая
8.
Cеравстречается
в
природе
в
свободном
(самородном) состоянии,
поэтому она была
известна человеку уже в
глубокой древности.
Сера привлекала внимание характерной окраской, голубым
цветом пламени и специфическим запахом, возникающим
при горении (запах сернистого газа).
9.
Серный колчедан(пирит FеS2)
Сера самородная (S)
S
Свинцовый блеск
(галенит PbS)
Киноварь (HgS)
Цинковая обманка
(сфалерит ZnS)
10.
— твердое агрегатноесостояние
— желтого цвета
— не растворима в воде
— не смачивается водой
(ФЛОТАЦИЯ)
— растворяется в
органических
растворителях
11.
Окислительныесвойства
1. Сера взаимодействует
практически со всеми
металлами
2Al + 3S = Al2S3
2. Со щелочными металлами
сера взаимодействует без
нагревания
2Na + S = Na2S
3. При повышенной
температуре сера
взаимодействует с водородом
H2 + S = H 2S
Восстановительные свойства
1. Сера взаимодействует с
кислородом (горит)
S + O2 = SO2
2. Сера взаимодействует со
фтором
S + 3F2 = SF6
12.
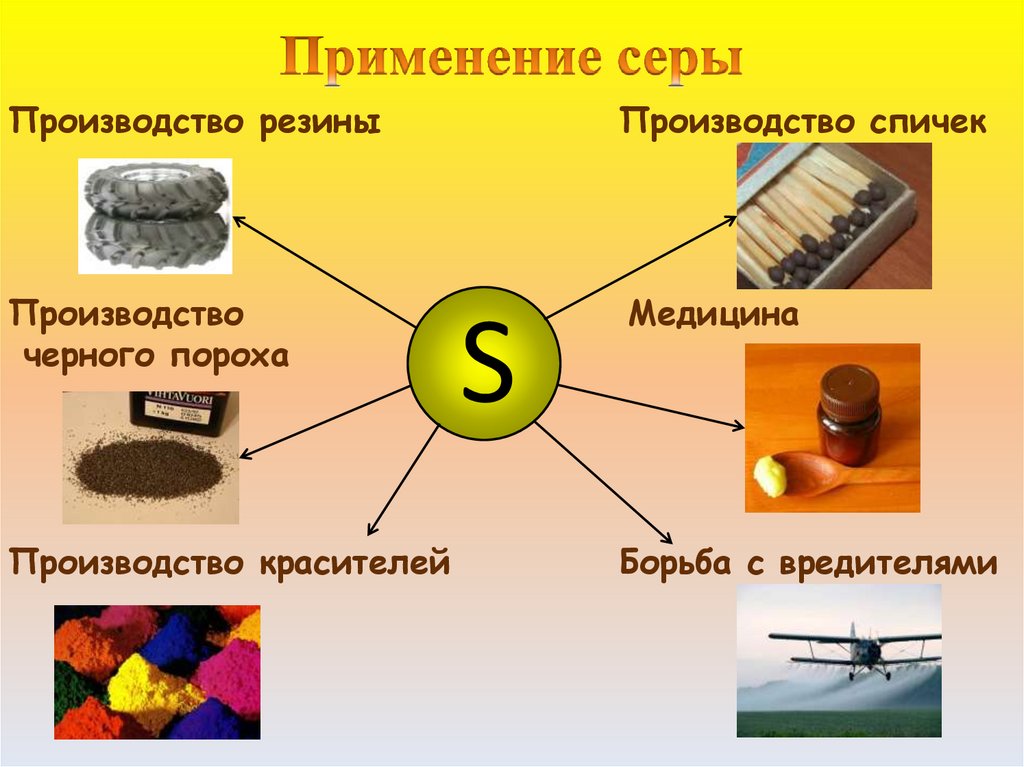
Производство резиныПроизводство спичек
Производство
черного пороха
Медицина
Производство красителей
S
Борьба с вредителями









 chemistry
chemistry








