Similar presentations:
Азот
1. АЗОТ.
МКОУ «Хохольский лицей»АЗОТ.
Воронежская область
пгт Хохольский 2015
2. ЦЕЛИ:
• Дать общую характеристикуэлементов 5 группы главной
подгруппы.
• изучить свойства азота и
область его применения на
основе строения атома и
молекулы;
3. Почему назвали “азот”?
Соединения азота - селитра, азотная кислота, аммиак - былиизвестны задолго до получения азота в свободном состоянии. В
1772 г. Д.Резерфорд, сжигая фосфор и другие вещества в
стеклянном колоколе, показал, что остающийся газ не
поддерживает дыхания и горения. Д.Резерфорд назвал его
“удушливым воздухом”.
К.Шееле назвал этот элемент, извлеченный из воздуха,- “дурным
воздухом”.
В 1787 г. А.Лавуазье установил, что “жизненный” и “удушливый”
газы, входящие в состав воздуха, это простые
вещества, и предложил название “азот”. “А” - отсутствие, “зоо” жизнь. “Безжизненный”- азот.
И не случайно: испытания проводили на лабораторных мышах,
помещая их под колпак с азотом, где они погибали.
4. Нахождение в природе.
Азот – один из распространенных элементов на Земле.- в атмосфере - 4•1051 по массе и 78% газообразного азота
по объёму
- литосфере – 1,9•10-3 по массе
- в живых организмах - 0,3% по массе
В белке животных и человека - 16–17% азота. В
организмах человека и плотоядных животных белок
образуется за счёт потребляемых белковых веществ
травоядных животных и в растениях.
Азот – четвертый по распространенности элемент
солнечной системы (после водорода, гелия и
кислорода)
5. Физические свойства азота
• Азот немного легче воздуха; плотность1,2506 кг/м3 (при н.у.), tпл.= - 209,8оС,
tкип.= -195,8оС. Азот сжижается с
трудом: плотность жидкого азота 800
кг/м3. В воде азот менее растворим чем
кислород: при 0оС в 1м3 Н2О
растворяется 23,3 г азота.
• Азот не поддерживает дыхание и
горение.
6. Химические свойства азота
С Ме:
N2+6Li (об.усл.) —> 2Li3N
N2+3Mg (об.усл.) —> Mg3N2
N2+2Al
—> 2AlN
С неМе:
N2+3H2 —> 2NH3
N2+O2 —>2NO-Q
N2+3F2 (эл. разряд) —> 2NF3
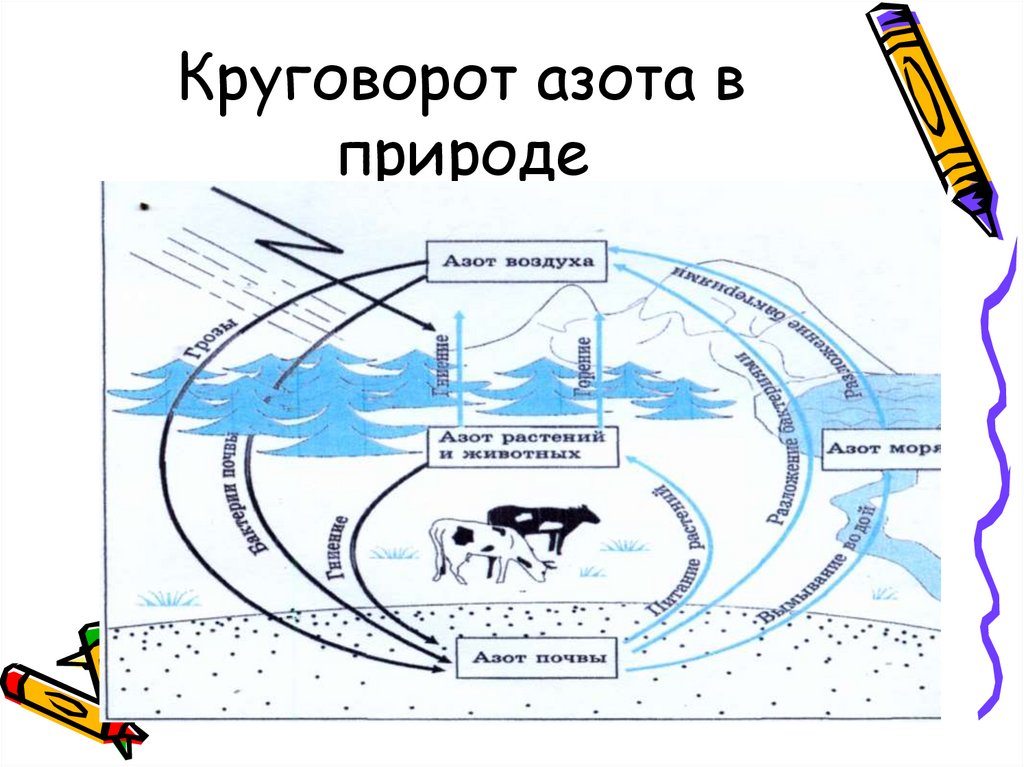
7. Круговорот азота в природе
8. Применение азота:
• создание инертных сред вметаллургии;
• синтез аммиака и азотной кислоты;
• производство минеральных
удобрений;
• производство взрывчатых веществ;
• жидкий азот в медицине.
9. Азот – друг или враг?
Азот – “безжизненный”.
Азот – главный элемент жизни.
Что можно сказать о хим.
активности азота? Почему?
В каких реакциях азот –
окислитель, в каких –
восстановитель?
10.
• Определите коэффициенты вуравнениях реакций методом
электронного баланса:
а) NH3+ O2→NO+H2O
б) NH3+ O2→N2+H2O
• Рассчитайте объем оксида азота
(IY), который получится при
растворении 6,4 г меди в азотной
кислоте?
11.
Д/з п.23 стр.107-111.№1, №2 (п.) стр.111










 chemistry
chemistry








