Similar presentations:
Глюкоза
1. Муниципальное общеобразовательное учреждение средняя общеобразовательная школа № 11
2. План изучения темы:
Глюкоза в природе.Биологические функции.
Физические свойства.
Строение глюкозы.
Химические свойства.
Получение.
Применение.
3. Глюкоза
Виноградный сахар4. Обнаружение глюкозы в различных продуктах
t0Исследуемое + реактив → осадок
вещество
Фелинга желтого
цвета
I ряд
виногр. сок
конфета
II ряд
мёд
печенье
III ряд
зефир
банан
5. Физические свойства глюкозы
Бесцветное кристаллическоевещество;
Хорошо растворяется в воде;
Сладкое на вкус.
6. Молекулярная формула
C6Н12О67. Глюкоза – многоатомный спирт ?
Лабораторный опыт:Взаимодействие с гидроксидом меди (II)
Глюкоза + NaOH + CuSO4 → ярко-синий
0,5 мл
2 мл
1 мл
раствор
8. Глюкоза – альдегид ?
Лабораторный опыт:Взаимодействие с аммиачным раствором
оксида серебра.
t0
AgNO3 + NH4OH + глюкоза → «серебряное
2 мл по каплям 1-2 мл
зеркало»
9. Глюкоза – многоатомный спирт ?
Лабораторный опыт:Взаимодействие с гидроксидом меди (II)
t0
Глюкоза + NaOH + CuSO4 → кирпично0,5 мл
2 мл
1 мл
красный
осадок
10. Глюкоза – карбоновая кислота?
Лабораторный опыт:Изменение окраски индикаторов
Глюкоза + лакмус → раствор красного
цвета
11.
А.А. Колли –русский химик, профессор
Московского университета
1 моль глюкозы + 5 моль СН3СООН
???
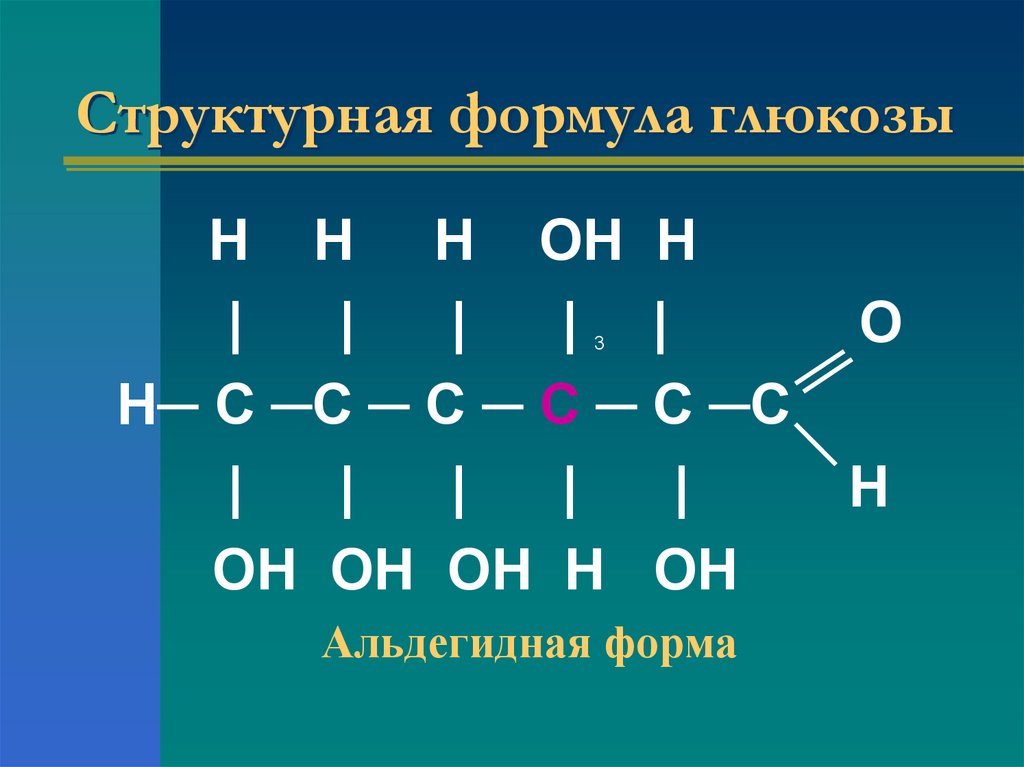
12. Структурная формула глюкозы
Н Н Н ОН Н|
|
|
| |
Н─ С ─С ─ С ─ С ─ С ─С
|
|
|
|
|
ОН ОН ОН Н ОН
3
Альдегидная форма
О
Н
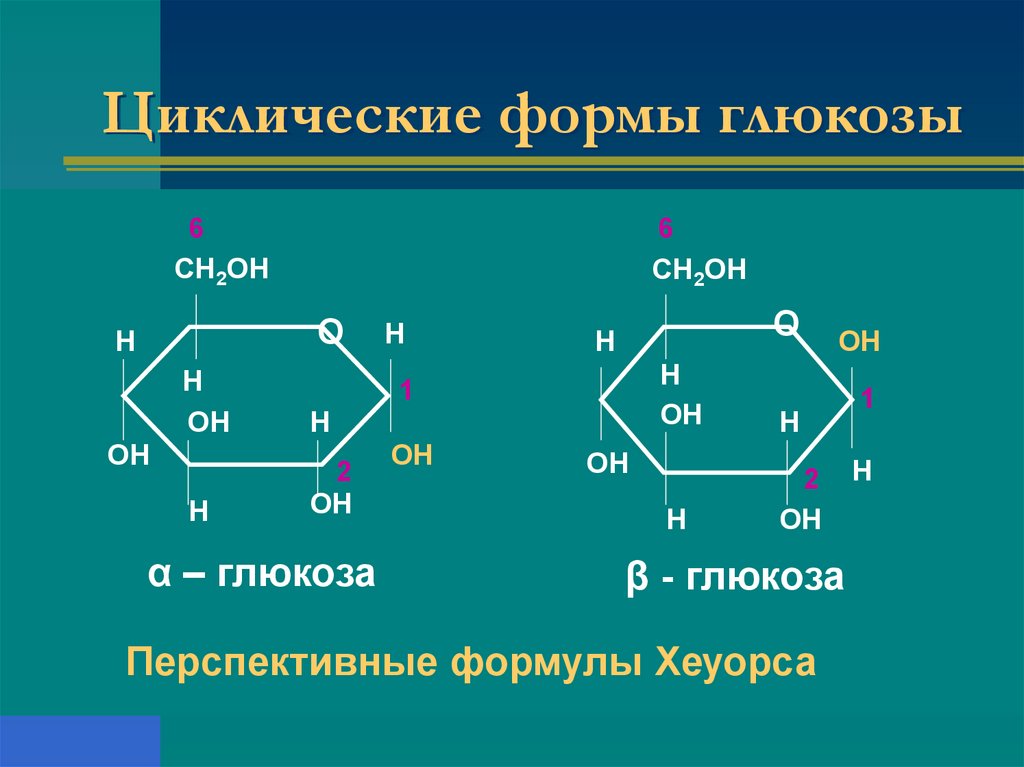
13. Циклические формы глюкозы
6СН2ОН
6
СН2ОН
О
Н
Н
ОН
Н
Н
2
ОН
ОН
Н
О
Н
1
α – глюкоза
ОН
Н
ОН
Н
Н
2
ОН
ОН
ОН
β - глюкоза
Перспективные формулы Хеуорса
1
Н
14. Таутомерия
α – глюкоза37%
альдегидная форма
0,0026%
β - глюкоза
63%
Таутомерия (динамическая изомерия)
существование изомерных форм,
находящихся в равновесии и способных
легко переходить в друг друга.
15. Химические свойства глюкозы
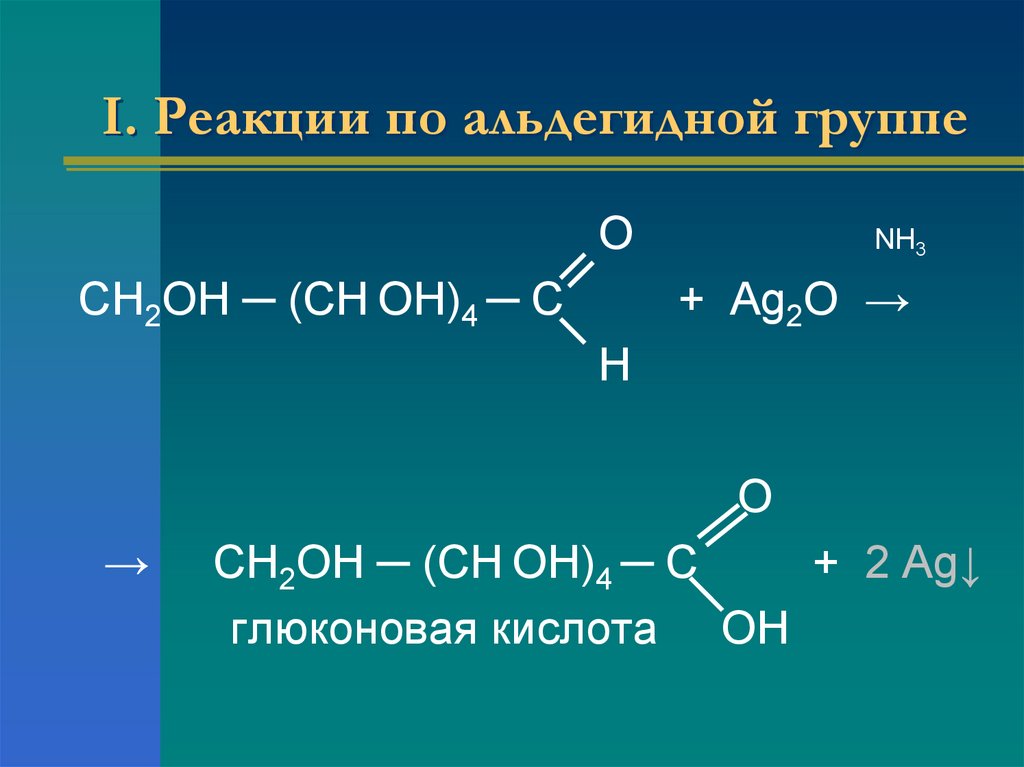
16. I. Реакции по альдегидной группе
ОСН2ОН ─ (СН ОН)4 ─ С
NH3
+ Аg2О →
Н
О
→
СН2ОН ─ (СН ОН)4 ─ С
+ 2 Аg↓
глюконовая кислота ОН
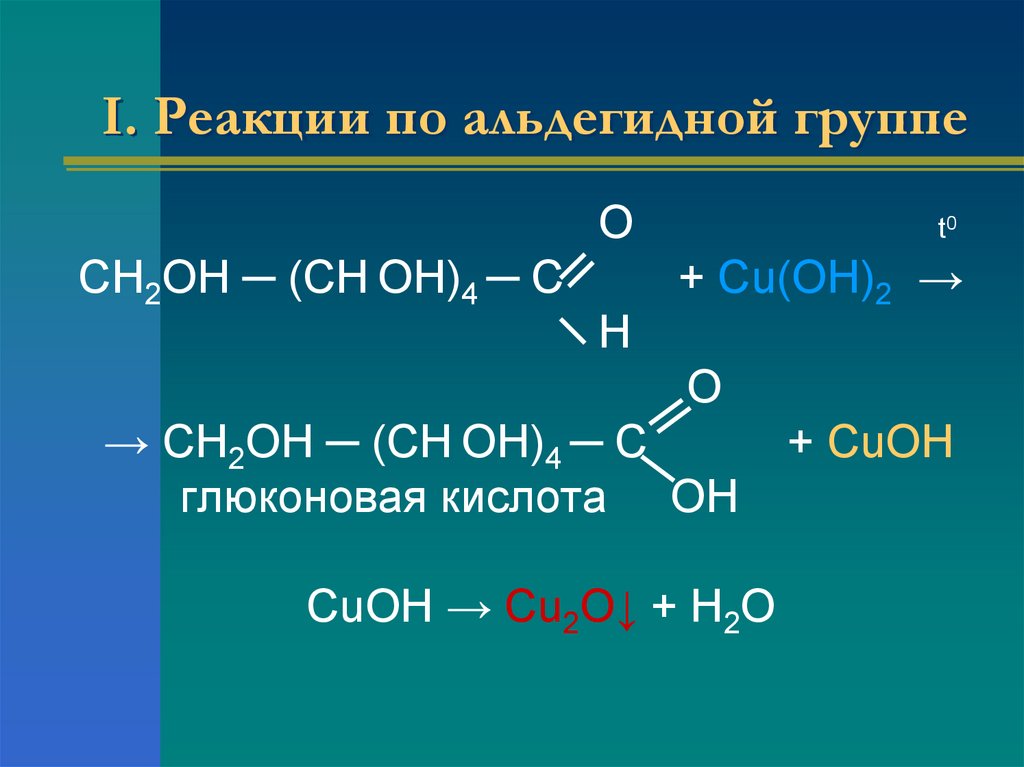
17. I. Реакции по альдегидной группе
ОСН2ОН ─ (СН ОН)4 ─ С
Н
t0
+ Cu(OH)2 →
О
→ СН2ОН ─ (СН ОН)4 ─ С
глюконовая кислота ОН
CuOH → Cu2O↓ + H2O
+ CuOH
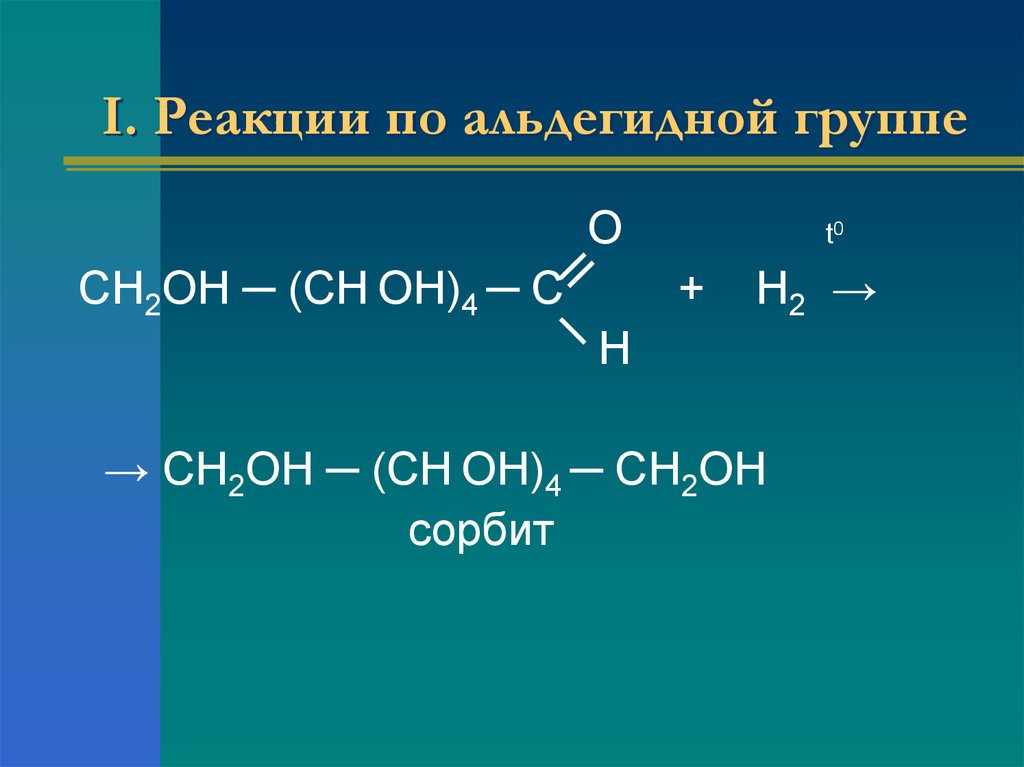
18. I. Реакции по альдегидной группе
ОСН2ОН ─ (СН ОН)4 ─ С
t0
+
H2 →
Н
→ СН2ОН ─ (СН ОН)4 ─ СН2ОН
сорбит
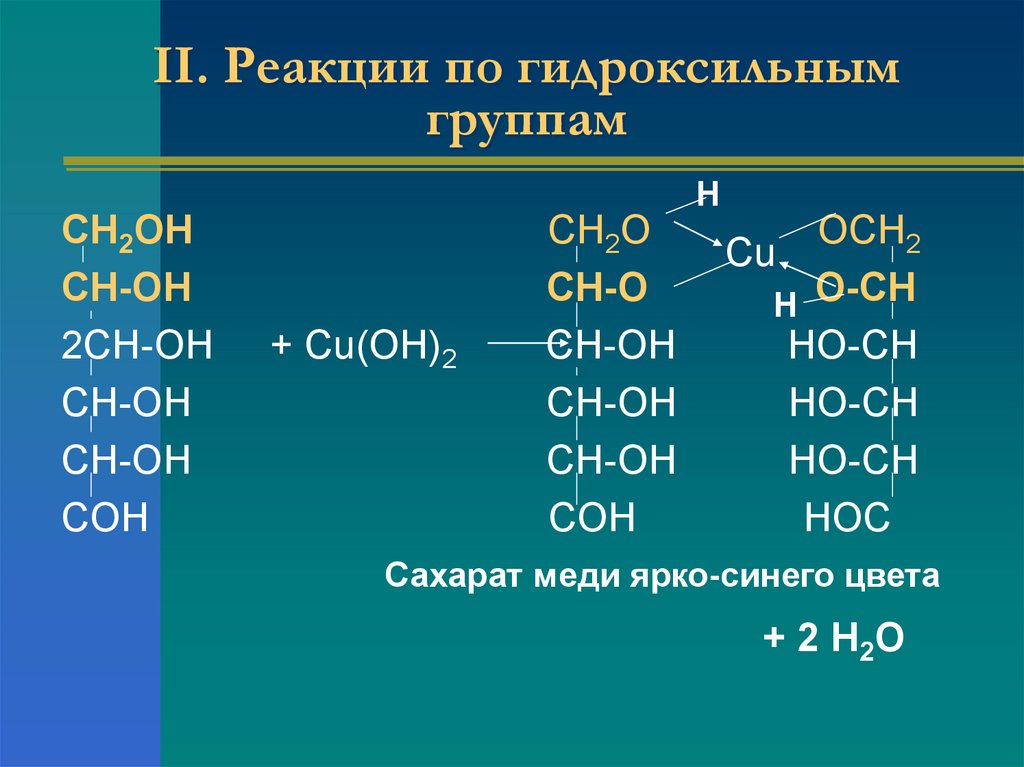
19. II. Реакции по гидроксильным группам
СН2ОНСН-ОН
2СН-ОН
СН-ОН
СН-ОН
СОН
+ Cu(OH)2
CН2О
СН-О
СН-ОН
СН-ОН
СН-ОН
СОН
Н
ОCН2
Cu
Н О-СН
НО-СН
НО-СН
НО-СН
НОС
Сахарат меди ярко-синего цвета
+ 2 Н2 О
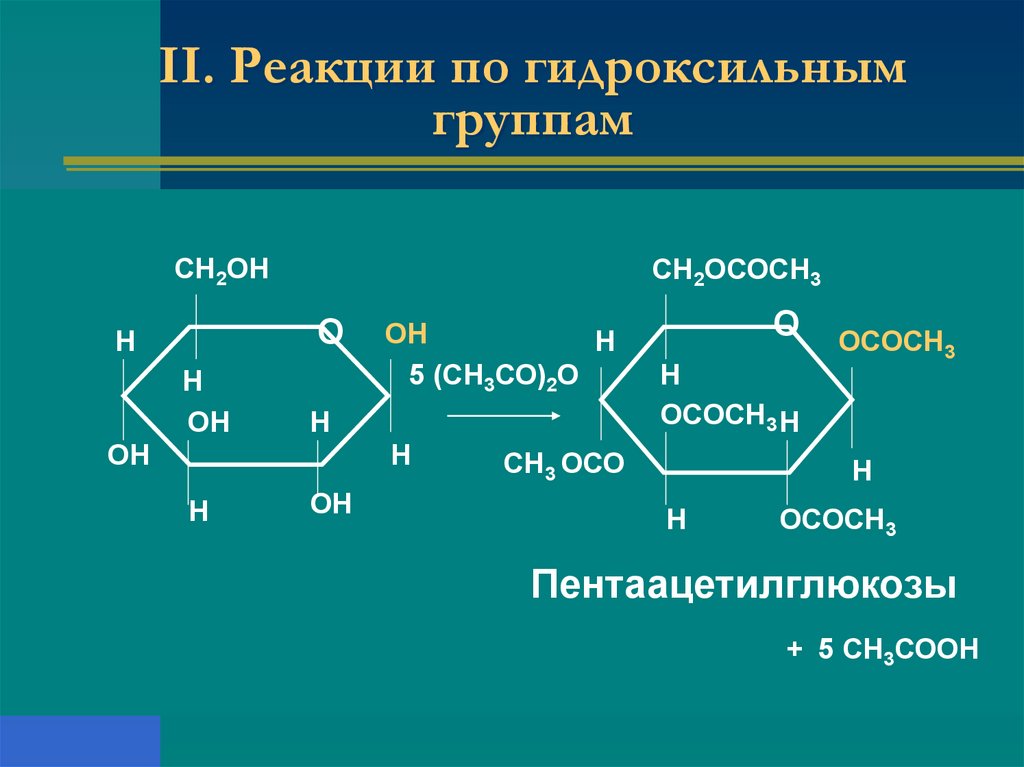
20. II. Реакции по гидроксильным группам
СН2ОНСН2ОСОСН3
О
Н
Н
ОН
ОН
Н
5 (СН3СО)2О
Н
ОН
Н
Н
ОН
О
Н
ОСОСН3 Н
СН3 ОСО
ОСОСН3
Н
Н
ОСОСН3
Пентаацетилглюкозы
+ 5 СН3СООН
21. II. Реакции по гидроксильным группам
СН2ОНСН2ОН
О
Н
Н
ОН
ОН
Н
Н
Н
Н
ОН
+ СН3ОН
ОН
ОН
О
Н
ОСН3
Н
ОН
Н
Н
ОН
Метилглюкозид
+ Н 2О
22. Специфические свойства глюкозы-реакции брожения
Специфические свойства глюкозыреакции броженияСпиртовое
С6Н12О6 → 2 С2Н5ОН + 2 СО2↑
Молочнокислое
С6Н12О6 → 2 СН3─ СН(ОН) ─ СООН
Маслянокислое
С6Н12О6 → С3Н7СООН + 2 СО2↑ + 2 Н2↑
23. Получение глюкозы
Фотосинтез6 СО2 + 6 Н2О
свет
С6Н12О6 + 6 О2
+ 2920 кДж
1861 год А.М. Бутлеров
синтезировал глюкозу
Са(ОН)2
6 Н-С = О
Н
С6Н12О6
















 biology
biology