Similar presentations:
Биохимический моделист-конструктор
1. Как образуется это разнообразие структур? Общие принципы.
Предшественниками синтеза служат относительнонебольшое количество первичных метаболитов.
Синтез четко спланирован и обслуживается набором
специальных ферментов, причем некоторые из них
весьма специфичны, а некоторые – нет
Для многих групп вторичных метаболитов
существует несколько путей их синтеза. Часто этапы
синтеза дублированы в разных компартментах клетки
(например, пластиды – цитозоль).
2. Биохимический моделист-конструктор. 1 этап
Образуется «скелет» молекулы - "базовая" структура, наоснове которой затем формируются многочисленные варианты.
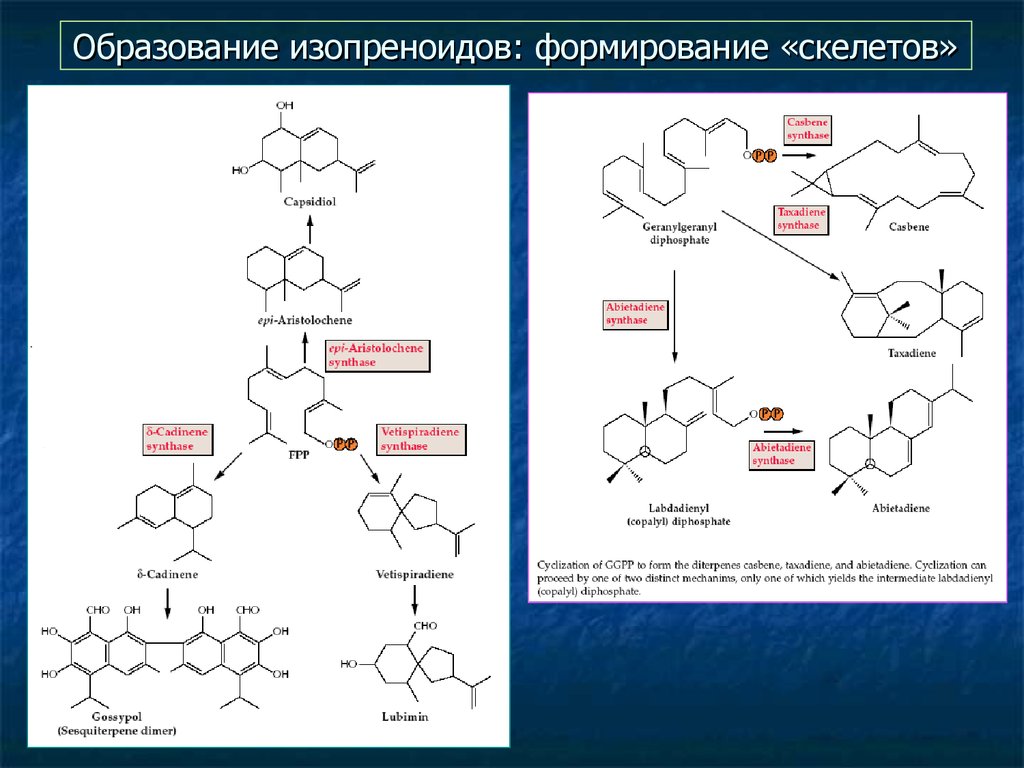
Принципы формирования «скелета» различны для разных групп
вторичных метаболитов.
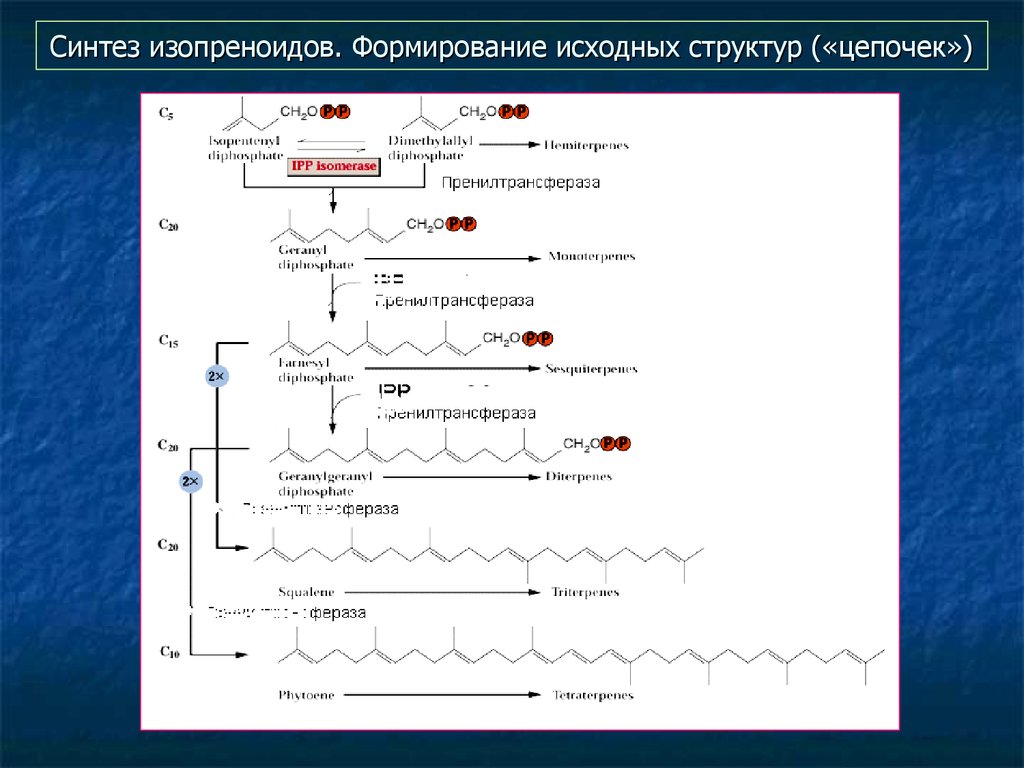
Для изопреноидов – формирование гибких цепочек разной
длины - 10, 15, 20, 30, 40 атомов углерода (пренилтрансферазы),
а затем сворачивание их в разнообразные циклы (циклазы).
Для алкалоидов – формирование гетероциклов за счет
конденсации аминоальдегидов и/или аминокетонов,
получаемых из аминов (аминооксидазы), которые в свою
очередь формируются из аминокислот (декарбоксилазы)
3. Биохимический моделист-конструктор. 2 этап
«Декорирование» скелета: метилирование, ацилирование,десатурация, гидроксилирование, гликозилирование.
«Декорирование» может кардинально менять биологическую
активность молекулы.
У арабидопсиса в геноме:
Найдено более 300 (!) генов различных изоформ цитохрома
Р450. Трансгенные растения арабидопсиса и табака с двумя
чужеродными генами «цианогенных» цитохромов синтезировали
цианогенные гликозиды.
Найдены гены более 100 диоксигеназ. Диоксигеназы участвуют в
биосинтезе алкалоидов, флавонидов, гиббереллинов, этилена. Для
них характерна широкая субстратная специфичность возможность использовать разные субстраты и образовывать
несколько продуктов.
4. Биохимический моделист-конструктор. 2 этап
Ацилтрансферазы. У арабидопсиса – более 50 генов.Ацилтрансферазы вторичного метаболизма у разных видов
структурно близки и имеют консервативный гистидинсодержащий мотив. Структурно они также похожи на
ацилтрансферазы первичного метаболизма. Гены ацилрансфераз
в арабидопсисе собраны в кластеры на 5 хромосоме, тогда как
гены диоксигеназ разбросаны по геному
Метилтрансферазы. O-, C-, N-и S- метилтрансферазы,
метилируют флавониды, изопреноиды, алкалоиды, полиамины,
поликетиды. C-, N-и S- метилтрансферазы эволюционно не
связаны, О-метилтрансферазы представляют одну группу и
имеют консервативный SАМ-связывающий мотив.
Гликозилтрансферазы. O-, C-, S- гликозилтрансферазы.
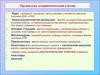
5. Образование алкалоидов. Общий взгляд
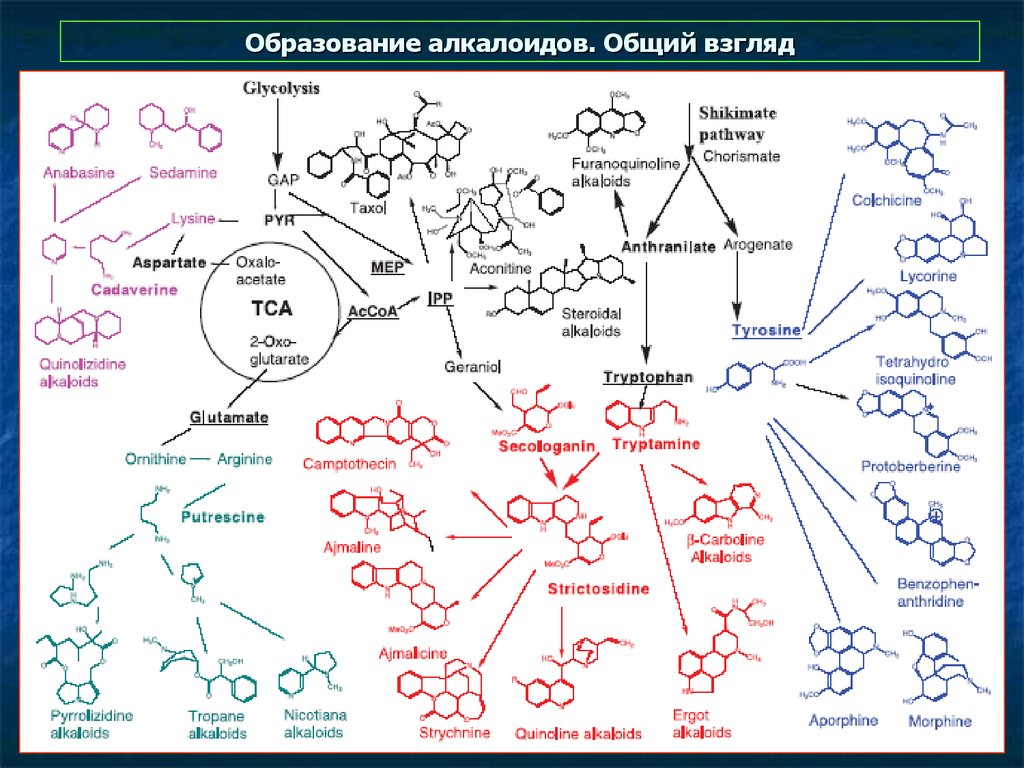
6. Образование пирролидиновых, пиперидиновых и пуриновых алкалоидов
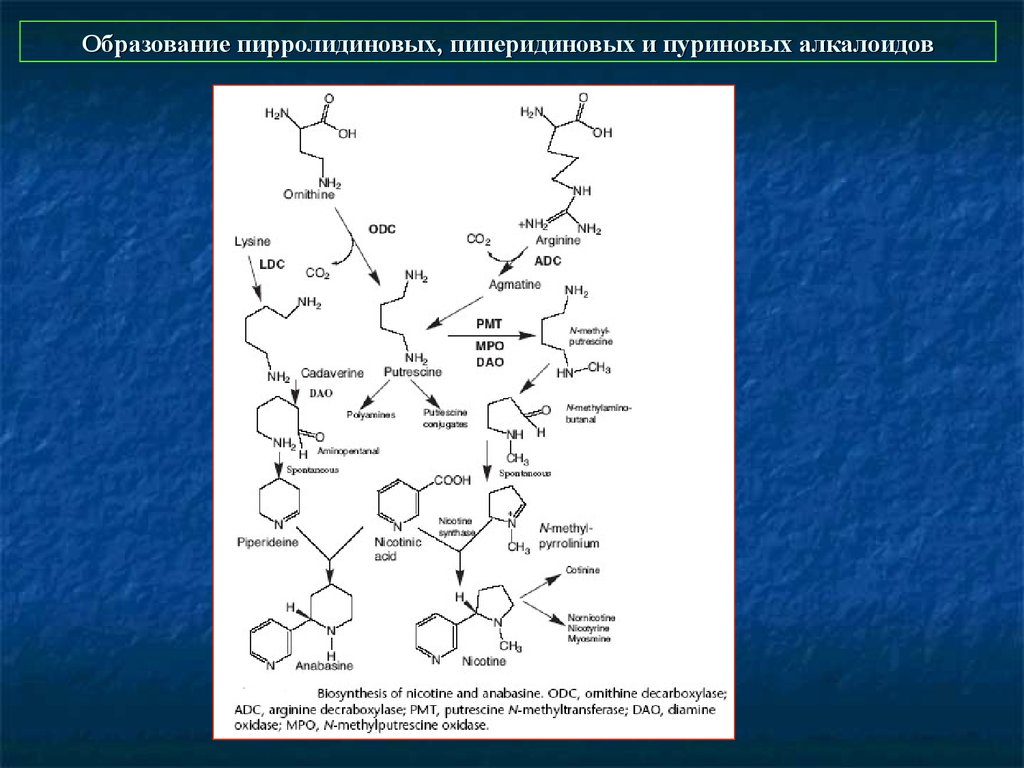
7. Образование тропановых алкалоидов
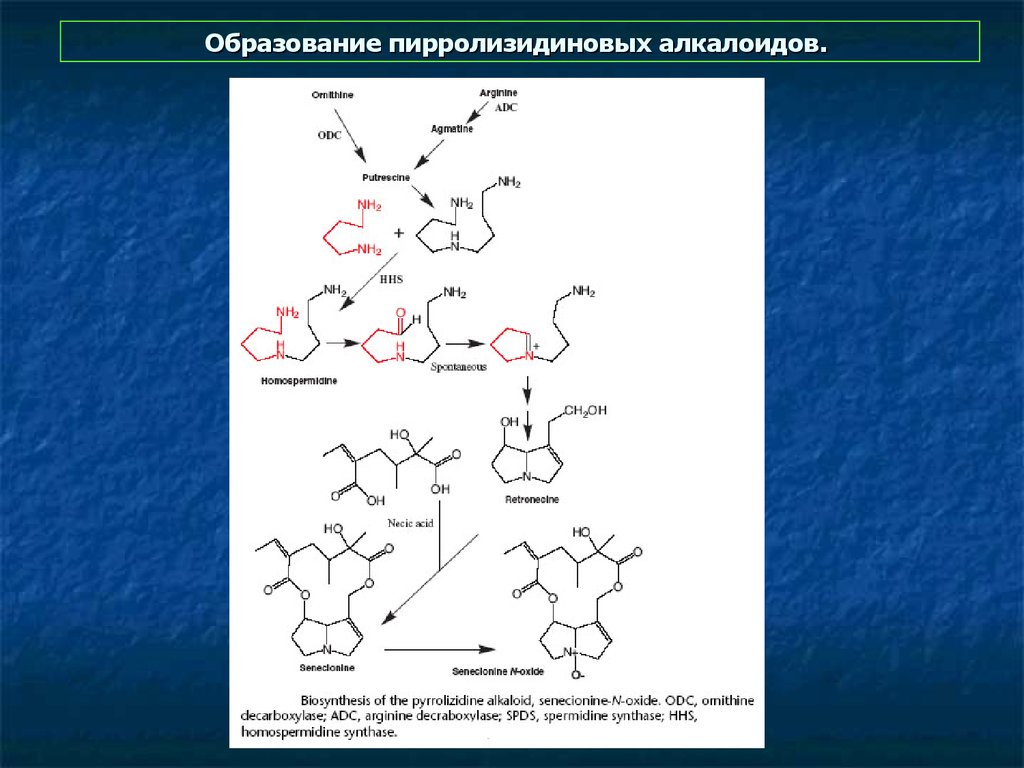
8. Образование пирролизидиновых алкалоидов.
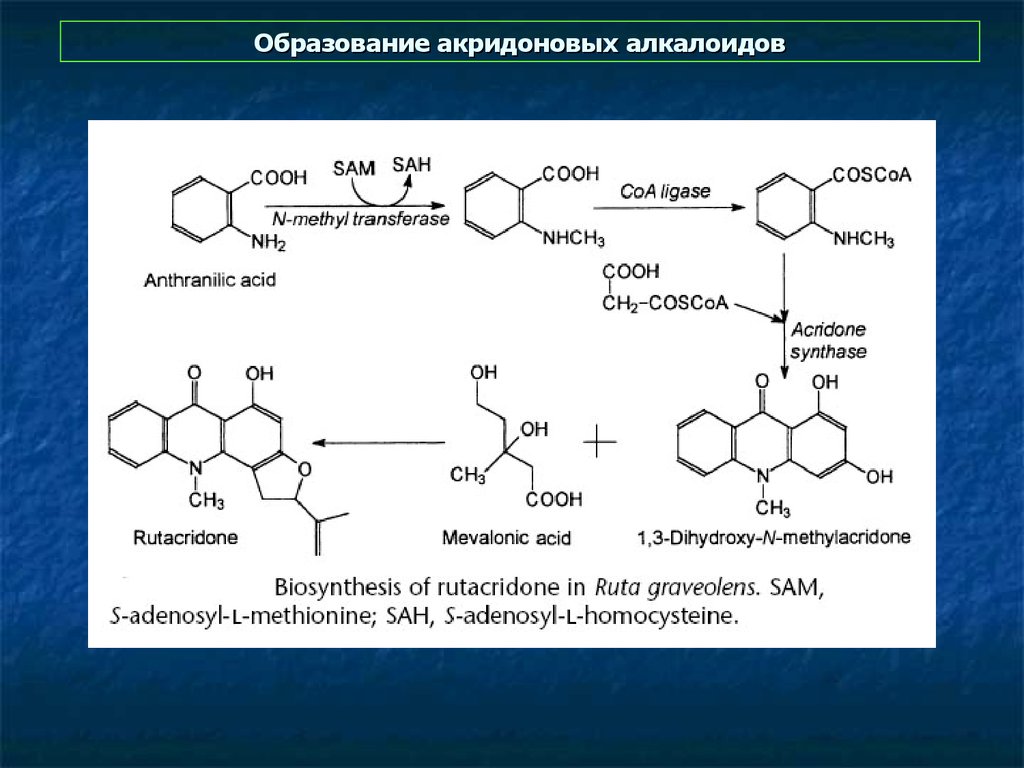
9. Образование акридоновых алкалоидов
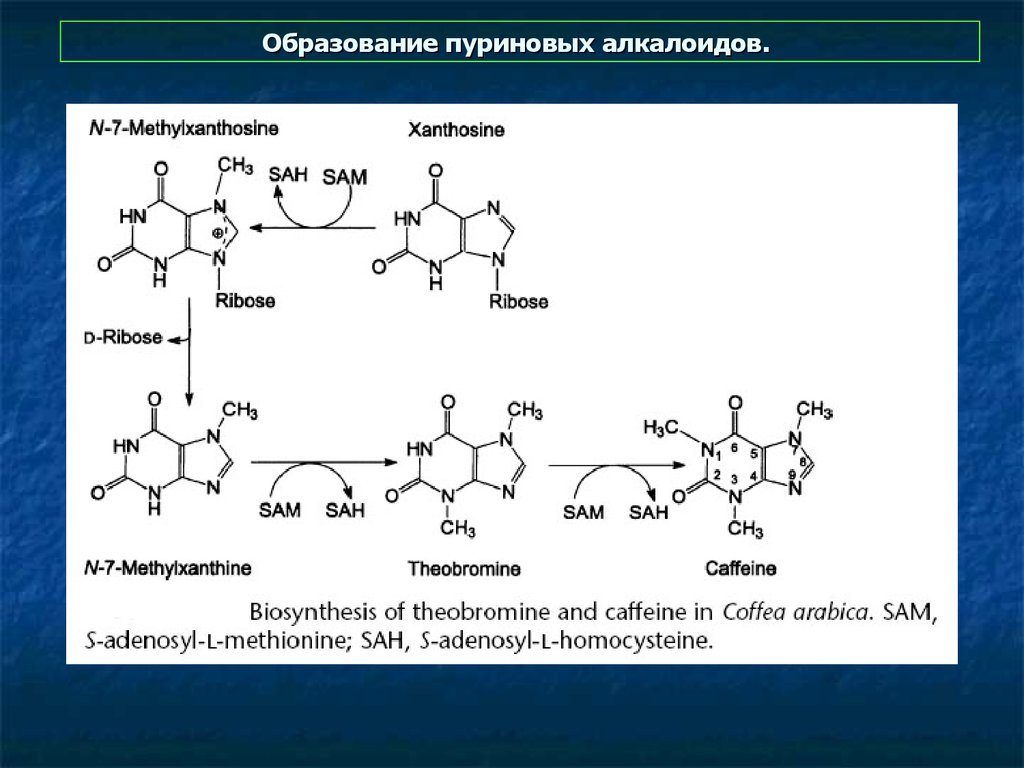
10. Образование пуриновых алкалоидов.
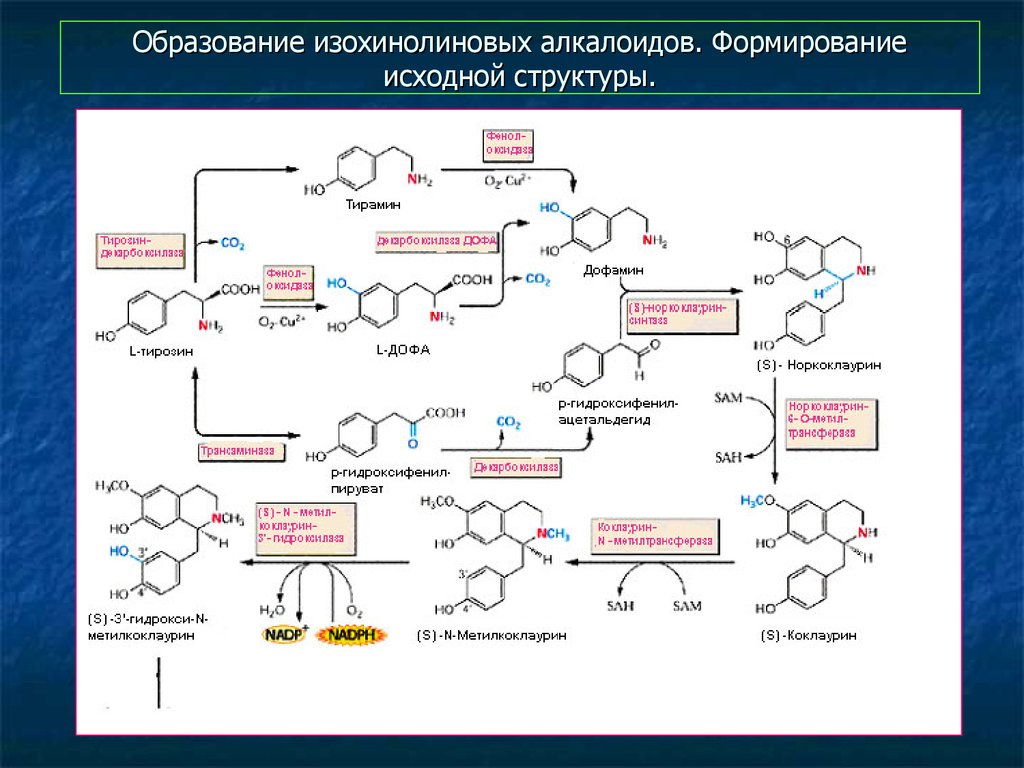
11. Образование изохинолиновых алкалоидов. Формирование исходной структуры.
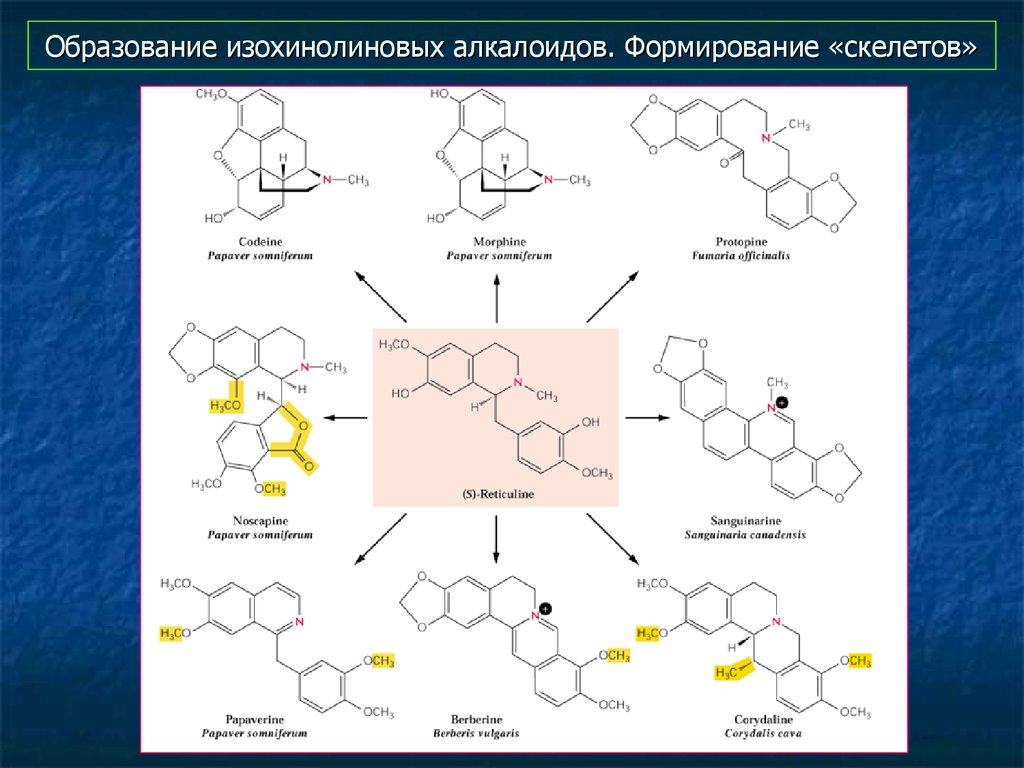
12. Образование изохинолиновых алкалоидов. Формирование «скелетов»
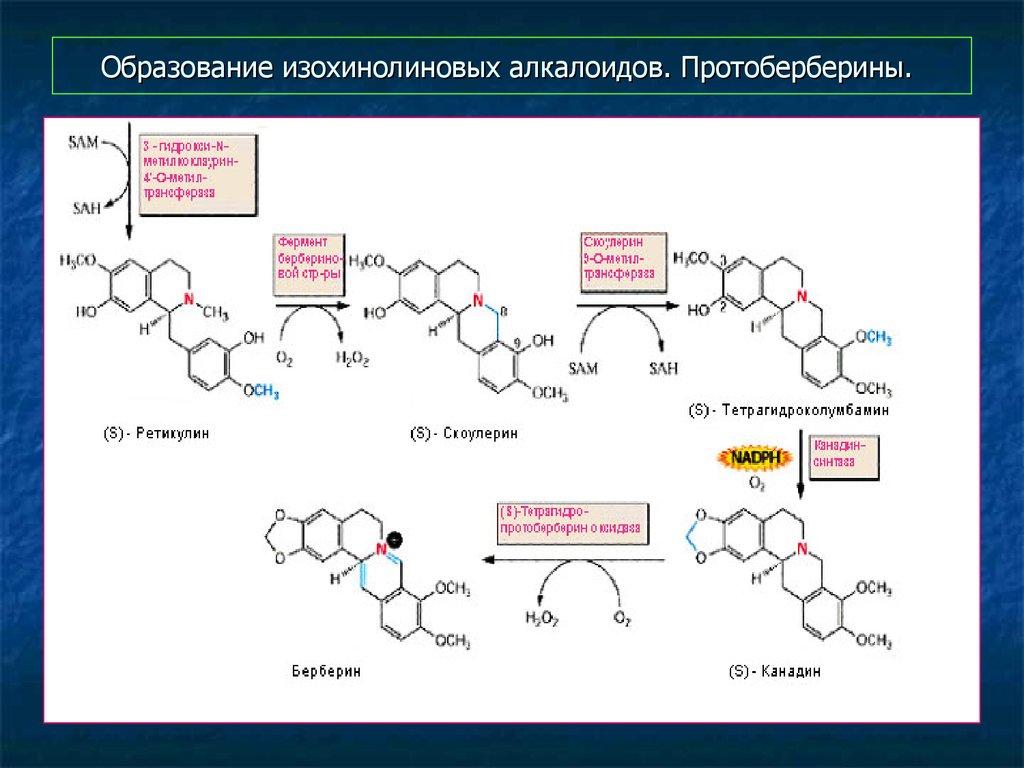
13. Образование изохинолиновых алкалоидов. Протоберберины.
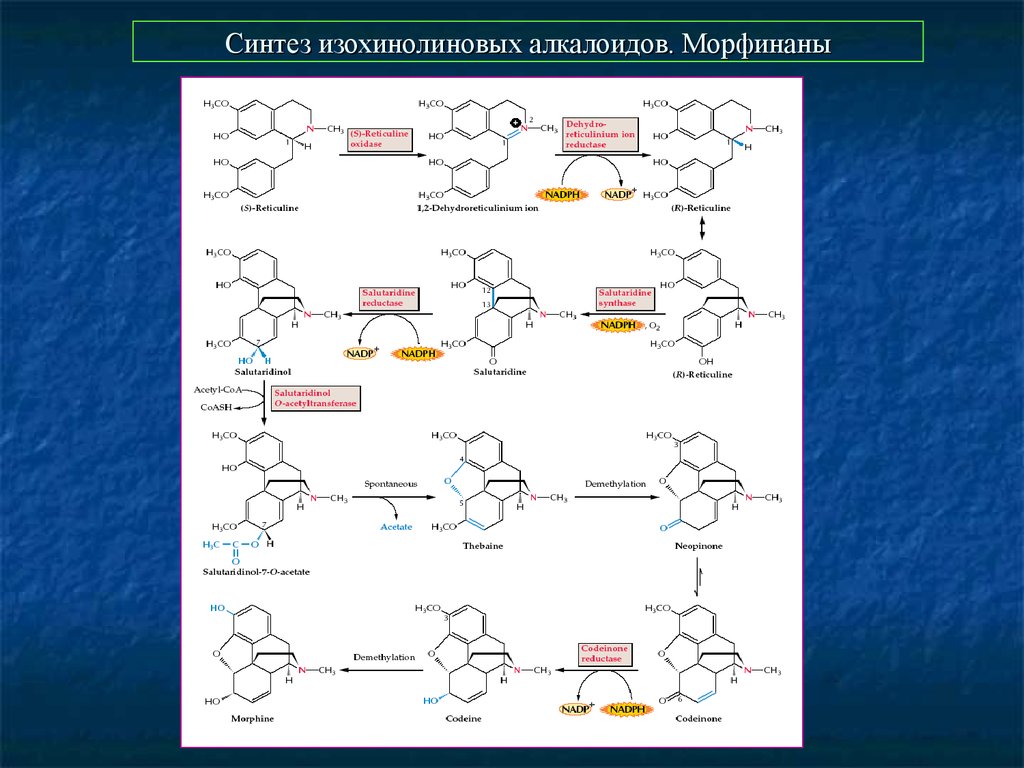
14. Синтез изохинолиновых алкалоидов. Морфинаны
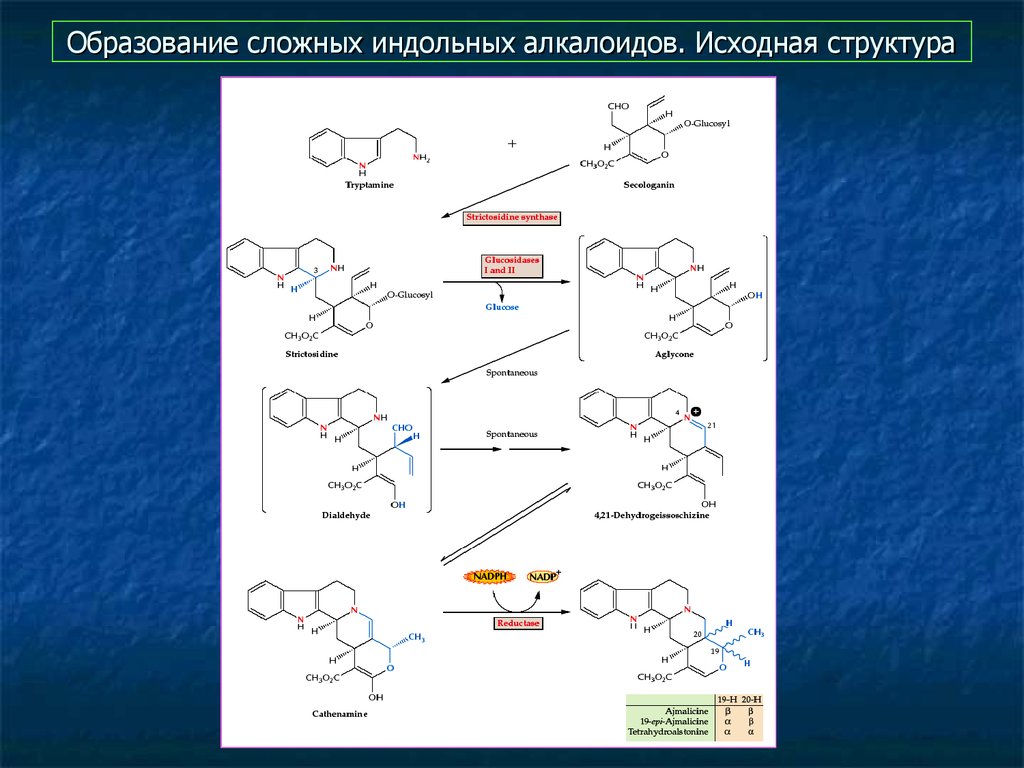
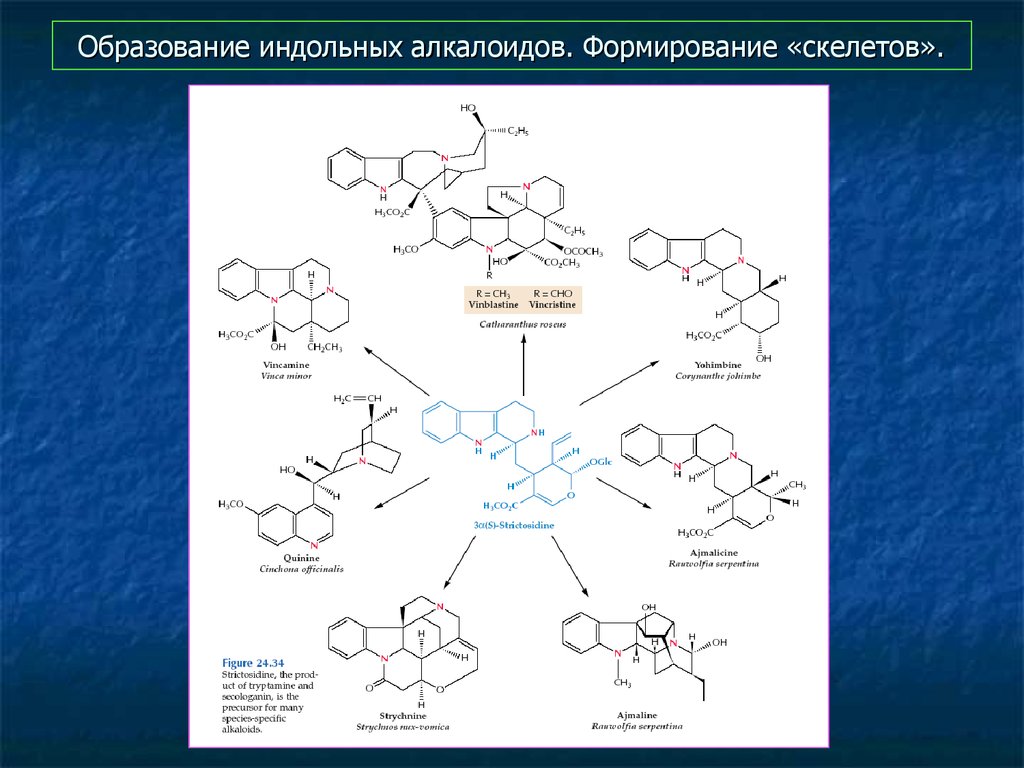
15. Образование сложных индольных алкалоидов. Исходная структура
16. Образование индольных алкалоидов. Формирование «скелетов».
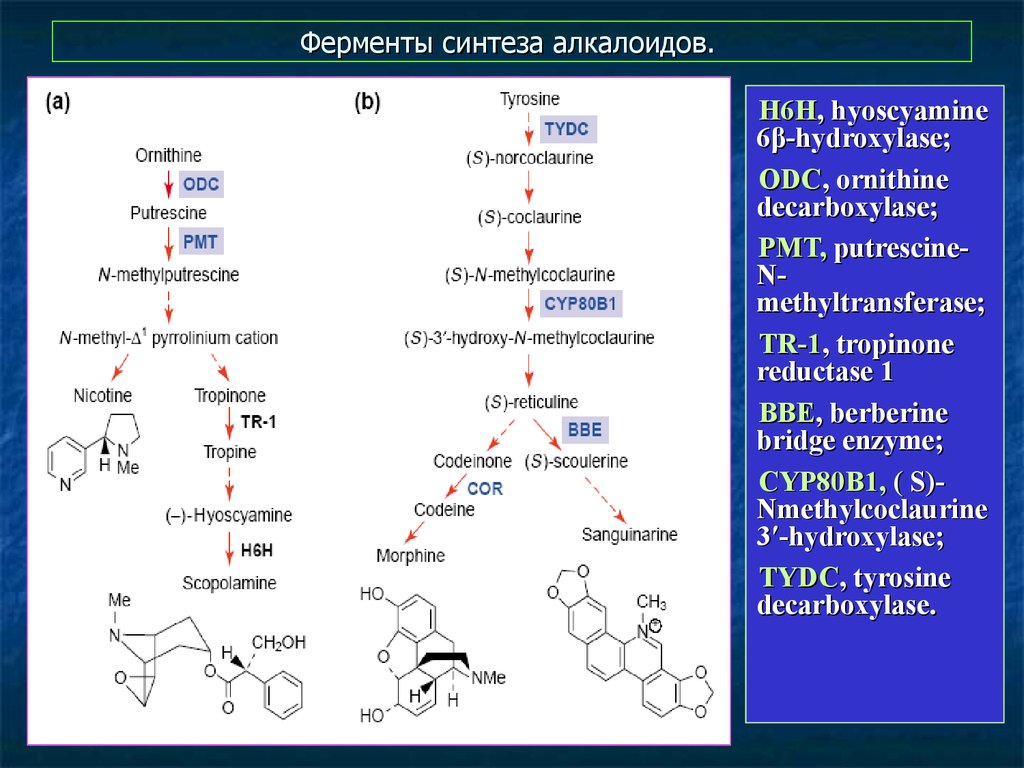
17. Ферменты синтеза алкалоидов.
H6H, hyoscyamine6β-hydroxylase;
ODC, ornithine
decarboxylase;
PMT, putrescineNmethyltransferase;
TR-1, tropinone
reductase 1
BBE, berberine
bridge enzyme;
CYP80B1, ( S)Nmethylcoclaurine
3′-hydroxylase;
TYDC, tyrosine
decarboxylase.
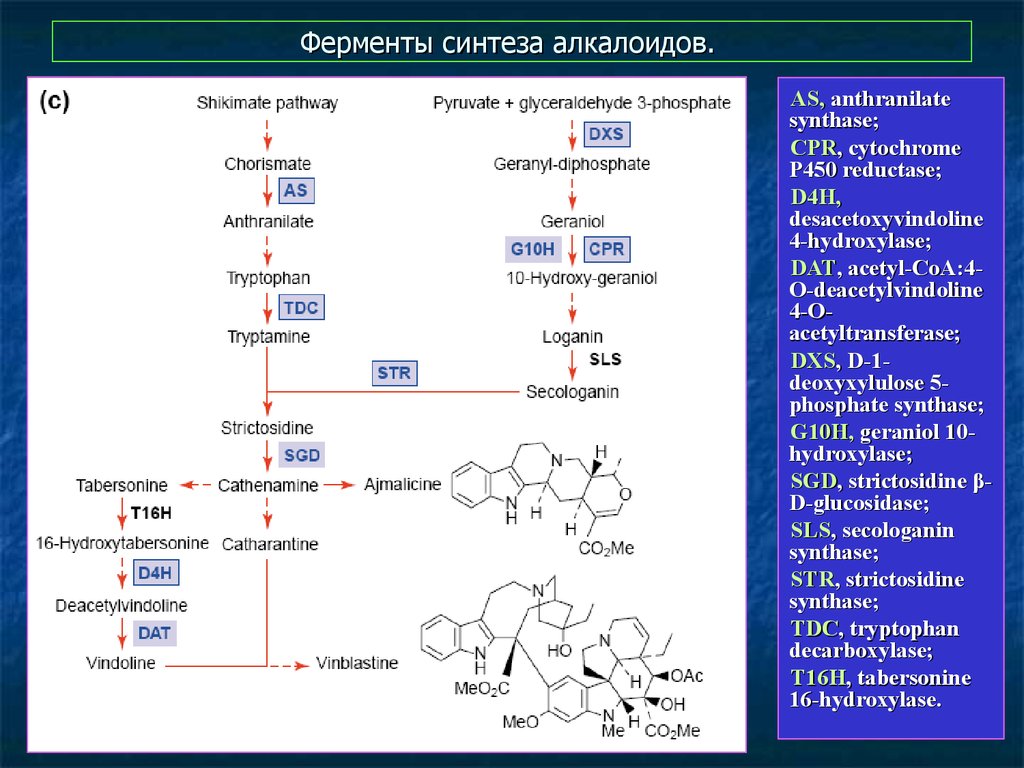
18. Ферменты синтеза алкалоидов.
AS, anthranilatesynthase;
CPR, cytochrome
P450 reductase;
D4H,
desacetoxyvindoline
4-hydroxylase;
DAT, acetyl-CoA:4O-deacetylvindoline
4-Oacetyltransferase;
DXS, D-1deoxyxylulose 5phosphate synthase;
G10H, geraniol 10hydroxylase;
SGD, strictosidine βD-glucosidase;
SLS, secologanin
synthase;
STR, strictosidine
synthase;
TDC, tryptophan
decarboxylase;
T16H, tabersonine
16-hydroxylase.
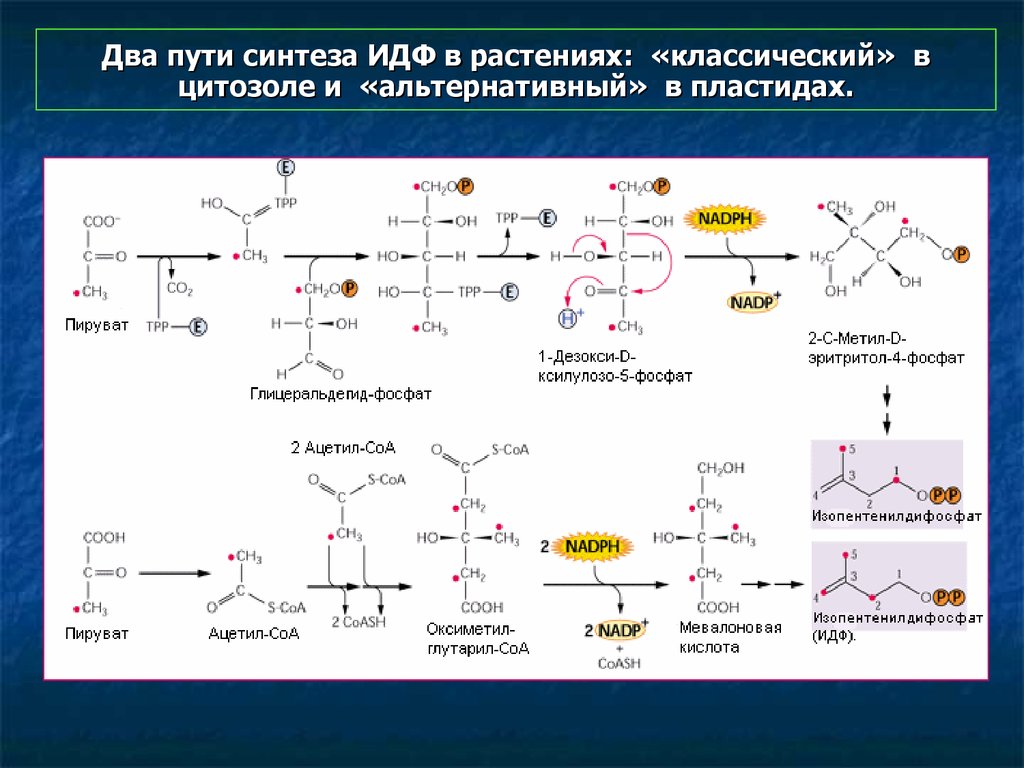
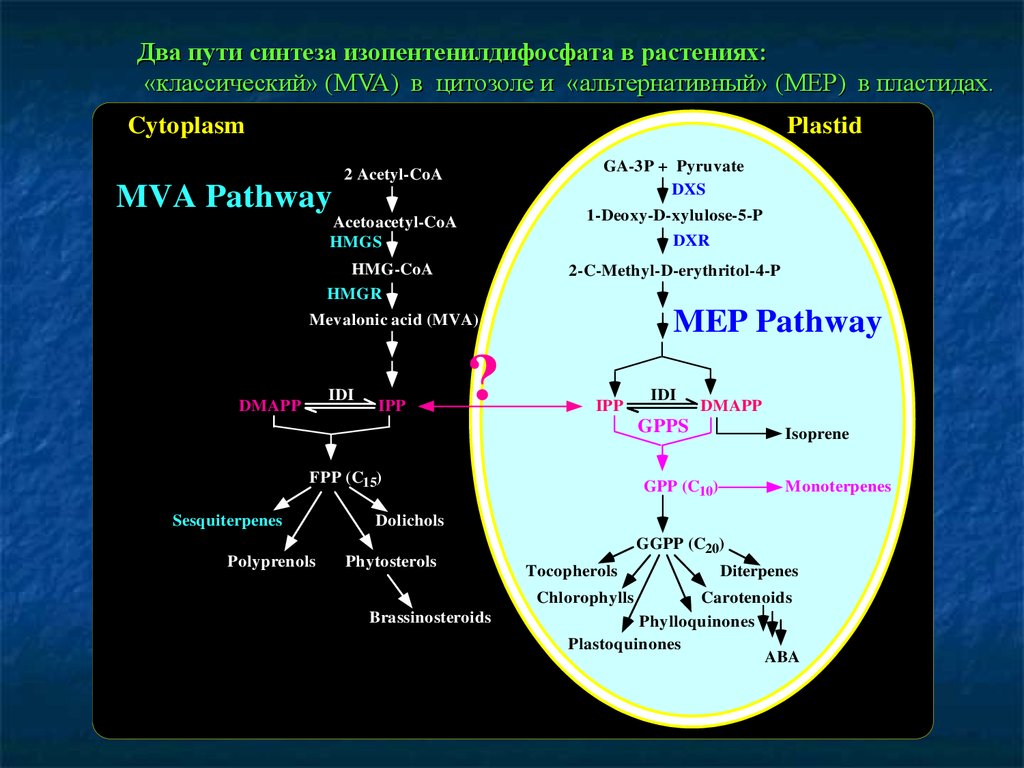
19. Два пути синтеза ИДФ в растениях: «классический» в цитозоле и «альтернативный» в пластидах.
20.
Два пути синтеза изопентенилдифосфата в растениях:«классический» (MVA) в цитозоле и «альтернативный» (MEP) в пластидах.
Cytoplasm
Plastid
2 Acetyl-CoA
GA-3P + Pyruvate
DXS
Acetoacetyl-CoA
HMGS
1-Deoxy-D-xylulose-5-P
MVA Pathway
DXR
HMG-CoA
HMGR
2-C-Methyl-D-erythritol-4-P
MEP Pathway
Mevalonic acid (MVA)
IDI
DMAPP
IPP
?
IPP
FPP (C15)
Sesquiterpenes
Polyprenols
IDI
GPPS
DMAPP
Isoprene
GPP (C10)
Monoterpenes
Dolichols
Phytosterols
Brassinosteroids
GGPP (C20)
Tocopherols
Chlorophylls
Diterpenes
Carotenoids
Phylloquinones
Plastoquinones
ABA
21. Синтез изопреноидов. Формирование исходных структур («цепочек»)
22. Образование изопреноидов: формирование «скелетов»
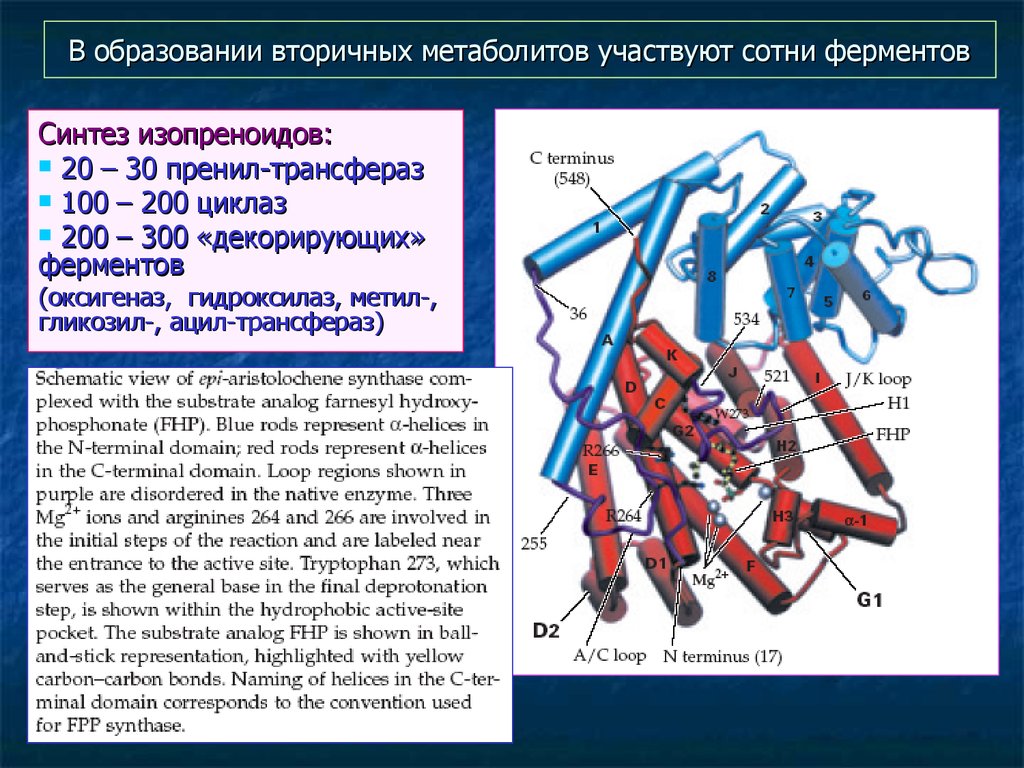
23. В образовании вторичных метаболитов участвуют сотни ферментов
Синтез изопреноидов:20 – 30 пренил-трансфераз
100 – 200 циклаз
200 – 300 «декорирующих»
ферментов
(оксигеназ, гидроксилаз, метил-,
гликозил-, ацил-трансфераз)
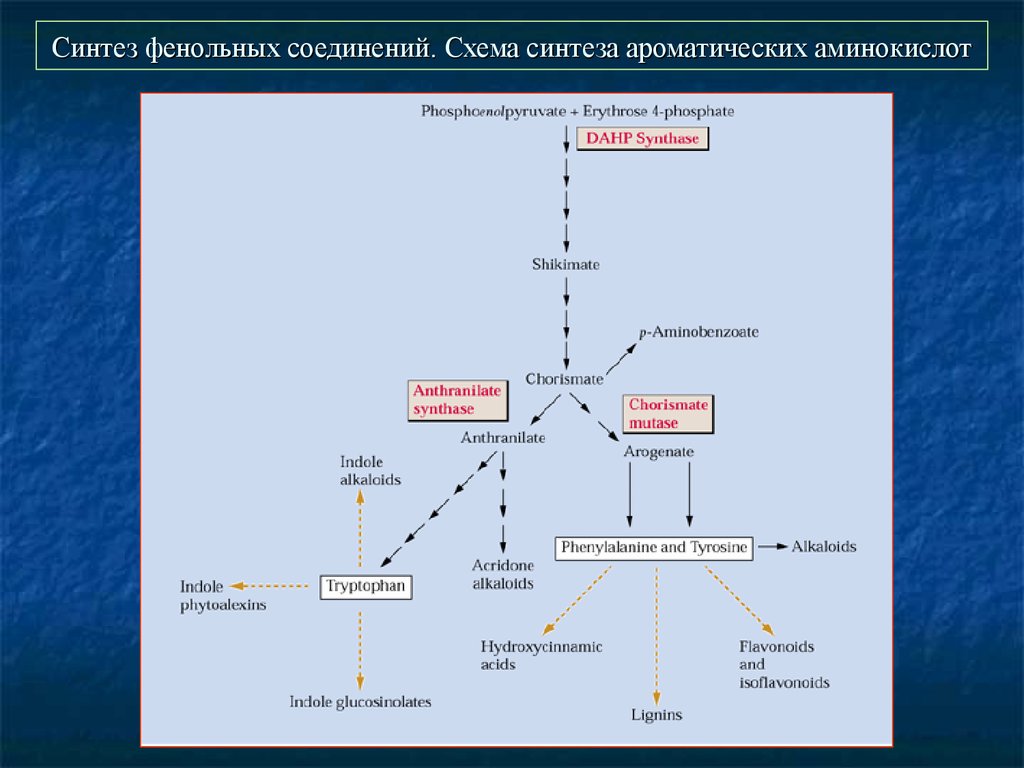
24. Синтез фенольных соединений. Схема синтеза ароматических аминокислот
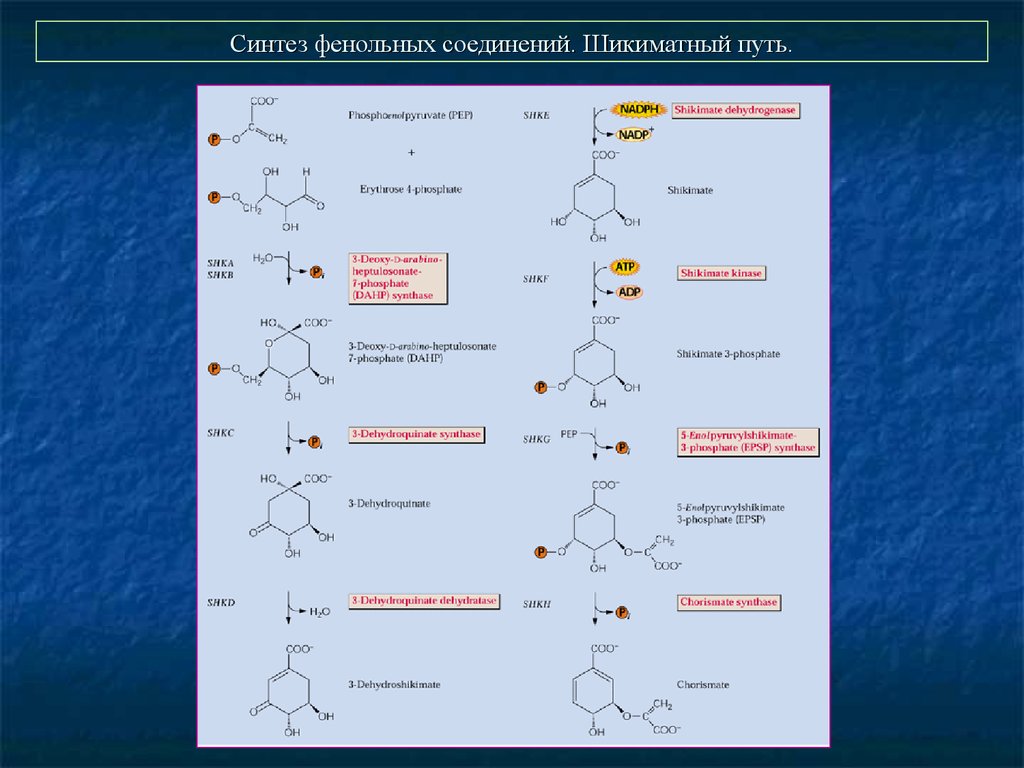
25. Синтез фенольных соединений. Шикиматный путь.
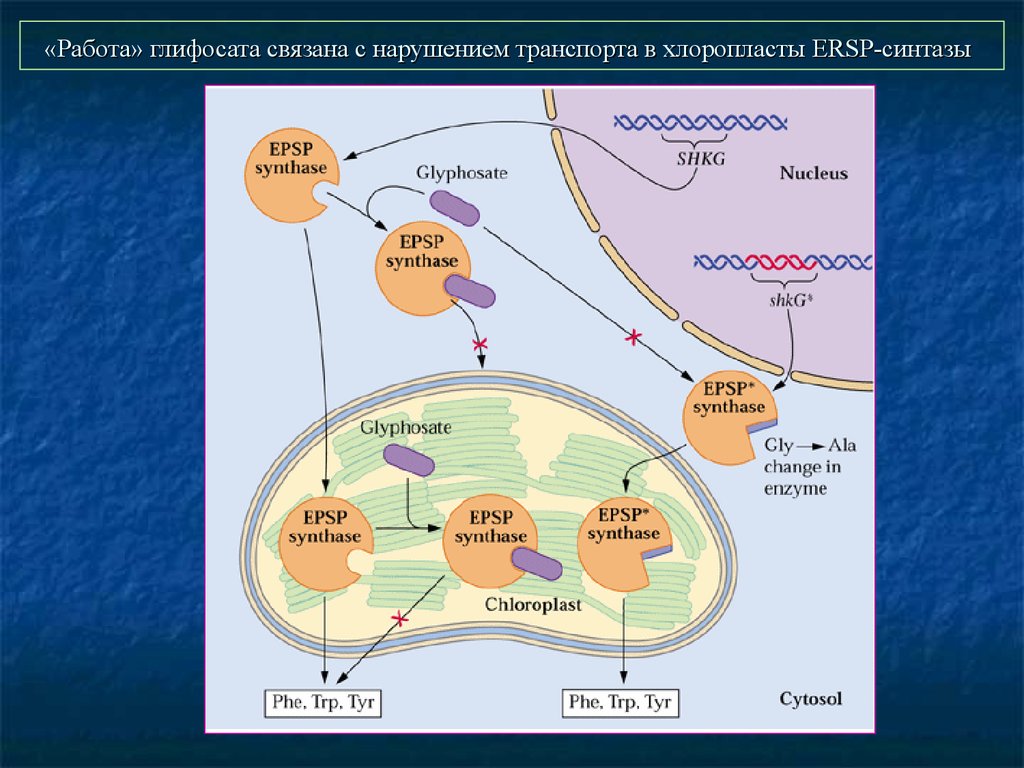
26. «Работа» глифосата связана с нарушением транспорта в хлоропласты ERSP-синтазы
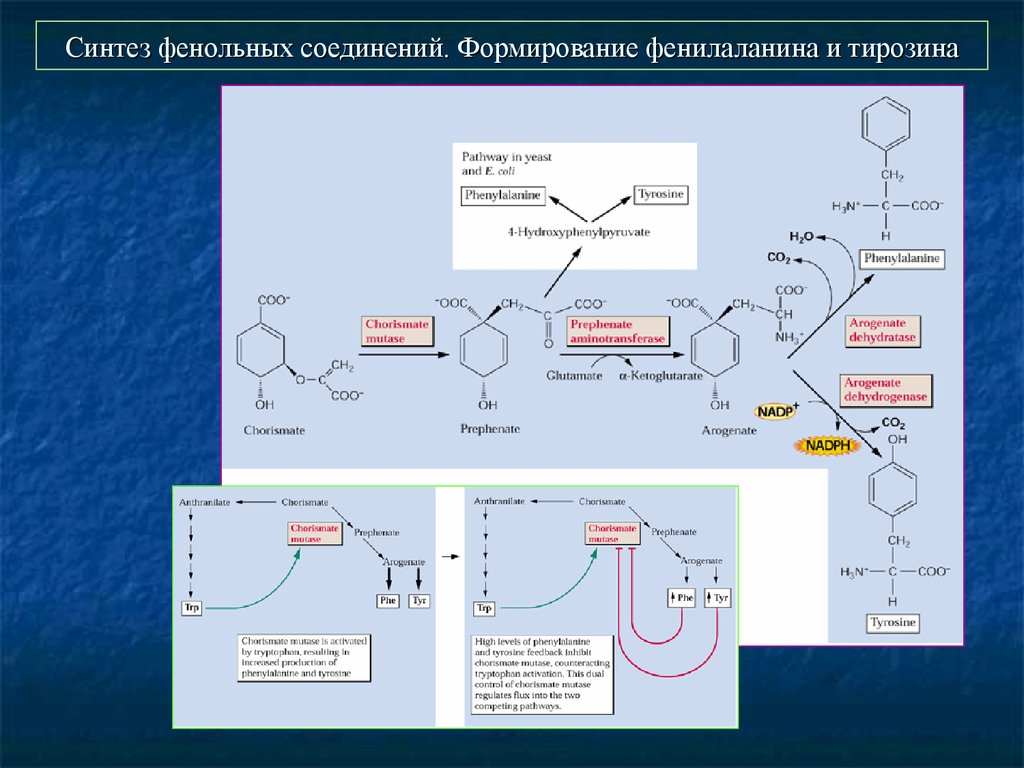
27. Синтез фенольных соединений. Формирование фенилаланина и тирозина
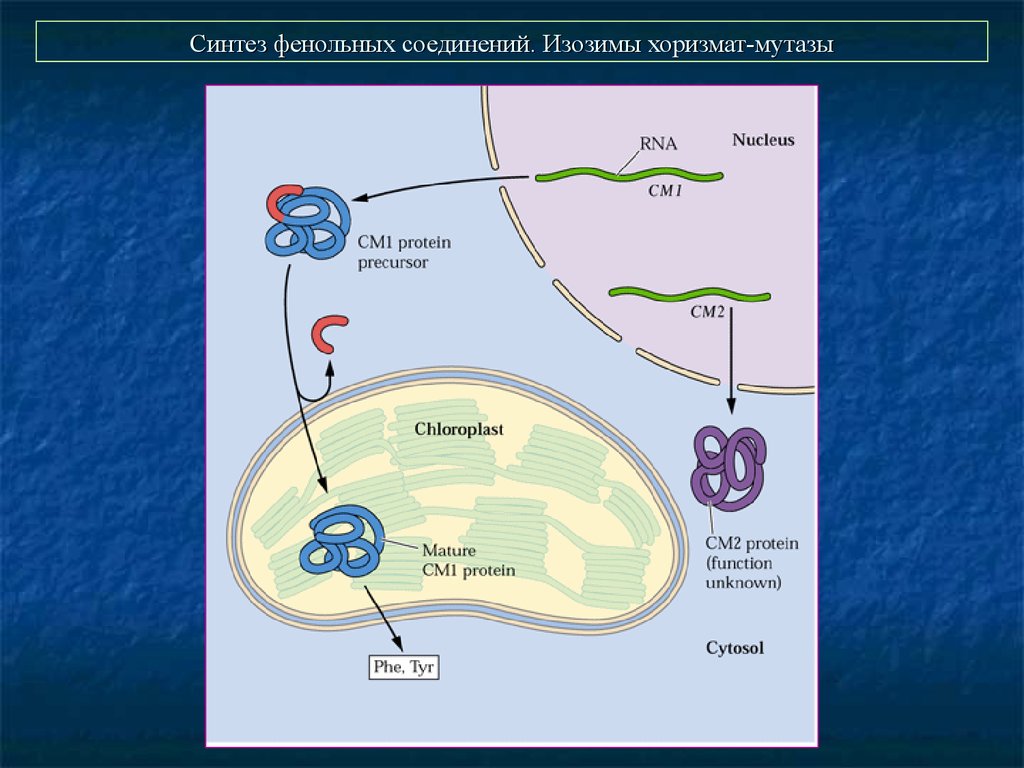
28. Синтез фенольных соединений. Изозимы хоризмат-мутазы
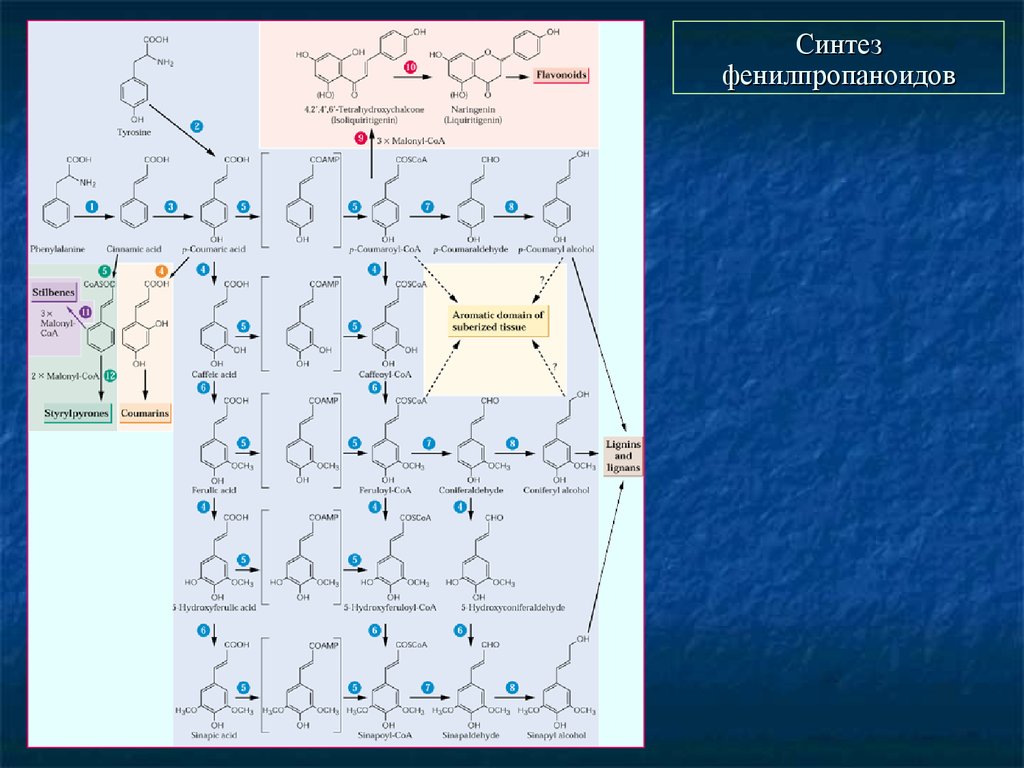
29. Синтез фенилпропаноидов
30. Синтез фенилпропаноидов.
31. Начальные ферменты синтеза фенилпропаноидов
Фенилаланин–аммиак-лиаза (ФАЛ, PAL). Первое сообщение – 1961 год (юбилей!),из ячменя, МВ ~ 330 kDa, гомотетрамер, Опт. рН ~ 8,8, без кофакторов. Структурно
сходна с гистидин-аммиак-лиазой из Pseudomonas putida.
Ряд изоформ. Как минимум две – ФАЛ1 ингибируется кофейной и феруловой
кислотами, ФАЛ2 – бензойными кислотами.
Кодируется мультигенным семейством. У Arabidopsis thaliana – 4 гена. Считается
растворимым ферментом, однако известны цитоплазматическая и мембраносвязанные изоформы. Предполагается ее ассоциация с гидроксилазой коричной
кислоты (С4Н), ассоциированной с ER.
Активируется многими факторами (патогены, УФ).
Для травянистых растений – распространена тирозин-аммиак лиаза (ТАЛ, TAL).
Гидроксилаза коричной кислоты (С4Н, САН). Цитохром-Р450 монооксигеназа.
CYP73A1. Известно более 80 цитохром-Р450 семейства CYP73А1, но не все имеют
активность С4Н
Мультигенное семейство, Два класса, существенно различающиеся по а-к
последовательности, I – для однодольных, II – для двудольных.
Гены клонированы, пробовали их экспрессировать в дрожжах…
Кумарат-СоА-лигаза (4CL). Два класса, I и II. У арабидопсиса – 11 генов, но не все
белки проявляют активность. Клонированы, экспрессированы в дрожжах…
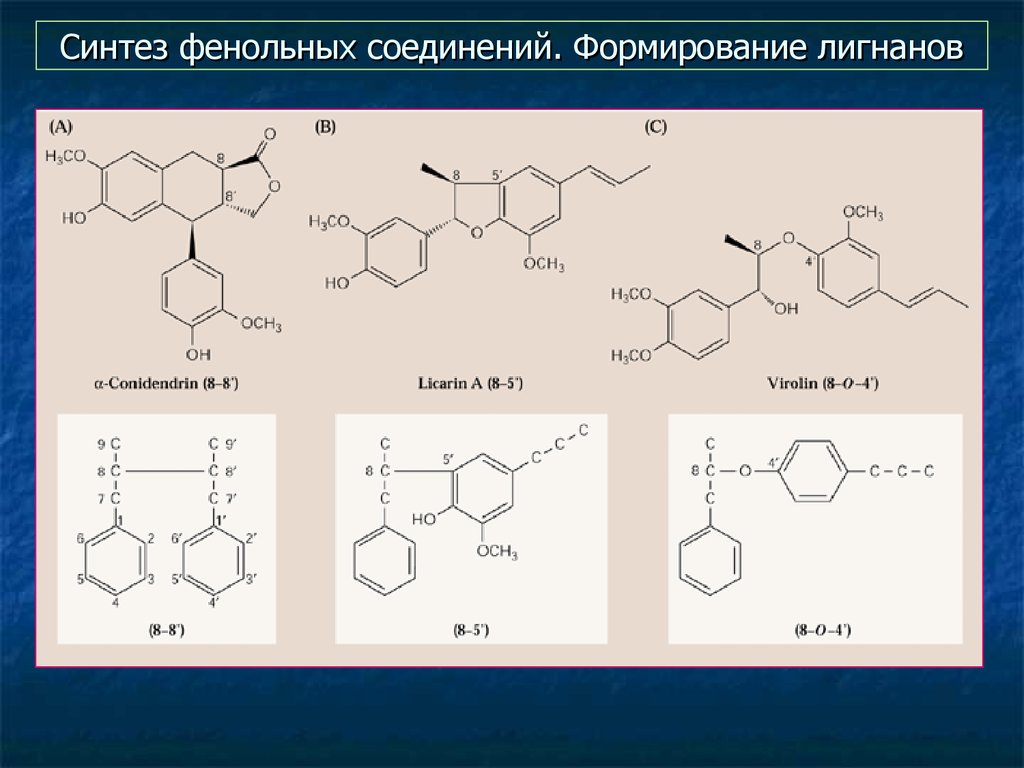
32. Синтез фенольных соединений. Формирование лигнанов
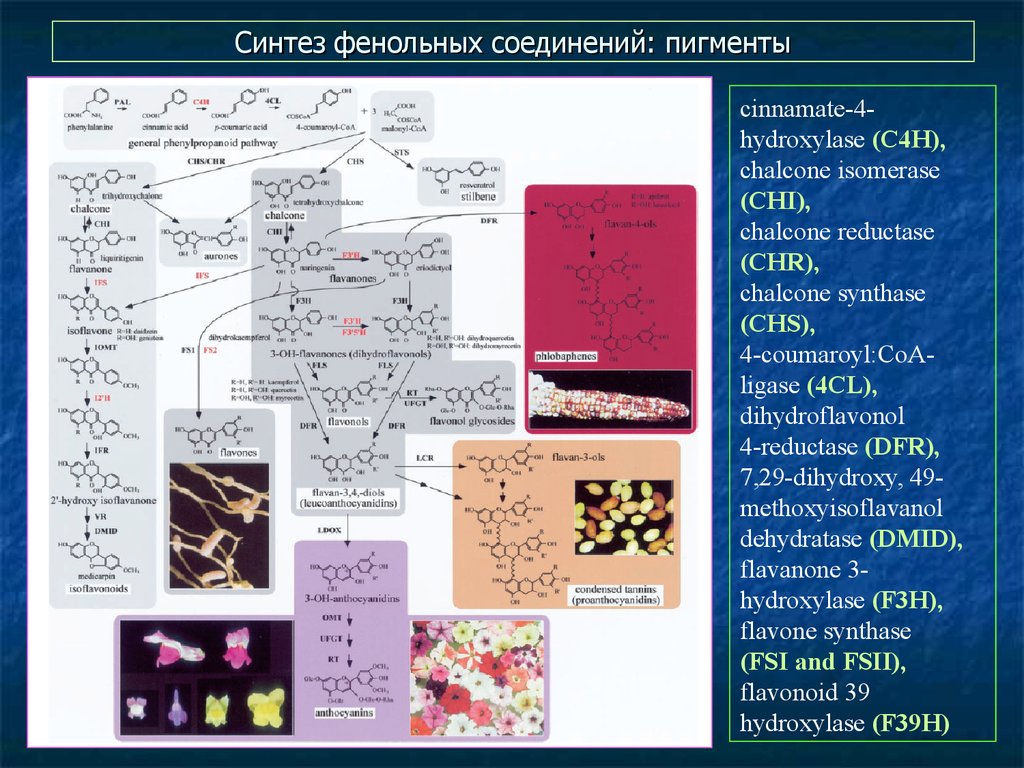
33. Синтез фенольных соединений: пигменты
cinnamate-4hydroxylase (C4H),chalcone isomerase
(CHI),
chalcone reductase
(CHR),
chalcone synthase
(CHS),
4-coumaroyl:CoAligase (4CL),
dihydroflavonol
4-reductase (DFR),
7,29-dihydroxy, 49methoxyisoflavanol
dehydratase (DMID),
flavanone 3hydroxylase (F3H),
flavone synthase
(FSI and FSII),
flavonoid 39
hydroxylase (F39H)
34. Формирование флавоноидов
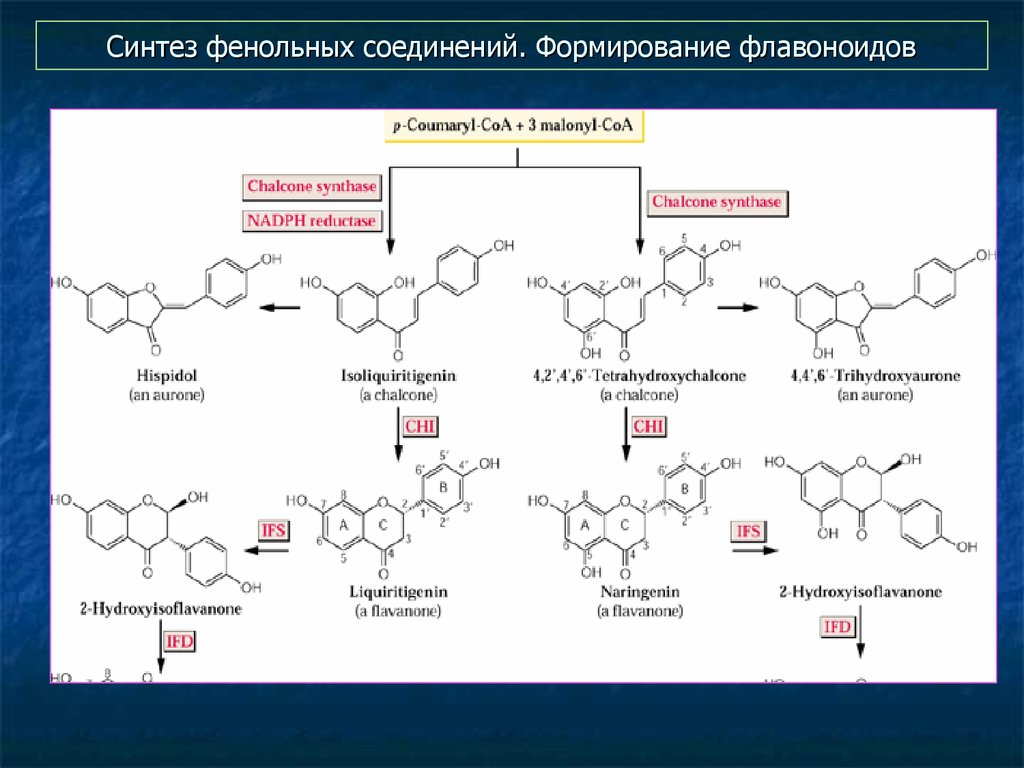
35. Синтез фенольных соединений. Формирование флавоноидов
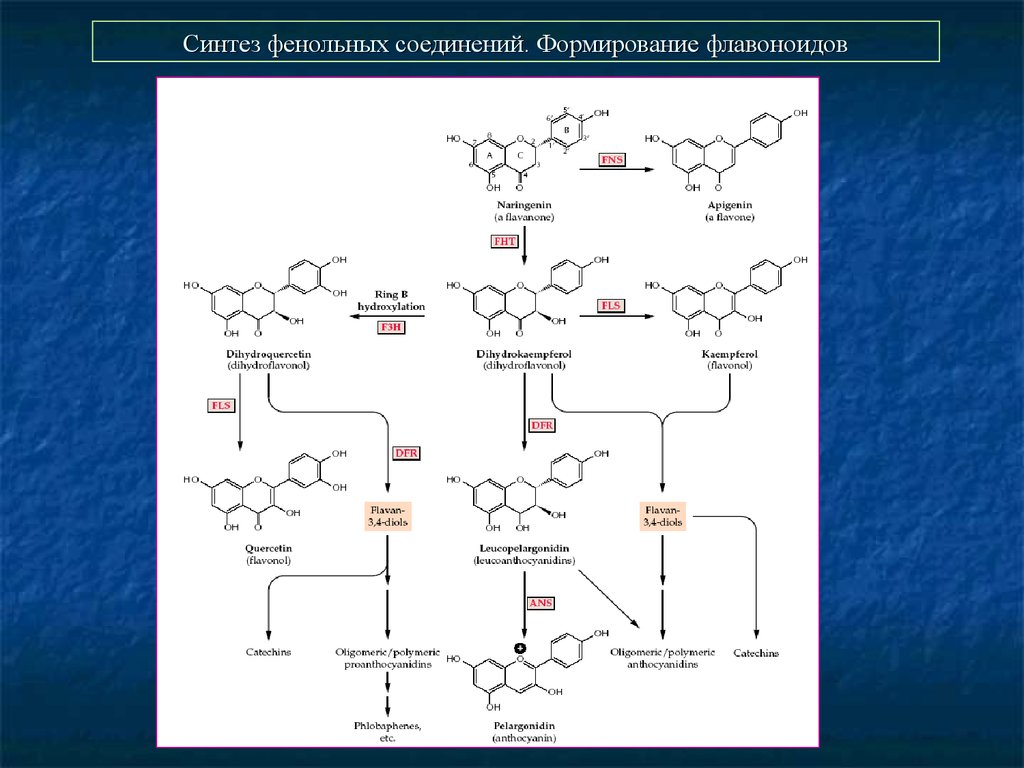
36. Синтез фенольных соединений. Формирование флавоноидов
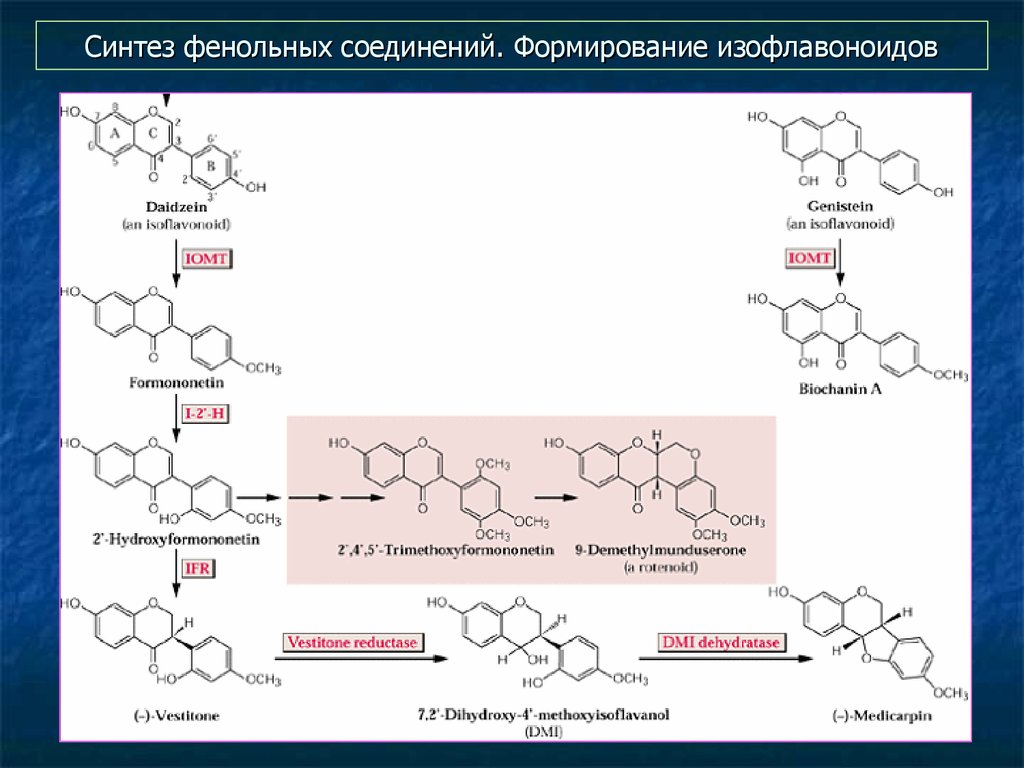
37. Синтез фенольных соединений. Формирование изофлавоноидов
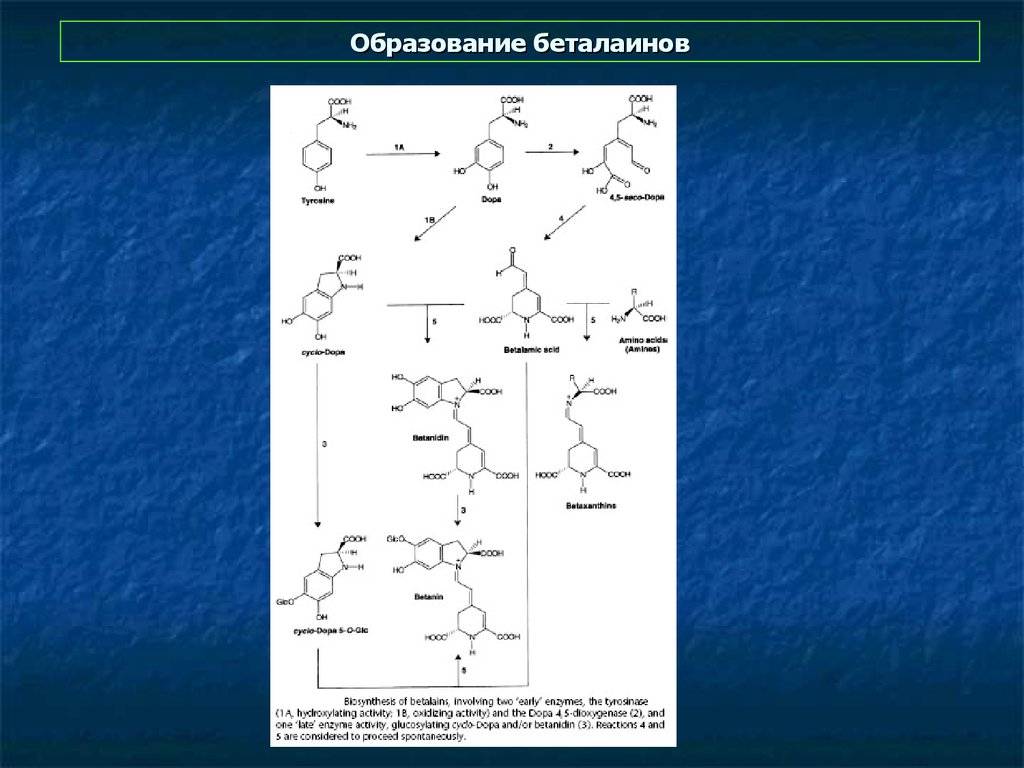
38. Образование беталаинов
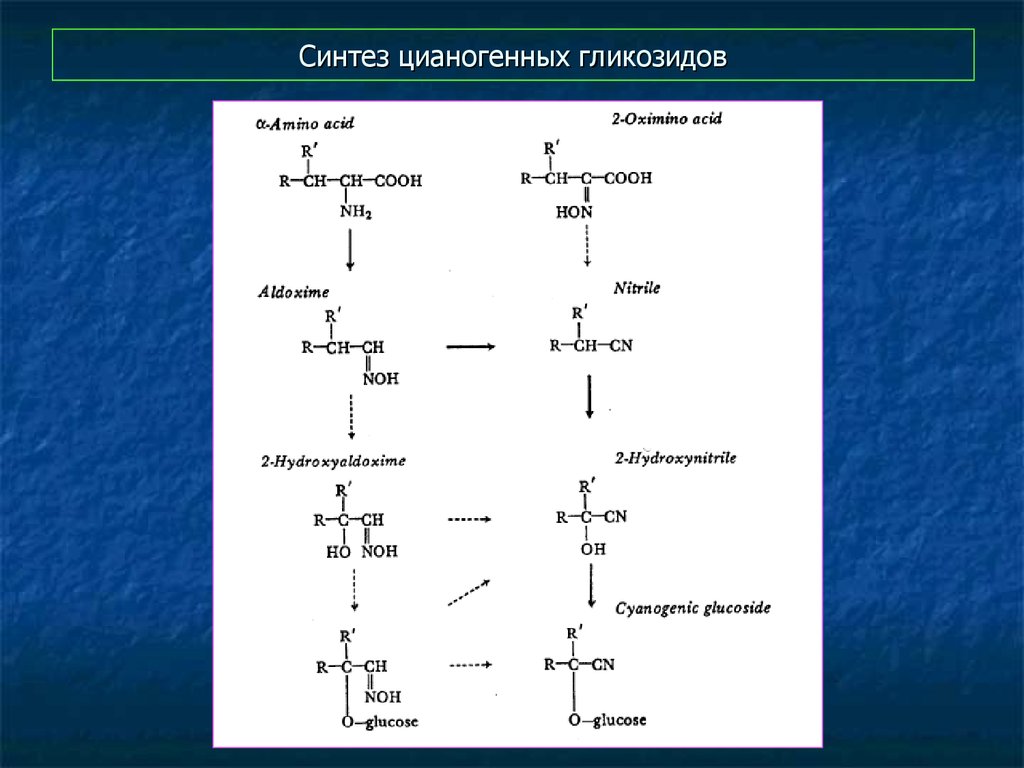
39. Синтез цианогенных гликозидов
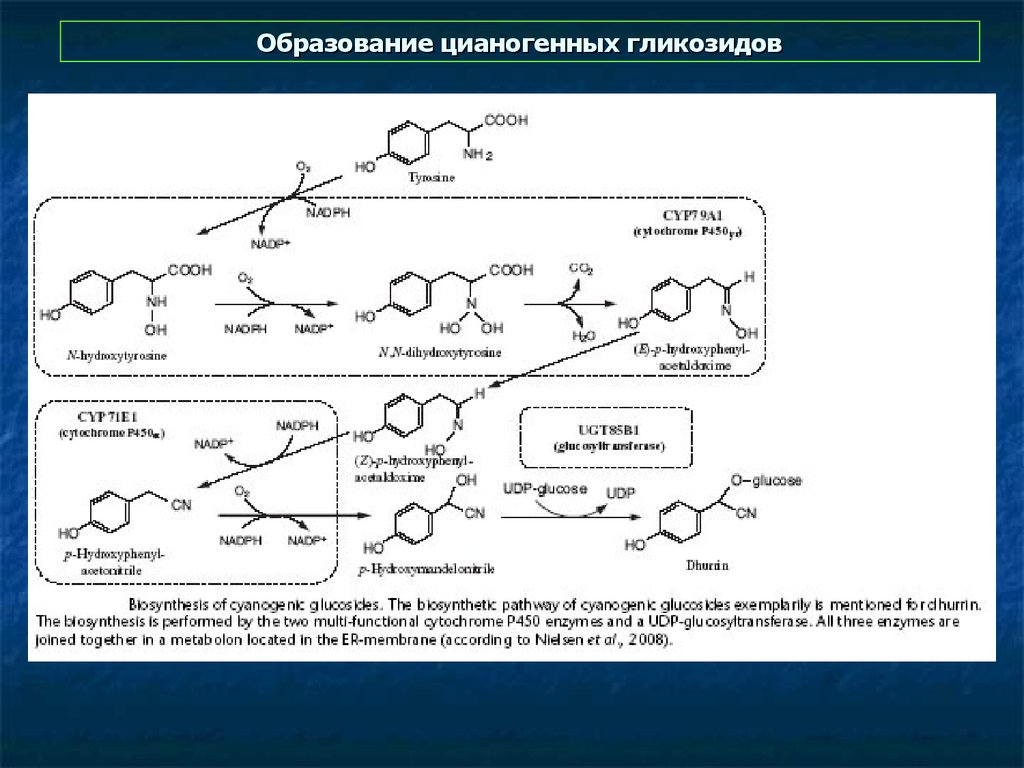
40. Образование цианогенных гликозидов
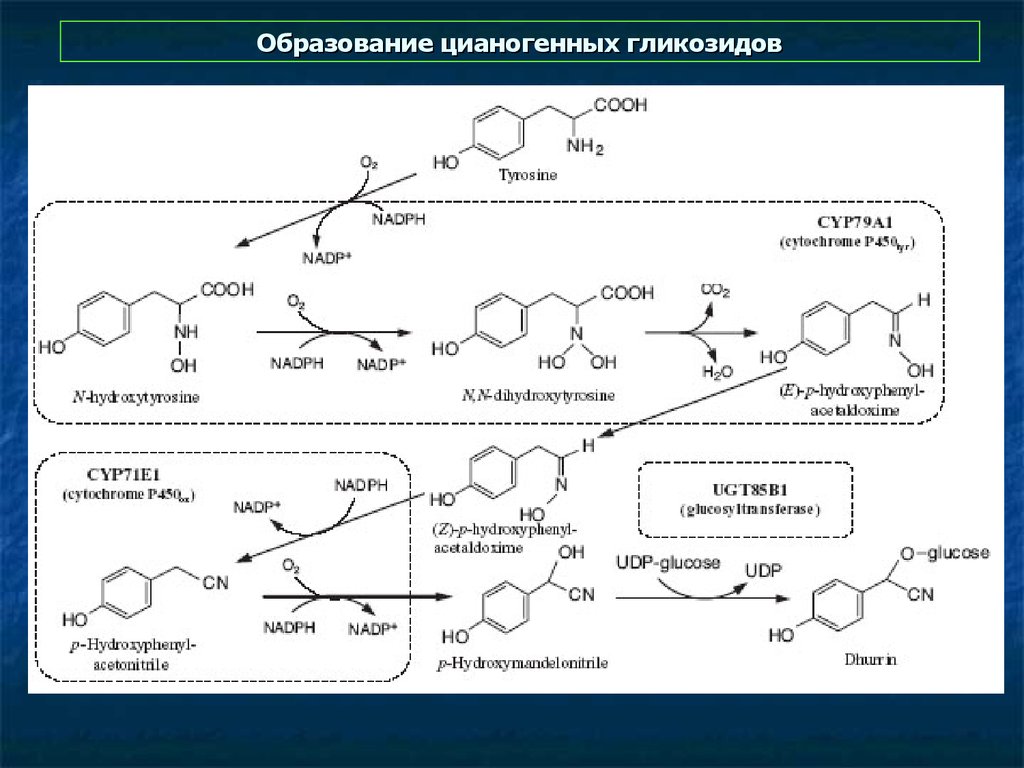
41. Образование цианогенных гликозидов
42. Образование глюкозинолатов
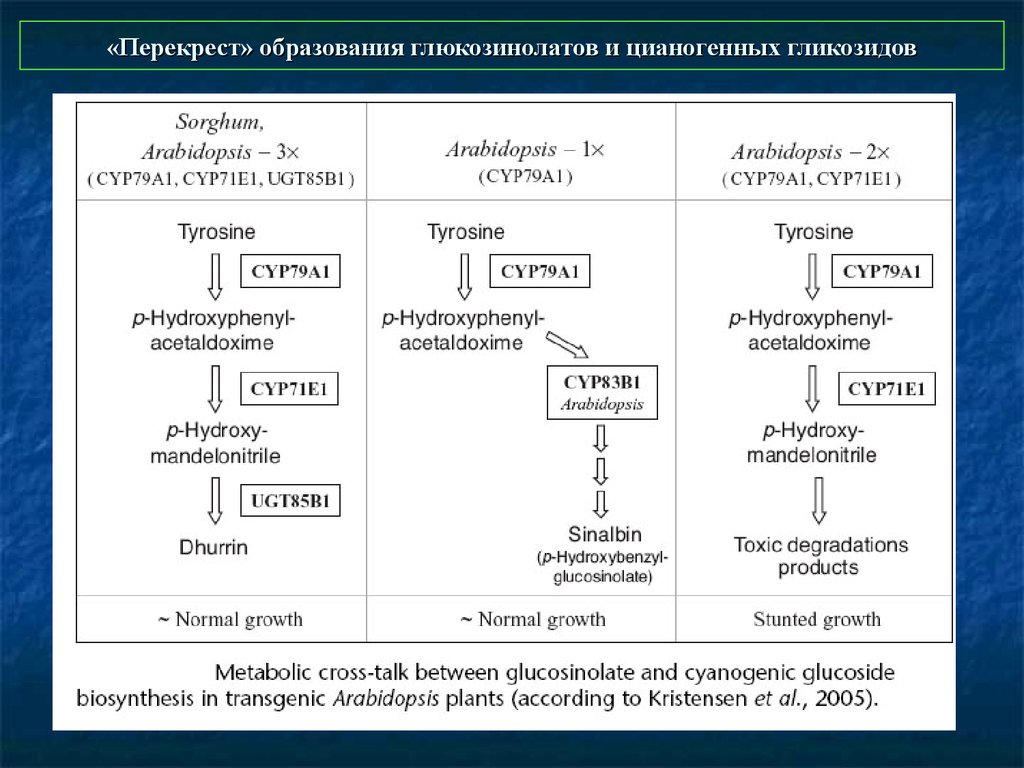
43. «Перекрест» образования глюкозинолатов и цианогенных гликозидов
44. Пример метаболической инженерии – вместо глюкозинолатов – амины…
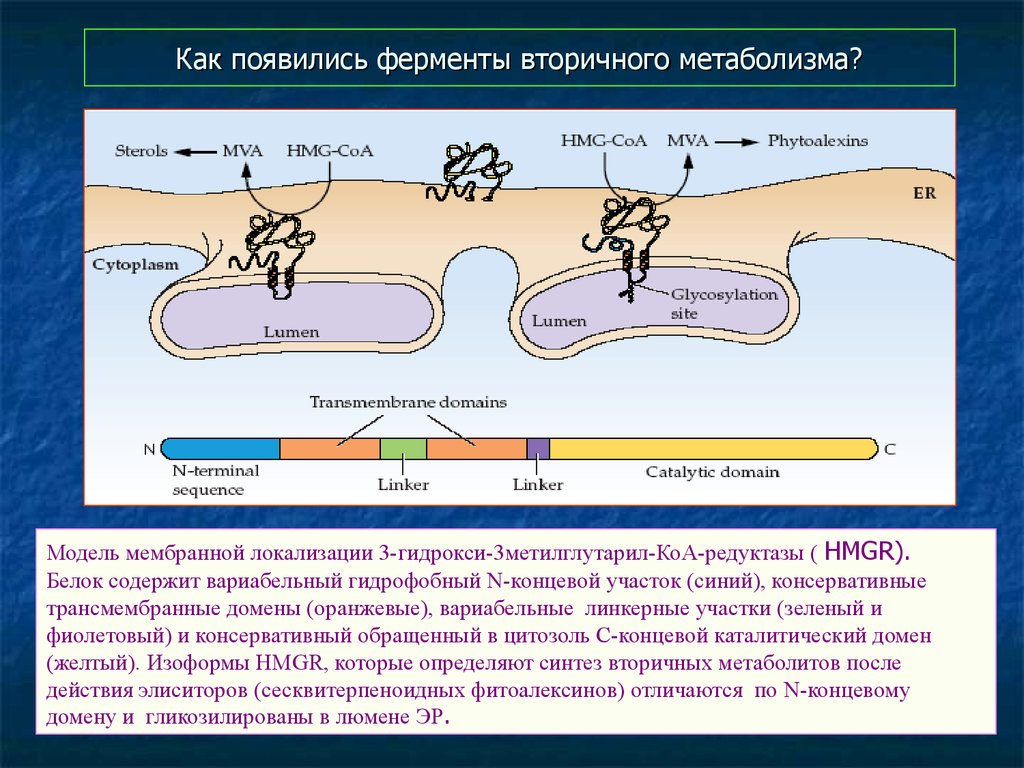
45. Как появились ферменты вторичного метаболизма?
Модель мембранной локализации 3-гидрокси-3метилглутарил-КоА-редуктазы ( HMGR).Белок содержит вариабельный гидрофобный N-концевой участок (синий), консервативные
трансмембранные домены (оранжевые), вариабельные линкерные участки (зеленый и
фиолетовый) и консервативный обращенный в цитозоль С-концевой каталитический домен
(желтый). Изоформы HMGR, которые определяют синтез вторичных метаболитов после
действия элиситоров (сесквитерпеноидных фитоалексинов) отличаются по N-концевому
домену и гликозилированы в люмене ЭР.
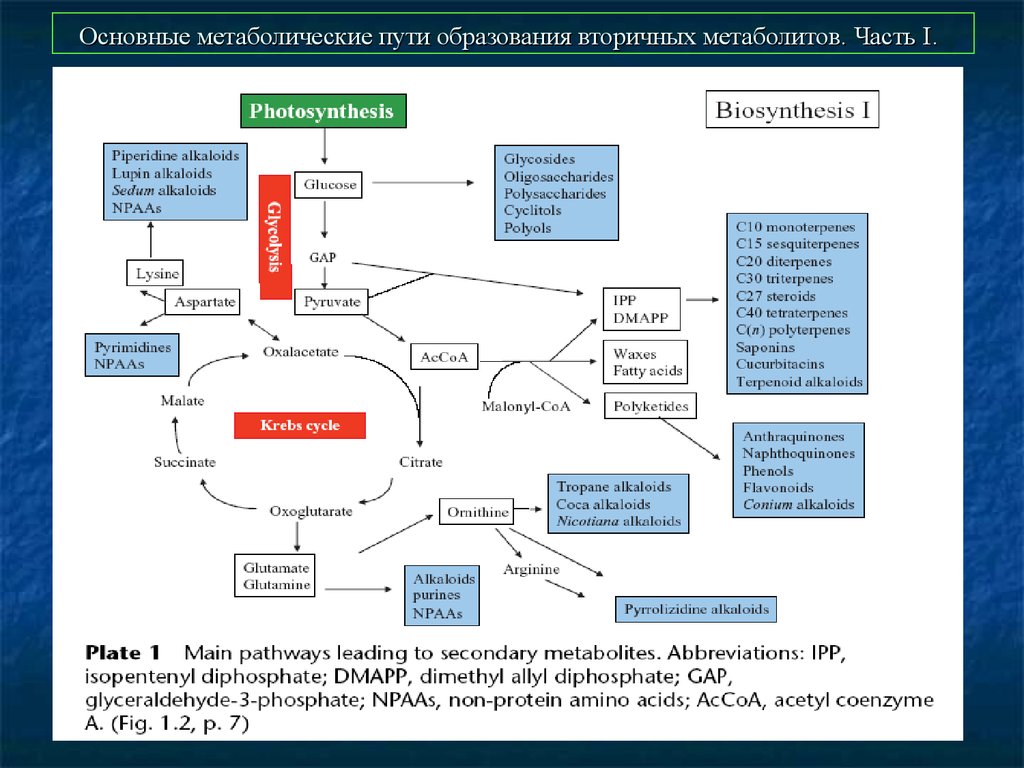
46. Основные метаболические пути образования вторичных метаболитов. Часть I.
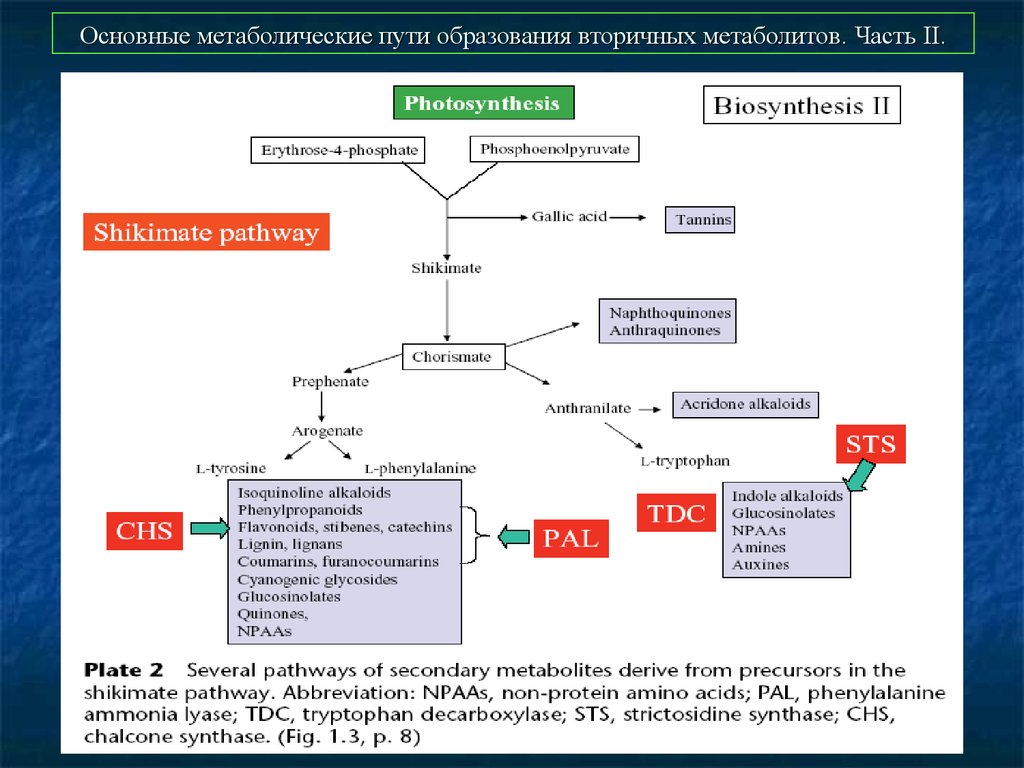
47. Основные метаболические пути образования вторичных метаболитов. Часть II.
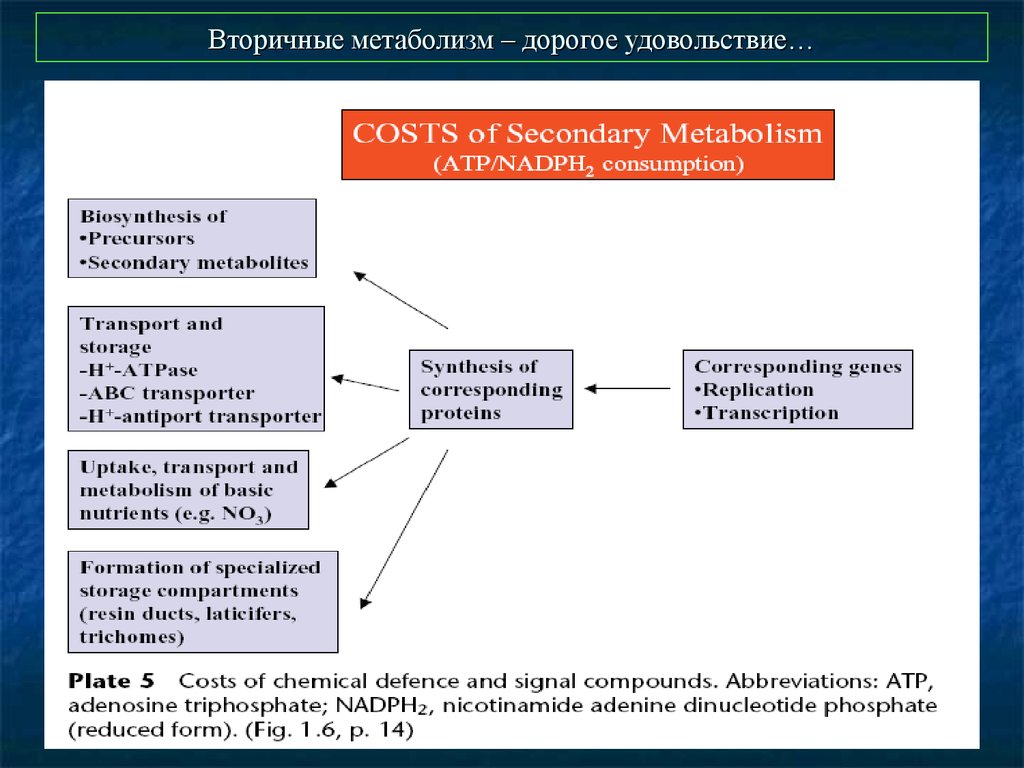
48. Вторичные метаболизм – дорогое удовольствие…
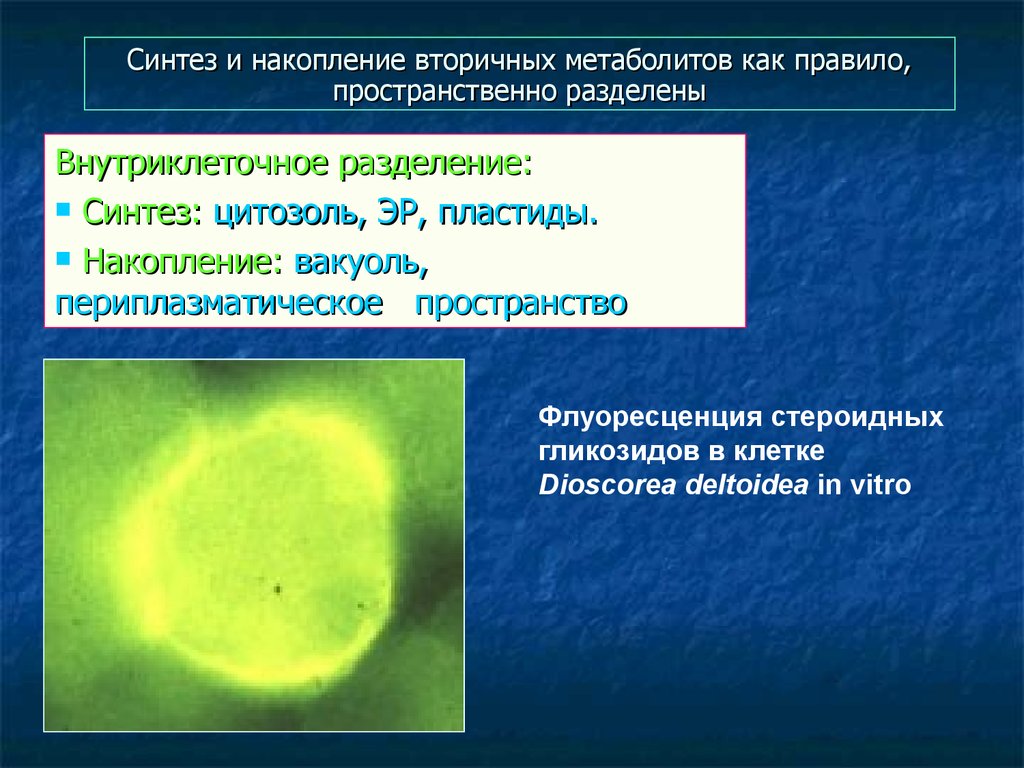
49. Синтез и накопление вторичных метаболитов как правило, пространственно разделены
Внутриклеточное разделение:Синтез: цитозоль, ЭР, пластиды.
Накопление: вакуоль,
периплазматическое пространство
Флуоресценция стероидных
гликозидов в клетке
Dioscorea deltoidea in vitro
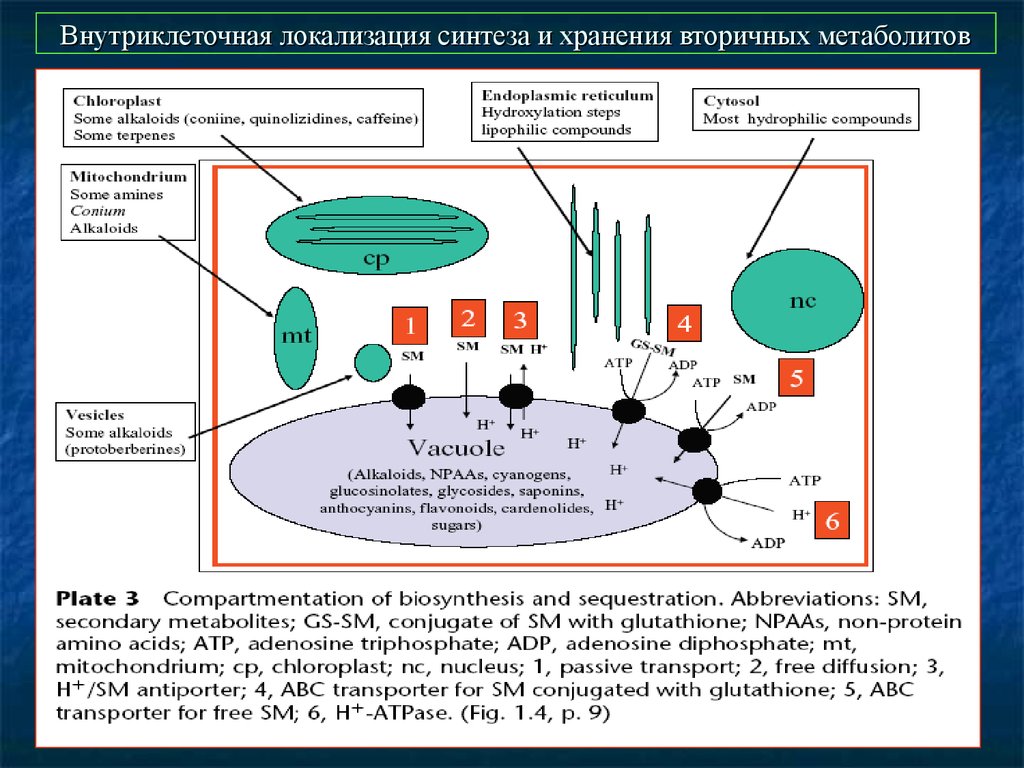
50. Внутриклеточная локализация синтеза и хранения вторичных метаболитов
51. Места хранения вторичных метаболитов
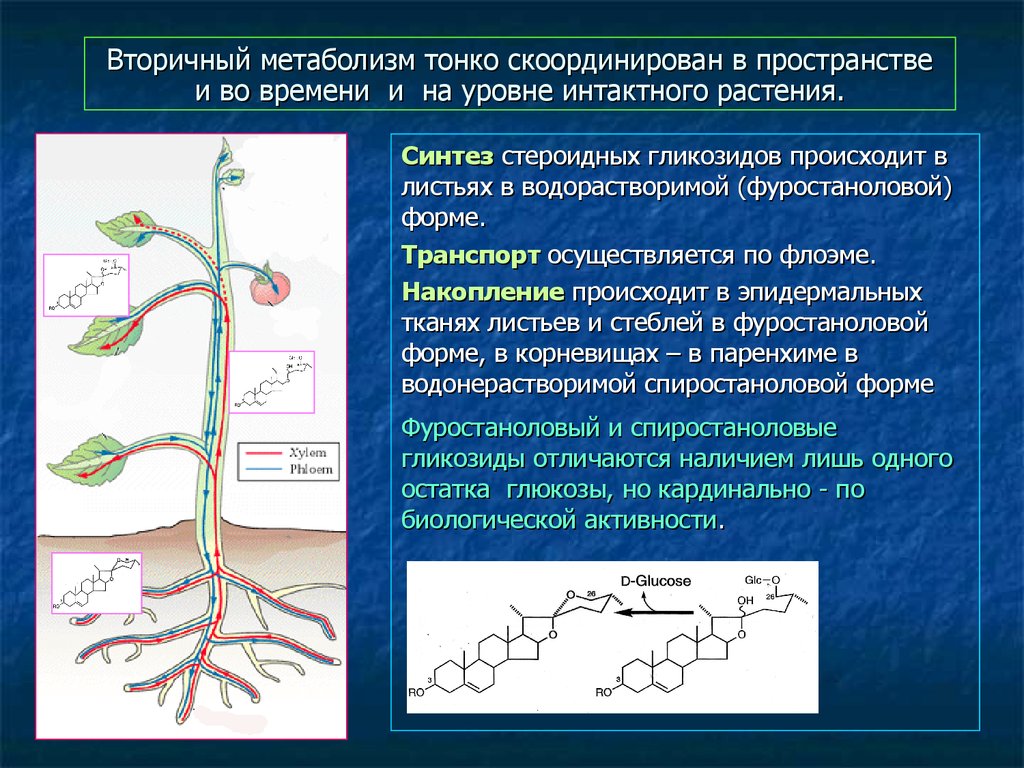
52. Вторичный метаболизм тонко скоординирован в пространстве и во времени и на уровне интактного растения.
Синтез стероидных гликозидов происходит влистьях в водорастворимой (фуростаноловой)
форме.
Транспорт осуществляется по флоэме.
Накопление происходит в эпидермальных
тканях листьев и стеблей в фуростаноловой
форме, в корневищах – в паренхиме в
водонерастворимой спиростаноловой форме
Фуростаноловый и спиростаноловые
гликозиды отличаются наличием лишь одного
остатка глюкозы, но кардинально - по
биологической активности.
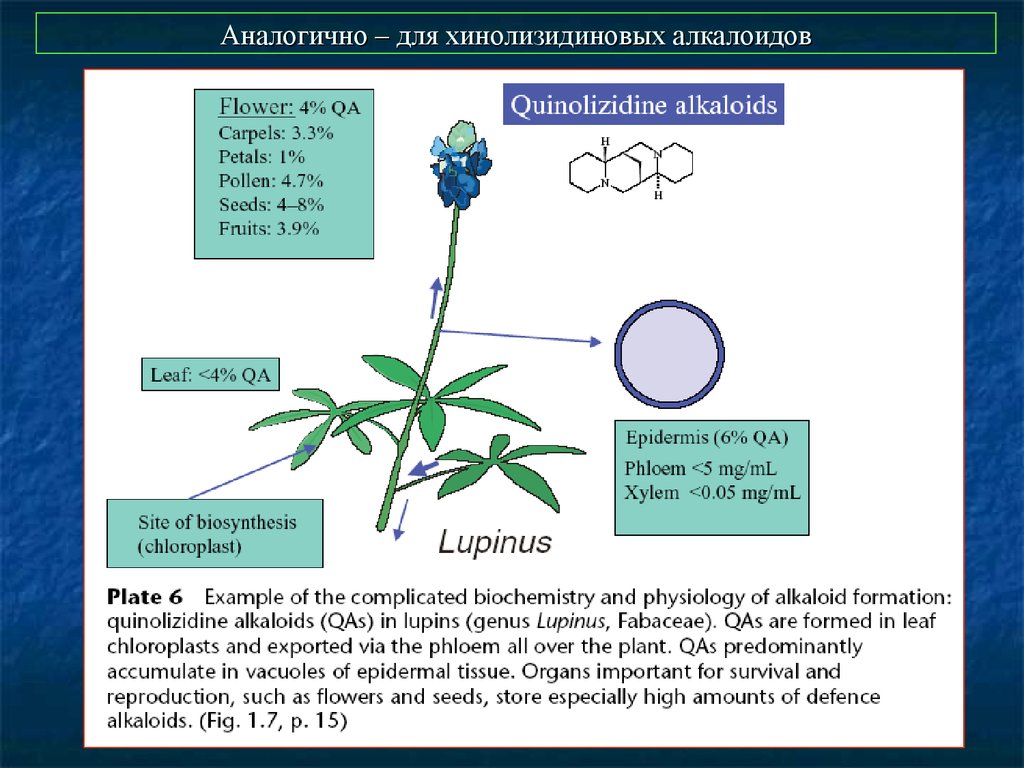
53. Аналогично – для хинолизидиновых алкалоидов
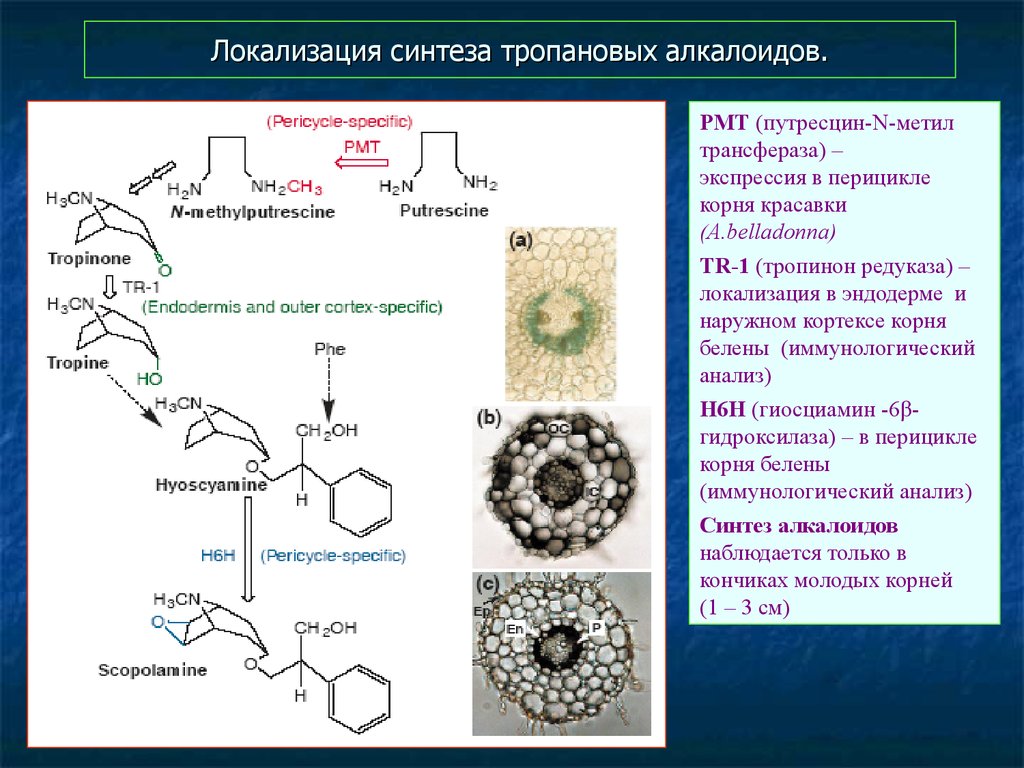
54. Локализация синтеза тропановых алкалоидов.
PMT (путресцин-N-метилтрансфераза) –
экспрессия в перицикле
корня красавки
(A.belladonna)
TR-1 (тропинон редуказа) –
локализация в эндодерме и
наружном кортексе корня
белены (иммунологический
анализ)
H6H (гиосциамин -6βгидроксилаза) – в перицикле
корня белены
(иммунологический анализ)
Синтез алкалоидов
наблюдается только в
кончиках молодых корней
(1 – 3 см)
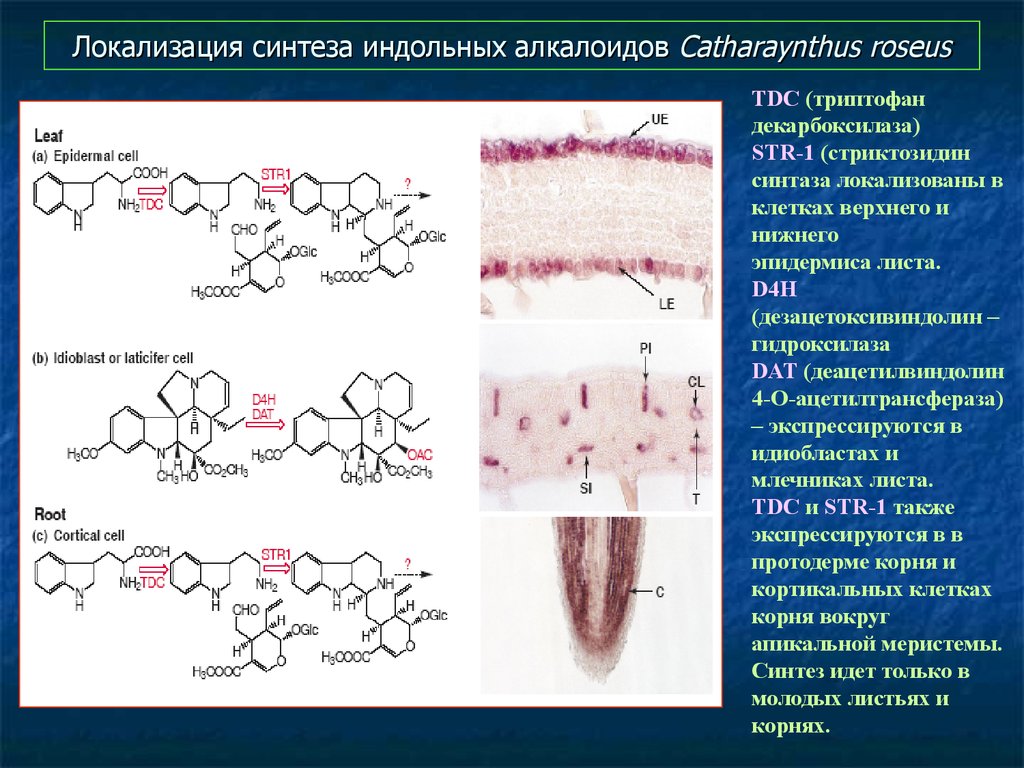
55. Локализация синтеза индольных алкалоидов Catharaynthus roseus
TDC (триптофандекарбоксилаза)
STR-1 (стриктозидин
синтаза локализованы в
клетках верхнего и
нижнего
эпидермиса листа.
D4H
(дезацетоксивиндолин –
гидроксилаза
DAT (деацетилвиндолин
4-О-ацетилтрансфераза)
– экспрессируются в
идиобластах и
млечниках листа.
TDC и STR-1 также
экспрессируются в в
протодерме корня и
кортикальных клетках
корня вокруг
апикальной меристемы.
Синтез идет только в
молодых листьях и
корнях.
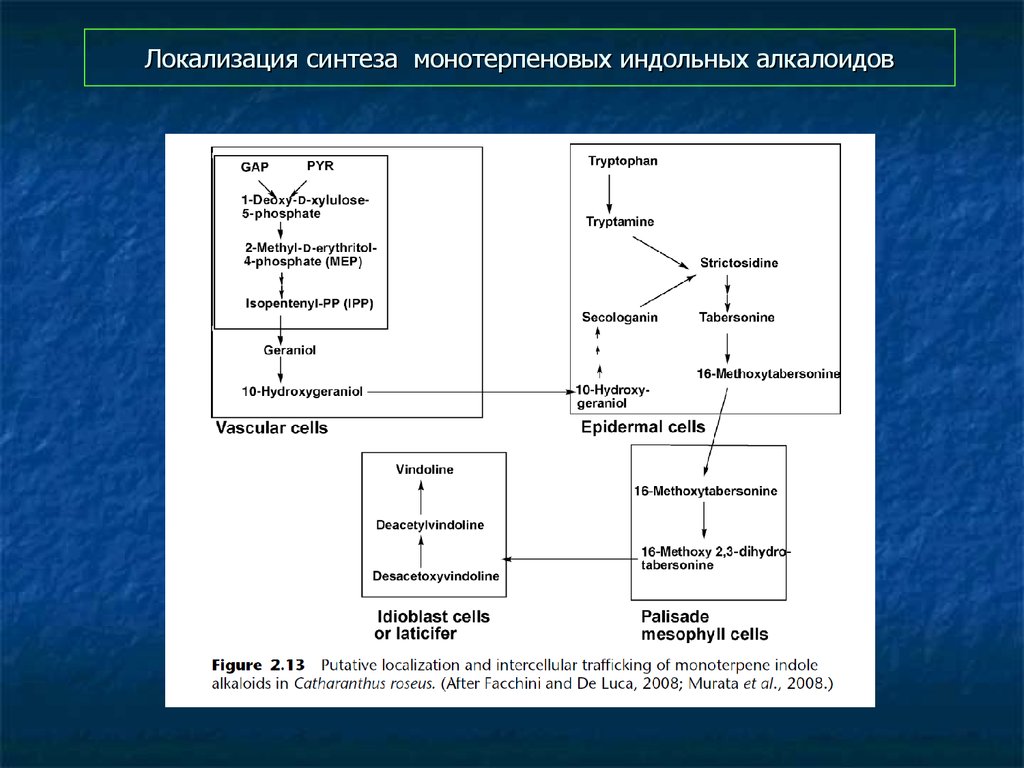
56. Локализация синтеза монотерпеновых индольных алкалоидов
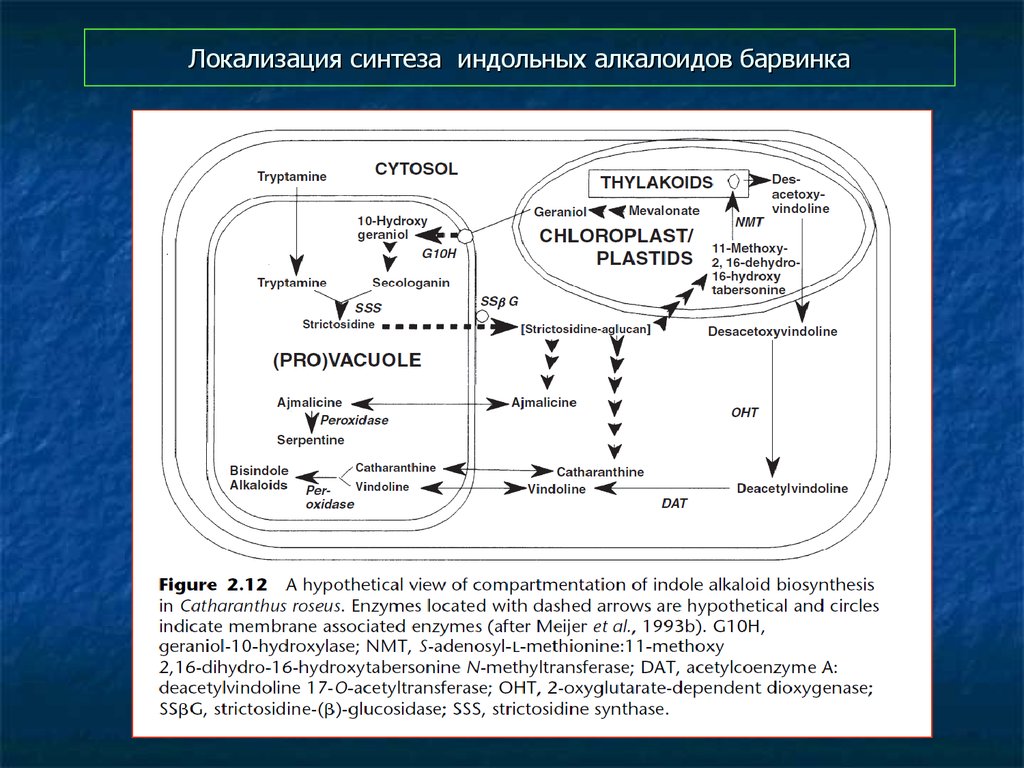
57. Локализация синтеза индольных алкалоидов барвинка
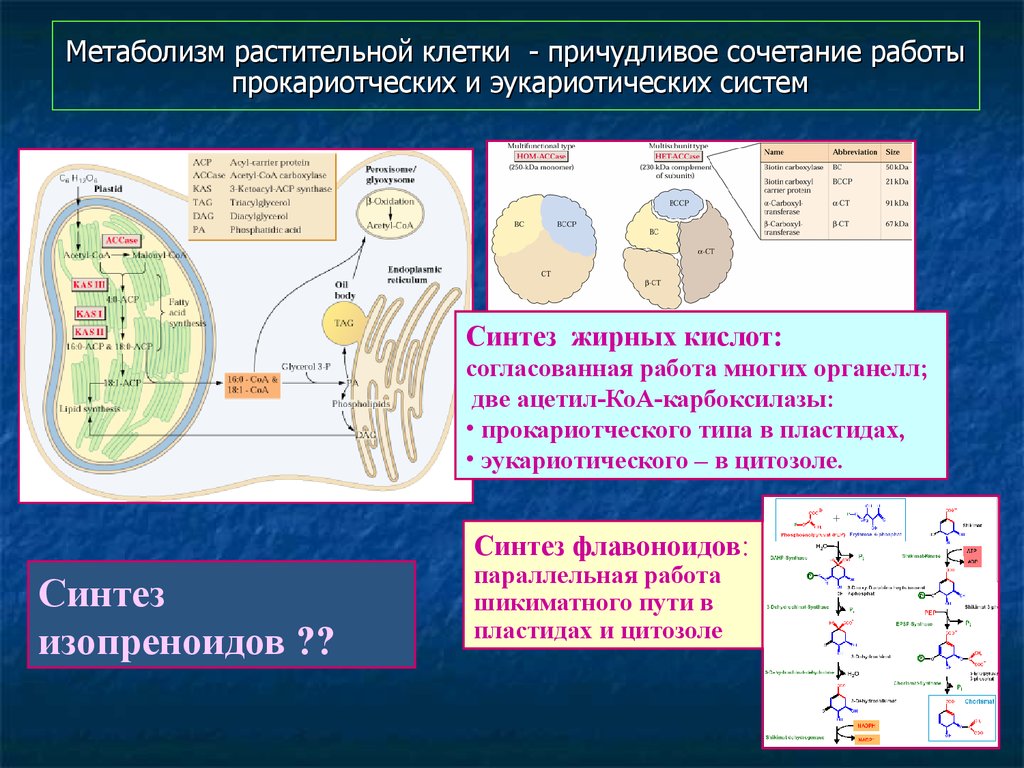
58. Метаболизм растительной клетки - причудливое сочетание работы прокариотческих и эукариотических систем
Синтез жирных кислот:согласованная работа многих органелл;
две ацетил-КоА-карбоксилазы:
• прокариотческого типа в пластидах,
• эукариотического – в цитозоле.
Синтез флавоноидов:
Синтез
изопреноидов ??
параллельная работа
шикиматного пути в
пластидах и цитозоле
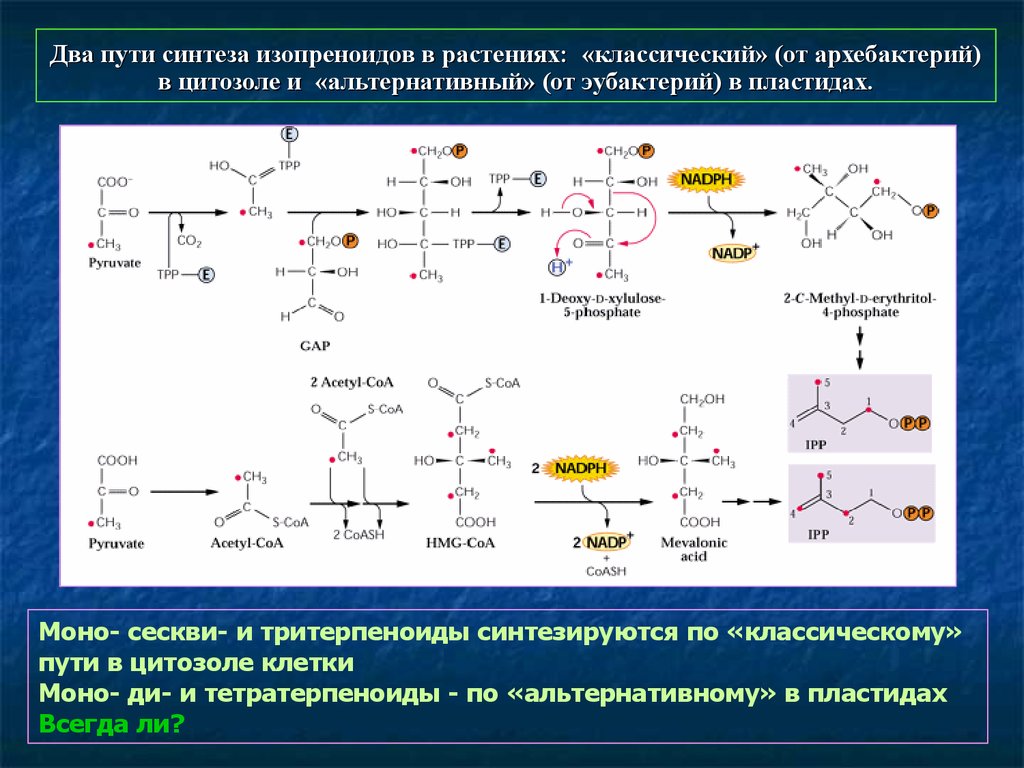
59. Два пути синтеза изопреноидов в растениях: «классический» (от архебактерий) в цитозоле и «альтернативный» (от эубактерий) в пластидах.
Моно- сескви- и тритерпеноиды синтезируются по «классическому»пути в цитозоле клетки
Моно- ди- и тетратерпеноиды - по «альтернативному» в пластидах
Всегда ли?
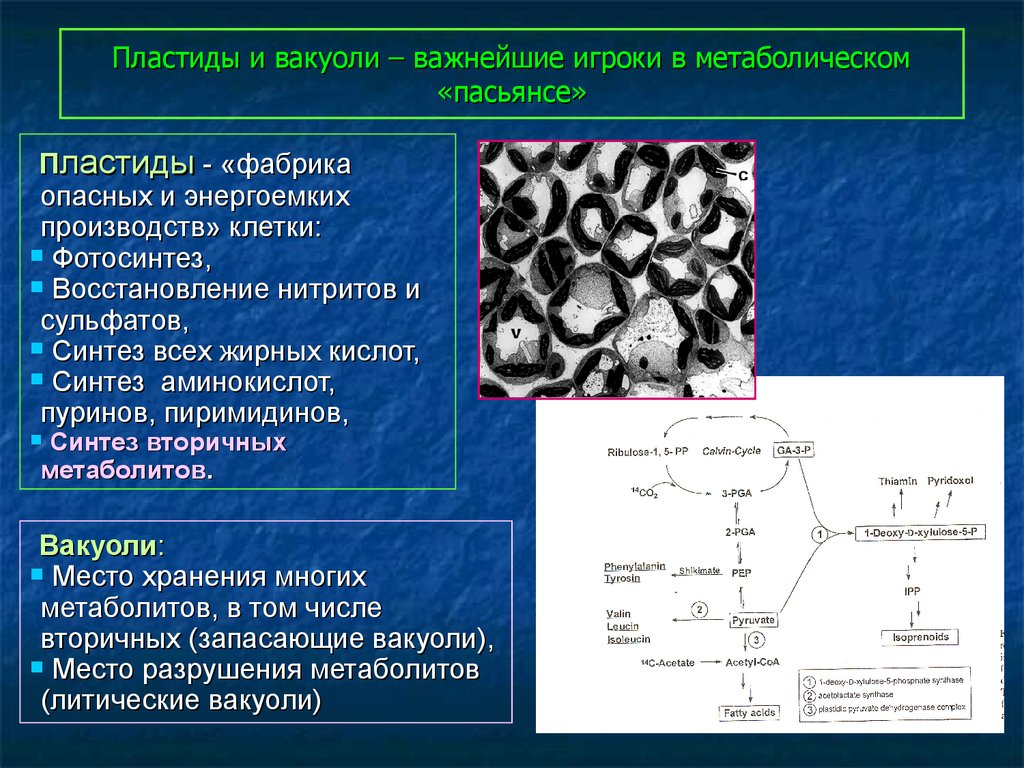
60. Пластиды и вакуоли – важнейшие игроки в метаболическом «пасьянсе»
Пластиды - «фабрикаопасных и энергоемких
производств» клетки:
Фотосинтез,
Восстановление нитритов и
сульфатов,
Синтез всех жирных кислот,
Синтез аминокислот,
пуринов, пиримидинов,
Синтез вторичных
метаболитов.
Вакуоли:
Место хранения многих
метаболитов, в том числе
вторичных (запасающие вакуоли),
Место разрушения метаболитов
(литические вакуоли)
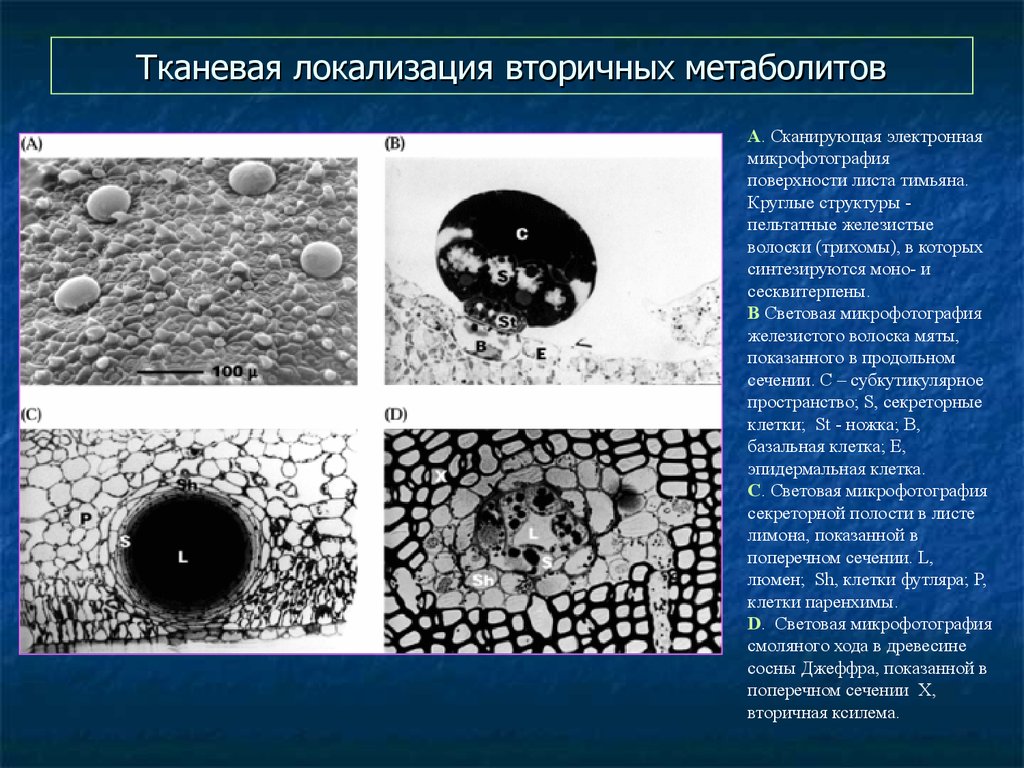
61. Тканевая локализация вторичных метаболитов
А. Сканирующая электроннаямикрофотография
поверхности листа тимьяна.
Круглые структуры пельтатные железистые
волоски (трихомы), в которых
синтезируются моно- и
сесквитерпены.
B Световая микрофотография
железистого волоска мяты,
показанного в продольном
сечении. C – субкутикулярное
пространство; S, секреторные
клетки; St - ножка; B,
базальная клетка; E,
эпидермальная клетка.
C. Световая микрофотография
секреторной полости в листе
лимона, показанной в
поперечном сечении. L,
люмен; Sh, клетки футляра; P,
клетки паренхимы.
D. Световая микрофотография
смоляного хода в древесине
сосны Джеффра, показанной в
поперечном сечении X,
вторичная ксилема.
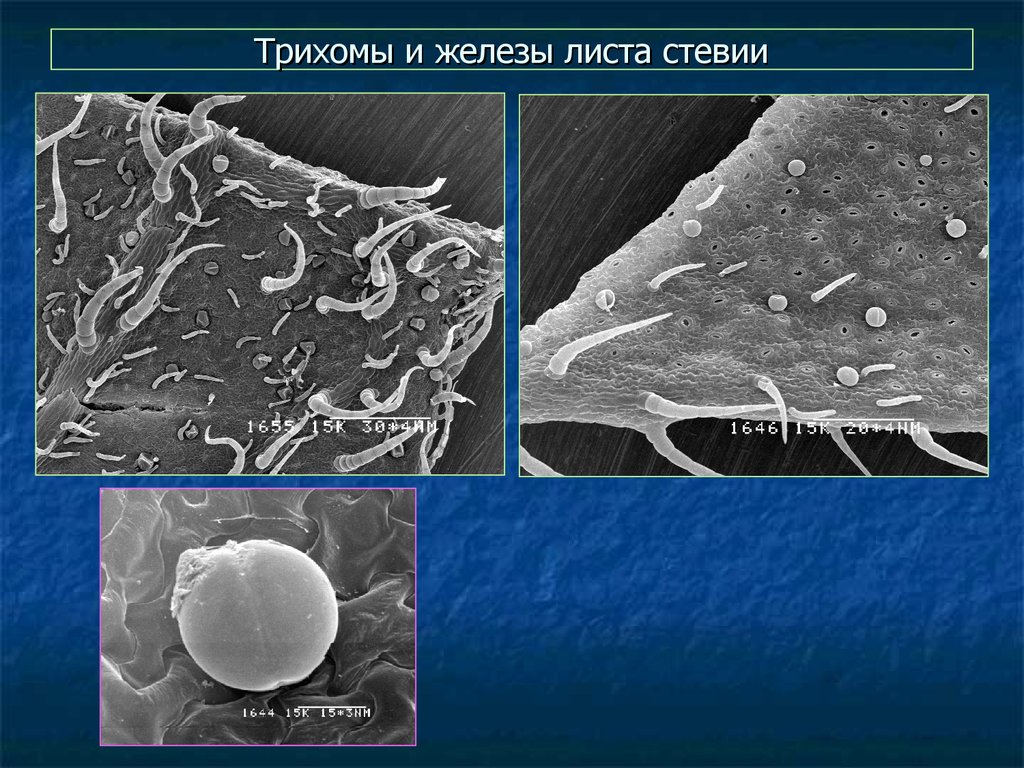
62. Трихомы и железы листа стевии
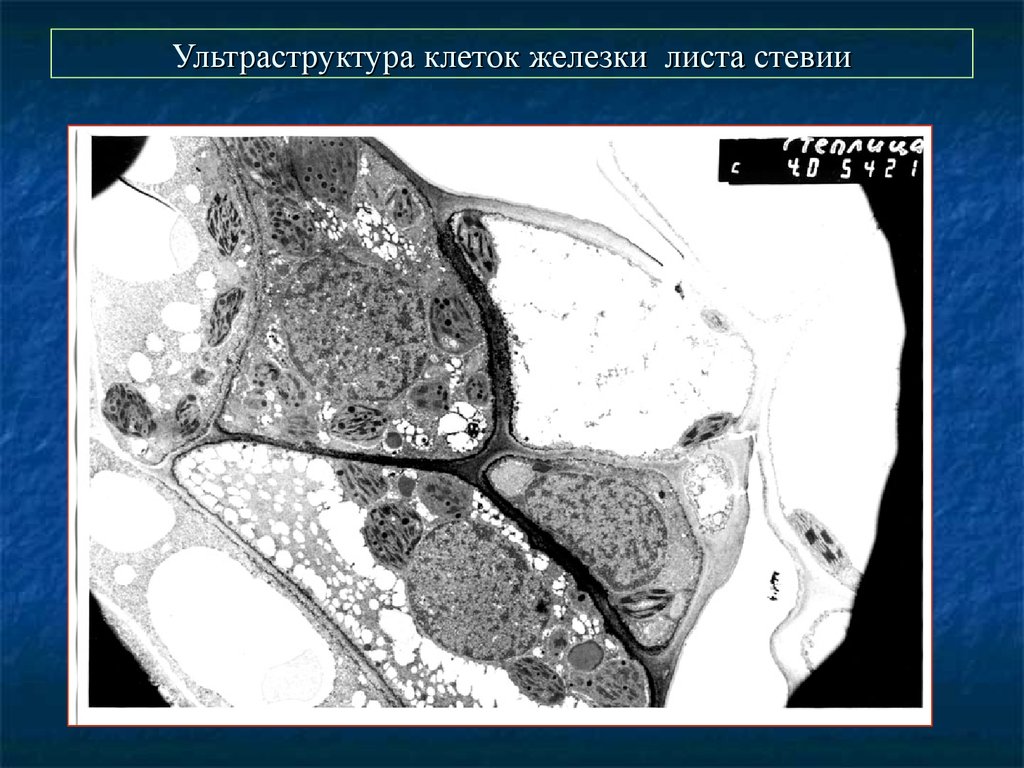
63. Ультраструктура клеток железки листа стевии
64.
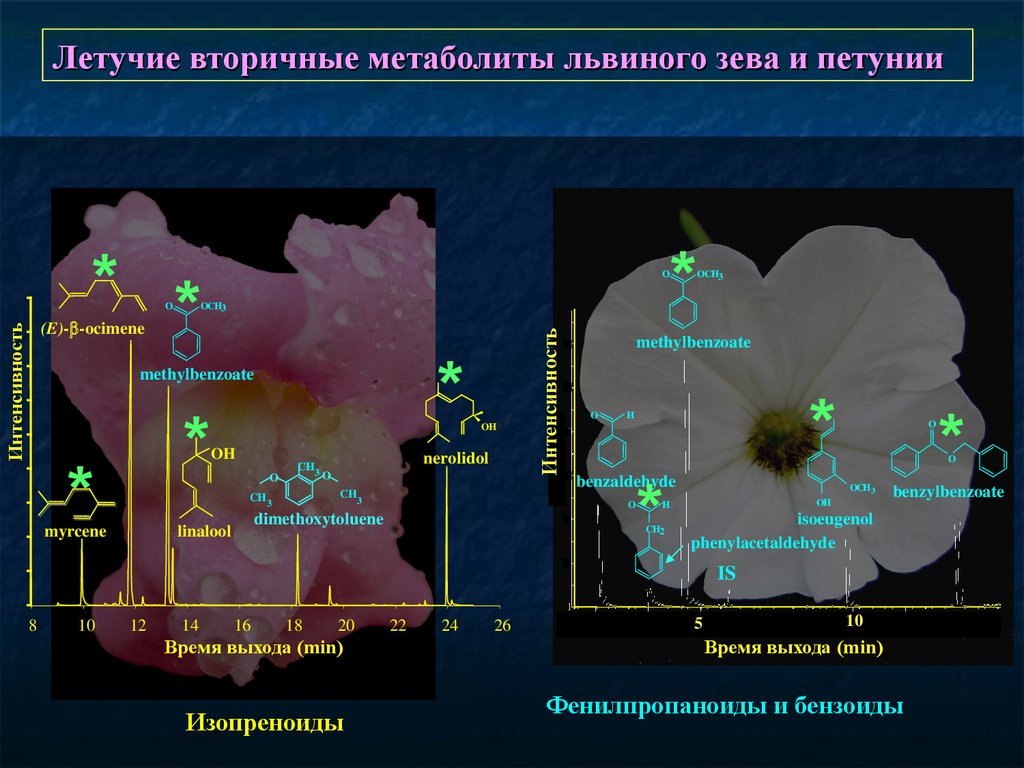
Летучие вторичные метаболиты львиного зева и петунии* *
OCH3
Интенсивность
(E)- -ocimene
*
methylbenzoate
*
*
OH
O
CH3
nerolidol
O
CH3
CH3
myrcene
OH
*
OCH3
methylbenzoate
O
*
H
benzaldehyde
O
dimethoxytoluene
linalool
Интенсивность
O
O
*
H
CH2
O
O
OCH 3
OH
benzylbenzoate
isoeugenol
phenylacetaldehyde
IS
8
10
12
14
16
18
20
Время выхода (min)
Изопреноиды
22
24
26
5
*
10
Время выхода (min)
Фенилпропаноиды и бензоиды
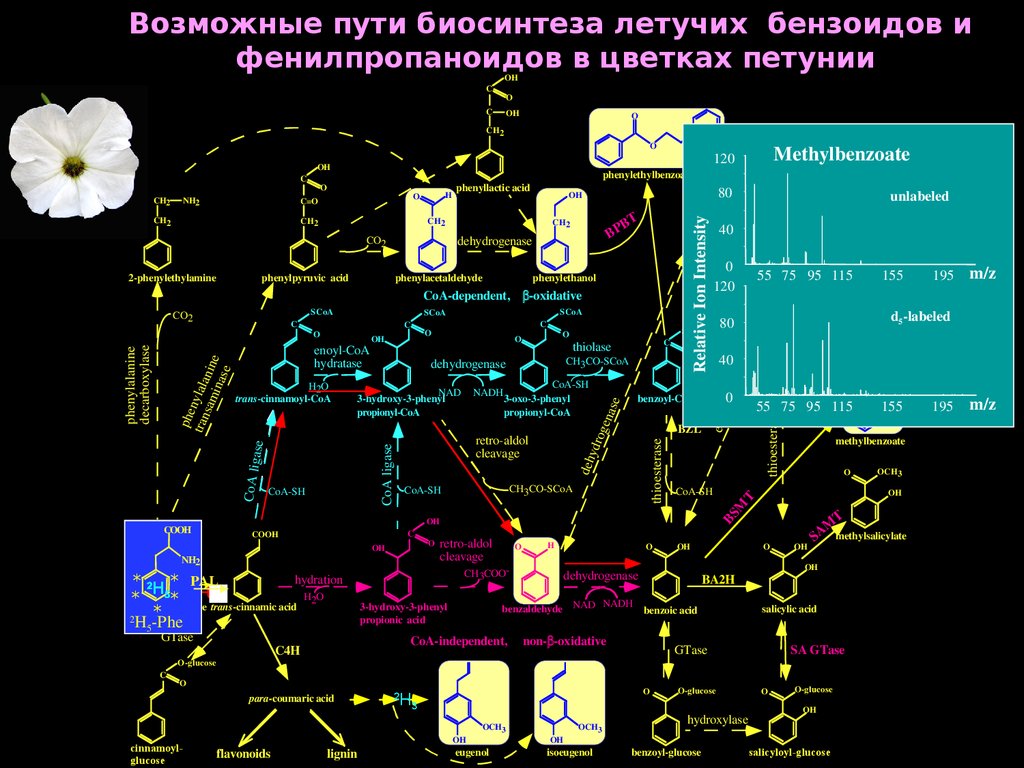
65.
Возможные пути биосинтеза летучих бензоидов ифенилпропаноидов в цветках петунии
OH
C
O
C
OH
O
CH2
O
OH
CH2
phenylpyruvic acid
B
BP
CH2
dehydrogenase
CO2
2-phenylethylamine
80OH
OH
phenylacetaldehyde
T
phenylethanol
O
O
CoA ligase
C
OH
hydration
* 2 *PAL
H5 PAL
H2O
*L-phenylalanine
*
trans-cinnamic acid
*
2
H5-Phe
GTase
retro-aldol
cleavage
O
O
CoA-SH
CoA-independent,
O
H3
2
lignin
OCH3
eugenol
OH
OCH3
isoeugenol
O-glucose
55 75 95 115
155
methylbenzoate
O
hydroxylase
benzoyl-glucose
OCH3
OH
OH
T
M
A
methylsalicylate
S
OH
salicylic acid
SA GTase
O
m/z
O
OH
salicyloyl-CoA
GTase
195
d5-labeled
OCH3
BA2H
non- -oxidative
155
O
O
benzaldehyde NAD NADH benzoic acid
3-hydroxy-3-phenyl
propionic acid
OH
flavonoids
OH
dehydrogenase
O
para-coumaric acid
C
0
BZL
H
CH3COO-
C4H
O-glucose
O
SCoA
O
benzoyl-CoA
CH3CO-SCoA
CoA-SH
benzylbenzoate
80
40
hydroxylase
thioesterase
CoA-SH
3-oxo-3-phenyl
propionyl-CoA
retro-aldol
cleavage
COOH
NH2
NH
2
cinnamoylglucose
C
thiolase
e
NADH
O
0BPBT
55 75 95 115
O
120
SCoA
CH3CO-SCoA
dehydrogenase
NAD
3-hydroxy-3-phenyl
propionyl-CoA
CoA-SH
O
OH
COOH
C
OH
C
oge
na s
enoyl-CoA
hydratase
CoA lig
ase
phe
tran nylala
sam nin
in a e
se
phenylalanine
decarboxylase
O
H2O
trans-cinnamoyl-CoA
SCoA
SCoA
C
ydr
C
deh
CO2
..
40
benzylalcohol
CoA-dependent, -oxidative
SCoA
unlabeled
thioesterase
CH2
phenyllactic acid
ase
CH2
H
O
T
O
C=O
BS
M
NH2
Relative Ion Intensity
CH2
Methylbenzoate
120
phenylethylbenzoate
este
r
C
O-glucose
OH
salicyloyl-glucose
195
m/z
66.
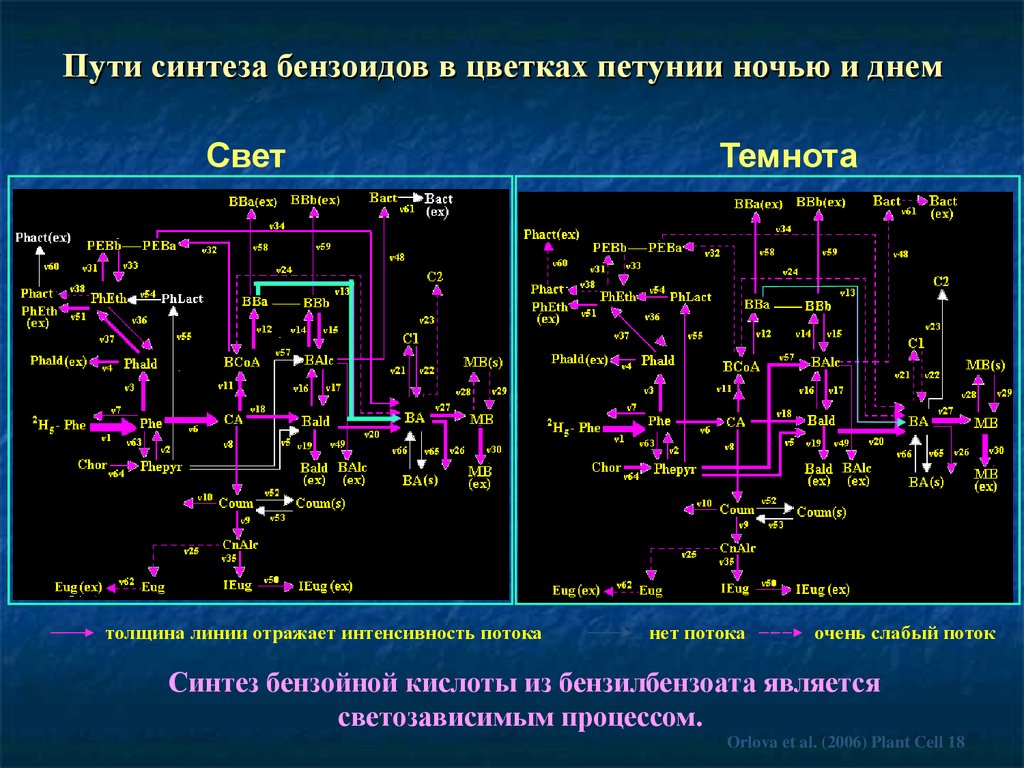
Пути синтеза бензоидов в цветках петунии ночью и днемСвет
толщина линии отражает интенсивность потока
Темнота
нет потока
очень слабый поток
Синтез бензойной кислоты из бензилбензоата является
светозависимым процессом.
Orlova et al. (2006) Plant Cell 18
67.
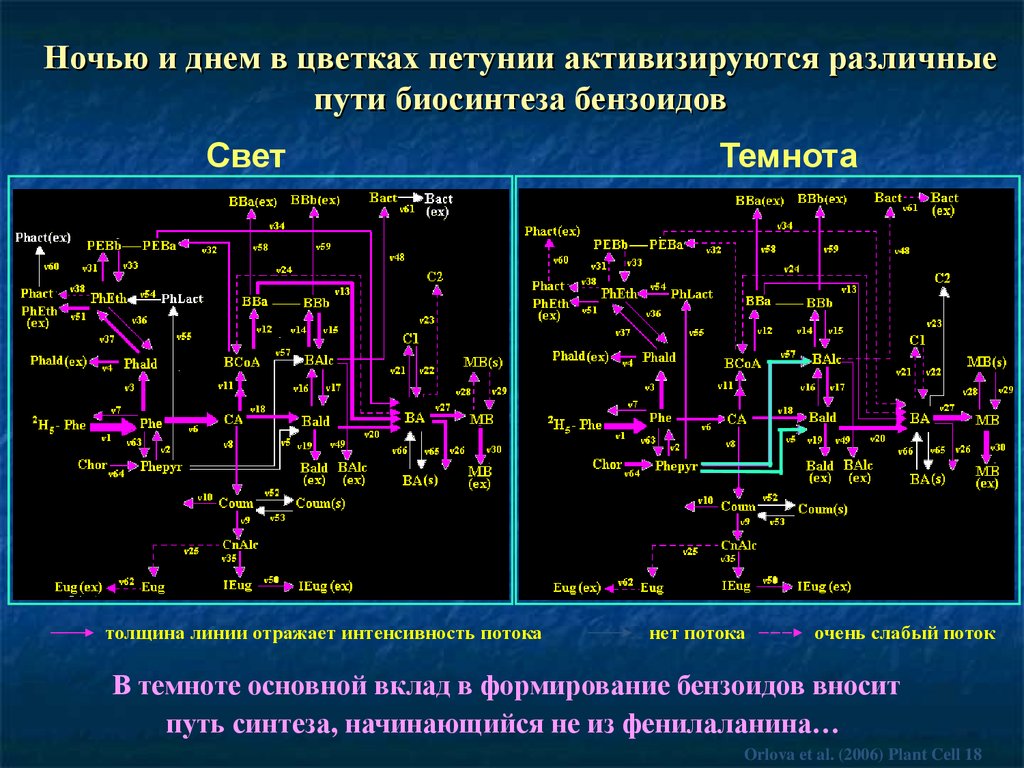
Ночью и днем в цветках петунии активизируются различныепути биосинтеза бензоидов
Свет
толщина линии отражает интенсивность потока
Темнота
нет потока
очень слабый поток
В темноте основной вклад в формирование бензоидов вносит
путь синтеза, начинающийся не из фенилаланина…
Orlova et al. (2006) Plant Cell 18
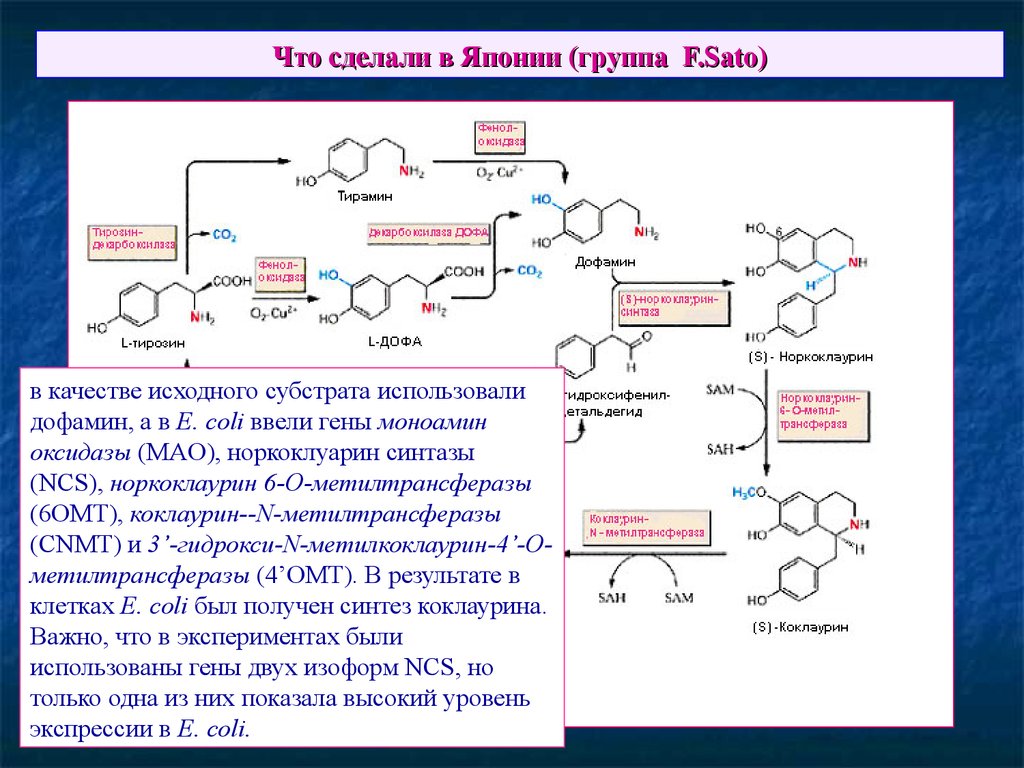
68. Что сделали в Японии (группа F.Sato)
в качестве исходного субстрата использовалидофамин, а в E. coli ввели гены моноамин
оксидазы (MAO), норкоклуарин синтазы
(NCS), норкоклаурин 6-O-метилтрансферазы
(6OMT), коклаурин--N-метилтрансферазы
(CNMT) и 3’-гидрокси-N-метилкоклаурин-4’-Oметилтрансферазы (4’OMT). В результате в
клетках E. coli был получен синтез коклаурина.
Важно, что в экспериментах были
использованы гены двух изоформ NCS, но
только одна из них показала высокий уровень
экспрессии в E. coli.
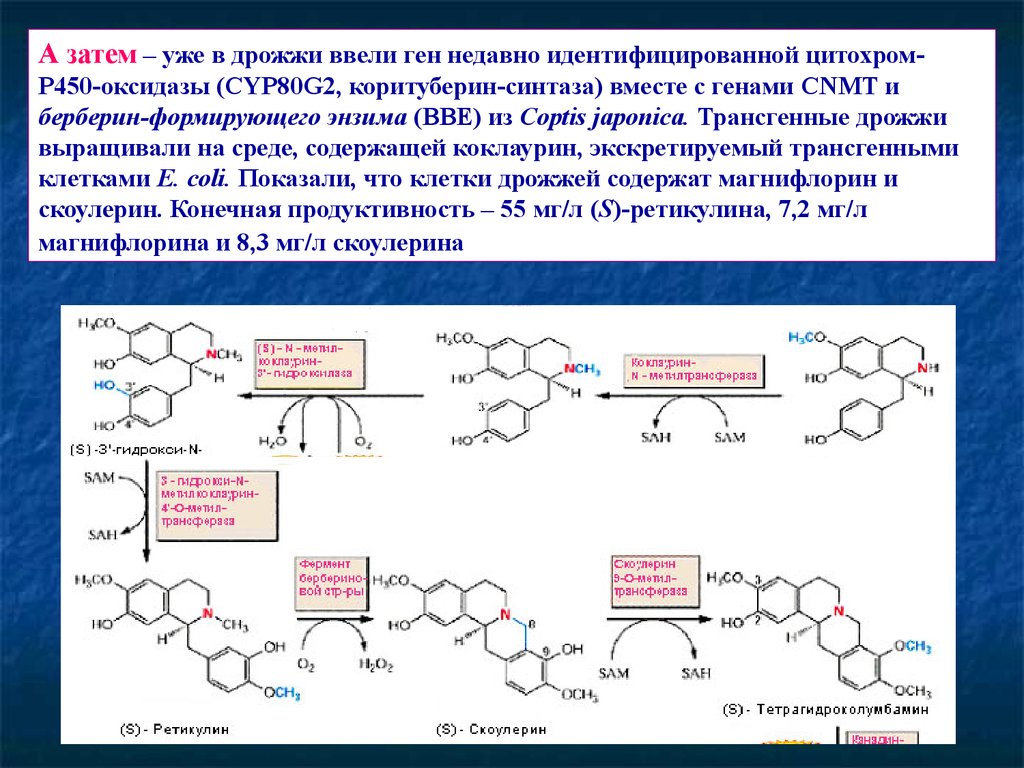
69.
А затем – уже в дрожжи ввели ген недавно идентифицированной цитохромР450-оксидазы (CYP80G2, коритуберин-синтаза) вместе с генами CNMT иберберин-формирующего энзима (BBE) из Coptis japonica. Трансгенные дрожжи
выращивали на среде, содержащей коклаурин, экскретируемый трансгенными
клетками E. coli. Показали, что клетки дрожжей содержат магнифлорин и
скоулерин. Конечная продуктивность – 55 мг/л (S)-ретикулина, 7,2 мг/л
магнифлорина и 8,3 мг/л скоулерина.
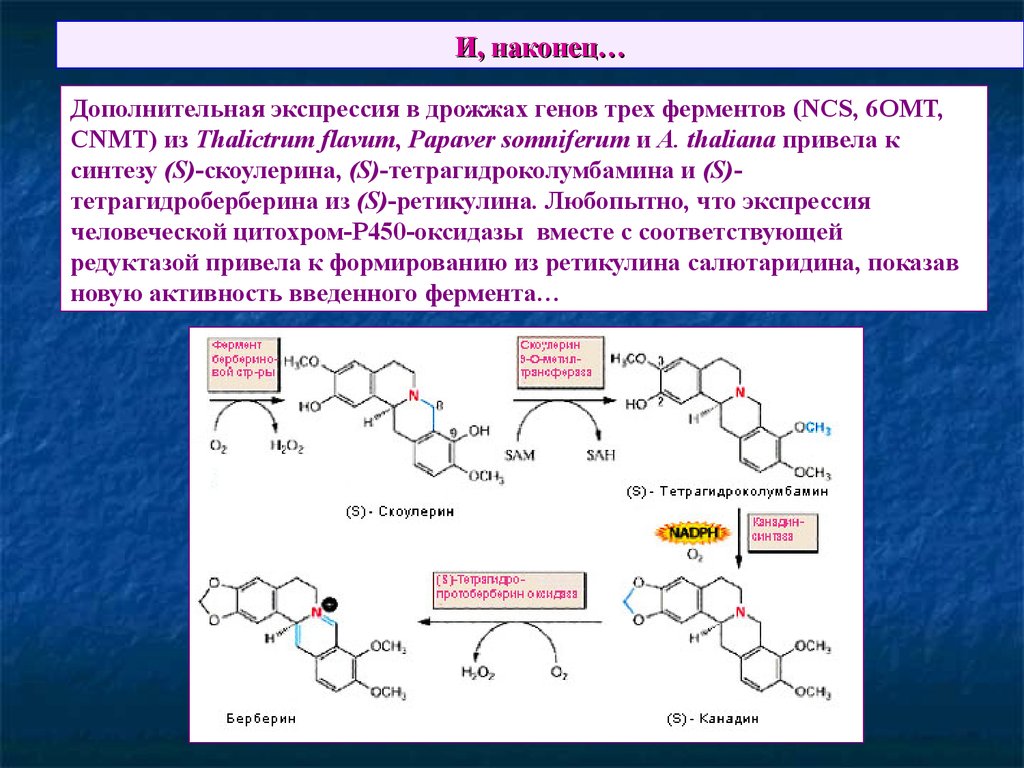
70. И, наконец…
Дополнительная экспрессия в дрожжах генов трех ферментов (NCS, 6OMT,CNMT) из Thalictrum flavum, Papaver somniferum и A. thaliana привела к
синтезу (S)-скоулерина, (S)-тетрагидроколумбамина и (S)тетрагидроберберина из (S)-ретикулина. Любопытно, что экспрессия
человеческой цитохром-Р450-оксидазы вместе с соответствующей
редуктазой привела к формированию из ретикулина салютаридина, показав
новую активность введенного фермента…
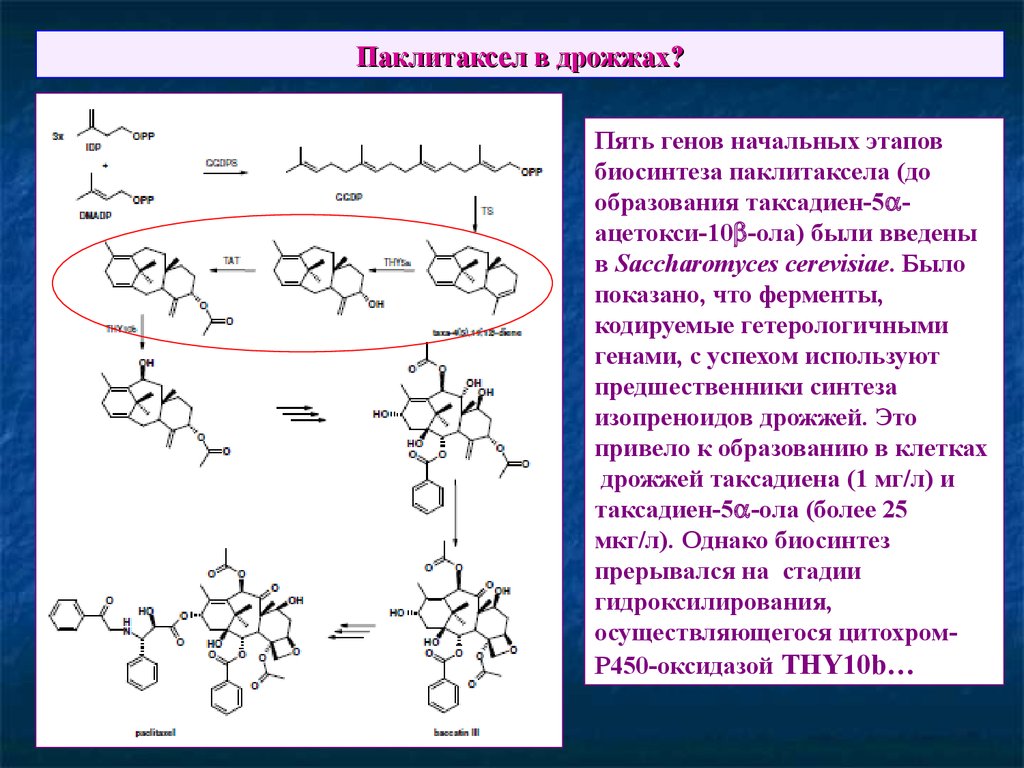
71. Паклитаксел в дрожжах?
Пять генов начальных этаповбиосинтеза паклитаксела (до
образования таксадиен-5 ацетокси-10 -ола) были введены
в Saccharomyces cerevisiae. Было
показано, что ферменты,
кодируемые гетерологичными
генами, с успехом используют
предшественники синтеза
изопреноидов дрожжей. Это
привело к образованию в клетках
дрожжей таксадиена (1 мг/л) и
таксадиен-5 -ола (более 25
мкг/л). Однако биосинтез
прерывался на стадии
гидроксилирования,
осуществляющегося цитохромР450-оксидазой THY10b…
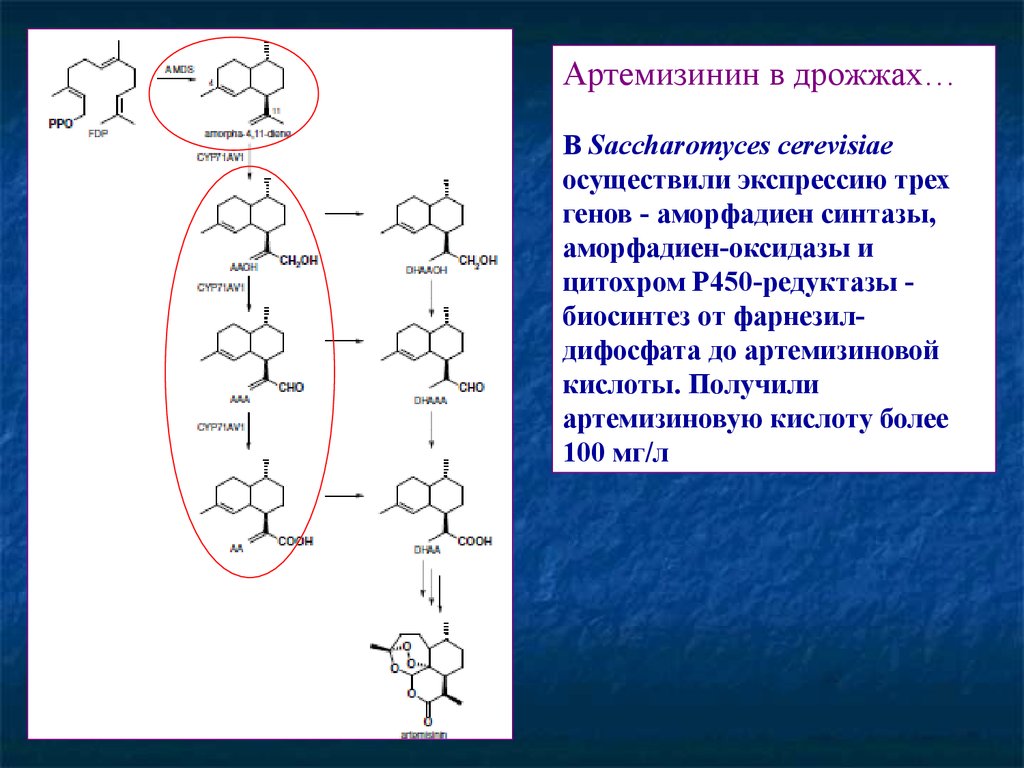
72.
Артемизинин в дрожжах…В Saccharomyces cerevisiae
осуществили экспрессию трех
генов - аморфадиен синтазы,
аморфадиен-оксидазы и
цитохром Р450-редуктазы биосинтез от фарнезилдифосфата до артемизиновой
кислоты. Получили
артемизиновую кислоту более
100 мг/л.
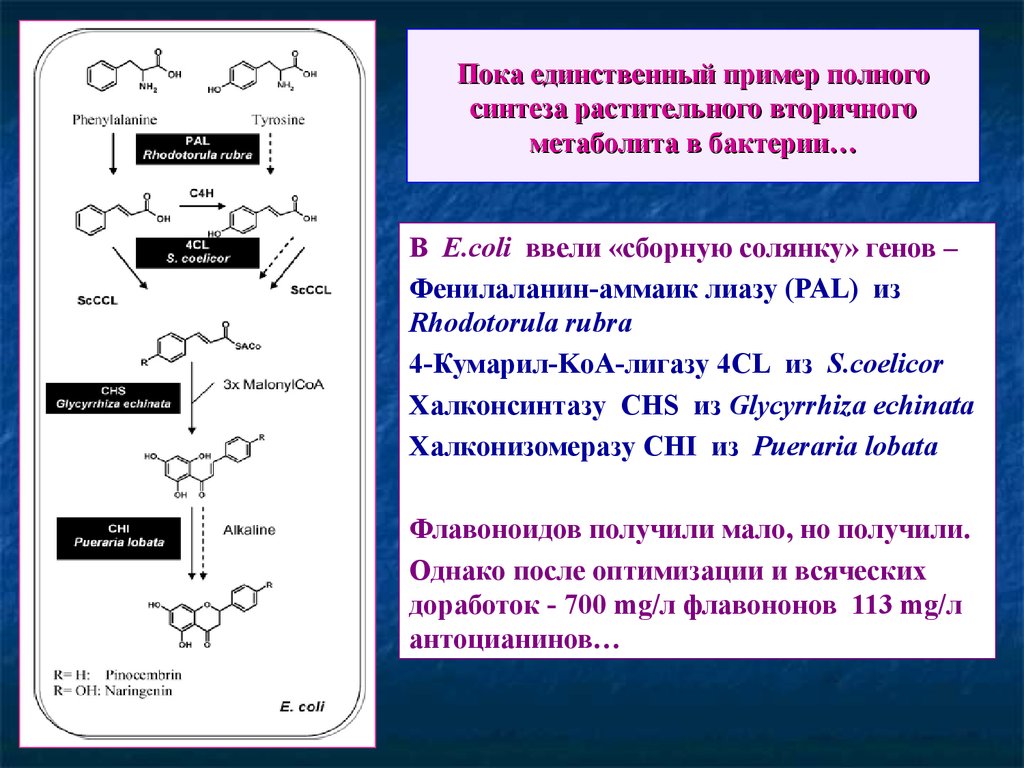
73. Пока единственный пример полного синтеза растительного вторичного метаболита в бактерии…
В E.coli ввели «сборную солянку» генов –Фенилаланин-аммаик лиазу (PAL) из
Rhodotorula rubra
4-Кумарил-KоА-лигазу 4CL из S.coelicor
Халконсинтазу CHS из Glycyrrhiza echinata
Халконизомеразу CHI из Pueraria lobata
Флавоноидов получили мало, но получили.
Однако после оптимизации и всяческих
доработок - 700 mg/л флавононов 113 mg/л
антоцианинов…
74. Зачем нужен вторичный метаболизм растению?
Основные точки зрения:Совсем не нужен (вторичные метаболиты – «отходы
производства»)
Вторичные метаболиты – запасные соединения
Вторичные метаболиты – защитные соединения
Вторичные метаболиты – «биохимические инструменты»
взаимодействия растения с окружающей средой
Но как это доказать ?
75. Стратегия защиты растения от патогенов. Три круга обороны.
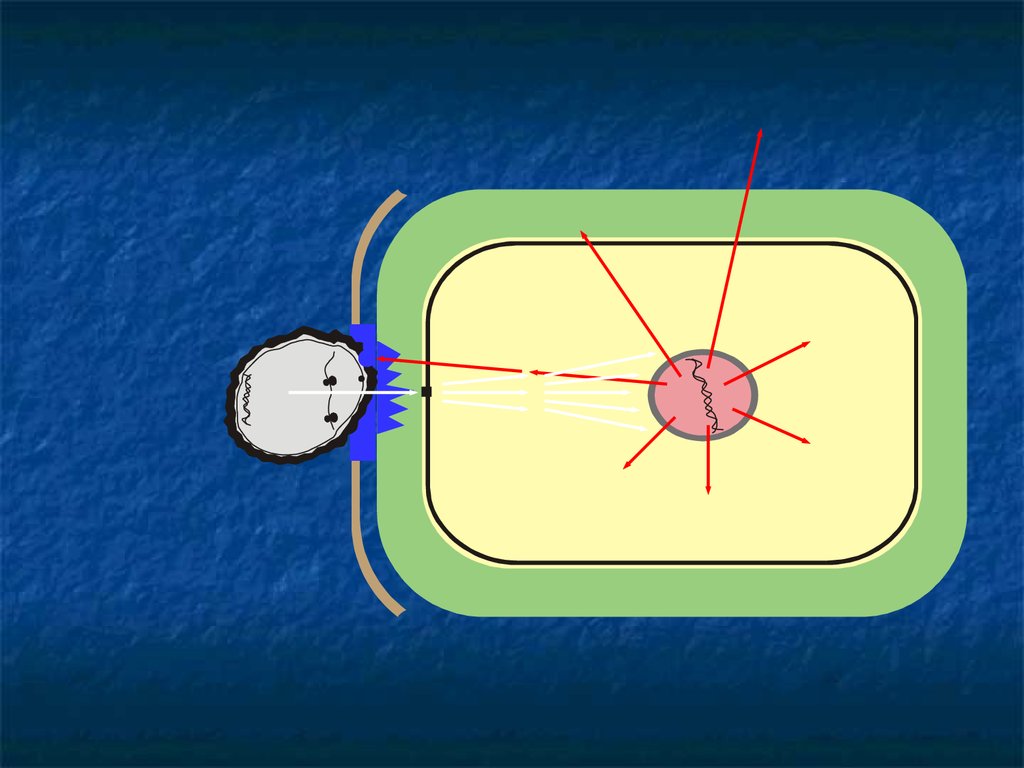
Проще всего доказать защитную роль вторичных метаболитов,участвующих в работе третьего круга обороны: фитоалексины
76.
77.
летучиетерпеноиды
системный
ответ
К
КС
ФА
вакуоль
ПАТОГЕН
СК
системин
РИБ
дефензины
мРНК
ферменты фенилпропаноидного
метаболизма
ферменты
терпеноидного
метаболизма
нуклеазы
хитиназа,
-1,3 глюаназа
каллоза
ингибиторы
гликаназ, протеиназ
каллозосинтаза
пролилгидроксилаза
апоптоз
цистеиновые
протеиназы
пероксидазы
ОПБ
укрепление КС
К
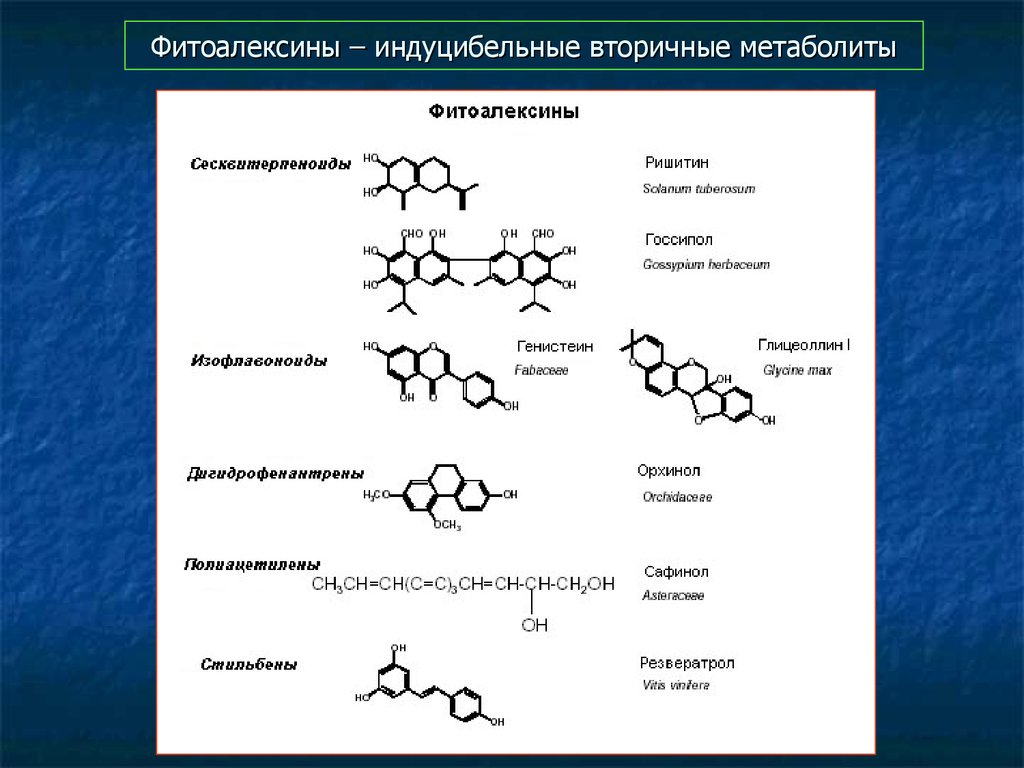
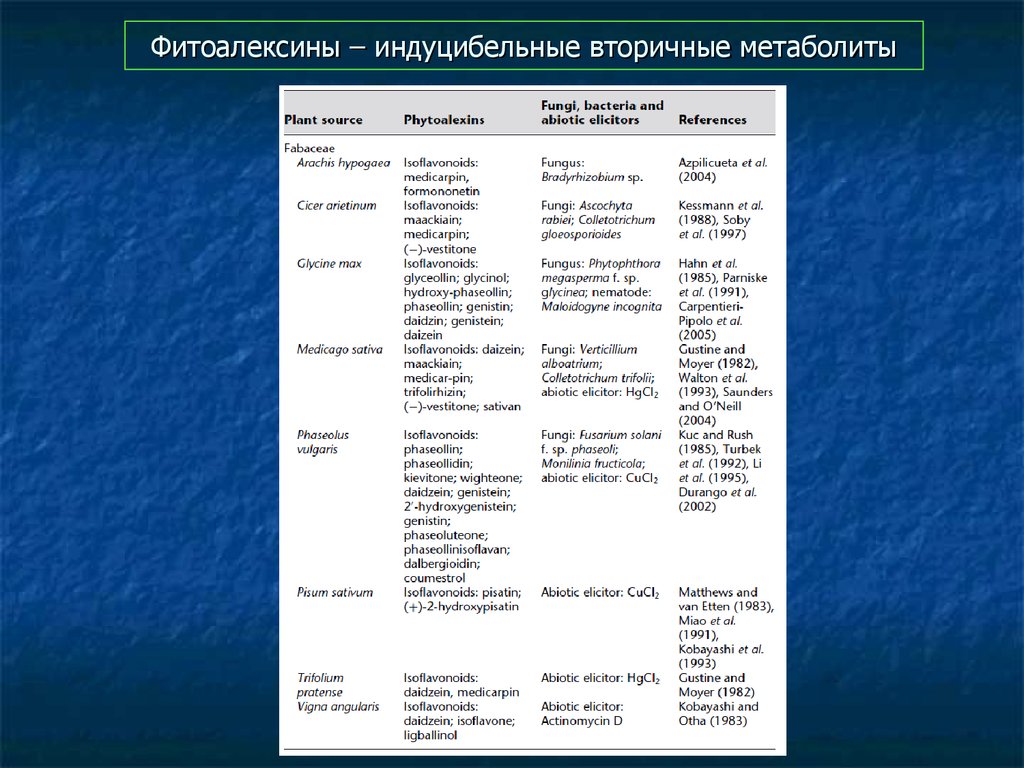
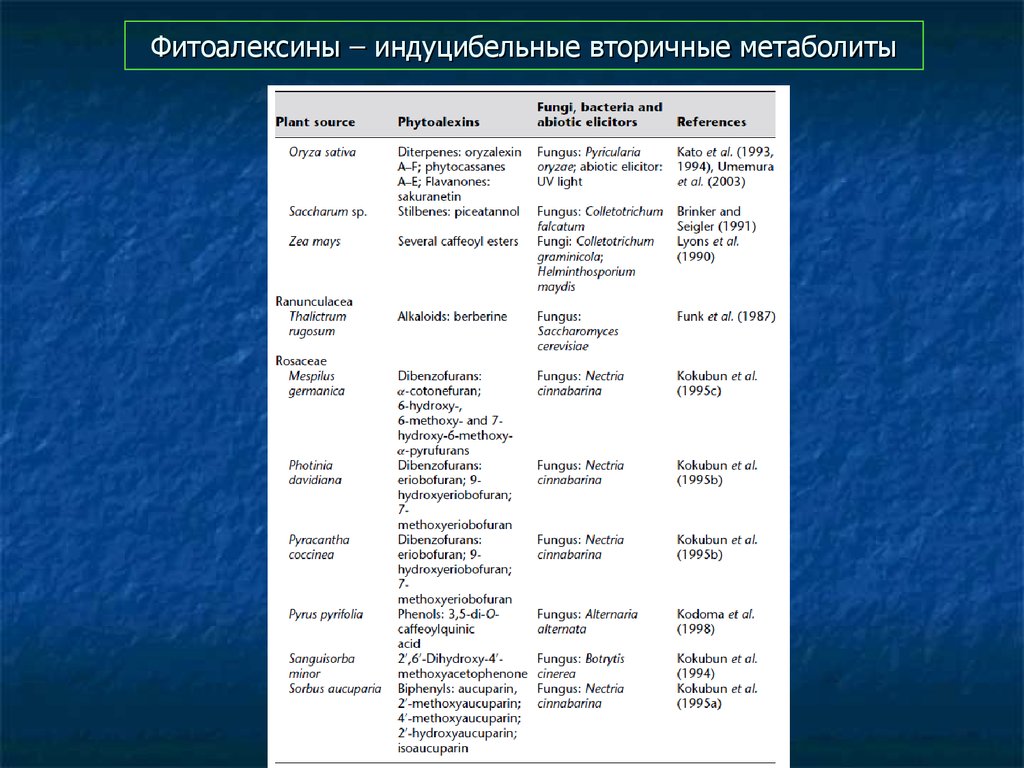
78. Фитоалексины – индуцибельные вторичные метаболиты
79. Фитоалексины – индуцибельные вторичные метаболиты
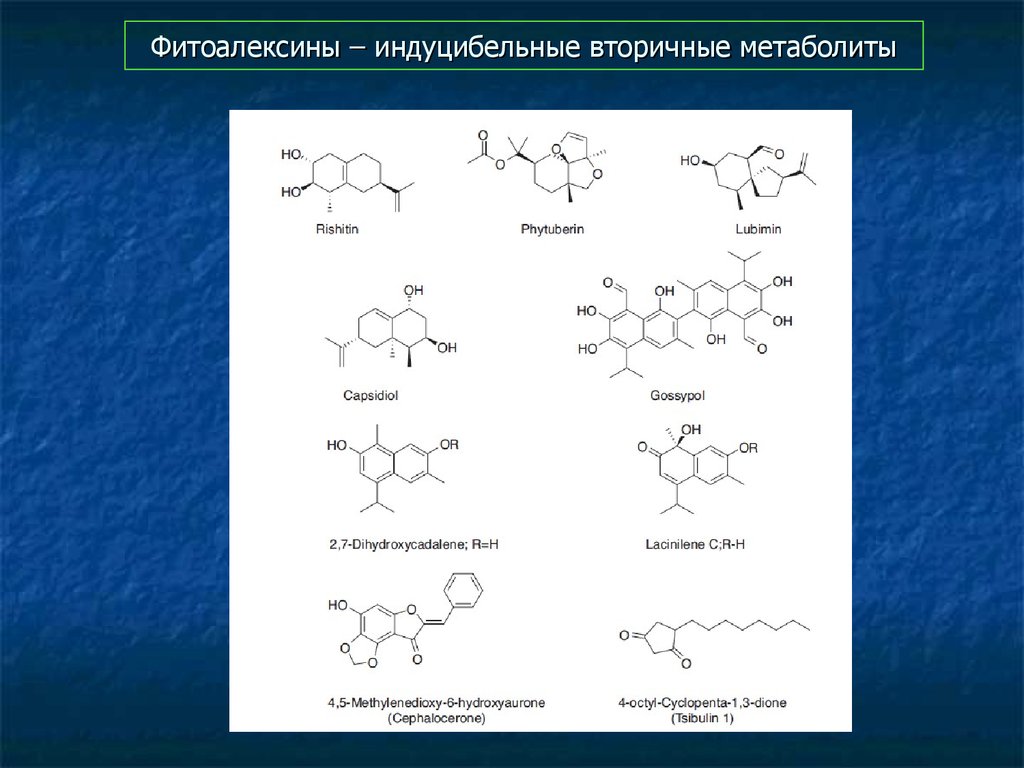
80. Фитоалексины – индуцибельные вторичные метаболиты
81. Фитоалексины – индуцибельные вторичные метаболиты
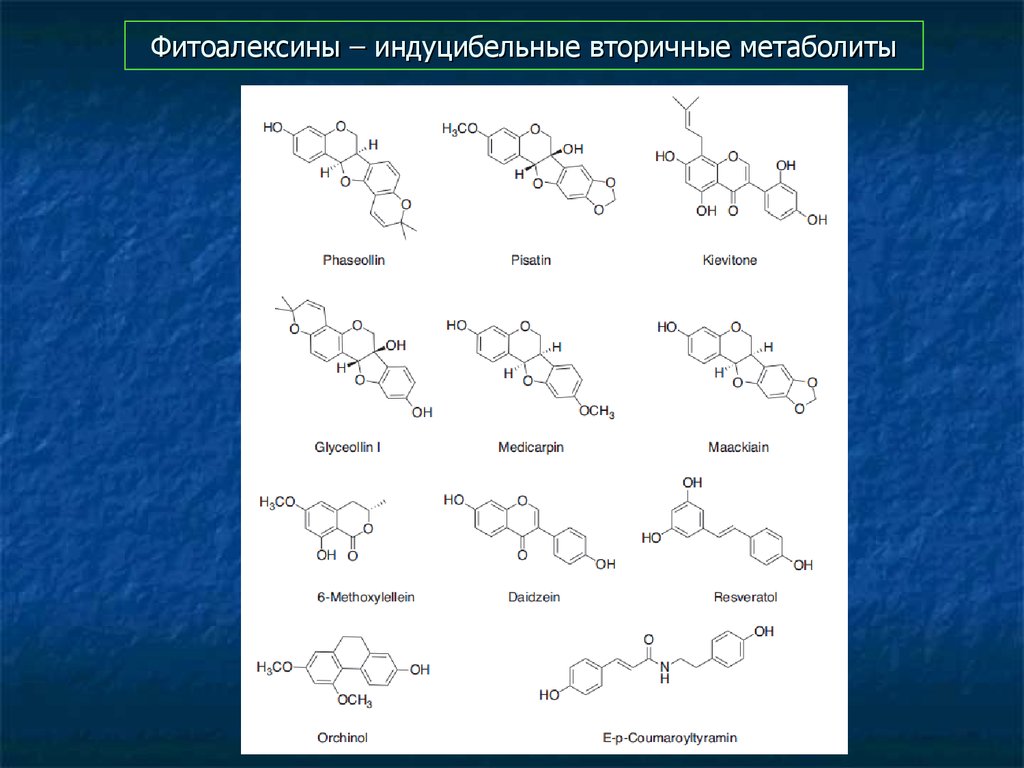
82. Фитоалексины – индуцибельные вторичные метаболиты
83. Фитоалексины – индуцибельные вторичные метаболиты
84. Фитоалексины – индуцибельные вторичные метаболиты
85. Фитоалексины – индуцибельные вторичные метаболиты
86. Фитоалексины – индуцибельные вторичные метаболиты
87. Фитоалексины – индуцибельные вторичные метаболиты
88. Фитоалексины – индуцибельные вторичные метаболиты
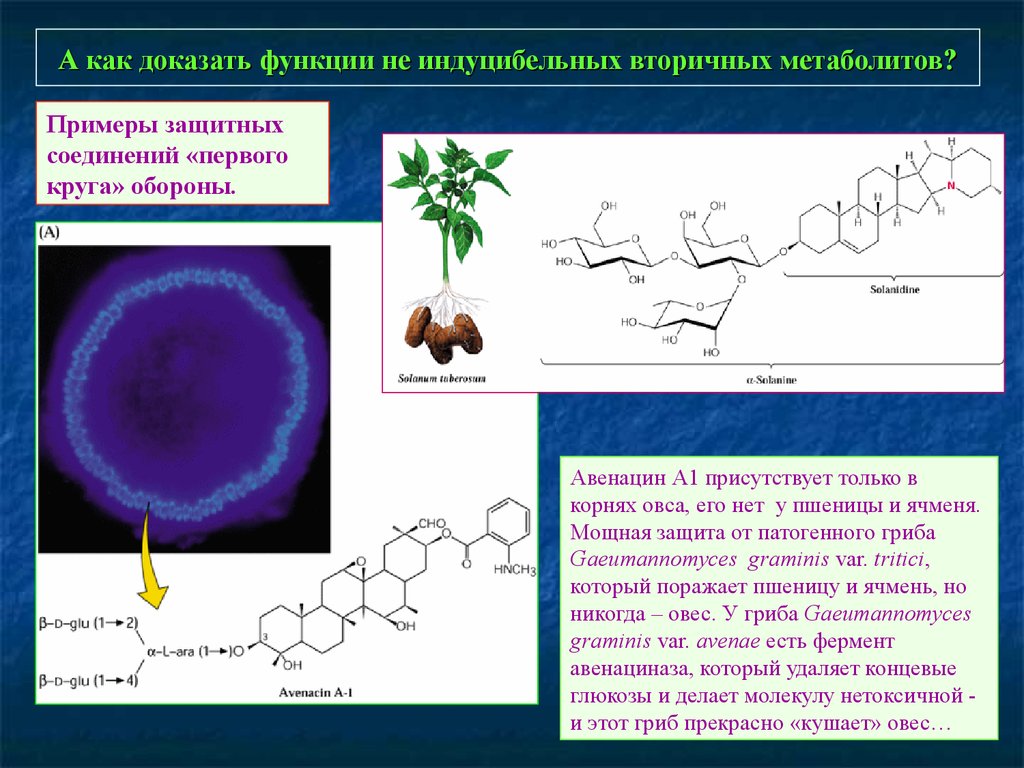
89. А как доказать функции не индуцибельных вторичных метаболитов?
Примеры защитныхсоединений «первого
круга» обороны.
Авенацин А1 присутствует только в
корнях овса, его нет у пшеницы и ячменя.
Мощная защита от патогенного гриба
Gaeumannomyces graminis var. tritici,
который поражает пшеницу и ячмень, но
никогда – овес. У гриба Gaeumannomyces
graminis var. avenae есть фермент
авенациназа, который удаляет концевые
глюкозы и делает молекулу нетоксичной и этот гриб прекрасно «кушает» овес…
90.
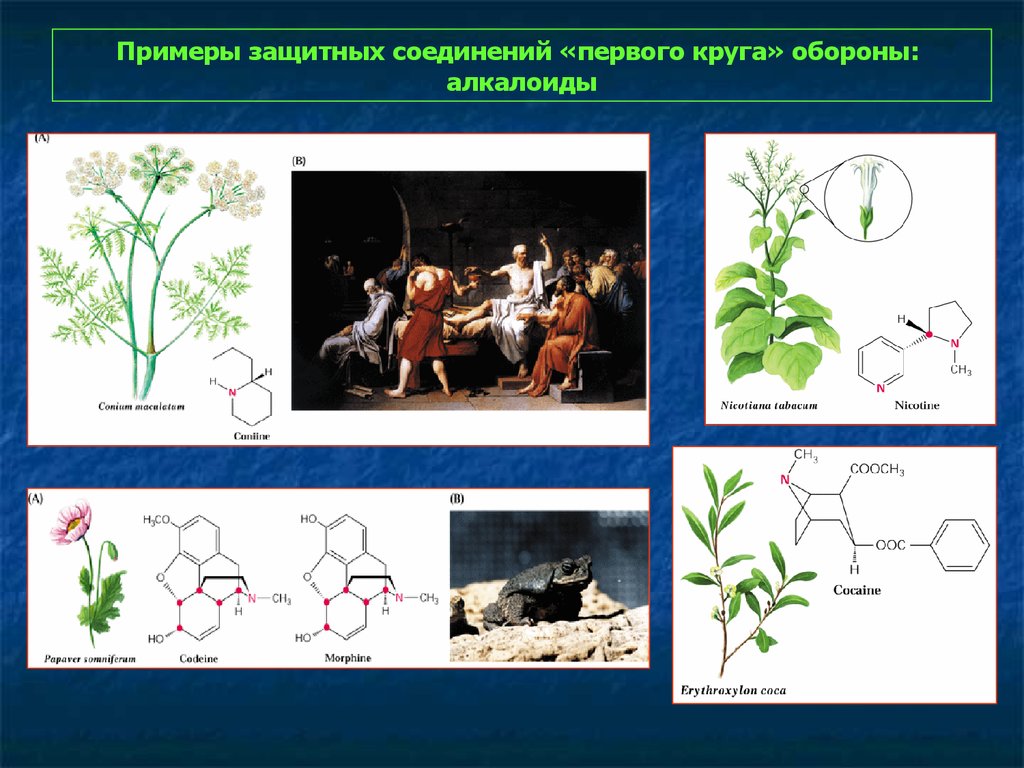
Примеры защитных соединений «первого круга» обороны:алкалоиды
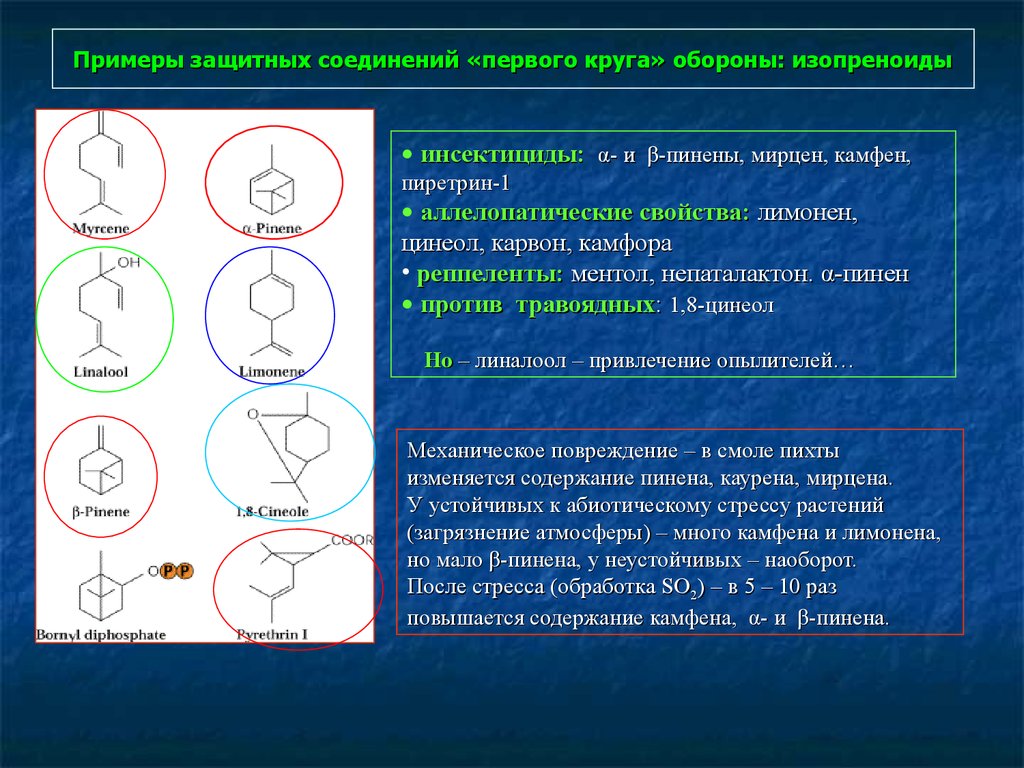
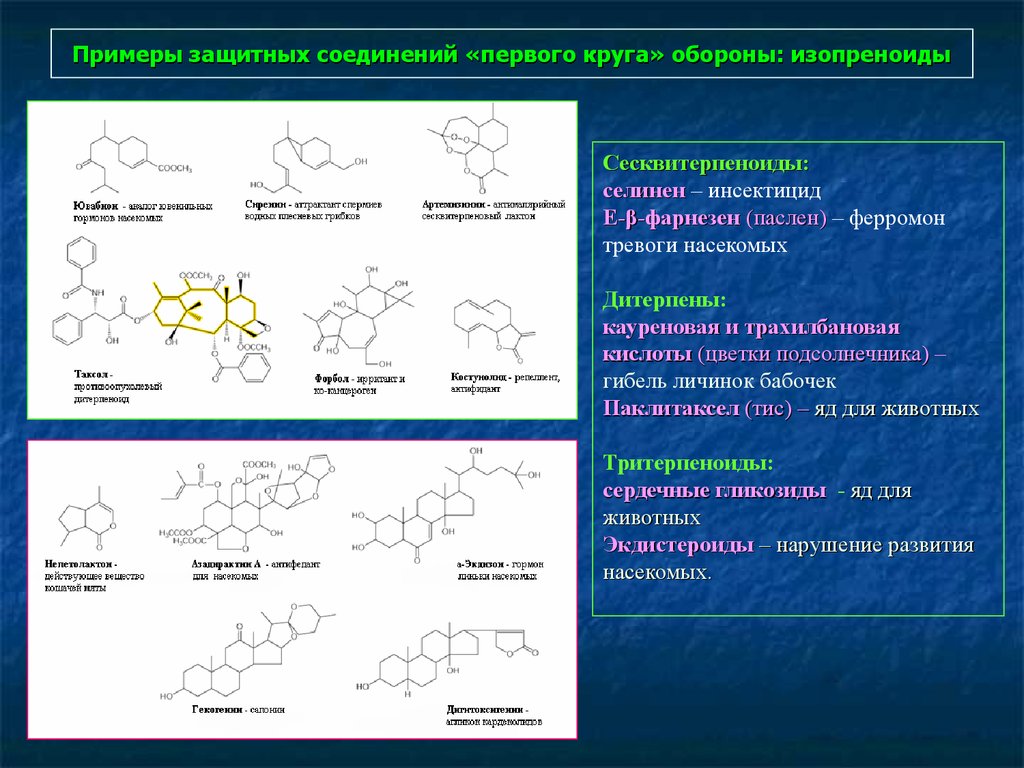
91. Примеры защитных соединений «первого круга» обороны: изопреноиды
• инсектициды: α- и β-пинены, мирцен, камфен,пиретрин-1
• аллелопатические свойства: лимонен,
цинеол, карвон, камфора
• реппеленты: ментол, непаталактон. α-пинен
• против травоядных: 1,8-цинеол
Но – линалоол – привлечение опылителей…
Механическое повреждение – в смоле пихты
изменяется содержание пинена, каурена, мирцена.
У устойчивых к абиотическому стрессу растений
(загрязнение атмосферы) – много камфена и лимонена,
но мало β-пинена, у неустойчивых – наоборот.
После стресса (обработка SO2) – в 5 – 10 раз
повышается содержание камфена, α- и β-пинена.
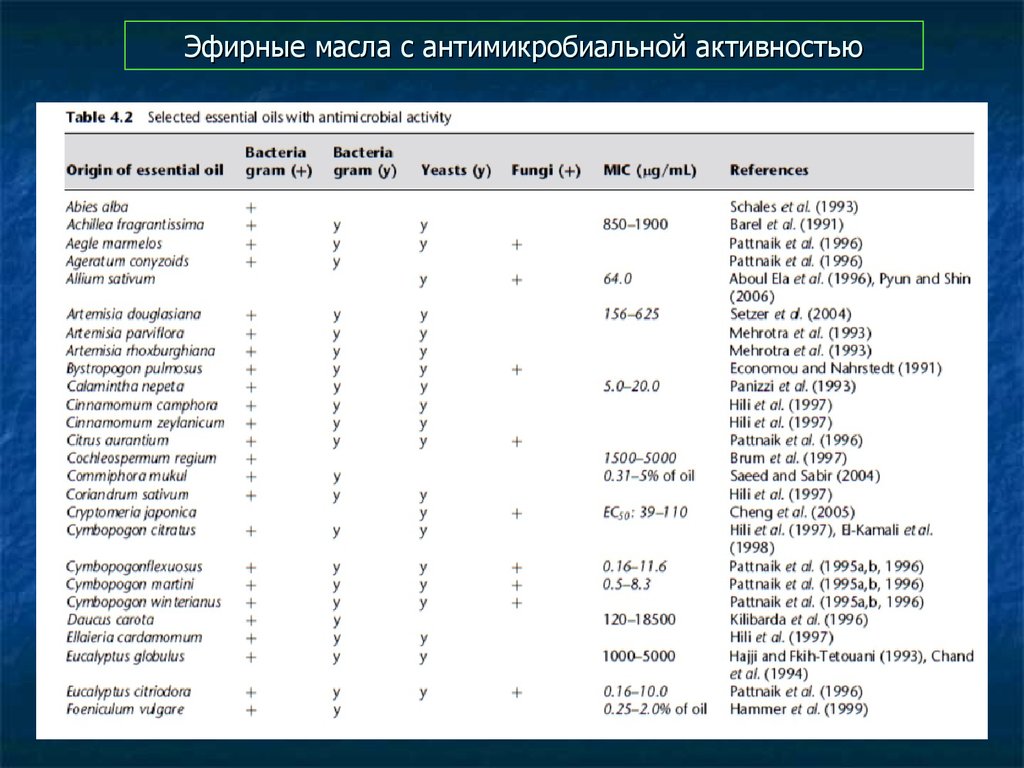
92. Эфирные масла с антимикробиальной активностью
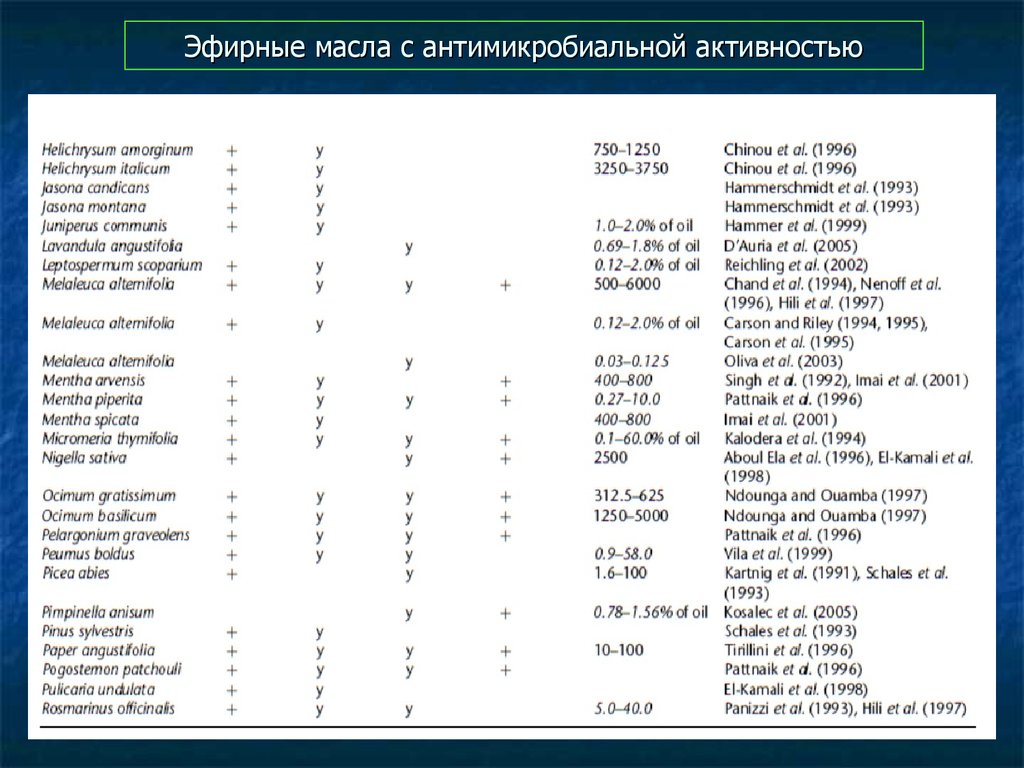
93. Эфирные масла с антимикробиальной активностью
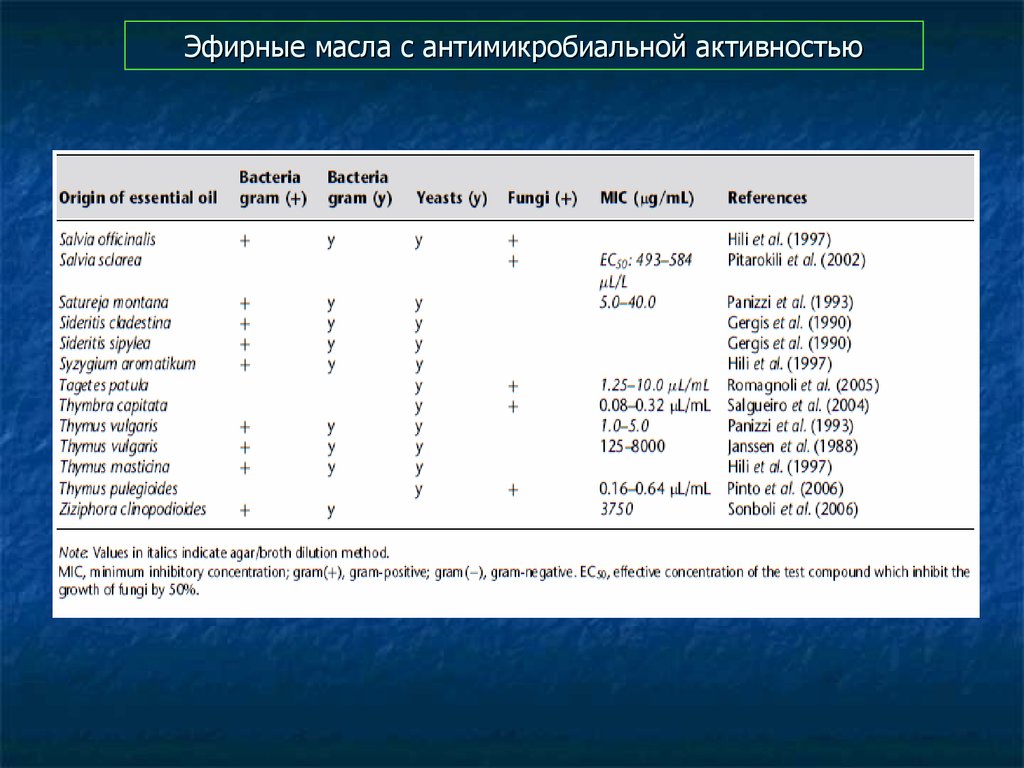
94. Эфирные масла с антимикробиальной активностью
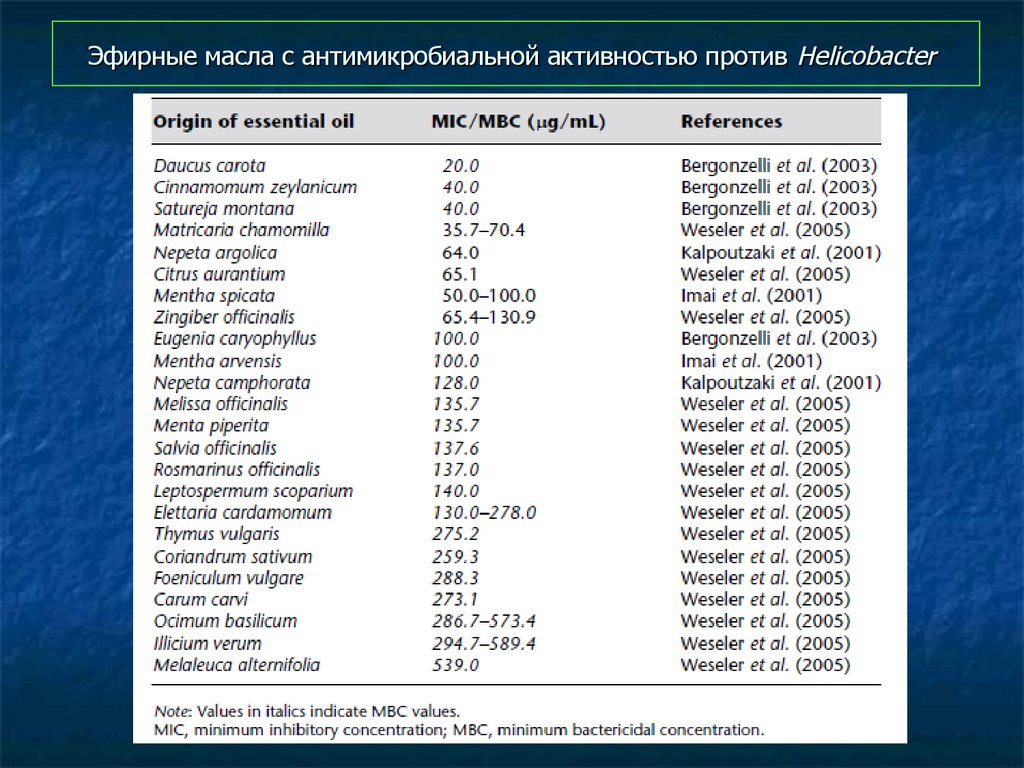
95. Эфирные масла с антимикробиальной активностью против Helicobacter
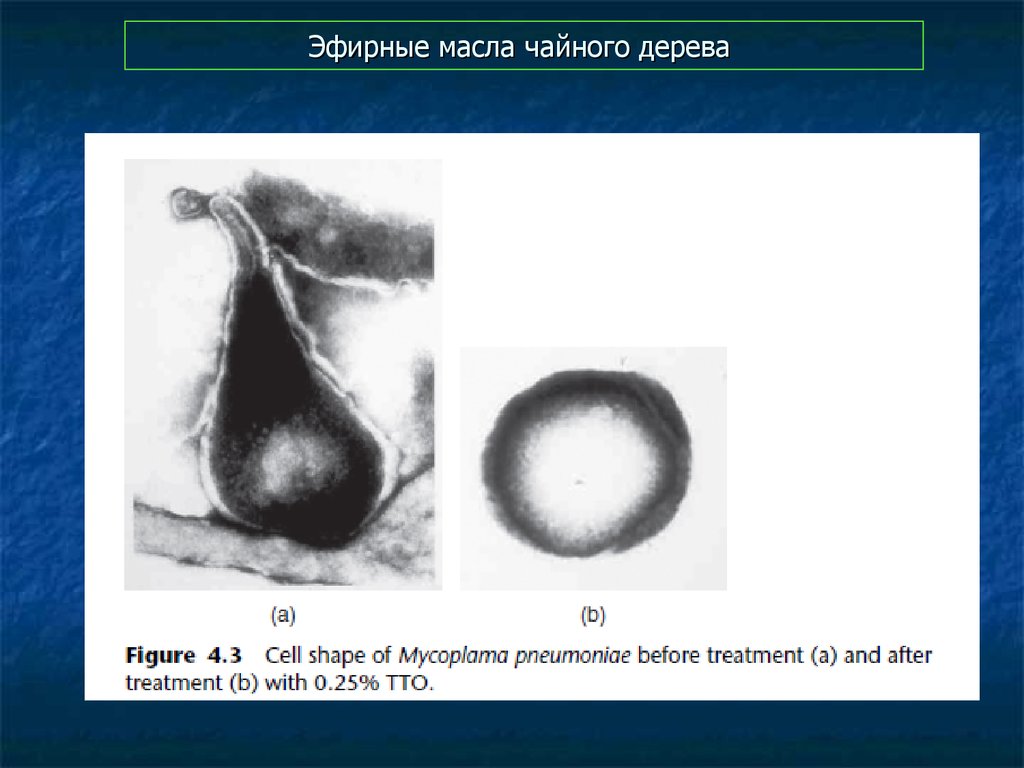
96. Эфирные масла чайного дерева
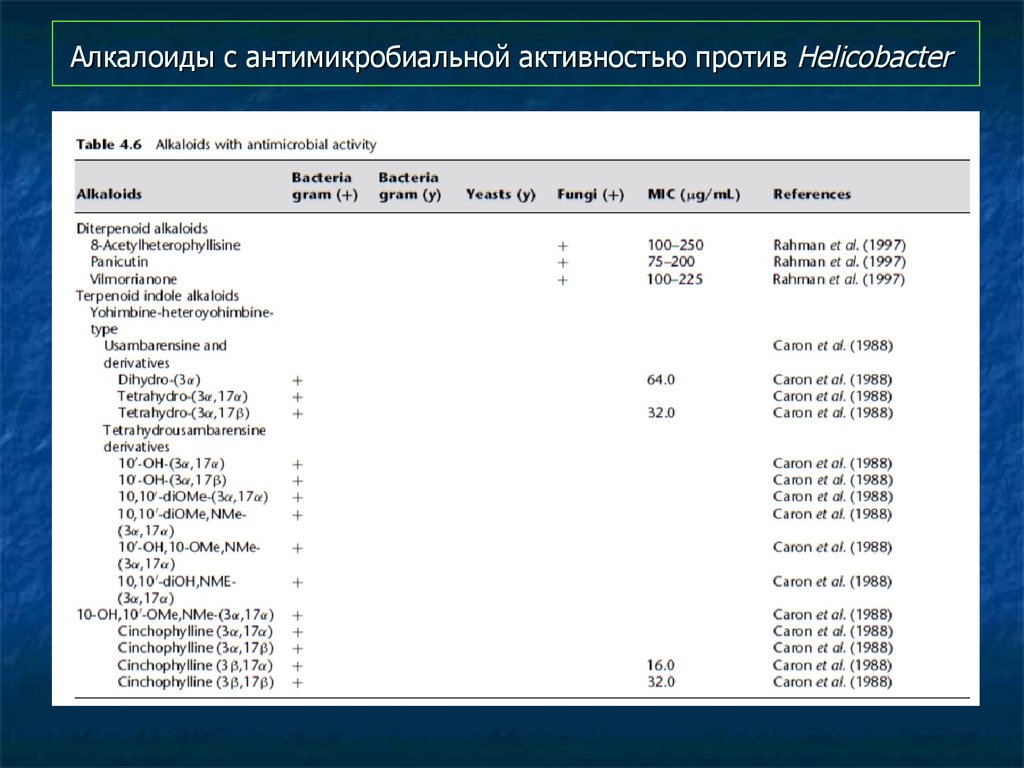
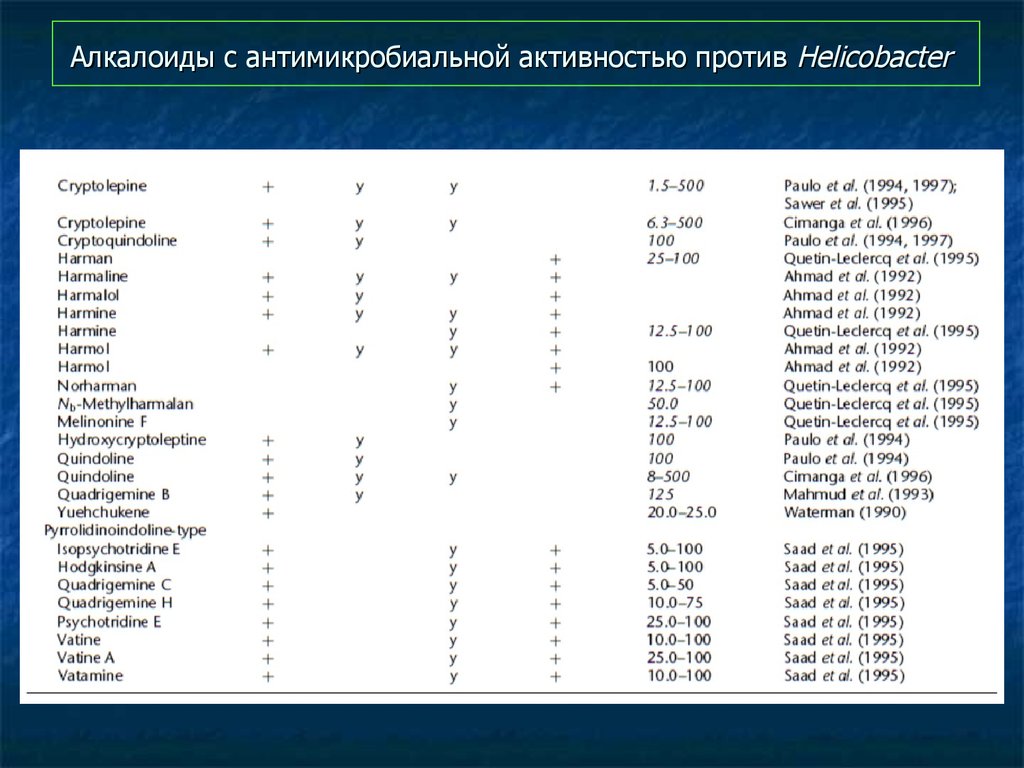
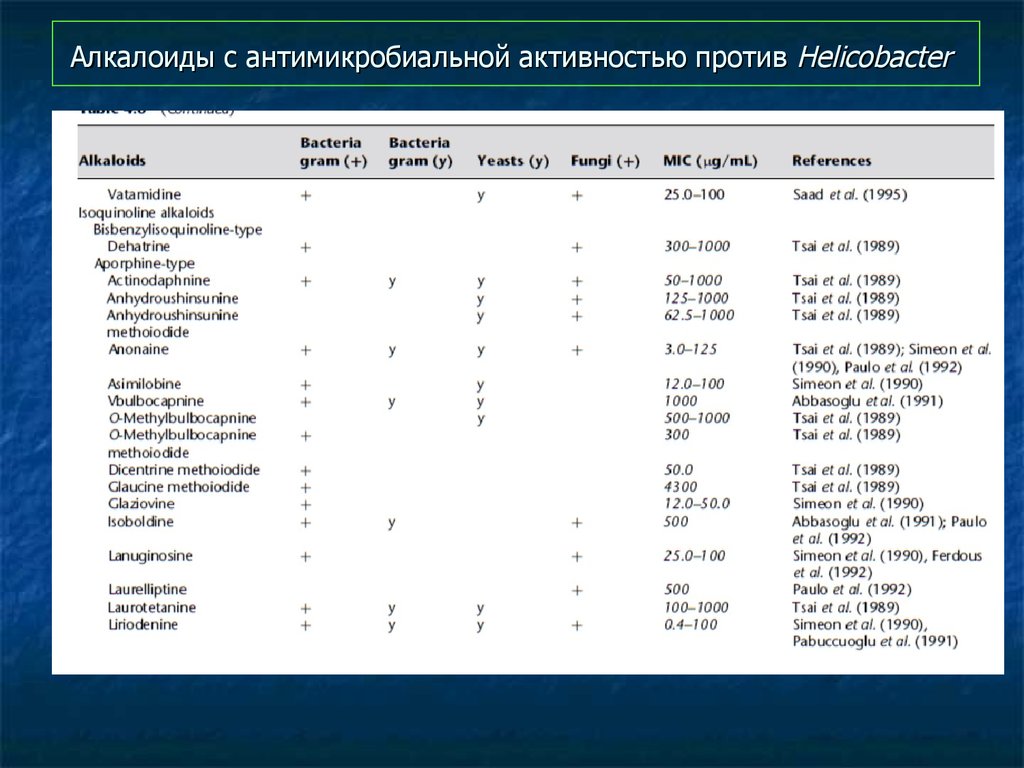
97. Алкалоиды с антимикробиальной активностью против Helicobacter
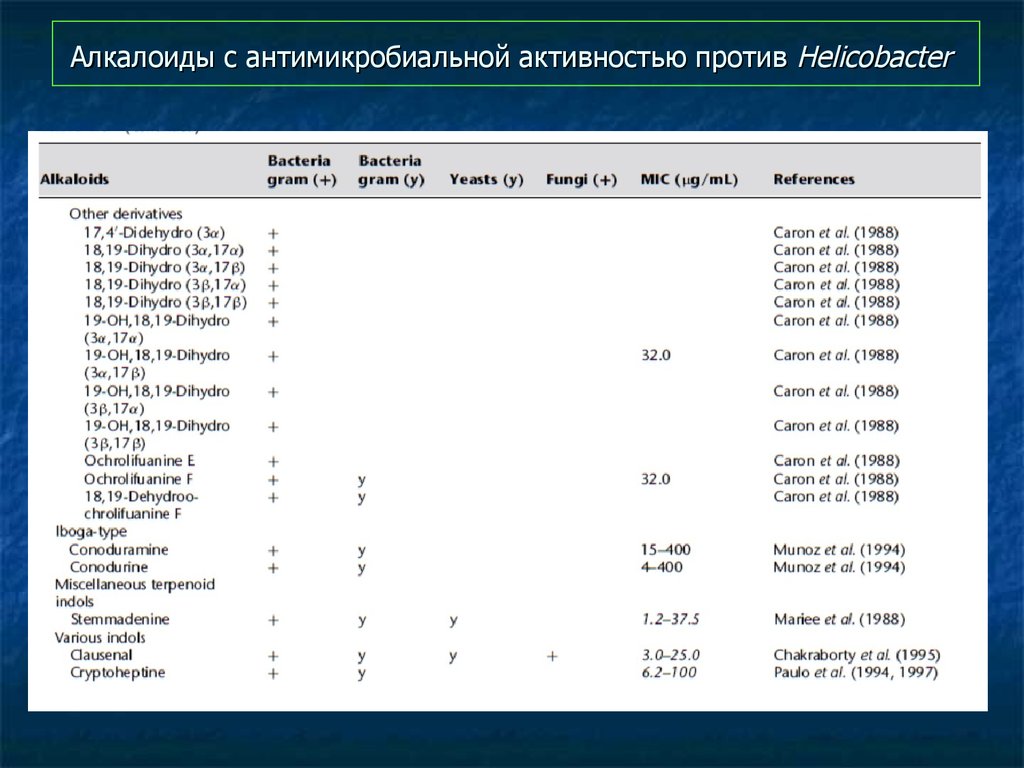
98. Алкалоиды с антимикробиальной активностью против Helicobacter
99. Алкалоиды с антимикробиальной активностью против Helicobacter
100. Алкалоиды с антимикробиальной активностью против Helicobacter
101. Антивирусная активность эфирных масел
Plant sourceViruses IC50 (%; ppm) References
Herpes simplex virus
( HSV; DNA virus)
Aloysia gratissima
HSV-1 65 ppm
Garcia et al. (2003)
Artemisia douglasiana
HSV-1 83 ppm
Garcia et al. (2003)
Citrus limon
HSV-1 0.0015%
Koch (2005)
Eucalyptus globulus
HSV-1 0.009%
Schnitzler et al. (2001)
HSV-2 0.008%
Schnitzler et al. (2001)
Eupatorium patens
HSV-1 125 ppm
Garcia et al. (2003)
Houttuynia cordata
HSV-1 0.0013%
Hayashi et al. (1995)
Hyssopus officinalis
HSV-1 0.0001%
Koch (2005)
HSV-2 0.0006%
Koch (2005)
Illicium verum
HSV-1 0.004%
Koch (2005)
HSV-.2 0.003%
Koch (2005)
Leptospermum
HSV-1 0.0001%
Reichling et al. (2005
scoparium
HSV-2 0.00006%
Reichling et al. (2005
Matricaria
HSV-1 0.00003%
Koch (2005)
recutita
HSV-2 0.00015%
Koch (2005)
Melaleuca alternifolia
HSV-1 0.0009%
Schnitzler et al. (2001)
HSV-2 0.0008%
Schnitzler et al. (2001)
Mentha piperita
HSV-1 0.002%
Schuhmacher et al. (2003)
HSV-2 0.0008%
Schuhmacher et al. (2003)
Pinus mugo
HSV-1 0.0007%
Koch (2005)
HSV-2 0.0007%
Koch (2005)
Santalum album
HSV-1 0.0002%
Koch (2005)
HSV-2 0.0005%
Koch (2005)
Tessaria absinthioides
HSV-1 105 ppm
Garcia et al. (2003)
Thymus vulgaris
HSV-1 0.001%
Koch (2005)
HSV-2 0.0007%
Koch (2005)
Zingiber officinale
HSV-1 0.0002%
Koch (2005)
HSV-2 0.0001%
Koch (2005)
102. Примеры защитных соединений «первого круга» обороны: изопреноиды
Сесквитерпеноиды:селинен – инсектицид
Е-β-фарнезен (паслен) – ферромон
тревоги насекомых
Дитерпены:
кауреновая и трахилбановая
кислоты (цветки подсолнечника) –
гибель личинок бабочек
Паклитаксел (тис) – яд для животных
Тритерпеноиды:
сердечные гликозиды - яд для
животных
Экдистероиды – нарушение развития
насекомых.
103. Защитное действие смол.
Массовая атака короедов сосны наствол Pinus contorta. Каждое белое
пятно на стволе - место нападения
жуков и выделения смолы из
поврежденного ими участка.
Дерево пережило атаку жуков, так
как содержание токсичных
компонентов эфирного масла,
содержащихся в смоле, было
достаточно, чтобы убить короедов,
которые были затем “удалены”
оттоком смолы. После испарения
эфирных масел и воздействия
воздуха, дитерпеновые смоляные
кислоты затвердевают и формируют
«пробку», которая «запечатывает»
рану.
104. Примеры защитных соединений «второго круга» обороны: цаногенные гликозиды, глюкозинолаты.
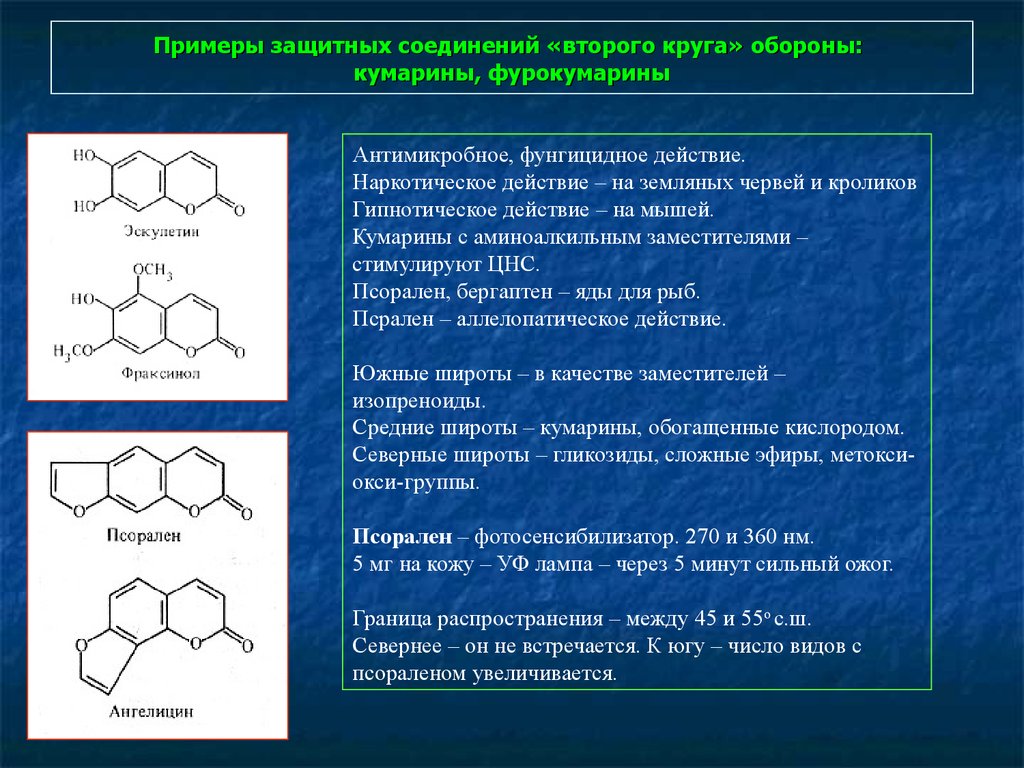
105. Примеры защитных соединений «второго круга» обороны: кумарины, фурокумарины
Антимикробное, фунгицидное действие.Наркотическое действие – на земляных червей и кроликов
Гипнотическое действие – на мышей.
Кумарины с аминоалкильным заместителями –
стимулируют ЦНС.
Псорален, бергаптен – яды для рыб.
Псрален – аллелопатическое действие.
Южные широты – в качестве заместителей –
изопреноиды.
Средние широты – кумарины, обогащенные кислородом.
Северные широты – гликозиды, сложные эфиры, метоксиокси-группы.
Псорален – фотосенсибилизатор. 270 и 360 нм.
5 мг на кожу – УФ лампа – через 5 минут сильный ожог.
Граница распространения – между 45 и 55о с.ш.
Севернее – он не встречается. К югу – число видов с
псораленом увеличивается.
106. Но: постоянное присутствие и биологическая активность не являются достаточным доказательством. Что делать?
Один из возможных подходов –использование культур клеток высших растений
107. Но: постоянное присутствие и биологическая активность не являются достаточным доказательством. Что делать?
Один из возможных подходов – использование культур клеток высших растенийОсновные свойства культуры клеток высших растений экспериментально созданной популяции соматических клеток
Снятие организменного
контроля развития переход к популяционным
механизмам развития системы
Отбор клеток по максимальной
и/или устойчивой пролиферации
основной принцип развития
поуляции
гетерогенность системы по
различным признакам
основа адаптационных
возможностей системы
Узкие адаптационые
возможности системы
следствие отсутствия
длительной эволюции
Большой невостребованный
генетический материал –
клетки in vitro имеют полную
информацию об интактном
растении
Влияние невостребованных
генов на развитие популяции
Судьба невостребованного
генетического материала –
возникновение и скорость
мутаций, сомаклональных
вариаций
Включение/выключение
невостребованных блоков –
программы морфогенеза,
соматического эмбриогенеза
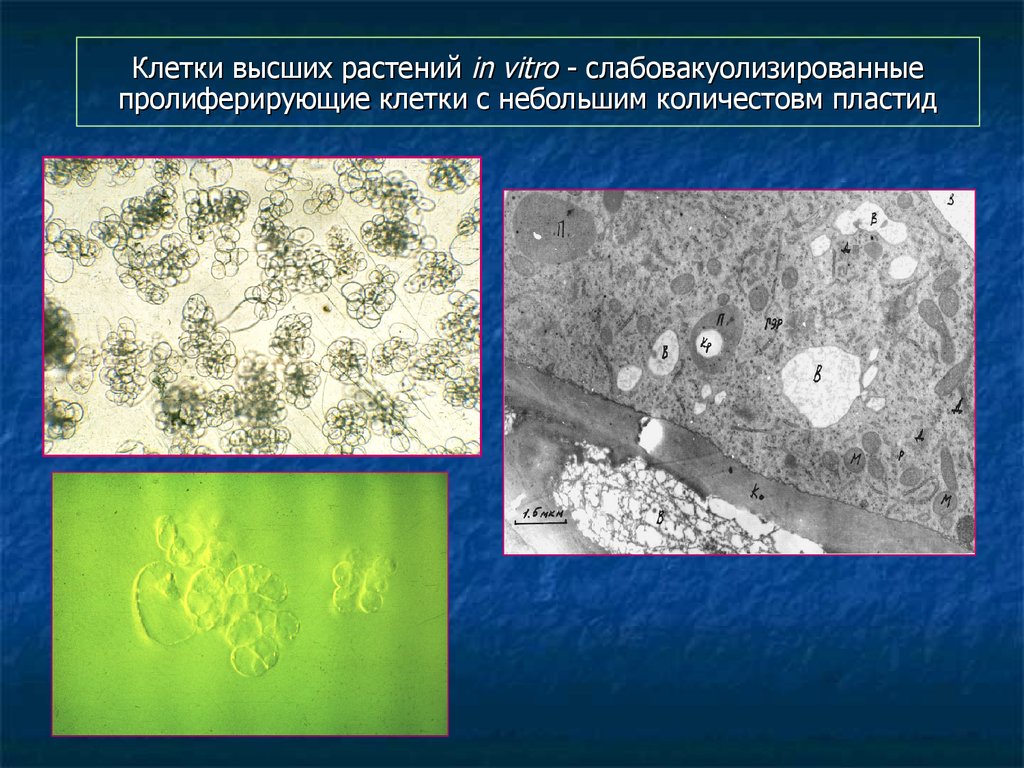
108. Клетки высших растений in vitro - слабовакуолизированные пролиферирующие клетки с небольшим количестовм пластид
109. Некоторые закономерности синтеза вторичных метаболитов в культуре клеток высших растений
Избирательная возможность синтеза метаболитовне получен синтез морфинанов, димерных индольных
алкалоидов, карденолидов.
Различия в синтезе по классам соединений
добиться синтеза фенольных соединений и изопреноидов проще,
чем алкалоидов
Различная стабильность синтеза для разных соединений при
длительном субкультивирвоании. Стабильный синтез соединений,
способствующих пролиферации клеток.
Различные закономерности синтеза в цикле культивирования.
Часто синтез активируется при замедлении роста культуры, реже
– во время активной пролиферации клеток.
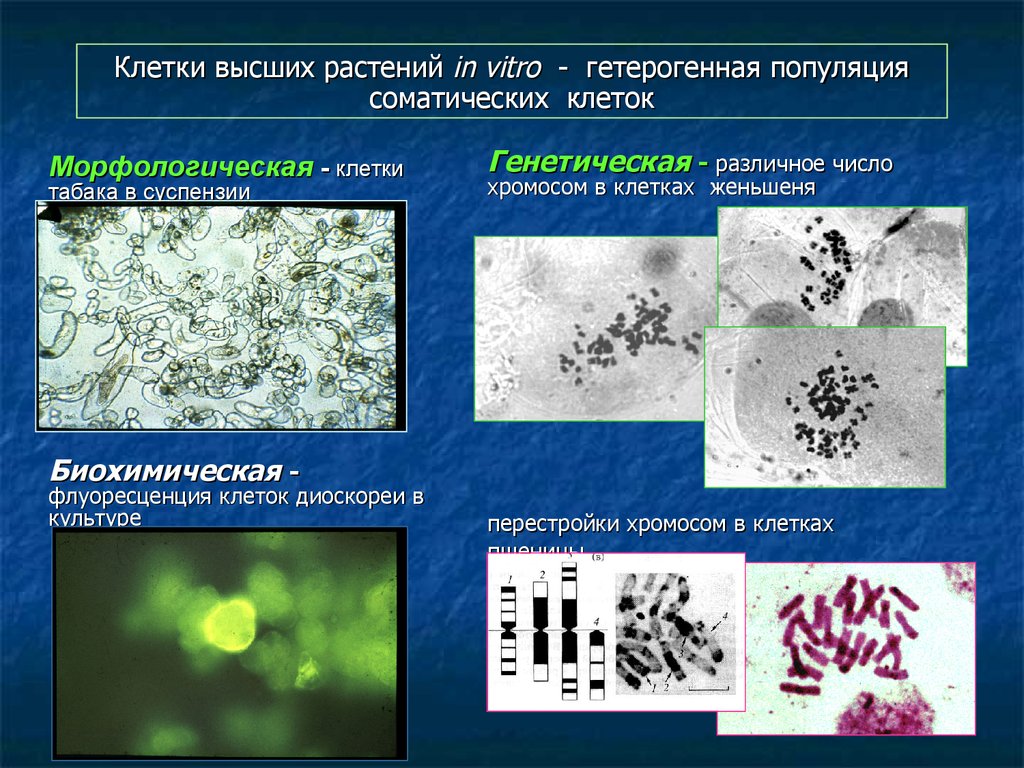
110. Клетки высших растений in vitro - гетерогенная популяция соматических клеток
Морфологическая - клеткитабака в суспензии
Генетическая - различное число
хромосом в клетках женьшеня
Биохимическая -
флуоресценция клеток диоскореи в
культуре
перестройки хромосом в клетках
пшеницы
111. Вторичный метаболизм в клетках in vitro - синтез изопреноидов
Dioscireadeltoidea
ginseng, P. japonicus,
P.quinquefolius
стероидные гликозиды
Panax
тритерпновые гликозиды
(гинзенозиды)
Serratula
экдистероиды
Stevia
дитерпеновые гликозиды
(стевиол-гликозиды)
coronata,
Ajuga reptans
rebaudiana
Polyscias
filicifolia
тритерпеновые гликозиды
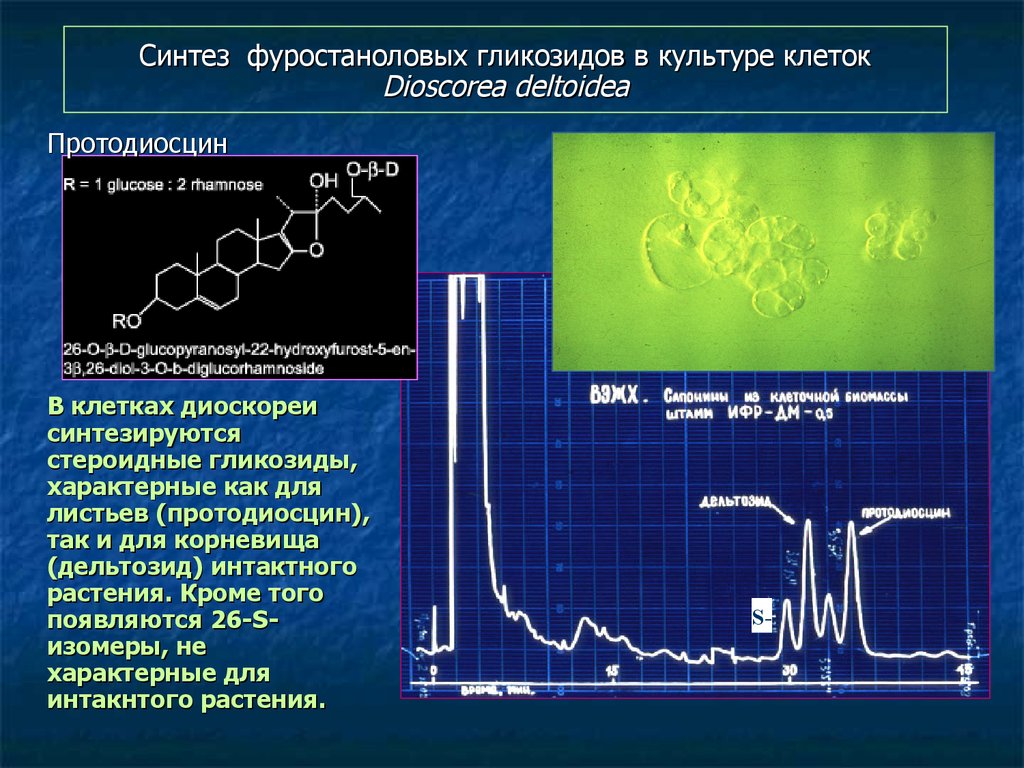
112. Синтез фуростаноловых гликозидов в культуре клеток Dioscorea deltoidea
ПротодиосцинВ клетках диоскореи
синтезируются
стероидные гликозиды,
характерные как для
листьев (протодиосцин),
так и для корневища
(дельтозид) интактного
растения. Кроме того
появляются 26-Sизомеры, не
характерные для
интакнтого растения.
S-
113.
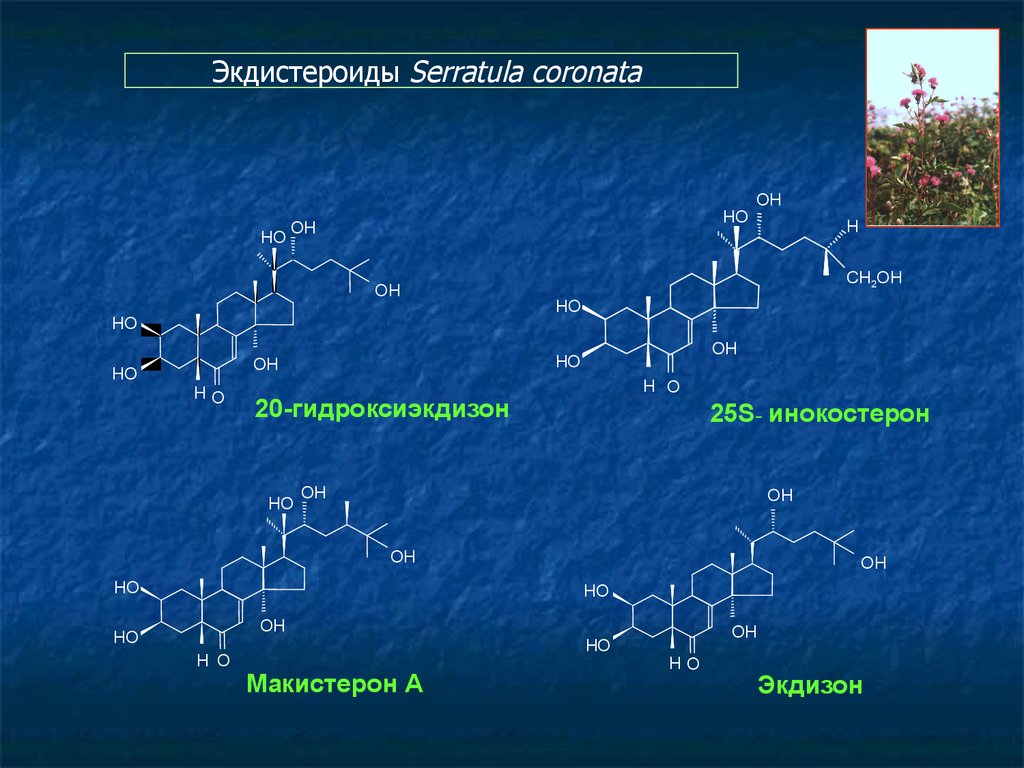
Экдистероиды Serratula coronataHO
HO
OH
OH
HO
HO
HO
НО
OH
H O
20-гидроксиэкдизон
HO
H
CH2OH
НО
OH
OH
25S- инокостерон
OH
OH
OH
НО
OH
НО
OH
НО
H O
НО
Макистерон А
OH
HO
Экдизон
114.
Экдистероиды Ajuga reptansС27 - стероиды
HO
OH
HО OH
OH
OH
HO
HО
OH
HO
HO
C28 - стероиды
20- гидроксиэкдизон
HО OH
HО
OH
Полиподин В
HО O
О
HО
OH
О
О
О
HО
HО
OH
HО
НО O
C29 - стероиды
OH
HО
29- норциастерон
HO
НO
29- норсенгостерон
O
OH
HО OH
HO O
O
О
OH
HO
HО
HO
OH
HO
OH
HO
HO
Аюгастерон В
O
HO
Аюгалактон
HО
OH
НО O
Сенгостерон
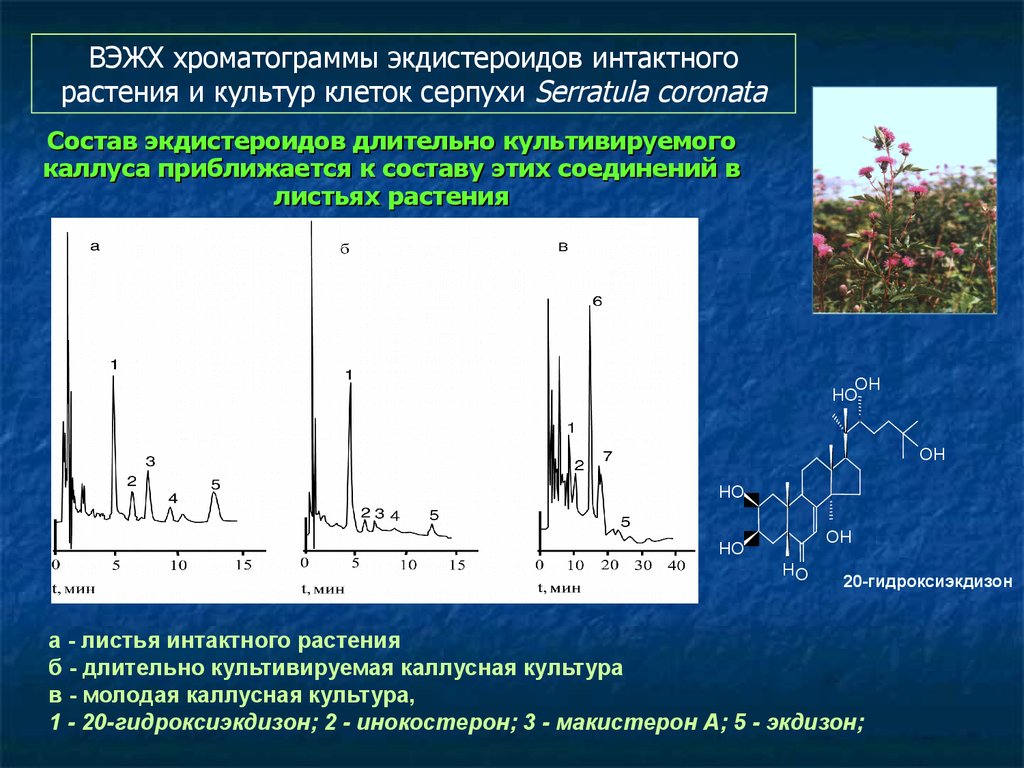
115. Состав экдистероидов длительно культивируемого каллуса приближается к составу этих соединений в листьях растения
ВЭЖХ хроматограммы экдистероидов интактногорастения и культур клеток серпухи Serratula coronata
Состав экдистероидов длительно культивируемого
каллуса приближается к составу этих соединений в
листьях растения
OH
HO
OH
HO
OH
HO
HO
20-гидроксиэкдизон
а - листья интактного растения
б - длительно культивируемая каллусная культура
в - молодая каллусная культура,
1 - 20-гидроксиэкдизон; 2 - инокостерон; 3 - макистерон А; 5 - экдизон;
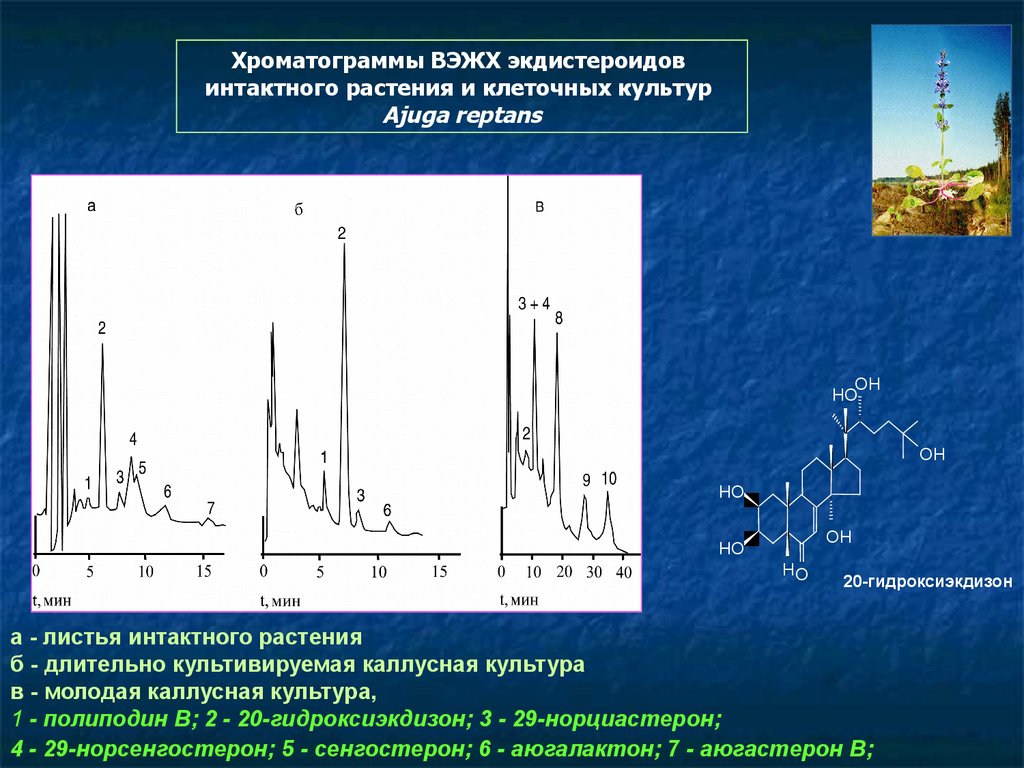
116.
Хроматограммы ВЭЖХ экдистероидовинтактного растения и клеточных культур
Ajuga reptans
OH
HO
OH
HO
OH
HO
HO
20-гидроксиэкдизон
а - листья интактного растения
б - длительно культивируемая каллусная культура
в - молодая каллусная культура,
1 - полиподин В; 2 - 20-гидроксиэкдизон; 3 - 29-норциастерон;
4 - 29-норсенгостерон; 5 - сенгостерон; 6 - аюгалактон; 7 - аюгастерон В;
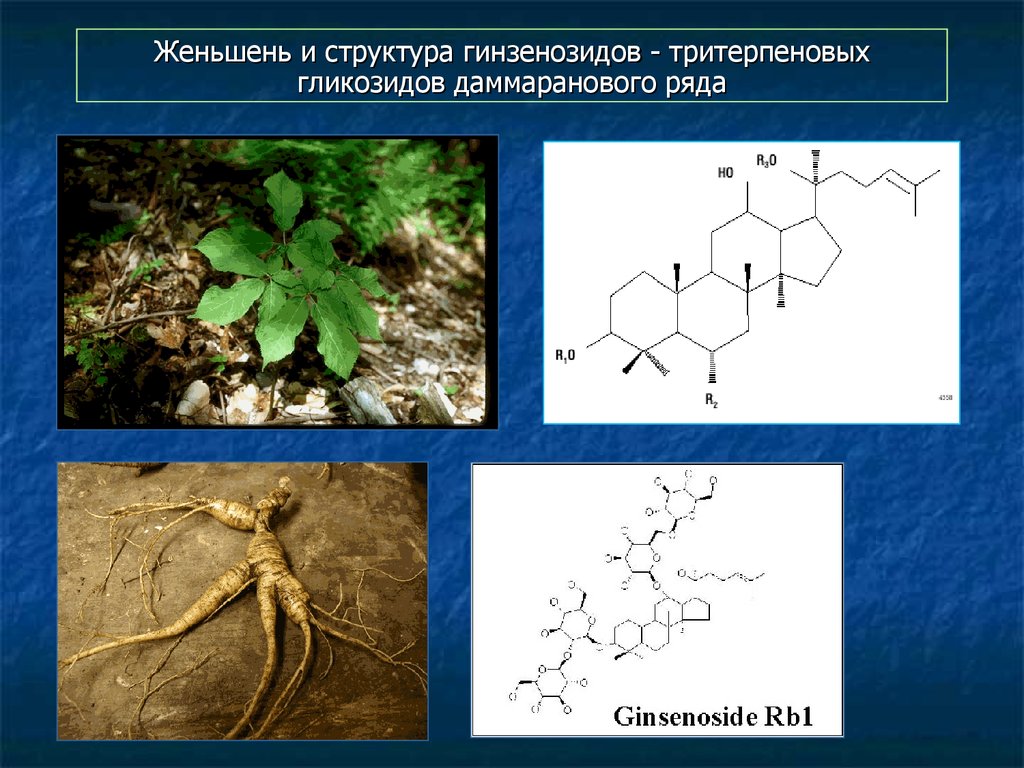
117. Женьшень и структура гинзенозидов - тритерпеновых гликозидов даммаранового ряда
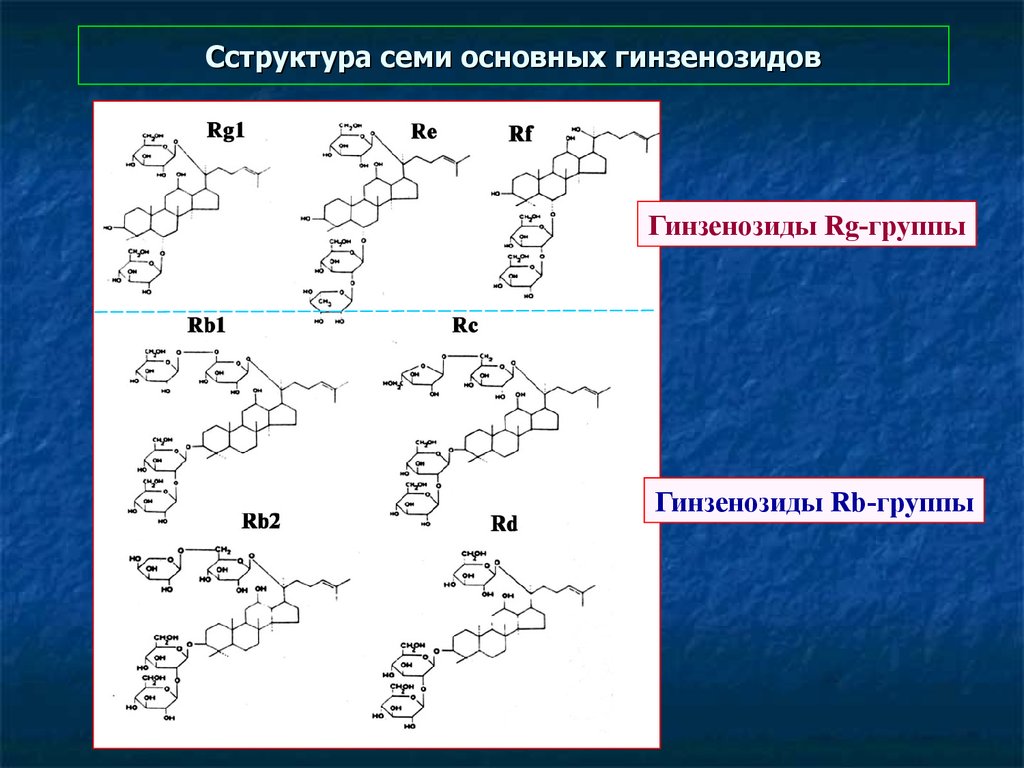
118. Cструктура семи основных гинзенозидов
Гинзенозиды Rg-группыГинзенозиды Rb-группы
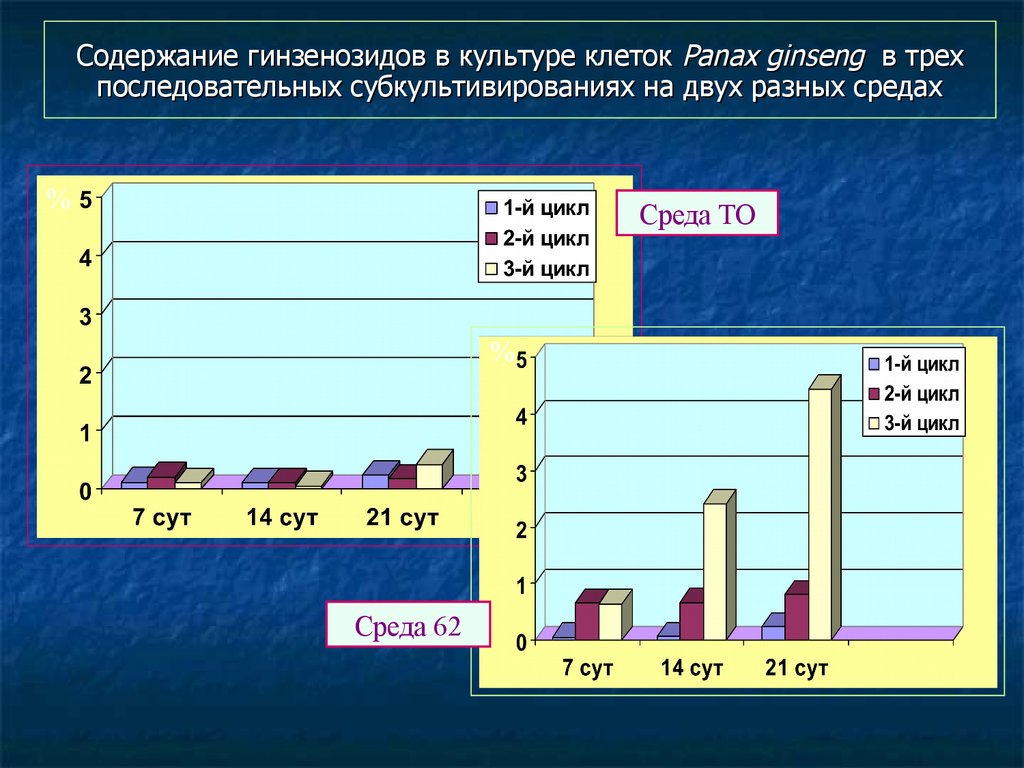
119. Содержание гинзенозидов в культуре клеток Panax ginseng в трех последовательных субкультивированиях на двух разных средах
%Среда ТО
%
Среда 62
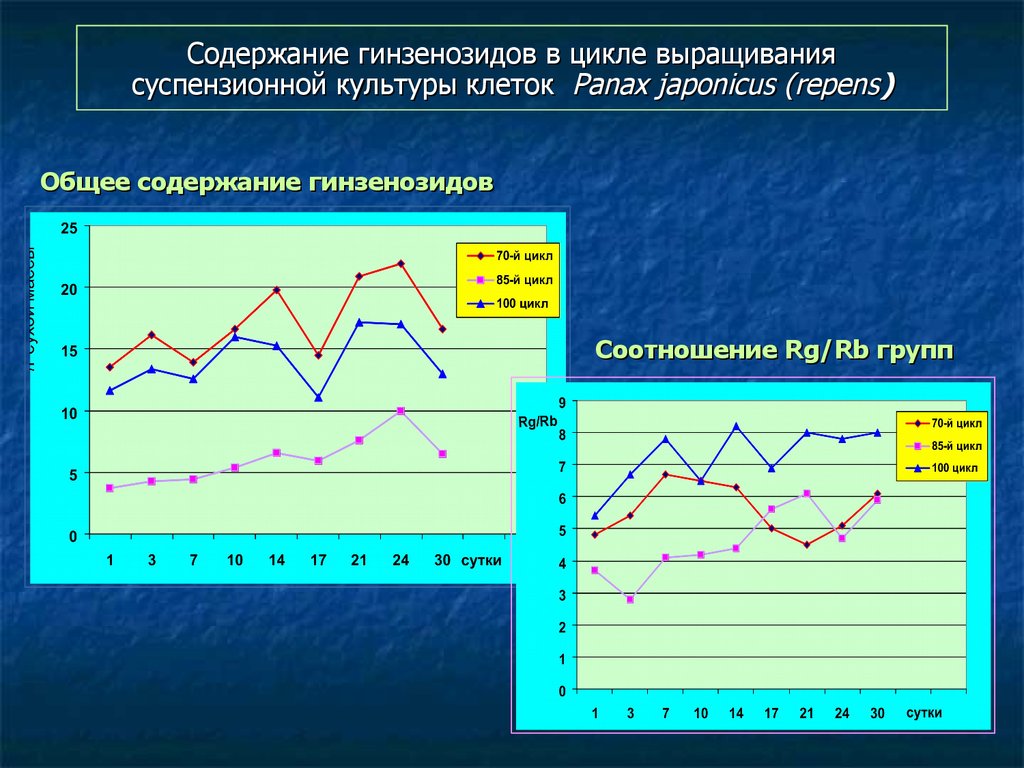
120. Содержание гинзенозидов в цикле выращивания суспензионной культуры клеток Panax japonicus (repens)
Общее содержание гинзенозидовСоотношение Rg/Rb групп
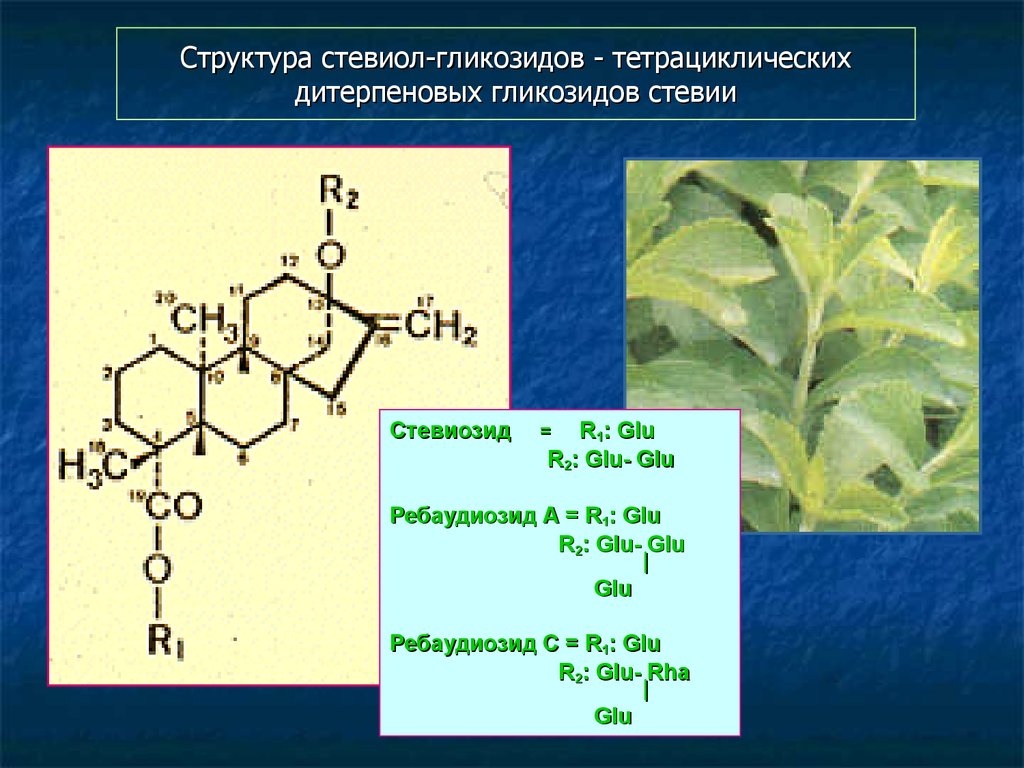
121. Структура стевиол-гликозидов - тетрациклических дитерпеновых гликозидов стевии
СтевиозидR1: Glu
R2: Glu- Glu
=
Ребаудиозид А = R1: Glu
R2: Glu- Glu
|
Glu
Ребаудиозид С = R1: Glu
R2: Glu- Rha
|
Glu
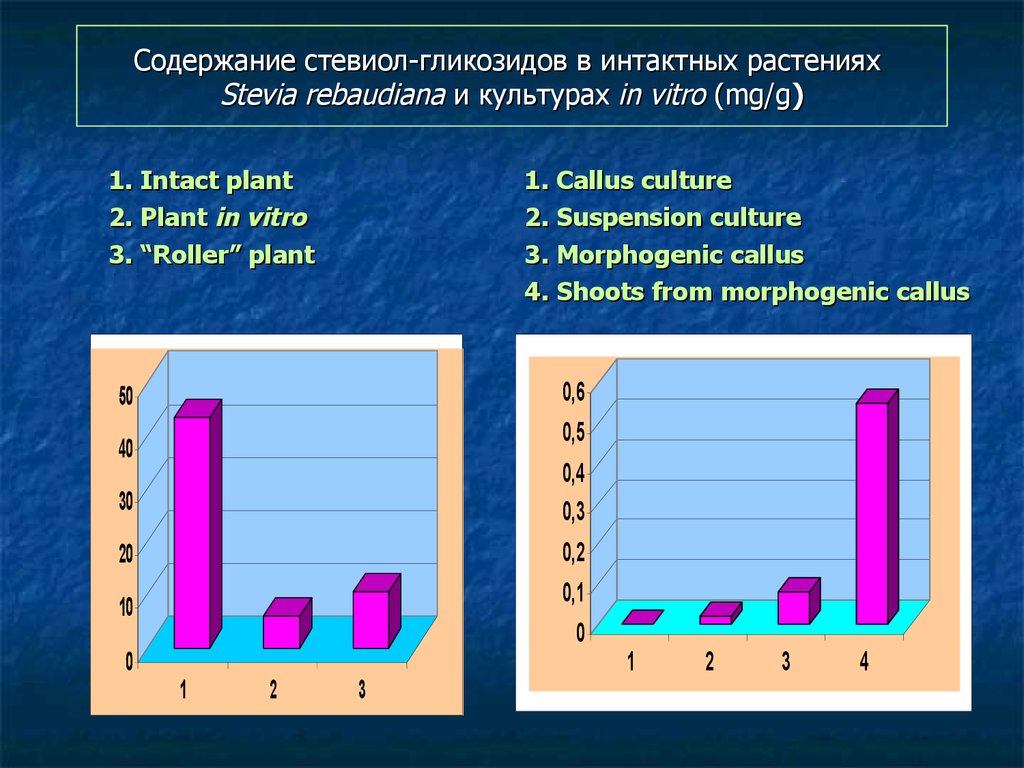
122. Содержание стевиол-гликозидов в интактных растениях Stevia rebaudiana и культурах in vitro (mg/g)
1. Intact plant2. Plant in vitro
3. “Roller” plant
1. Callus culture
2. Suspension culture
3. Morphogenic callus
4. Shoots from morphogenic callus
0,6
50
0,5
40
30
0,4
0,3
20
0,2
0,1
10
0
0
1
2
3
1
2
3
4
123. Содержание стевиол-гликозидов в миксотрофных каллусных культурах стевии
СГ, мкг/г сух. массы120
100
80
Реб. А
60
Реб. С
40
Сумма
20
0
1
К
линии
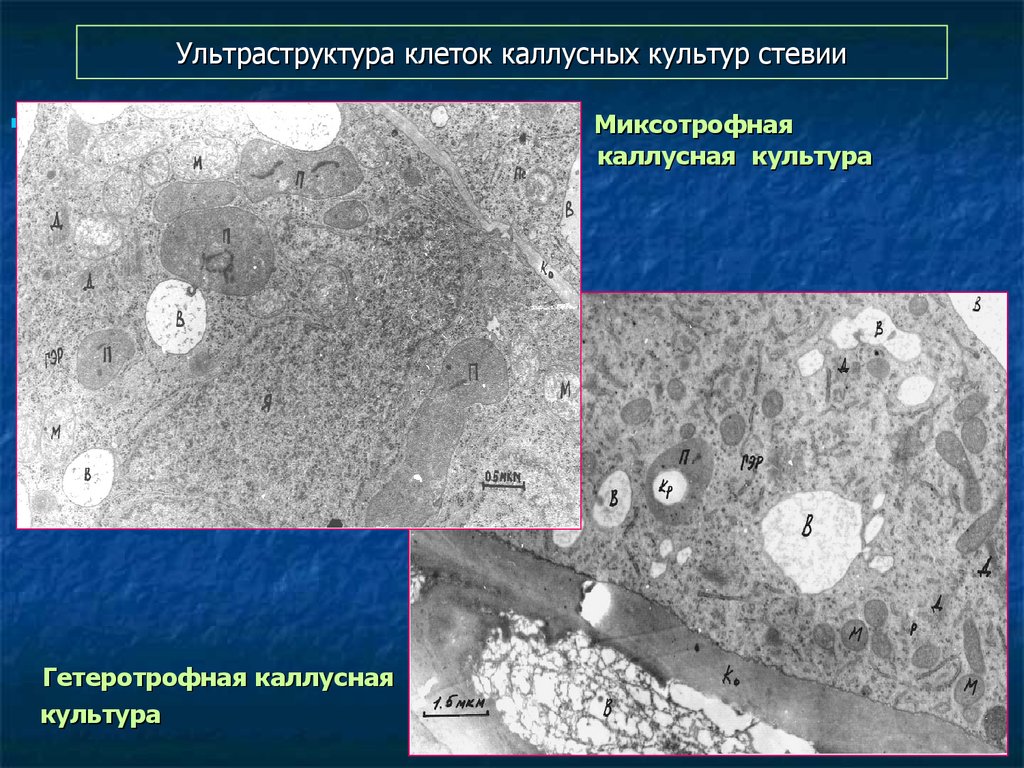
124. Ультраструктура клеток каллусных культур стевии
Миксотрофнаякаллусная культура
Гетеротрофная каллусная
культура



























 biology
biology