Similar presentations:
Непредельные углеводороды
1. Непредельные углеводороды
Непредельными называютсяуглеводороды, в молекулах
которых имеются атомы
углерода, связанные между
собой двойной или тройной
связью.
2. Алкены. Олефины . Углеводороды ряда этилена.
1.Определение класса.Алкены - непредельные углеводороды , в
молекулах которых имеются два атома
углерода, связанные двойной связью.
Н-С=С-Н
| |
H H
3. 3. Общая формула алкенов
• H2C=CH2 ; H3C-CH=CH2 ;• H3C- H2C-HC=CH2
• С2Н4
С3Н6
С4Н8
Cn H2n
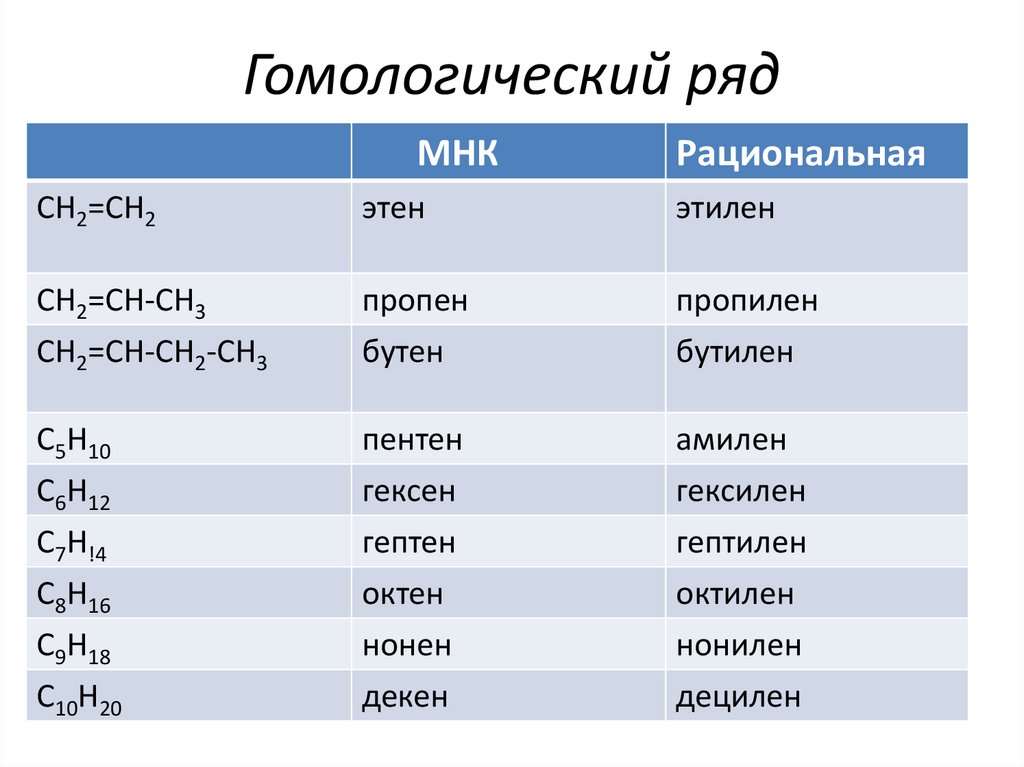
4. Гомологический ряд
МНКРациональная
CH2=CH2
этен
этилен
CH2=CH-CH3
пропен
пропилен
CH2=CH-CH2-CH3
бутен
бутилен
C5H10
C6H12
пентен
гексен
амилен
гексилен
C7H!4
C8H16
гептен
октен
гептилен
октилен
C9H18
C10H20
нонен
декен
нонилен
децилен
5. 5. Номенклатура
54
3
2
1
6
CH3-CH-CH2-C =CH-CH3
|
|
CH3
CH2
|
CH3
5-метил-3-этилгексен-2
Внимание !!! Нумеруем с того конца, где ближе
двойная связь, а называть начинаем с младшего
радикала-заместителя
6.
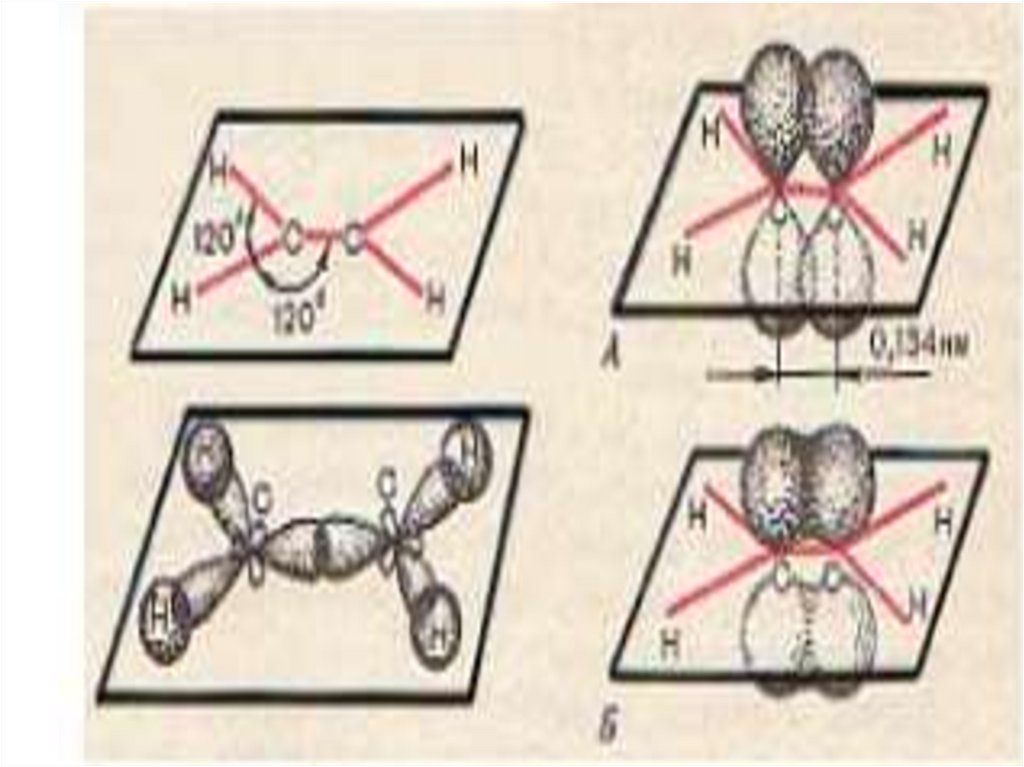
Алкены – это непредельные УВ, имеющие встроении одну двойную связь (1-σ и 1-π ).
Каждая молекула алкенов содержит два атома
углерода в sp2- гибридизации. Это второе
валентное состояние углерода.
1s + 2p = 3sp2- гибридизованных облака
образуют σ-связи под углом 120о
Негибридизованные р - электроны образуют πсвязь, которая располагается перпендикулярно
плоскости молекулы. Длина связи 0,134 нм.
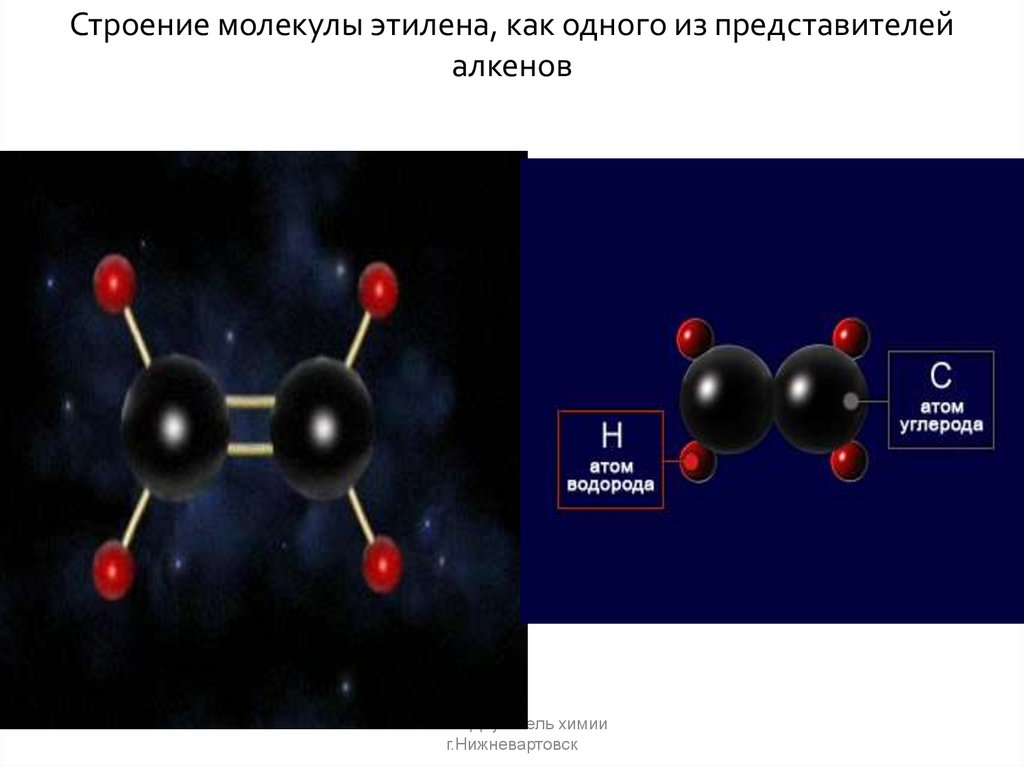
7.
Строение молекулы этилена, как одного из представителейалкенов
Клок Г.Д. учитель химии
г.Нижневартовск
8. π-связь очень непрочная и легко поляризуется. Lc = c= 0,134нм
Этилен(этен)
9.
10.
Изомерия углеродного скелета:CH2=CH-CH2-CH3 бутен-1
CH2=C –CH3 2- метилпропен
Изомерия положения двойной связи:
CH2=CH-CH2-CH3 - бутен-1
CH3-CH=CH-CH3 - бутен -2
Межклассовая изомерия:
CH2=CH-CH2-CH2-CH3 - пентен
CH3
Пространственная изомерия
CH3
H
транс- пентен-2
C=C
H
C2H5
H
H
цис-пентен-2
C=C
CH3
C2H5
-
циклопентан
Гомологический ряд:
C2H4 этен
C3H6 пропен
C4H8 бутен
C5H10 пентен
C6H12 гексен
C7H14 гептен
C8H16 октен
C9H18 нонен
C10H20 декен
11.
12.
Свойства иполучение алкенов
13. Физические свойства
С2H4 до C4H8 - газы
C5 H10 до C16H32 - жидкости
C17H34 и т.д.
– твердые вещества.
С ростом числа атомов углерода возрастает
tкип, tпл и плотность. Все алкены не
растворяются в воде
14. Химические свойства :
Химические свойстваопределяются наличием двойной
связи.
Х а р а к т е р н ы е р е а к ц и и присоединение , окисление,
полимеризация
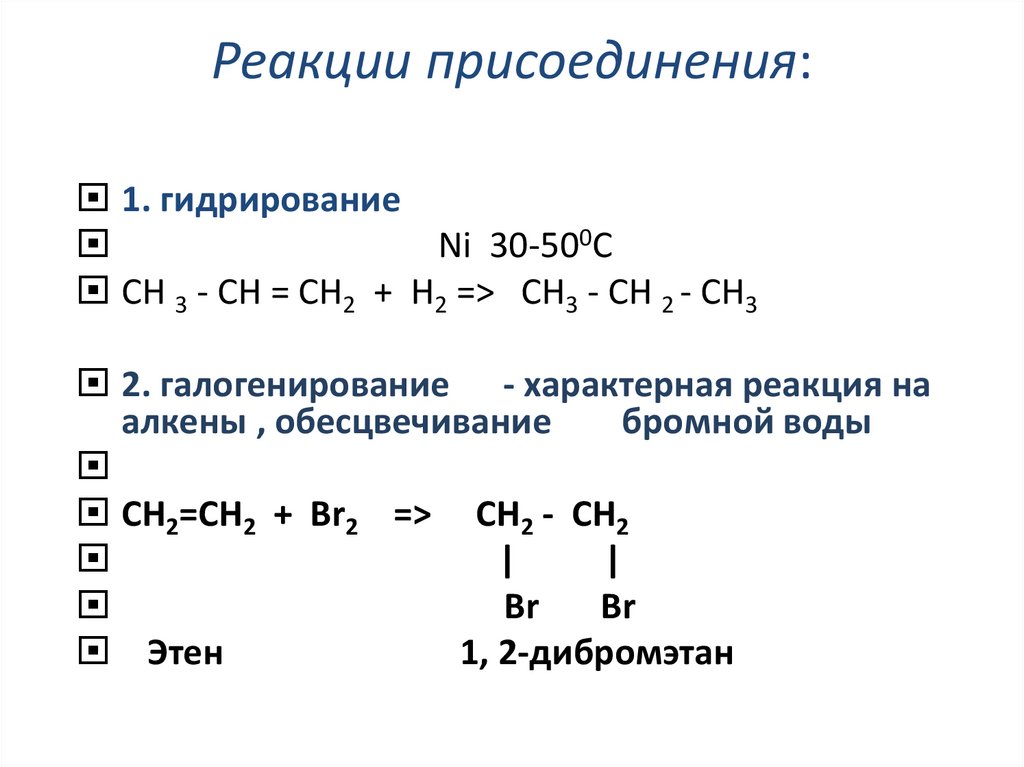
15. Реакции присоединения:
1. гидрированиеNi 30-500C
CH 3 - CH = CH2 + H2 => CH3 - CH 2 - CH3
2. галогенирование - характерная реакция на
алкены , обесцвечивание
бромной воды
CH2=CH2 + Br2 => CH2 - CH2
|
|
Br
Br
Этен
1, 2-дибромэтан
16.
3.реакция гидратации – присоединение водыСH2=CH2+ H2O 600 C
Этен
Н2SO4
CH3 – CH2 – OH
этиловый спирт
4. реакция гидрогалогенирования –
присоединение галогеноводородов
17.
Присоединение полярных молекул18.
19. Реакции окисления
мягкое окисление – характерная реакция , обесцвечиваниераствора перманганата калия
KMnO4
CH2 =CH2 + [ O ] + H2O => CH2 =CH2
|
|
OH OH
этиленгликоль
(двухатомный спирт)
Этандиол или
реакция Вагнера
(3CH2=CH2 + 2KMnO4 + 4H2O =>
3CH2=CH2 + 2MnO2 + 2KOH)
|
|
OH OH
20.
Качественные реакции на этилен21.
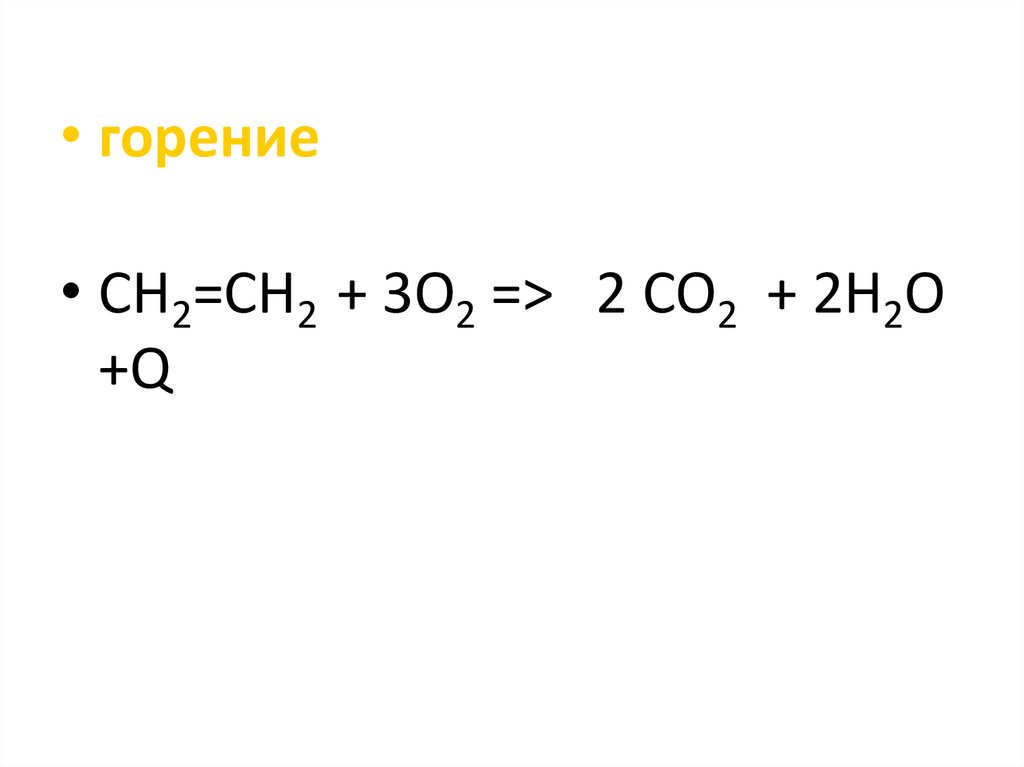
• горение• CH2=CH2 + 3O2 => 2 CO2 + 2H2O
+Q
22. реакции полимеризации
процесс соединения одинаковых молекул в более крупныеназывается п о л и м е р и з а ц и е й , а продукт этой
реакции полимером.
…СH2=CH2 +CH2=CH2+CH2=CH2 ..=>
..CH2-CH2-CH2-CH2-..
nCH2=CH2=> (-CH-CH-)n
СH2=CH2 - мономер
(-CH2-CH2-)n-полимер
[-CH2-CH2- ] структурное звено
n – степень полимеризации
23.
ГексадеканЭтан
Этен
Октан Октен
24.
25. Отдельный представитель -Этен или этилен
а) в природе находится в небольших количествах вприродном и светильном газе
б) в лабораториях получают реакцией дегидратации
этилового спирта
в) физические свойства- газ, без цвета, запах сладковатый.
горит светящимся слабо коптящим пламенем.
г) при смешивании с воздухом образует взрывчатую смесь
д) обладает наркотическими свойствами
е) сырье для получения спирта
ж) используется для получения иприта – сильного
отравляющего вещества
з) используется для ускорения созревания фруктов
26. Домашнее задание
• П.7, упр.1, 2, 6• П.8





















 chemistry
chemistry








