Similar presentations:
Алюминий
1. АЛЮМИНИЙ
Куцапкина Людмила ВасильевнаУчитель химии
ГБОУ гимназия №343Невского района
2. АЛЮМИНИЙ. Нахождение в природе
Алюмосиликаты:Глина – Al2O3*nSiO2*mH2O
Бокситы – Al2O3*nH2O
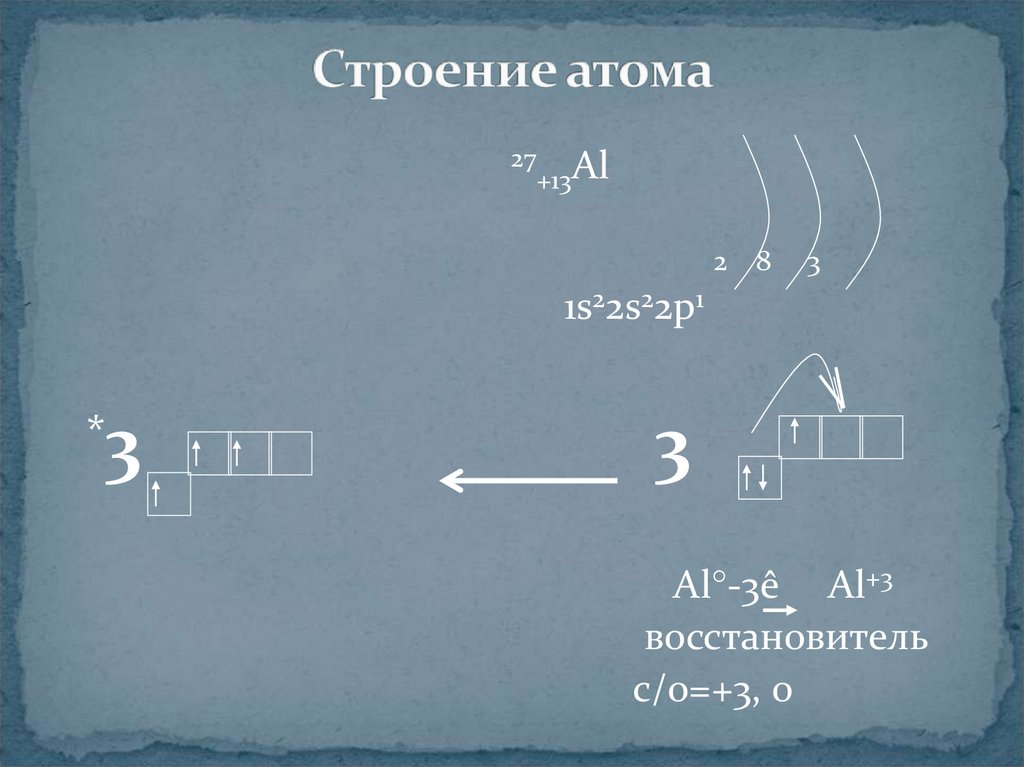
3. Строение атома
27 Al+13
2
8
3
1s22s22p1
*
3
3
Al°-3ê Al+3
восстановитель
с/о=+3, 0
4. ФИЗИЧЕСКИЕ СВОЙСТВА
Al-серебристо-белый металлМягкий, пластичный (легко
вытягивается в проволоку и
раскатывается в листы), легкий
(плотность 2,7г/см3)
Хорошо проводит тепло и электрический
ток
Температура плавления - 660°С
Особо чистый Аl хорошо отражает
солнечные лучи
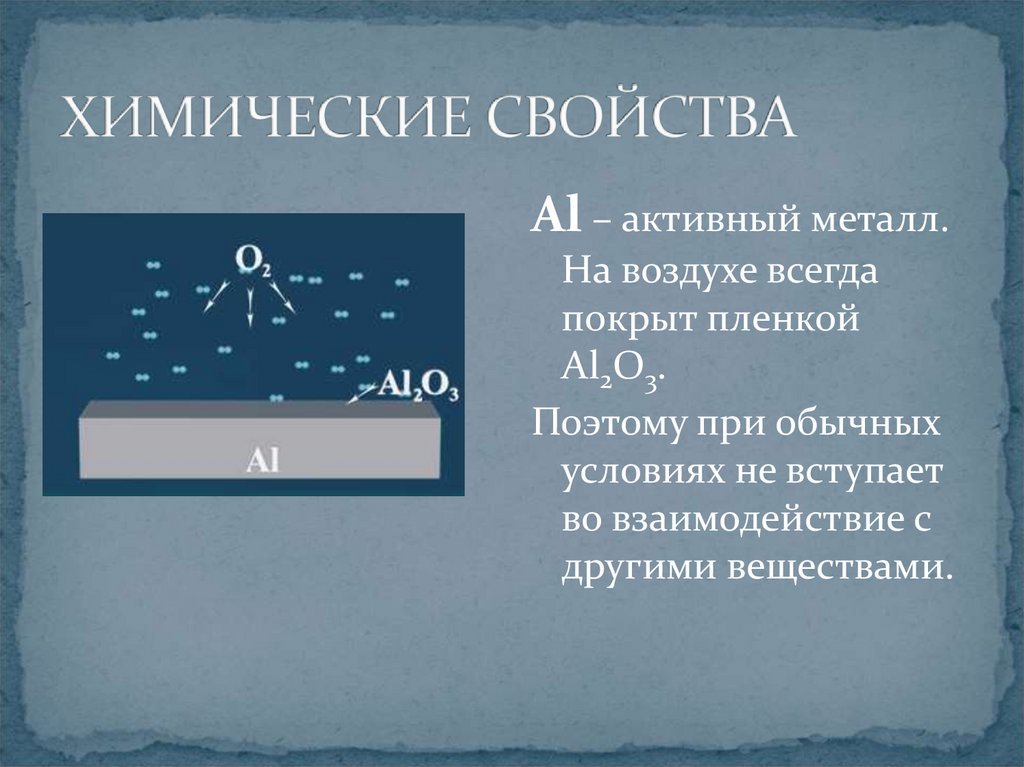
5. ХИМИЧЕСКИЕ СВОЙСТВА
Al – активный металл.На воздухе всегда
покрыт пленкой
Al2O3.
Поэтому при обычных
условиях не вступает
во взаимодействие с
другими веществами.
6. ВЗАИМОДЕЙСТВИЕ С ПРОСТЫМИ ВЕЩЕСТВАМИ
При обычныхусловиях
Взаимодействие с
кислородом:
4Al+ 3O2 =2Al2O3 +Q
Взаимодействие с
галогенами:
2Al+ 3Br2 =2Al2Br3
При нагревании
Взаимодействие с
углеродом:
4Al+3C=Al4C3
(1500-1700°C)
Взаимодействие с
серой:
2Al+3S= Al2S3
(150-170°C)
7. Взаимодействие со сложными веществами
Взаимодействие с водой (очищенныйот оксидной пленки)
2 Al +6H2O=2Al(OH)3 +3H2
Взаимодействует с растворами
кислот
2Al +6HCl= 2AlCl3 + 3H2
Взаимодействует с растворами
щелочей (образуется
тетрагидроксоалюминат натрия)
2 Al+2 NaOH + 6H2O=2Na[Al(OH)4]+3H2
8. Алюминий при обычных условиях не взаимодействует с концентрированными H2SO4и HNO3 (он пассивируется),но при нагревании реакция
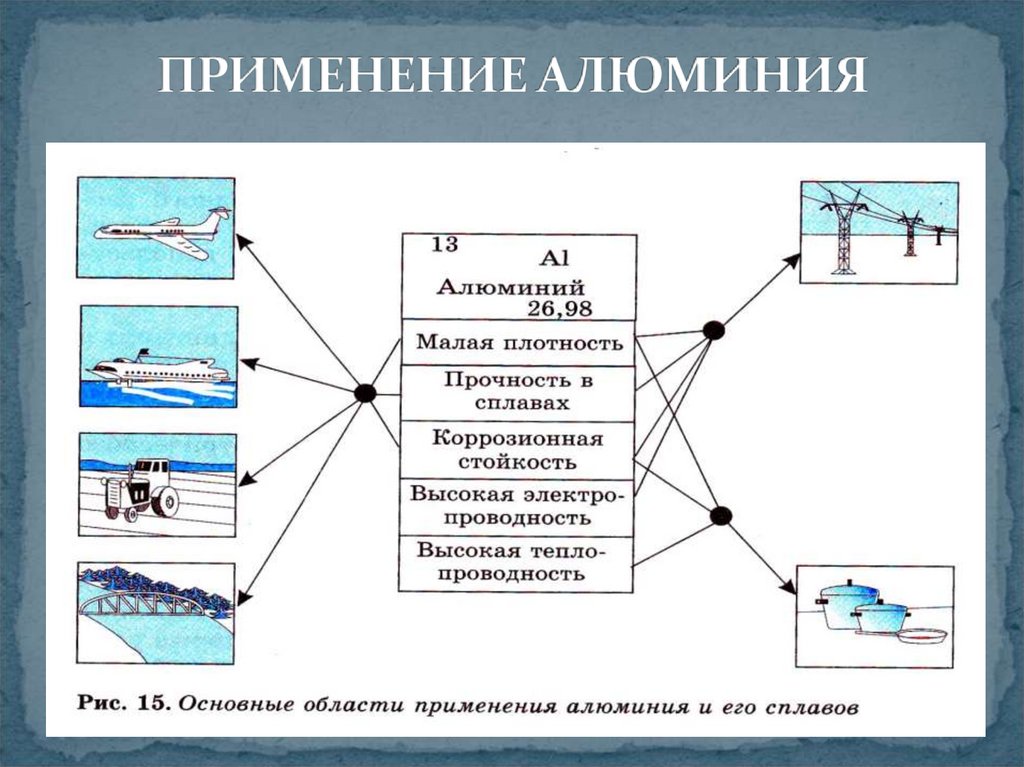
9. ПРИМЕНЕНИЕ АЛЮМИНИЯ
10. Домашнее задание
§ 13 (до соединений алюминия)Работа с текстом конспекта
Подберите коэффициенты методом электронного
баланса( в реакциях с конц. серной и азотной
кислотами , идущих при нагревании) :
Al + H2SO4= Al2(SO4)3 + SO2 + H2O
Al + HNO3 = Al(NO3)3 + NO2 + H2O







 chemistry
chemistry








