Similar presentations:
Лекция 10.7. Фазовые диаграммы
1. 10.7. ФАЗОВЫЕ ДИАГРАММЫ
2. Фаза
• – гомогенная часть системы отделенная отдругих частей поверхностью раздела и
имеющая во всех точках одинаковые
химические и физические свойства.
• 1) 5 кусков льда в воде, 20 пузырьков газа в
жидкости – сколько фаз?
• 2) на дне стакана с водой сахарный песок,
есть градиент концентрации сахара в
растворе – сколько фаз?
3. Правило фаз
С=K+N–Ф• С – число степеней свободы – число
независимых параметров системы, которые
можно изменять произвольно в некотором
интервале, не меняя числа и вида фаз.
• Ф – число фаз в системе
• N – число независимых параметров
pV = RT
сколько независимых
параметров для 1 моль вещества?
р, Т независимы V = RT/p зависим
4.
С=K+N–Ф
К – число независимых компонентов
Компонент – вещество, которое может
быть выделено из системы.
Независимые компоненты – вещества,
концентрации которых в системе могут
быть изменены произвольно.
Число независимых компонентов в
системе – число компонентов минус число
уравнений реакций, связывающих их.
SO2 + NO2 SO3 + NO
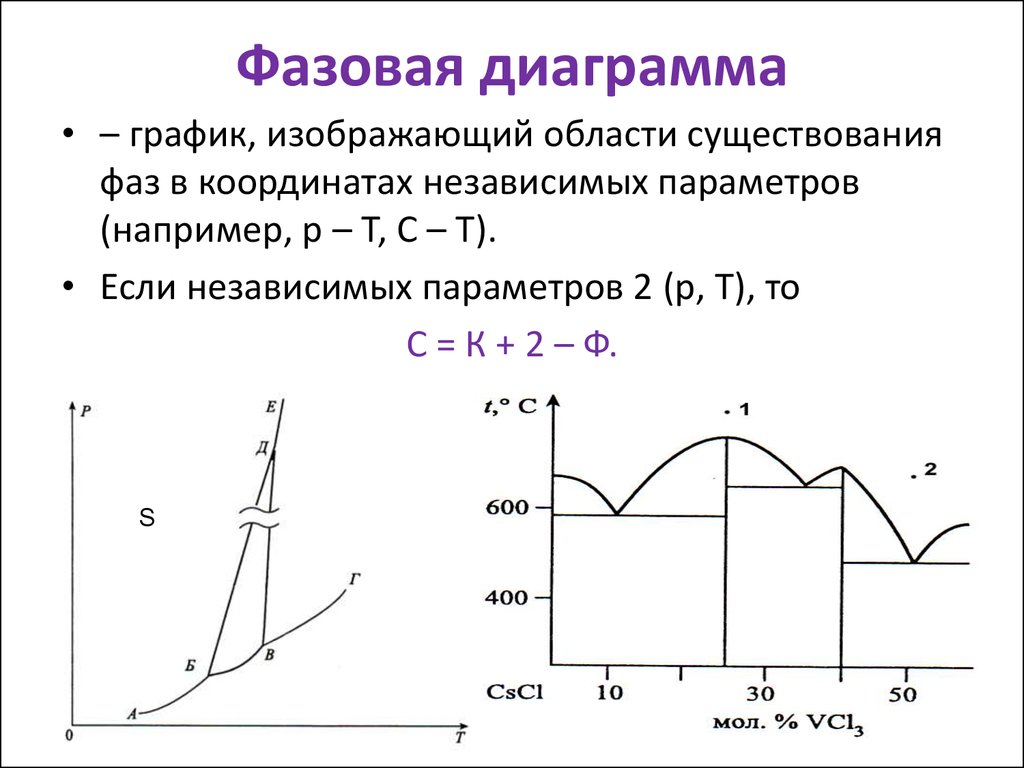
5. Фазовая диаграмма
• – график, изображающий области существованияфаз в координатах независимых параметров
(например, р – Т, С – Т).
• Если независимых параметров 2 (р, Т), то
С = К + 2 – Ф.
S
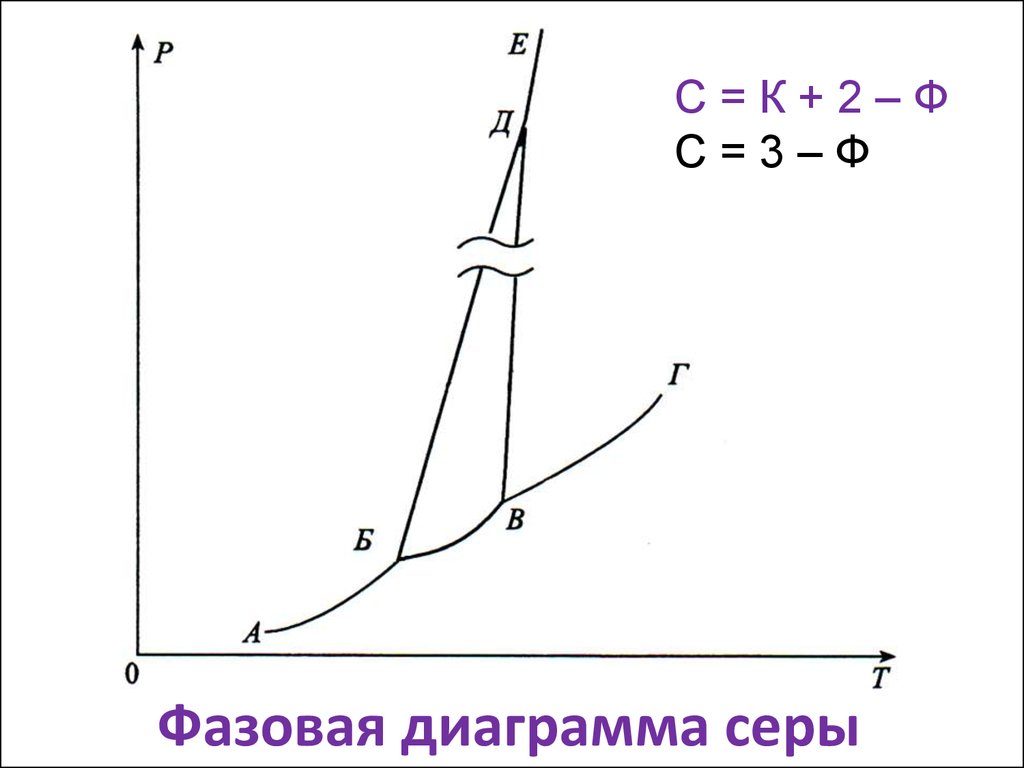
6. Фазовая диаграмма серы
С=К+2–ФС=3–Ф
Фазовая диаграмма серы
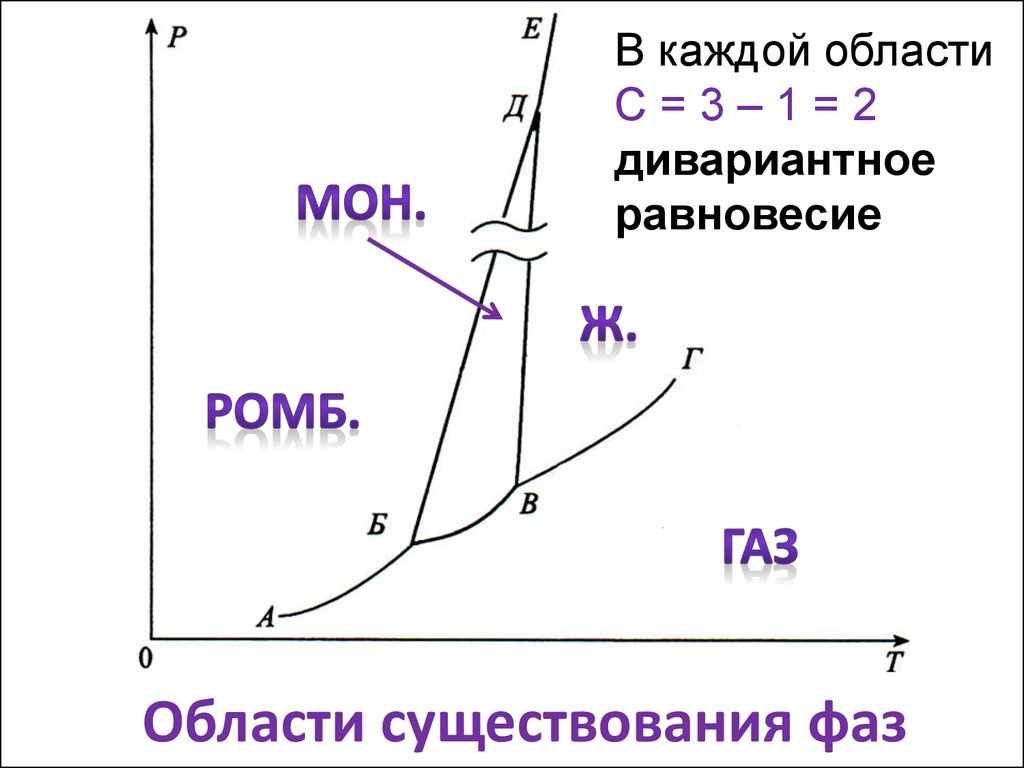
7. Области существования фаз
В каждой областиС=3–1=2
дивариантное
равновесие
Области существования фаз
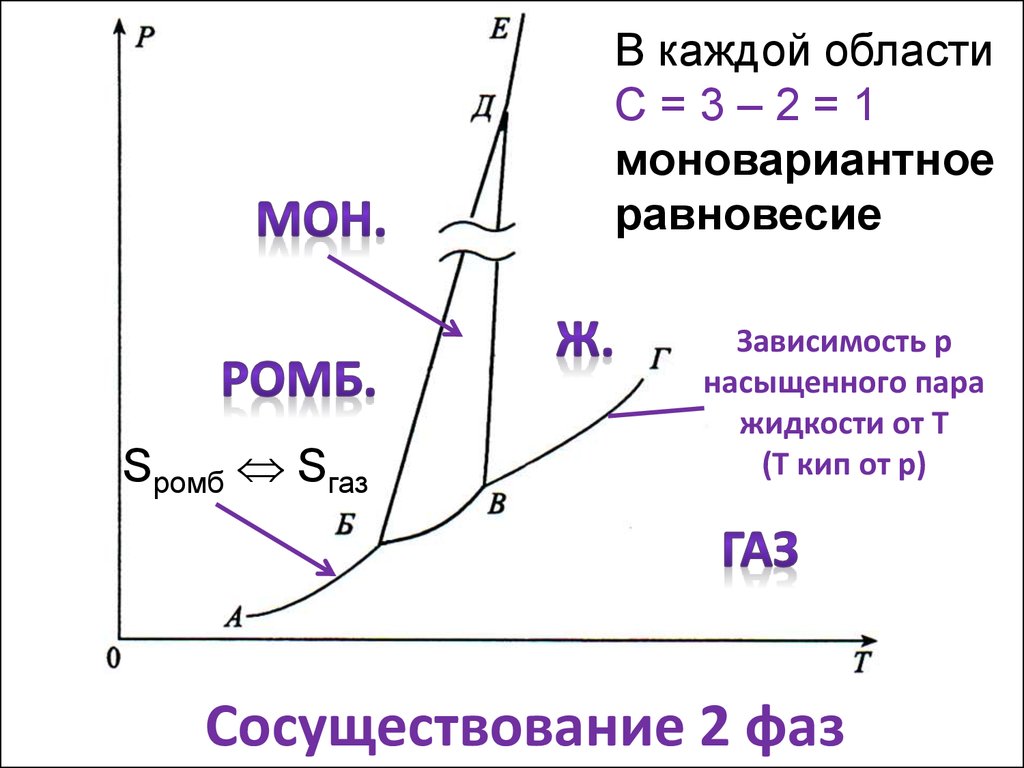
8. Сосуществование 2 фаз
В каждой областиС=3–2=1
моновариантное
равновесие
Sромб Sгаз
Зависимость р
насыщенного пара
жидкости от Т
(Т кип от р)
Сосуществование 2 фаз
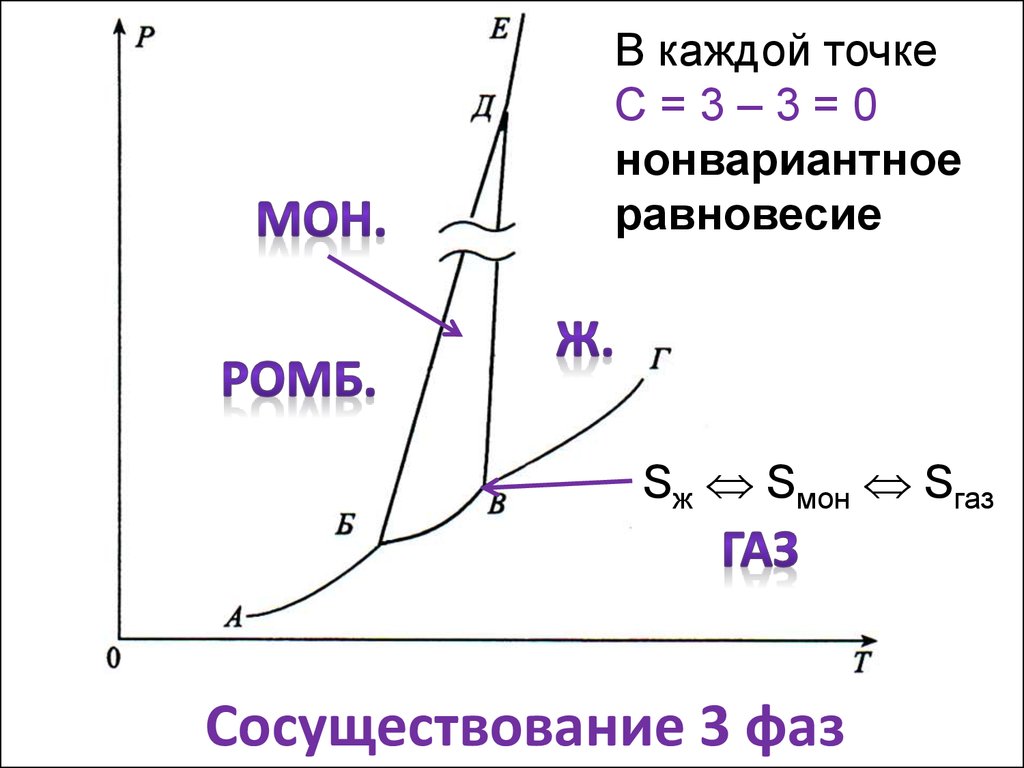
9. Сосуществование 3 фаз
В каждой точкеС=3–3=0
нонвариантное
равновесие
Sж Sмон Sгаз
Сосуществование 3 фаз
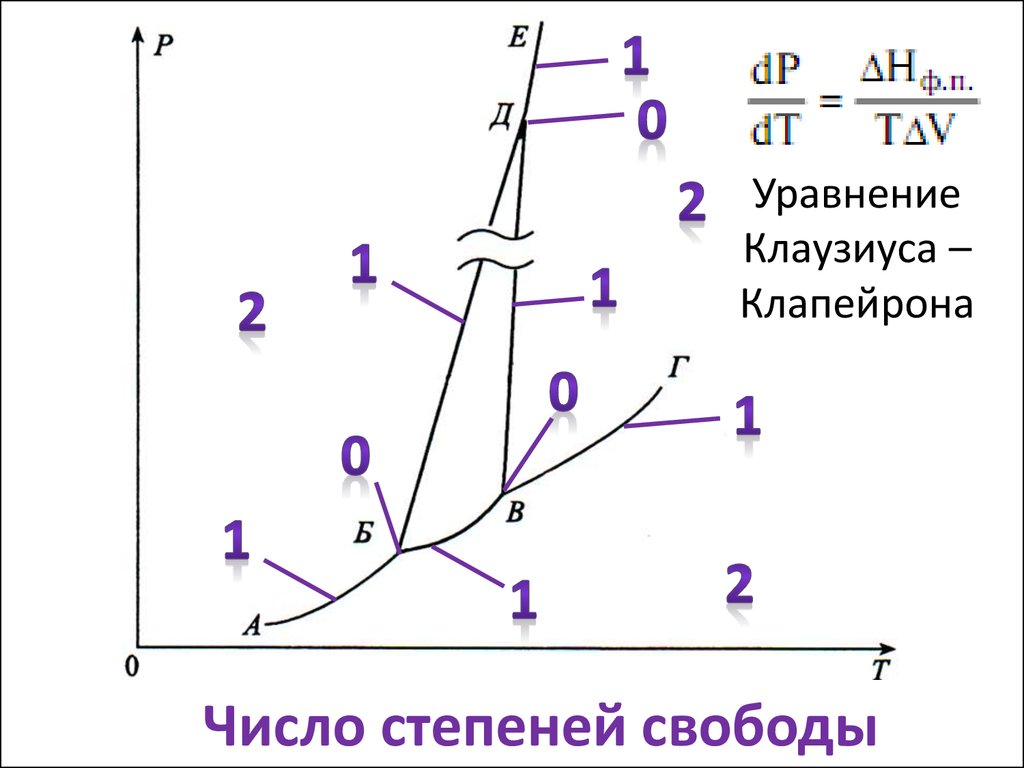
10. Число степеней свободы
УравнениеКлаузиуса –
Клапейрона
Число степеней свободы
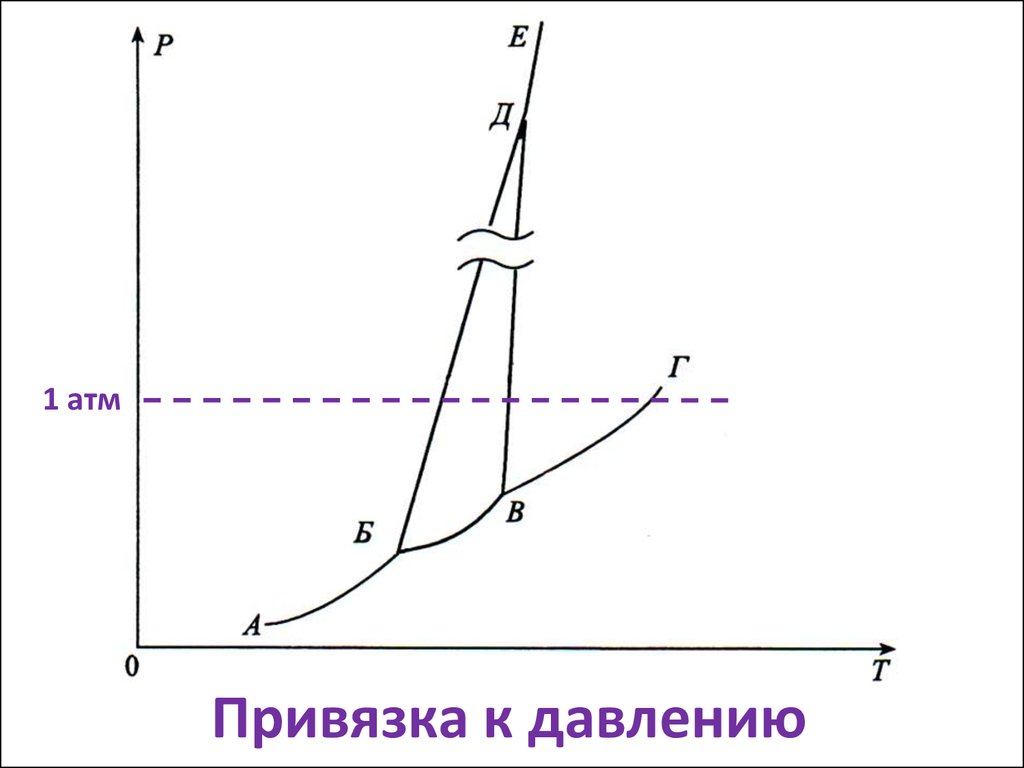
11. Привязка к давлению
1 атмПривязка к давлению
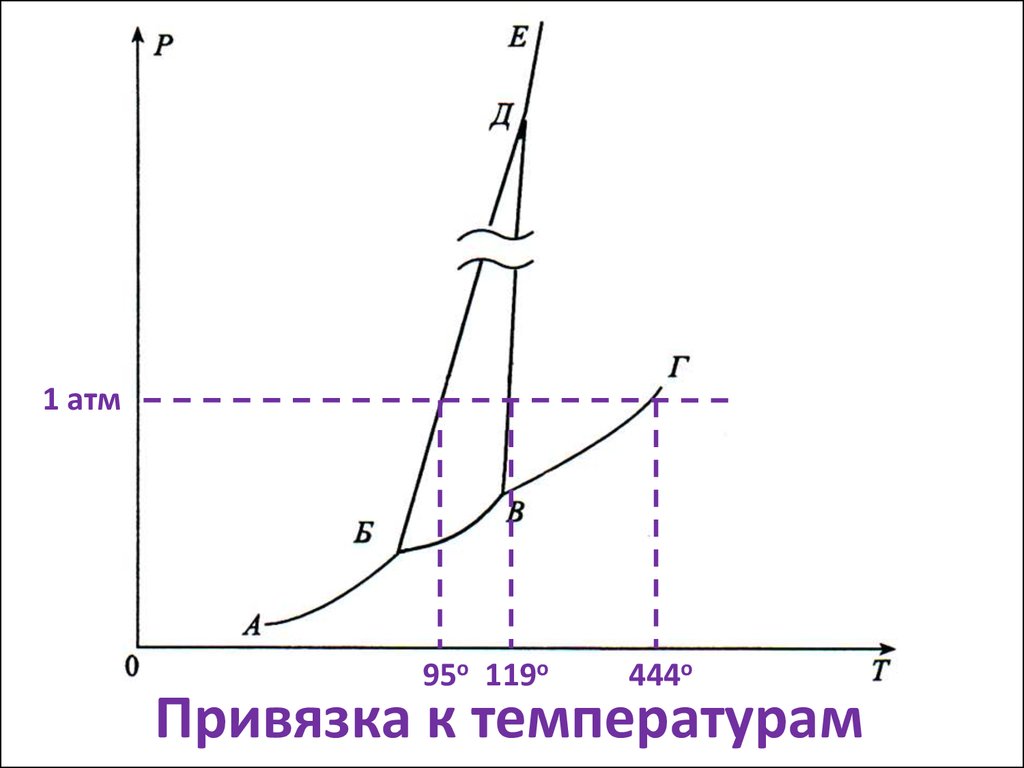
12. Привязка к температурам
1 атм95о 119о
444о
Привязка к температурам
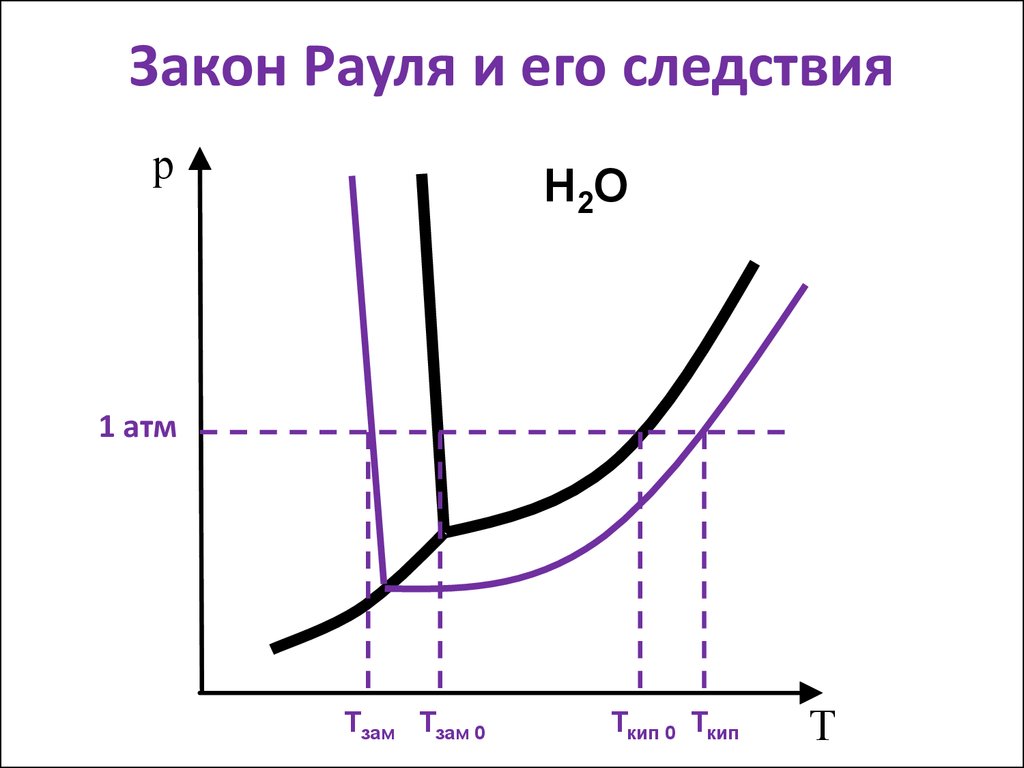
13. Закон Рауля и его следствия
рН 2О
1 атм
Тзам Тзам 0
Ткип 0 Ткип
Т
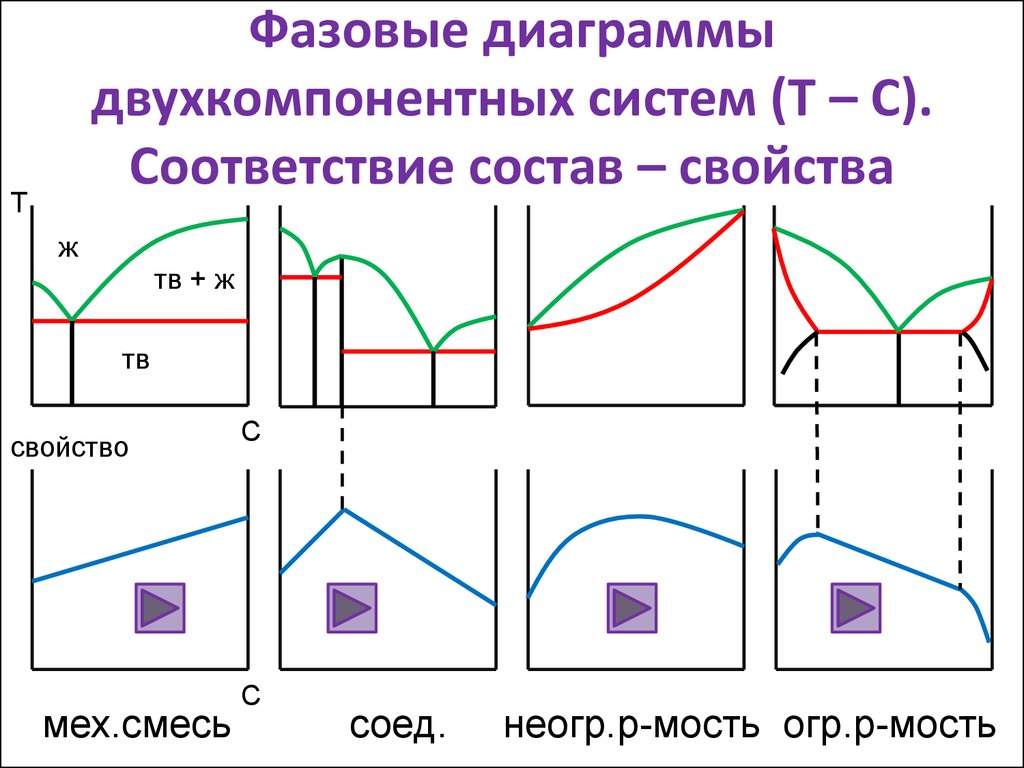
14. Фазовые диаграммы двухкомпонентных систем (Т – С). Соответствие состав – свойства
Тж
тв + ж
тв
свойство
мех.смесь
С
С
соед.
неогр.р-мость огр.р-мость
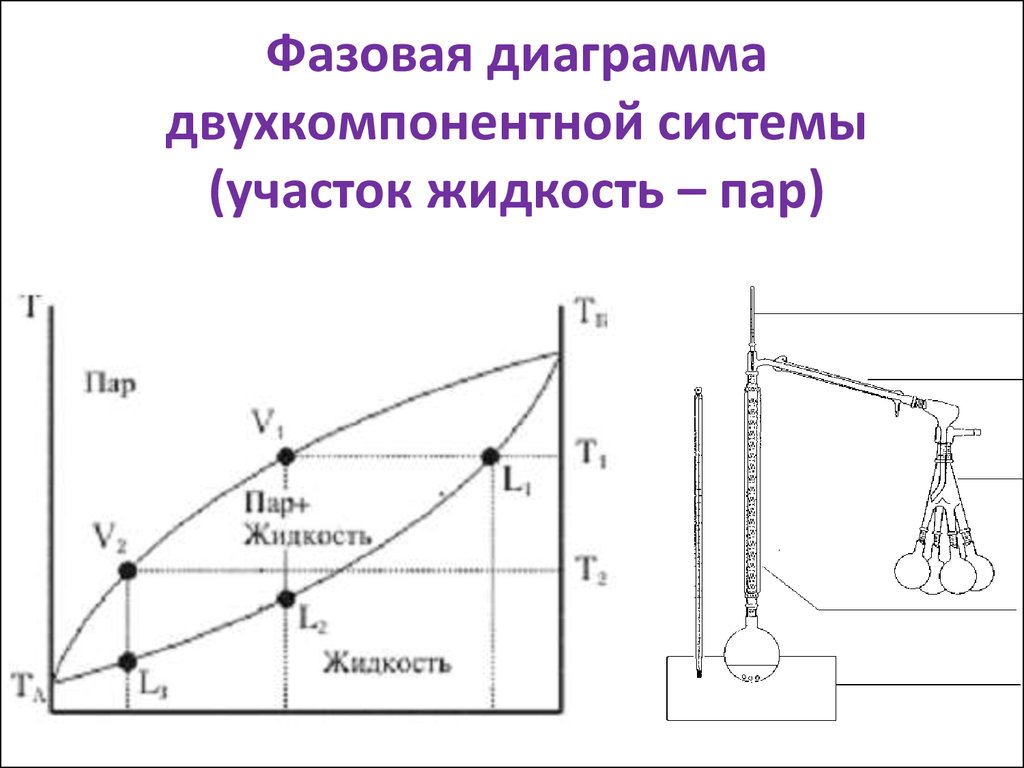
15. Фазовая диаграмма двухкомпонентной системы (участок жидкость – пар)
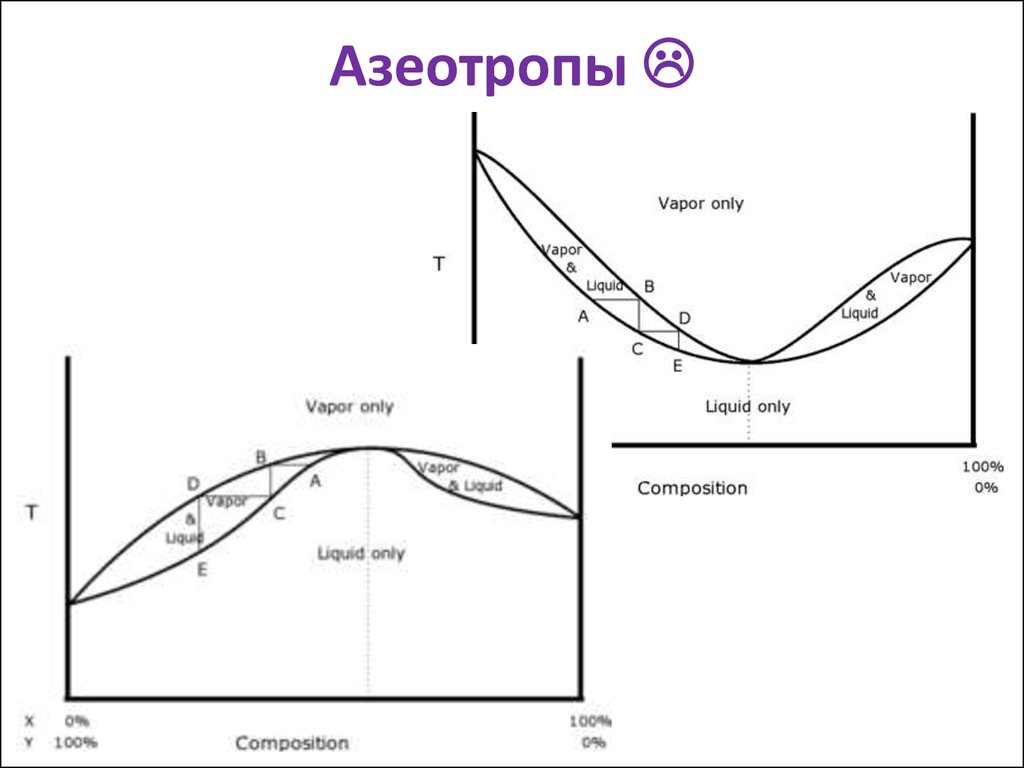
16. Азеотропы
Азеотропы17. Диаграмма (не фазовая )
Диаграмма (не фазовая )18.
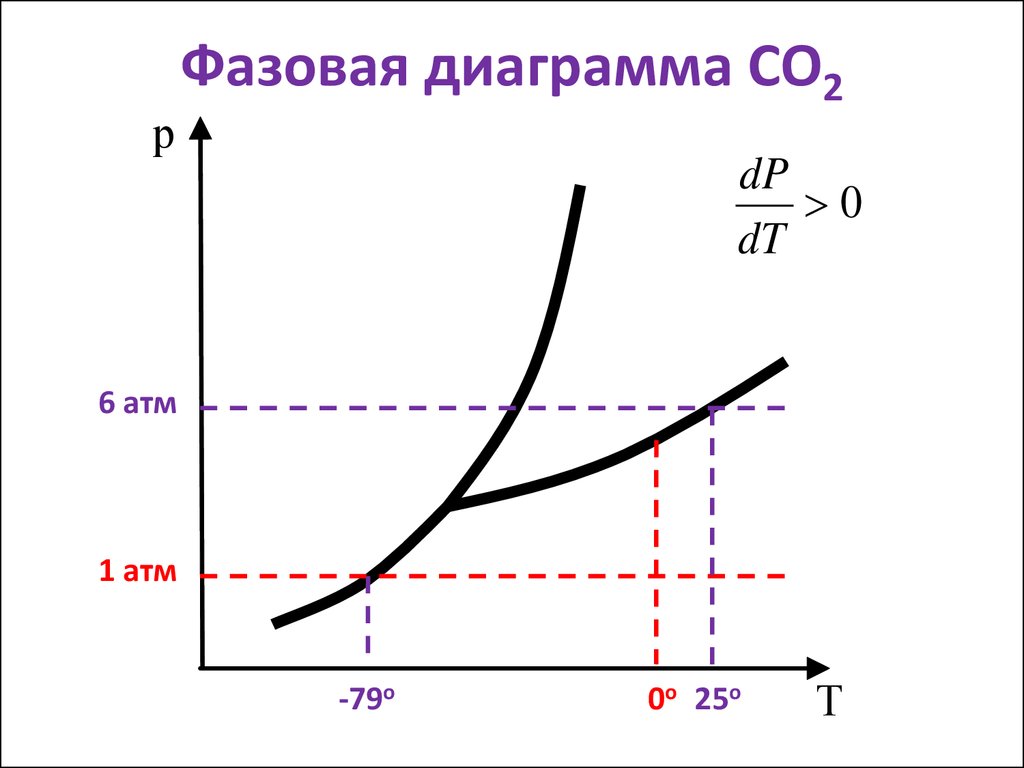
19. Фазовая диаграмма СО2
рФазовая диаграмма СО2
dP
0
dT
6 атм
1 атм
-79о
0о 25о
Т
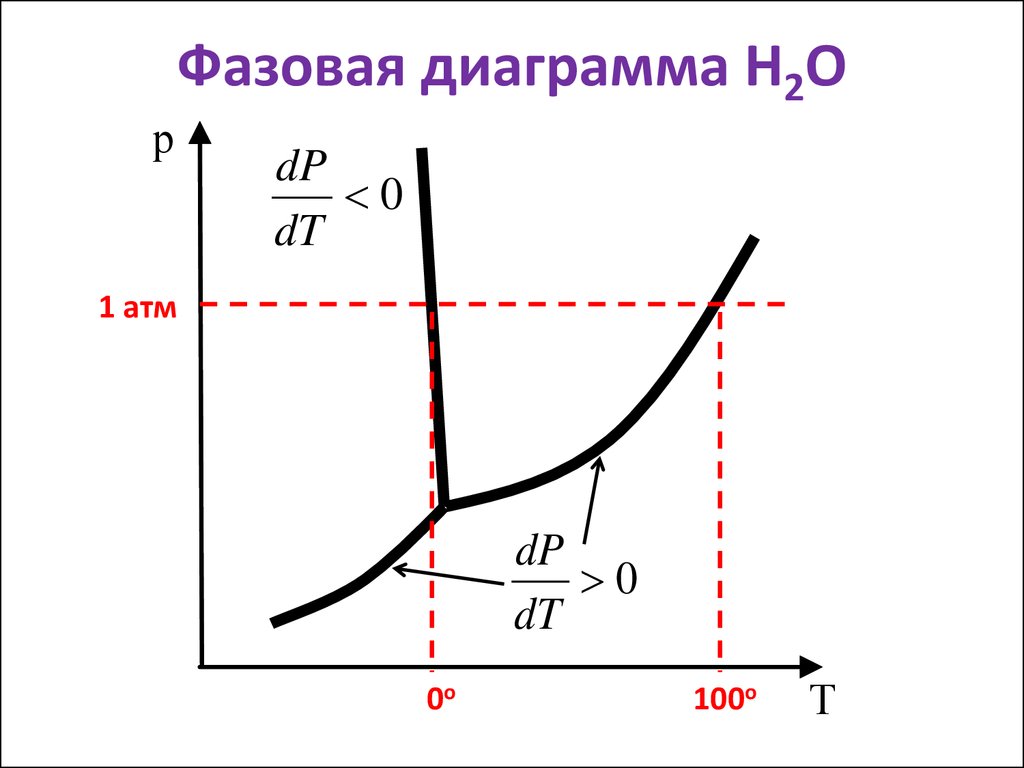
20. Фазовая диаграмма Н2О
рdP
0
dT
1 атм
dP
0
dT
0о
100о
Т
21.
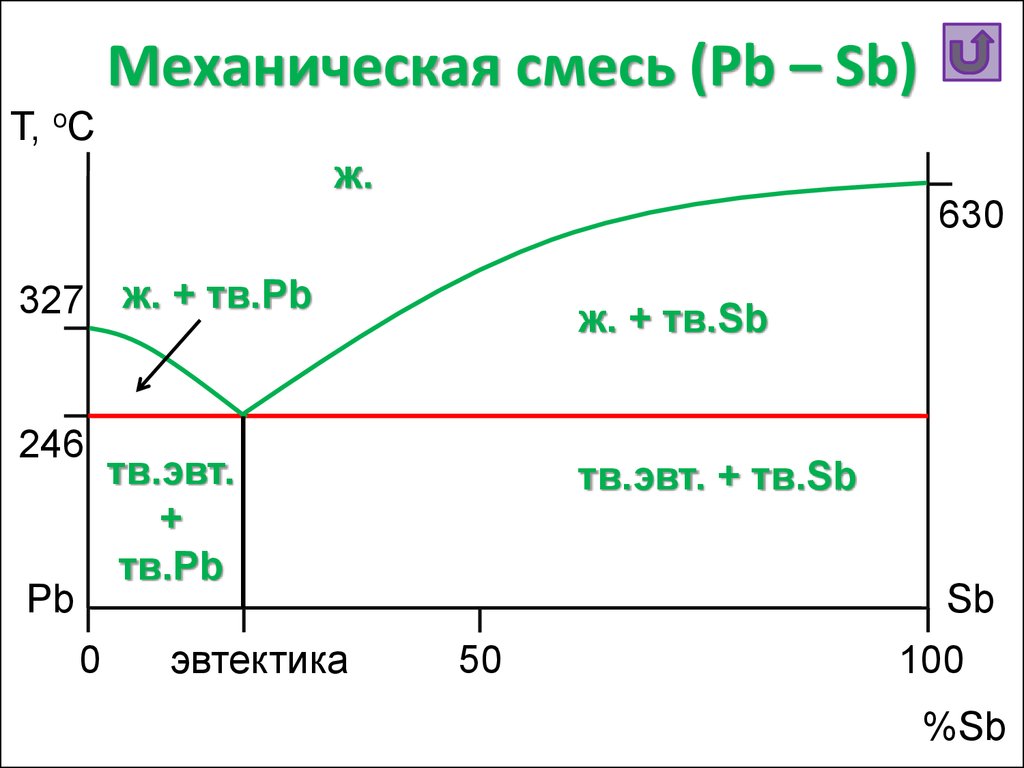
22. Механическая смесь (Pb – Sb)
Т, oCж.
630
327 ж. + тв.Pb
246
Pb
0
ж. + тв.Sb
тв.эвт.
+
тв.Pb
эвтектика
тв.эвт. + тв.Sb
Sb
50
100
%Sb
23. Система с химическим соединением (Mg – Pb)
Т, oC650 ж. + тв.Mg
ж. + тв.Mg2Pb
ж.
тв.эвт.1 +
тв.Mg2Pb
тв.эвт.1 +
тв.Mg
460
ж. +
тв.Mg2Pb
Mg
0
эвт.1 33
Mg2Pb
тв.эвт.2 +
тв.Mg2Pb
50
ж. + тв.Pb
327
тв.эвт.2 + 250
тв.Pb
Pb
эвт.2
100
%Pb
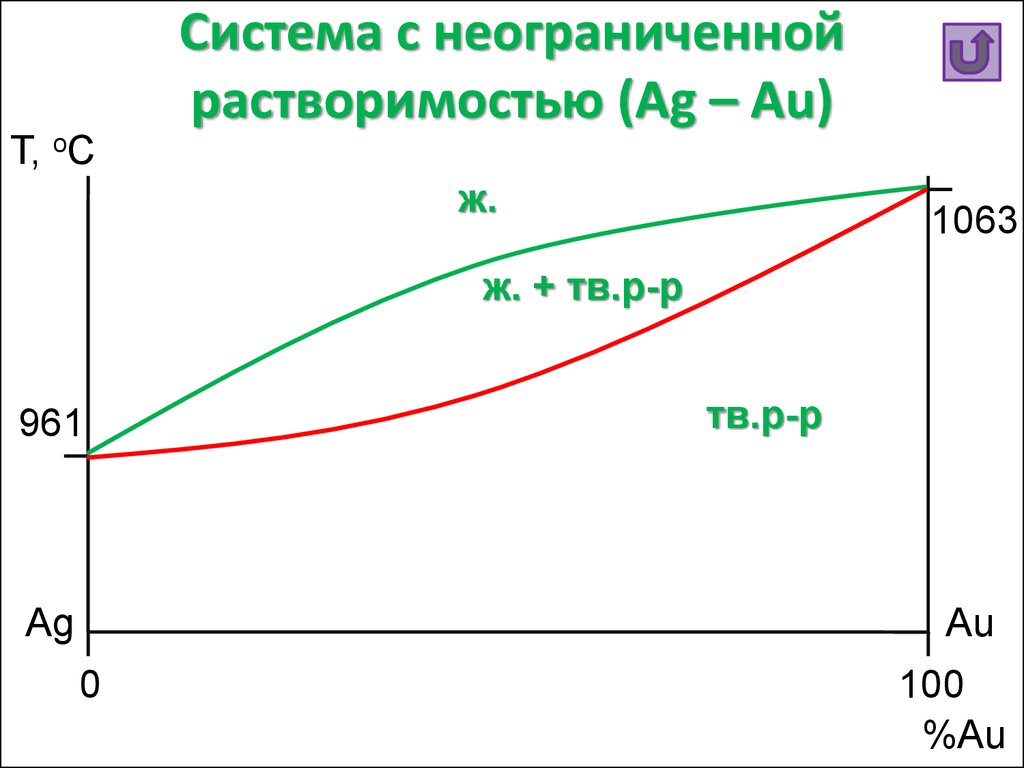
24. Система с неограниченной растворимостью (Ag – Au)
Т, oCСистема с неограниченной
растворимостью (Ag – Au)
ж.
1063
ж. + тв.р-р
961
Ag
тв.р-р
Au
0
100
%Au
25. Система с ограниченной растворимостью (Pb – Sn)
Т, oC327 тв.р-р1 (Sn в Pb)
ж.
тв.р-р2 (Pb в Sn)
ж. + тв.р-р1
ж. +
тв.р-р2
232
183
эвт. + тв.р-р1
эвт. + тв.р-р2
Pb
Sn
0
50
100
%Sn








 physics
physics








