Similar presentations:
Растворы. Задачи
1.
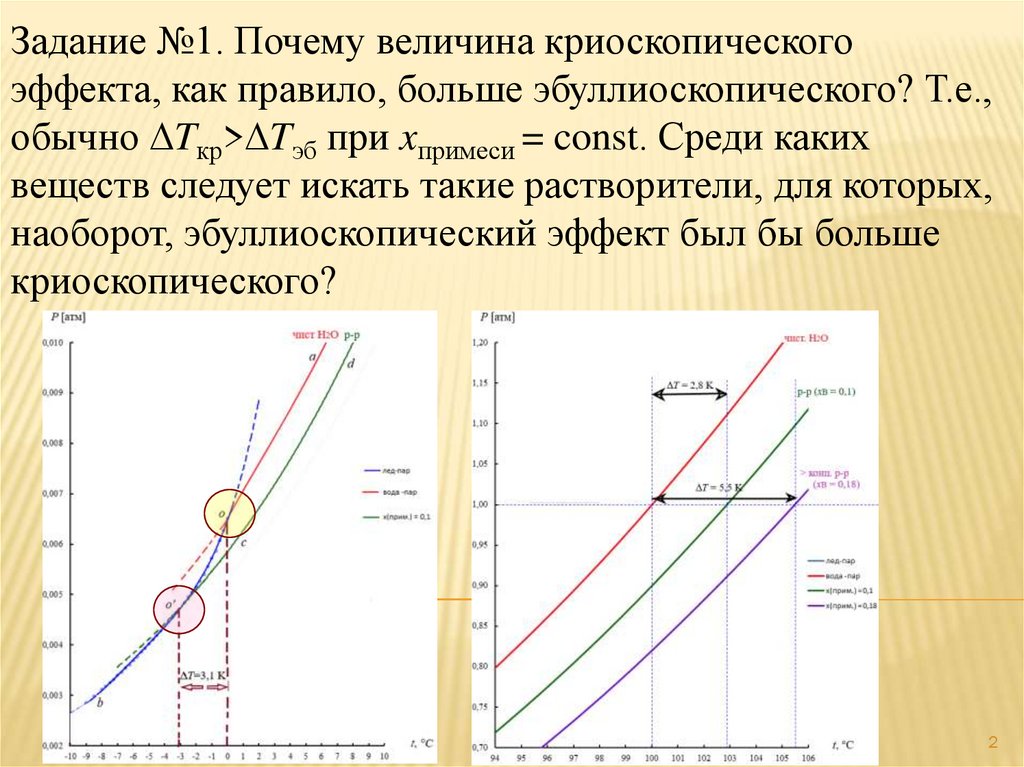
Задание №1. Почему величина криоскопическогоэффекта, как правило, больше эбуллиоскопического? Т.е.,
обычно Tкр> Tэб при xпримеси = const. Среди каких
веществ следует искать такие растворители, для которых,
наоборот, эбуллиоскопический эффект был бы больше
криоскопического? Раствор считать идеальным.
1
2.
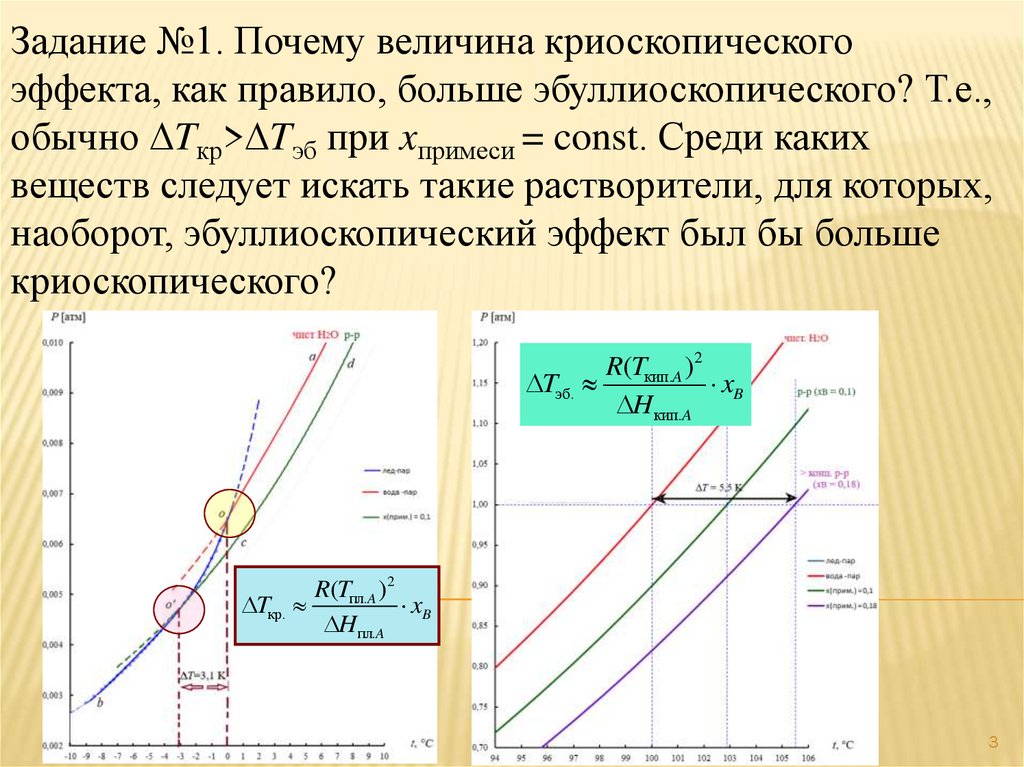
Задание №1. Почему величина криоскопическогоэффекта, как правило, больше эбуллиоскопического? Т.е.,
обычно Tкр> Tэб при xпримеси = const. Среди каких
веществ следует искать такие растворители, для которых,
наоборот, эбуллиоскопический эффект был бы больше
криоскопического?
2
3.
Задание №1. Почему величина криоскопическогоэффекта, как правило, больше эбуллиоскопического? Т.е.,
обычно Tкр> Tэб при xпримеси = const. Среди каких
веществ следует искать такие растворители, для которых,
наоборот, эбуллиоскопический эффект был бы больше
криоскопического?
R(Tкип.A )2
Tэб.
xB
H кип.A
R(Tпл.A )2
Tкр.
xB
H пл.A
3
4.
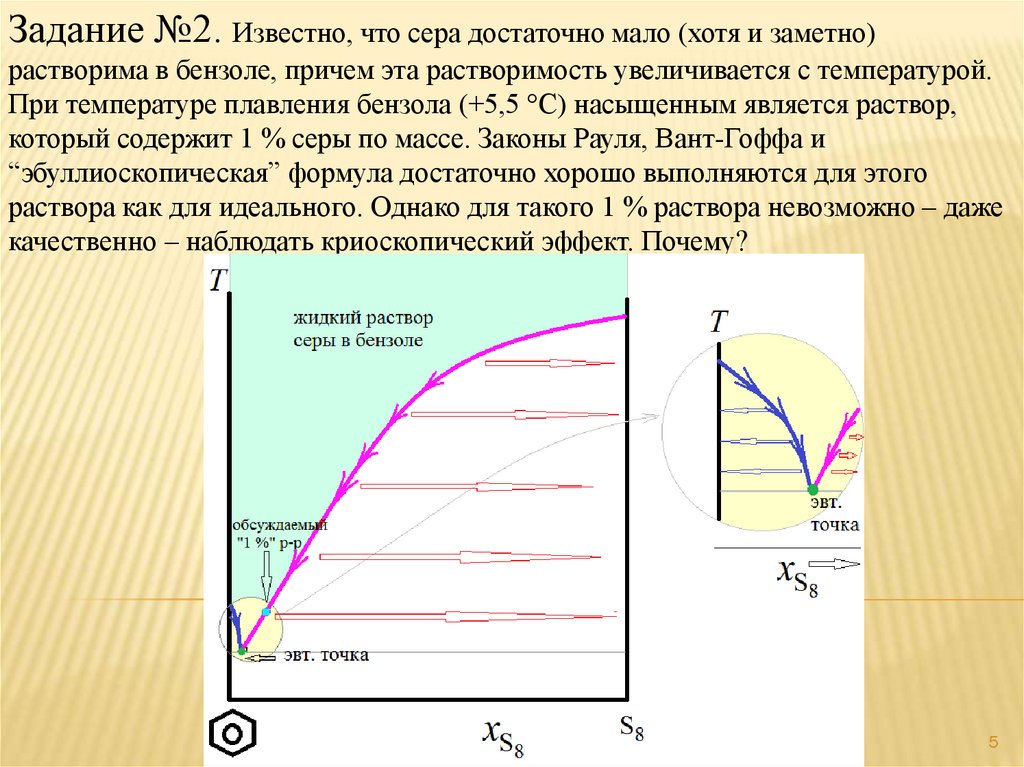
Задание №2. Известно, что сера достаточно мало (хотя и заметно)растворима в бензоле, причем эта растворимость увеличивается с
температурой. При температуре плавления бензола (+5,5 С)
насыщенным является раствор, который содержит 1 % серы по
массе. Законы Рауля, Вант-Гоффа и “эбуллиоскопическая” формула
достаточно хорошо выполняются для этого раствора как для
идеального. Однако для такого 1 % раствора невозможно – даже
качественно – наблюдать криоскопический эффект. Почему?
4
5.
Задание №2. Известно, что сера достаточно мало (хотя и заметно)растворима в бензоле, причем эта растворимость увеличивается с температурой.
При температуре плавления бензола (+5,5 С) насыщенным является раствор,
который содержит 1 % серы по массе. Законы Рауля, Вант-Гоффа и
“эбуллиоскопическая” формула достаточно хорошо выполняются для этого
раствора как для идеального. Однако для такого 1 % раствора невозможно – даже
качественно – наблюдать криоскопический эффект. Почему?
5
6.
Задание №3. В пустой аквариум помещают 2 открытые чашки,содержащие по 100 г жидкостей. В одной находится чистая вода, во
второй – 10 % (масс.) раствор сахарозы в воде. Аквариум с чашками
накрывают сверху крышкой, что предотвращает испарение
жидкости в среду вне аквариума. Полученную конструкцию
оставляют на длительное время при постоянной температуре и
внешнем давлении. Что увидит вернувшийся к наблюдению
экспериментатор?
Каковы будут
концентрации растворов
в каждой из чашек?
Сахарозу считать
нелетучим веществом.
6
7.
Задание №3. В пустой аквариум помещают 2 открытые чашки,содержащие по 100 г жидкостей. В одной находится чистая вода, во
второй – 10 % (масс.) раствор сахарозы в воде. Аквариум с чашками
накрывают сверху крышкой, что предотвращает испарение
жидкости в среду вне аквариума. Полученную конструкцию
оставляют на длительное время при постоянной температуре и
внешнем давлении. Что увидит вернувшийся к наблюдению
экспериментатор?
Каковы будут
концентрации растворов
в каждой из чашек?
Сахарозу считать
нелетучим веществом.
7
8.
Задание №3а. В пустой аквариум помещают 2 открытые чашки,содержащие по 100 г жидкостей. В одной из чашек находится 10 %
(по массе) раствор глицерина, во второй – водный раствор
этиленгликоля с такой же массовой долей. Аквариум с чашками
накрывают сверху крышкой, что предотвращает испарение
жидкости в среду вне аквариума. Полученную конструкцию
оставляют на длительное время при постоянной температуре и
внешнем давлении. Что увидит вернувшийся к наблюдению
экспериментатор?
Каковы будут
концентрации растворов
в каждой из чашек?
Этиленгликоль и
глицерин считать
нелетучими веществами.
Раствор считать
идеальным.
8
9.
Задание №3а. В пустой аквариум помещают 2 открытые чашки,содержащие по 100 г жидкостей. В одной из чашек находится 10 %
(по массе) раствор глицерина, во второй – водный раствор
этиленгликоля с такой же массовой долей. Аквариум с чашками
накрывают сверху крышкой, что предотвращает испарение
жидкости в среду вне аквариума. Полученную конструкцию
оставляют на длительное время при постоянной температуре и
внешнем давлении. Что увидит вернувшийся к наблюдению
экспериментатор? Каковы будут концентрации (мольные доли)
растворов в каждой из чашек? Этиленгликоль и глицерин считать
нелетучими веществами.
xэт = 3.1 мол.% > xгл = 2.1 мол.%
перенос воды в сторону этиленгликоля
nглиц .
nэт.
(nH2O nH 2O ) nглиц (nH2O nH 2O ) nэт.
Это условие равновесия по з-ну Рауля.
xглиц . xэт.
nH 2O – количество перенесенной через
газовую фазу воды в сторону эт-ля.
9
10.
Задание №3а. В пустой аквариум помещают 2 открытые чашки,содержащие по 100 г жидкостей. В одной из чашек находится 10 %
(по массе) раствор глицерина, во второй – водный раствор
этиленгликоля с такой же массовой долей. Аквариум с чашками
накрывают сверху крышкой, что предотвращает испарение
жидкости в среду вне аквариума. Полученную конструкцию
оставляют на длительное время при постоянной температуре и
внешнем давлении. Что увидит вернувшийся к наблюдению
экспериментатор? Каковы будут концентрации (мол. %) растворов в
каждой из чашек? Этиленгликоль и глицерин считать нелетучими
веществами.
xэт = 3.1 мол.% > xгл = 2.1 мол.%
Решая относительно nH O
перенос воды в сторону этиленгликоля получаем nH O 0,926;
2
2
xглииц.= xэт 2.7 мол. %
nэт.
xглиц . xэт.
(nH2O nH2O ) nглиц (nH2O nH 2O ) nэт.
Это условие равновесия по з-ну Рауля.
nглиц .
nH 2O – количество перенесенной через
газовую фазу воды в сторону эт-ля.
10
11.
Задание №4. Мысленный эксперимент.Предложите как можно больше способов
получения жидкой воды из атмосферного воздуха
(например, в условиях пустыни), пользуясь
любыми реактивами и оборудованием. Однако
реактивы надо вернуть в неизменном виде.
11
12.
Задание №5. Мысленный эксперимент.Предложите как можно больше способов опреснения морской воды,
пользуясь любыми реактивами и оборудованием. Однако реактивы
надо вернуть в неизменном виде.
Варианты:
- дистилляция;
- обратный осмос;
- вымораживание (и отбор образовавшегося льда);
- ионный обмен при совместном использовании
катионитов и ионитов:
Na+ + H–(R– R )n = H+ + Na–(R–R)n и
Cl– + HO–(R –R )n = OH– + Cl–(R –R )n (аналогично и с
SO42–); далее: H+ + OH- = H2O;
+
–
- элетродиализ;
Cl– H2O Na+
- электролиз (последний подходит только формально).
12
13.
Задание №6. Мысленный эксперимент.Предложите как можно больше способов
приготовить куриное яйцо вкрутую* в
высокогорных условиях, пользуясь любыми
реактивами и оборудованием. Однако реактивы
надо вернуть в неизменном виде.
* Более корректное задание: денатурировать белок
яйца
13
14.
Задание №7.Просмотреть видео:
https://www.youtube.com/watch?v=JIMswYhNGB0
Объяснить происходящие явления более научно,
чем в ролике.
14
15.
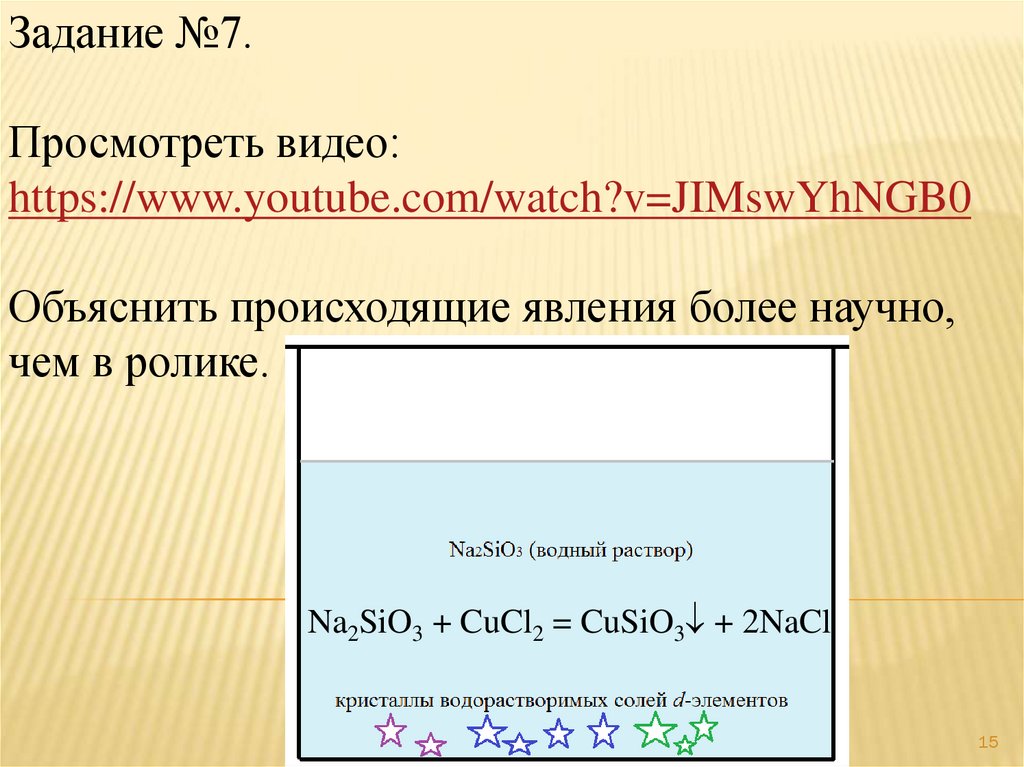
Задание №7.Просмотреть видео:
https://www.youtube.com/watch?v=JIMswYhNGB0
Объяснить происходящие явления более научно,
чем в ролике.
Na2SiO3 + CuCl2 = CuSiO3 + 2NaCl
15
16.
Задание №8.Некоторый гриб, растущий под слоем асфальта, содержит
в своем плодовом теле (т.е. в том, что в быту и называется
грибом) 10 г водорастворимого белка с молекулярной
массой 1000 и 50 г воды (плотность раствора принять за
1,00 г/см3). Сможет ли этот гриб, насыщаясь из почвы
водой, взломать асфальт, если для этого требуется развить
избыточное давление 1 атм? Для простоты считать, что
окружающая гриб почва является практически водной
средой, которая находится при температуре +15 С.
Принять оболочку гриба очень прочной перегородкой,
которая пропускает молекулы воды, но не белка.
16
17.
Задание №8.Некоторый гриб, растущий под слоем асфальта, содержит в своем плодовом теле
(т.е. в том, что в быту и называется грибом) 10 г водорастворимого белка с
молекулярной массой 1000 и 50 г воды (плотность раствора принять за 1,00 г/см3).
Сможет ли этот гриб, насыщаясь из почвы водой, взломать асфальт, если для
этого требуется развить избыточное давление 1 атм? Для простоты считать, что
окружающая гриб почва является практически водной средой, которая находится
при температуре +15 С. Принять оболочку гриба очень прочной перегородкой,
которая пропускает молекулы воды, но не белка.
Решение.
Vр-ра = mр-ра/ р-ра
P Cприм.RT {mбел/(MбелVр-ра)}RT = mбел р-раRT/(Mбелmр-ра)
P {10 1 106/(1000 60)}8,314 (273+15) = 399072 Па 4 атм
Взломает...
17
18.
Задание №9. В 100 г раствора на основе феноласодержится 1 г серы. Этот раствор начинает
кристаллизоваться (равновесие: раствор –
кристаллический фенол) при температуре 40,54 С и
начинает закипать при атмосферном давлении (равновесие
раствор – пар фенола) при температуре 181,55 С. Чистый
фенол при атмосферном давлении плавится при 40,80 С и
кипит при 181,40 С. Стандартная энтальпия плавления
фенола равна 11600 Дж/моль, а стандартная энтальпия
кипения фенола составляет 47300 Дж/моль. На основании
этих данных рассчитать среднее число атомов, входящих в
молекулы серы (фенольный раствор) при температурах
первичной кристаллизации и кипения указанного
раствора.
18
19.
Задание №9. В 100 г раствора на основе фенола содержится 1 г серы. Этотраствор начинает кристаллизоваться (равновесие: раствор – кристаллический
фенол) при температуре 40,54 С и начинает закипать при атмосферном давлении
(равновесие раствор – пар фенола) при температуре 181,55 С. Чистый фенол при
атмосферном давлении плавится при 40,80 С и кипит при 181,40 С.
Стандартная энтальпия плавления фенола равна 11600 Дж/моль, а стандартная
энтальпия кипения фенола составляет 47300 Дж/моль. На основании этих данных
рассчитать среднее число атомов, входящих в молекулы серы (фенольный
раствор) при температурах первичной кристаллизации и кипения указанного
раствора.
2
Tкр.
R(Tпл.A )
xB
H пл.A
Подставим в выражение для xB
1
1 8,314 (40,8 273,2) 2
M Sx
94
40,8 40,54 99
11600
молярные массы (M A , M B ) :
через массы (mA , mB ) и
mB
nB
nB
M B mB M A
xB =
»
=
=
mA
nA + nB nA
mA M B
MA
MSx = 258,065 г/моль
x = 8,044 – это по криоскопии.
По аналогичной формуле для
эбулиоскопии получаем x = 7,017.
19
Среднее x 7,5.
20.
Задание №10. Определите температуру первичнойкристаллизации (с образованием кристаллов бензола)
раствора, содержащего 1,24 г белого фосфора P4 в 89 мл
жидкого бензола. Плотность C6H6 (ж) равна 0,876 г/см3.
Стандартные энтальпии плавления: 9950 и 2510 Дж/моль
для бензола и фосфора соответственно. Температуры
плавления составляют +5,5 С и +44,2 С для бензола и
фосфора соответственно.
Дополнительное задание*. При какой минимальной
температуре может существовать жидкий раствор белого
фосфора в бензоле? Какой состав ему отвечает?
Все растворы считать идеальными.
20
21.
Задание №10. Определите температуру первичной кристаллизации (собразованием кристаллов бензола) раствора, содержащего 1,24 г белого фосфора
P4 в 89 мл жидкого бензола. Плотность C6H6 (ж) равна 0,876 г/см3. Стандартные
энтальпии плавления: 9950 и 2510 Дж/моль для бензола и фосфора
соответственно. Температуры плавления составляют +5,5 С и +44,2 С для
бензола и фосфора соответственно.
Дополнительное задание*. При какой минимальной температуре может
существовать жидкий раствор белого фосфора в бензоле? Какой состав ему
отвечает? Все растворы считать идеальными.
H пл.A 1
1
ln(1 xB )
( *
)
R
T Tпл.A
H пл.B 1
1
ln( xB )
( *
)
R
T Tпл.B
21
22.
Задание №11. Расположить 1 % (мол.) растворыследующих веществ в ряд по понижению температуры
первичной кристаллизации.
Вещества: C2H5OH, KCN, KCl, HCOOH, BaCl2.
Ответ обосновать.
22
23.
Задание №11. Расположить 1 % (мол.) растворыследующих веществ в ряд по понижению температуры
первичной кристаллизации.
Вещества: C2H5OH, KCN, KCl, HCOOH, BaCl2.
Ответ обосновать.
KCN —> K+ + CN–
Вроде бы два иона из одной частицы.
Но далее
CN – + HOH HCN + OH –
Итого 3 иона при полном гидролизе. Но у нас равновесие. Поэтому
количество ионов будет между 2 и 3 на 1 исходную формульную
единицу KCN.
А у KCl гидролиза почти нет. Там 2 частицы.
Итог: р-р KCN нужно расположить между KCl и BaCl2.
23
24.
Задание №12. Распределите следующие растворы 0,01 Мводные растворы в ряд по возрастанию pH:
K2S, K2SO3, K2SO4, KHSO4, H2SO4. Записать необходимые
уравнения диссоциации и гидролиза.
Оцените, будет ли окрашивать 0,01 M раствор KCN
добавленный к нему в качестве индикатора фенолфталеин,
из этот индикатор становится малиновым при pH > 9.
Константа диссоциации HCN по составляет 8 10-10.
24
25.
Задание №13Произведение растворимости хлорида серебра (+1)
составляет при 18 ºС величину 1,1 10-10. При этой же
температуре произведение растворимости хромата
серебра (+1) – Ag2CrO4 – составляет 1,6 10-12. Для каждой
из солей готовят насыщенный водный раствор при
комнатной температуре.
В каком из растворов концентрация ионов серебра
больше? Во сколько раз?
25
26.
Задание №14При 25 ºС произведение растворимости гидроксида
Cd(OH)2 составляет величину 2,1 10-14.
Рассчитайте величину pH насыщенного водного раствора
гидроксида кадмия в предположении полной ионизации
растворенной части этого вещества по основному типу.
Какая масса гидроксида кадмия выпадет в осадок при
охлаждении 1 л насыщенного раствора от 100 ºС до 25 ºС,
если известно, что при 100 ºС ПР = 6 10-10?
Плотности растворов принять за 1 г/см3. Считать, что
гидроксид кадмия в водной среде проявляет только
основные свойства.
26
27.
Задание №15Приготовили водный раствор соляной кислоты с
концентрацией последней 1 10–7.
Рассчитайте pH данного раствора. Проконтролируйте себя
на предмет возможной абсурдности ответа (и удержитесь
от такого ответа).
27
28.
Задание №16*При температурах, близких к комнатной, произведение
растворимости хлорида серебра (+1) составляет величину
1,1 10-10, а карбоната серебра – 6,15 10-12. Какой из осадков
будет обнаружен после добавления капли конц. раствора
нитрата серебра к 1 л раствора, содержащего смесь
хлорида и карбоната натрия и являющегося 0,1 М как по
Na2CO3, так и по NaCl? Считать, что в ходе образования
осадка концентрации хлорида и карбоната натрия в
водном растворе практически не изменяются.
Возможными кинетическими затруднениями, а также
комплексобразованием пренебречь.
28
29.
Задание №17*. Имеются 2 склянки, каждая из которых содержит100 мл 0,1 М водного раствора NaOH. Через каждую из склянок
барботируют газы: через 1-ую пропускают SO2, через 2-ую H2S.
а)* Оцените pH 1-го и 2-ого растворов (комнатная температура),
полученных при поглощении щелочью 0,112 л (н.у.) SO2 (1-ый р-р)
и H2S (2-ой р-р).
Продолжение задачи. Барботирование газов продолжают до
насыщения – до момента, когда газы перестают растворяться. В
первой склянке среда становится кислой, а во второй – сохраняется
щелочной (условия опыта стандартные).
б)* Почему так происходит? Какие компоненты присутствуют в
склянках после насыщении р-ров газами?
в)** Оцените величины pH растворов, которые получились при
полном насыщении каждого из растворов указанными газами.
Для справки.
Для H2S: Ka1 = 1 10–7; Ka2 = 2,5 10–13;
Для H2SO3: Ka1 = 1,4 10–2; Ka2 = 6,2 10–8.
29

























 chemistry
chemistry