Similar presentations:
Углеводы: классификация, строение и физико-химические свойства
1. Лекция на тему: Углеводы: классификация, строение и физико-химические свойства.
Министерство здравоохранения УкраиныЗапорожский государственный медицинский университет
Кафедра органической и биоорганической химии
Лекция на тему: Углеводы:
классификация, строение и
физико-химические свойства.
1
2. План лекции
1. Углеводы. Общая характеристика2. Углеводы. Классификация.
3. Углеводы. Функции в живых организмах.
4. Углеводы. Классификация.
5. Моносахариды. Классификация, строение (структурная и
пространственная изомерия).
6. Таутомерия. Кольчато-цепная таутомерия.
7. Моносахариды. Физико-химические свойства.
8. Таутомерия. Кето-ендиольная таутомерия.
9. Некоторые
представители моносахаридов,
играющие
важную роль в биохимических процессах.
10. Олигосахариды. Классификация, химические свойства.
11. Полисахариды. Классификация, химические свойства.
2
3.
Углеводы. (Сахара, карбогидраты).Термин “углеводы” – предложен К.Г.Шмидтом в 1844г
Cn(H2O)m
(n=3-9)
Углеводы чрезвычайно распространены в природе.
80% сухой массы растений и 2% животных приходится
на углеводы.
Простейшие углеводы синтезируются фотосинтезом.
Фотосинтез характерен для высших и низших растений
(водоросли, лишайники, цианобактерии т.д. ).
Фотосинтез осуществляется в две стадии:
световая стадия (синтез АТФ, востановленнного
НАДФ и выделение кислорода):
2Н2О = 4Н+ + 4е + О2
темновая стадия (синтез моносахаридов с участием
образованих в световой стадии АТФ и востановленного
НАДФ):
6СО2 + 12Н2О + 18АТФ + 12 (НАДФН+Н+) = C6H12O6 +
18Н3РО4 + 18 ФДФ + 12НАДФ
3
4.
Углеводы.Углеводы – один из основных пищевых продуктов. На углеводы
приходится 2/3 рациона человека и по калорийности 55%.
Продукт
Рис
Крупа перловая
Мука пешеничная
Мука ржаная
Чернослив
Мука гречневая
Горох
Фасоль
Хлеб пшеничный
Картофель
Вишня
Дыня
Буряки столовые
Арбуз
Капуста белокачанная
Содержание
углеводов,%
75,8
73,8
73,6
70,4
69,0
67,4
54,1
53,8
42,4
20,0
14,3
11,3
10,4
9,0
5,3
4
5.
Углеводы.Углеводов в биосфере больше, чем всех органических соединений
вместе взятых. Растительные полисахариды можно считать
восстаналивающимся природным сырьем, которое заменит нефть,
газ, уголь.
2500г
2100г
2050г
5
6.
Углеводы. Функции в живых организмах.В живых организмах углеводы выполняют следующие функции:
Энергетические (энергия, выделяемая в процессе их окисления, запасается
в макроэргических связях АТФ и в дальнейшем используется для обеспечения
энергетических потребностей клеток);
Структурные (нерастворимые полисахариды играют важную роль в
поддержании структуры растений). Аналогичную функцию выполняют
полисахариды соединительной ткани животных;
Пластические (углеводы используются для образования других классов
органических веществ в клетках гликопротеидов, протеогликанов, нуклеотидов и т.д.);
Депонирующие (полисахариды (крахмал, гликоген) представляют собой
своеобразное депо глюкозы в организме растений и животных, обеспечивающие поддержание резервного запаса глюкозы, как энергетического
субстрата и пластического материала);
Защитные (углеводы принимаю участие в образовании антител у животных,
которые обеспечивают защиту организма от чужеродных агентов);
Информационные (углеводы входят в состав рецепторов и участвуют в
процессе «узнавания» различных лигандов).
6
7.
Углеводы. Классификация.Углеводы (сахара, карбогидраты) огромная группа природных и
синтетических веществ, которые по химическому строению являются
полигидроксильными соединениями, содержащими альдегидную или
кетонную группу или образуют их в результате гидролиза.
Моносахариды
состоят из одного углеводного звена, не способны гидролизоваться
Олигосахариды
образуют при гидролизе от 2 до 10 молекул моносахаридов
Полисахариды
Гидролизуються с образованием более 10 молекул моносахаридов
7
8.
Моносахариды. Классификация.Моносахариды (монозы) – полигидроксильные соединения,
содержащие альдегидную или кето-группу
Характер оксогрупп
(химическое строение)
кетоза
CH2OH
HO
C O
H
альдоза
H
O
C
H
OH
H
OH
H
OH
H
OH
H
OH
CH2OH
D-фруктоза
кетогексоза
Длина углеродной цепи
Принадлежность к классу углеводов
числитель+окончание «оза»
CH2OH
Триозы не считаются сахаридами
Тетрозы в природе не встречаются
Пентозы
Гексозы
D-рибоза
альдопентоза
8
9.
Построение проекционных формул ФишераO
O
H C H
H
HO
H
OH
OH
HO
H
H
H
OH
H
O
HO
HO
H
H
HO
H
HO
C
H
H
HO
H
H
C H
OH
H
OH
OH
H
H
OH
CH2OH
D-глюкоза
1. Главная углеродная цепь располагается вертикально
2. Асимметрический атом углерода в плоскости чертежа
3. Заместители, расположенные горизонтально находятся
над плоскостью, вертикально - за плоскостью
9
10.
Моносахариды. Пространственная изомерияH
H
H
O
D-глицериновый альдегид
H
OH
H
OH
H
H
H
CH2OH
CH2OH
O
*
HO
* OH
H
O
L-глицериновый альдегид
H2C
OH
H
O
H
OH
OH
H
OH
* OH
HO
CH2OH
D-Альдогексоза
Последний ассиметрический
атом углерода
* H
CH2OH
L-Кетогексоза
10
11.
Число оптических изомеров: N=2nH
O
C
* OH
H
H
C
H
HO
O D-эритроза
H
O
C
C
*
H
OH
HO
H
*
H
OH
H
OH
*
H
OH
H
OH
CH2OH
CH2OH
O
H
C
C
H
H
H
H
* OH HO
* OH
H
* OH
* OH
CH2OH
D-алоза
O
H
H
O
OH
H
HO
H
H
D-треоза
C
OH
HO
H
H
HO
H
H
OH
O
H
C
пентозы
OH
CH2OH
D-ксилоза
H
O
C
CH2OH
D-арабиноза
H
O
H
O
C
C
H
тетрозы
CH2OH
H
H
H
H
CH2OH
D-рибоза
O
C
D-глицериновый
альдегид
* OH
* OH
H
триоза
CH2OH
O
H
Генетический ряд D-альдоз:
O
C
D-ликсоза
H
O
H
O
C
C
OH HO
H
H
OH HO
H
OH HO
H
H
H
OH
H
OH HO
H
HO
H гексозы
H
OH
H
OH
H
OH HO
H
HO
H HO
H
HO
H
H
OH
H
OH
H
OH
OH
H
OH H
OH
HO
H
CH2OH
CH2OH
CH2OH
CH2OH
CH2OH
D-альтроза
D-глюкоза
D-манноза
D-гулоза
D-идоза
H
OH HO
H
H
OH
CH2OH
CH2OH
D-галактоза
D-талоза
11
12.
Строение моносахаридов.Моносахариды не образуют гидросульфитные производные, не
реагируют с фуксинсернистой кислотой
H H OH H
O
O
HOCH2
C
OH OH H OH
H
+
R'
NaHSO3
OH
+
H
C
OH
R'
C
R
H
R
полуацеталь
D-глюкоза
Карбонильная и гидроксильная группы моносахаридов взаимодействуют
внутримолекулярно с образованием циклического полуацеталя:
полуацетальный
гидроксил
Циклические формулы
моносахаридов по
Колли-Толленсу
аномерный центр
-
H + O
1C
1
HO C H
H
2
OH
HO
3
H
H
4
OH
H
5
6
O
CH2OH
-D-глюкопираноза
H
2
OH
HO
3
H
H
4
OH
..
H 5 O
.. H
6
CH2OH
D-глюкоза
1
H C OH
H
2
OH
HO
3
H
H
4
OH
H
5
O
6
CH2OH
-D-глюкопираноза
12
13.
Строение моносахаридов.Гидроксильная
группа
при
аномерном
центре
называется
полуацетальной или гликозидной.
Диастереомеры – стереоизомеры, которые не являются
зеркальним отображением один одного.
Аномеры – диастереомеры, отличающиеся конфигурацией
аномерного атома углерода.
перспективные формулы моносахаридов по Хеуорсу (1929 г)
O
пиранозныый цикл
полуацетальный
гидроксил
6
CH2OH
O H
H
H
4
1
OH H
HO 3
2 OH
H
OH
5
-D-глюкопираноза
O
фуранозный цикл
полуацетальный
гидроксил
6
HO
CH2OH
5
4
H
H O
OH
3
H
-D-глюкофураноза
OH
H
1
H
OH
2
13
14.
Строение моносахаридов.Заместители, расположенные слева от углеродной цепи,
изображаются в формуле Хеуорса над плоскостью цикла, а
заместители, расположенные справа – под плоскостью. У аномера моносахаридов D-ряда полуацетальный гидроксил
находится под плоскостью цикла (в транс-положении по
отношению к группе –СН2ОН), а у -аномера – над плоскостью (в
цис-положении по отношению к группе –СН2ОН).
полуацетальный
гидроксил
полуацетальный
гидроксил
1
H
2
HO
3
H
4
H
5
1
HO C H
H
2
HO
3
H
4
H
5
6
6
OH O
H
HO
CH2OH
5
4
H
H O
OH
3
H
OH
H
1
H
OH
2
OH
CH2OH
CH2OH
Циклическая формула по
Колли-Толленсу
6
6
CH2OH
5
O H
H
OH
O
H
4
1
H
OH H
HO 3
2 OH
OH
OH
-D-глюкопираноза H
H C OH
-D-глюкофураноза
Циклическая формула по
Хеуорсу
14
15.
Моносахариды. Конформации.Аналогично к циклогексану, пиранозный цикл моносахаридов может иметь
две конформации: форма «кресла» или форма «ванны». Более энергетически
выгодной является форма «кресла». В молекуле -глюкопиранозы
полуацетальный гидроксил расположен экваториально, а в -глюкопиранозе
аксиально. Более энергетически выгодным является экваториальное
положение, в данном случае не наблюдается взаимоотталкивания
гидроксильных групп 1 и 2 положения.
H
OH
H
H2C
O
HO
OH
H2C
O
HO
H
H
H
HO
H
HO
H
H
OH
H
OH
Аксиальное
расположение
-Глюкопираноза
OH
OH
H
Экваториальное
расположение
-Глюкопираноза
15
16.
Строение моносахаридов.рацемическая форма - и -аномеров
Таутомерия.
кольчато-цепная или цикло-оксо-таутомерия.
CH2OH
HO
H O
H
OH
H
H
H
OH
H
OH
-D-глюкофураноза
CH2OH
HO
H O
H
OH
OH
H
H
H
OH
-D-глюкофураноза
CH2OH
O
Н
Н
ОН
OH H
HO
H
OH
D-глюкопираноза
O
C
H
OH
CH2OH
H
O H
H
OH H
HO
OH
H
OH
H
-D-глюкопираноза (~36%)
H
OH
H
OH
D-глюкоза
CH2OH
H
O OH
H
OH H
HO
H
H
OH
(~0,024%)
-D-глюкопираноза (~64%)
HO
CH2OH
Мутаротация – самопроизвольное изменение величины
оптического вращения свежеприготовленных растворов оптически
активных соединений.
16
17.
Химические свойстваПо цепной форме
H
По циклической форме
O
CH2OH
H
O H
H
OH H
HO
OH
H
OH
C
H
OH
HO
H
H
OH
H
OH
CH2OH
Внутримолекулярная дегидратация
HO
OH
CH HC
H
HCl; t
H
C
CH
O
C
O H HO
H
альдопентоза
HO
H
HOH2C
- 3H2O
O
Реакция позволяет
отличить гексозы
от пентоз
O
C
H
фурфурол
OH
CH HC
C
C
O H HO
альдогексоза
HCl; t
H
C
O
H
- 3H2O HOH2C
O
C
O
H
5-гидроксиметилфурфурол
17
18.
4. Реакции с участием альдегидной группыВзаимодействие с гидроксиламином
H
O
H
C
H
HO
N
OH
C
C
OH
H
H
OH
H
OH
H2N_OH
H
HO
- H2O
OH
H
OH
-H2O
H
H
H
H
OH
H
OH
AgOH
HO
HO
- AgCN
- H2 O
H
H
OH
H
OH
CH2OH
CH2OH
оксинитрил
D-арабиноза
O
HC N NH C6 H5
C
H
O
C
OH
HO
CH2OH
оксим
D-глюкоза
Образование озазонов
H
H
CH2OH
H
OH
N
OH
H
H
OH
H
OH
CH2OH
D-глюкоза
C
_
_
3 C6H5 NH NH2, t
_ C H _ NH ; _ NH ; _ 2H O
6 5
2
3
2
HO
N NH C6 H5
H
H
OH
H
OH
CH2OH
озазон
D-Глюкоза, D-манноза и D-фруктоза дают один и тот же озазон
18
19.
Химические свойства.Окисление в кислой и нейтральной среде приводит к
образованию „альдоновых кислот”
H
HO
O
C
C
H
HO
H
HO
H
H
CH2OH
H
OH
H
H
OH
H
OH
CH2OH
_
CОО
ОH
H
OH
OH
O
D-глюкоза
HBrO (Br 2+H2O)
HO
OH
H
H
OH
H
OH
CH2OH
D-глюконовая кислота
Са2+
. Н2 О
2
кальция глюконат
применяется в медицине при аллергических
заболеваниях, кровотечениях, заболеваниях кожи,
токсических поражениях печени и др.
19
20.
Химические свойства.Сильные окислители (конц.НNO3) образуют „альдаровые” или
„сахарные кислоты”.
H
O
COOH
C
H
HO
H
OH
H
H
OH
H
OH
CH2OH
D-глюкоза
HNO3 конц.
HO
OH
H
H
OH
H
OH
COOH
D-глюкаровая кислота;
D-сахарная кислота
20
21.
Химические свойства.Окисление в щелочной среде
Альдозы и кетозы восстанавливают в щелочной среде Ag(NH3)2OH –
реактив Толленса и комплекс Cu2+ с тартрат-ионом – реактив Фелинга.
При этом гликоновые кислоты образуются в незначительном количестве,
так как в щелочной среде протекает деградация углеродного скелета
моносахаридов.
R C
O
H
альдоза
R C
O
H
+ [Ag(NH3)2]OH
Ag
+
продукты деструктивного окисления
реактив Толленса
+ Cu2+ (комплекс)
Cu2O
+ продукты деструктивного окисления
реактив Фелинга
21
22.
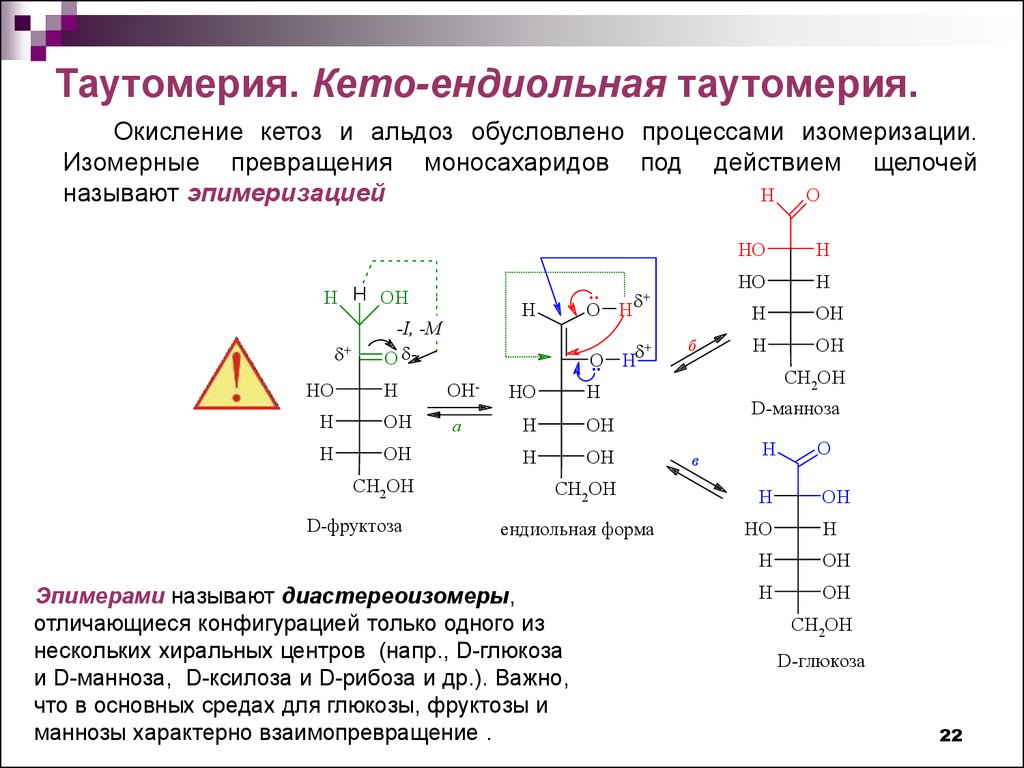
Таутомерия. Кето-ендиольная таутомерия.Окисление кетоз и альдоз обусловлено процессами изомеризации.
Изомерные превращения моносахаридов под действием щелочей
H
O
называют эпимеризацией
H H OH
+
HO
-I, -M
O H
H
OH
H
OH
CH2OH
D-фруктоза
OHа
H
..
+
O H
HO
+
O
H
..
H
H
OH
H
OH
CH2OH
ендиольная форма
Эпимерами называют диастереоизомеры,
отличающиеся конфигурацией только одного из
нескольких хиральных центров (напр., D-глюкоза
и D-манноза, D-ксилоза и D-рибоза и др.). Важно,
что в основных средах для глюкозы, фруктозы и
маннозы характерно взаимопревращение .
б
HO
H
HO
H
H
OH
H
OH
CH2OH
D-манноза
в
H
O
H
OH
HO
H
H
OH
H
OH
CH2OH
D-глюкоза
22
23.
Химические свойства. Реакции с участием циклических формОбразование гликозидов
CH2OH
O H
H
H
2
OH H
HO
OH
H
OH
2C2H5OH
HСl (газ)
-2H2O
-D-глюкопираноза
CH2OH
O H
H
H
OH H
HO
O
H
OH
+
C2 H5
этил- -D-глюкопиранозид
CH2OH
O O
H
H
OH H
HO
H
H
OH
C2 H5
этил- -D-глюкопиранозид
Неуглеводная часть молекулы гликозида – агликон
Связь между аномерным атомом углерода и агликоном - гликозидная
Гидролиз гликозидов
CH2OH
O H
Н
Н
+ H2O
OH H
HO
OCН3
H
OH
метил- -D-глюкопиранозид
CH2OH
O
Н
+
H
Н
ОН + CH3OH
OH H
HO
H
OH
D-глюкопираноза (смесь - и -аномеров)
23
24.
В зависимости от гетероатома через который осуществляется связьгликона с агликоном, гликозиды подразделяют на:
S-гликозиды (синигрин);
N-гликозиды (нуклеозиды, например: цитидин, уридин, тимидин,
аденозин, инозин и др.);
О-гликозиды (амигдалин, рутин, арбутин и др.).
O
O
NH2
N
N
CH3
CH3
OO
OMe
OH OH
Строфантин К
O
H
CH2OH
O
OH
OH
OH
Аденозин
CH2OH
O
OH
OH
OH
HOH2 C
OH
H2C
H
H
O
O
OH
CH3
H
N
N
HO
O H
H
OH H
S
H
OH
O
O
S
OK
O
N
Синигрин
24
25.
Химические свойства. Реакции с участием циклических формАлкилирование
CH2OH
O H
Н
Н
OH H
HO
OH
H
OH
-D-глюкопираноза
CH2OCH3
O
Н
5CH3I
Н
ОCН3
OCН3 H
BaO
H3C O
OCН3
H
CH2OCH3
O
Н
+
Н2О; Н
Н
ОН
H
OCН
- СН3ОН
3
H3CO
OCН3
H
метил-2,3,4,6-тетраметилD-глюкопиранозид
2,3,4,6-тетраметилD-глюкопираноза
Ацилирование
CH2 OH
H
OH
O
P
OH
CH2 OAc
O
H
OH
H
H
OH
OH
HO
D-глюкопиранозa
5(CH3CO)2O
СН3COONa
H
Ac O
H
O
OAc
H
H
OAc
ОAc
+ 5AcOH
где Ас = СН3СО-
пентаацетилглюкопираноза;
пента-О-ацетил-D-глюкопираноза
H2C O
O H
H
H
OH H
HO
OH
H
OH
Глюкозо-6-фосфат
25
26.
Химические свойства.При селективном окислении первичной спиртовой группы
образуются уроновые кислоты.
COOH
CH2 OH
H
O
H
OH
ОCH3
H
O
H
[O]
H
OH
H
H
OH
ОCH3
HO
HO
OH
H
метил-D-глюкопиранозид
COOH
H
H
O
OH
H
H
OH
ОH
HO
H2O; H+
-CH3OH
H
O
H
OH
HO
H
H
OH
H
OH
HO
O
D-глюкуроновая кислота
Уроновые кислоты участвуют в процессе выведения из организма
токсичных веществ
26
27.
Химические свойства.Восстановление
При восстановлении карбонильной группы альдоз образуются
многоатомные спирты – глициты.
H
H
HO
H
C
H
O
H
OH
CH2OH
D-ксилоза
H
[H]
HO
H
H
OH
H
C H2OH
C
CH2OH
OH
O
HO
H
OH
H
OH
CH2OH
H
OH
D-ксилит
H
OH
CH2OH
D-глюкоза
[H]
HO
OH
H
H
OH
H
OH
CH2OH
D-сорбит
D-Ксилит и D-сорбит — заменители сахара.
27
28.
Химические свойства. Энергетический обмен с участиеммоносахаридов
Гликолиз:
Глюкоза → глюкозо-6-фосфат → фруктозо-6-фосфат → диоксиацетонфосфат
→ глицеральдегидо-3-фосфат → 3-фосфоглицерат → фосфоенолпируват →
пируват → цикл Кребса
Спиртовое брожение:
Глюкоза → глюкозо-6-фосфат → фруктозо-6-фосфат → диоксиацетонфосфат
→ глицеральдегидо-3-фосфат → 3-фосфоглицерат → фосфоенолпируват →
пировиноградная кислота → уксусный альдегид → этиловый спирт
C6H12O6
дрожжи (зимаза)
2C2H5OH + 2CO2
Молочнокислое брожение (лактатное) Lactobacillius и Streptococcus
Глюкоза → глюкозо-6-фосфат → фруктозо-6-фосфат → диоксиацетонфосфат
→ глицеральдегидо-3-фосфат → 3-фосфоглицерат → фосфоенолпируват →
пировиноградная кислота → молочная кислота
C6H12O6
энзим
2 H3C CH COOH
OH
Глицериновое брожение
Глюкоза→ глицериновый альдегид→глицерин
C6H12O6
энзим
2 H2C CH
CH2
HO OH OH
28
29.
Химические свойства. Брожение моносахаридовПропионовокислое брожение:
Глюкоза→ глицериновый альдегид→глицериновая кислота →пировиноградная кислота→ щавелевоуксусная кислота→ яблочная кислота → фумаровая
кислота → янтарная кислота → пропионовая кислота
энзим
C6H12O6
H3C CH2 COOH + СО2
Маслянокислое брожение (Clostridium):
Глюкоза→пировиноградная кислота→ масляная кислота
C6H12O6
энзим
H3C CH2 CH2 COOH + СО2
Ацетонобутаноловое брожение:
Глюкоза→ глицериновый альдегид→глицериновая кислота
→пировиноградная кислота→ ацетоуксусная кислота → ацетон
C6H12O6
энзим
H3C C
CH3
+ C4H9OH + CO2
O
29
30.
Альтернативный путь окисления глюкозы.Образование аскорбиновой кислоты.
H2C OH
COOH
O
H
O OH
H HO
COOH
HO H2C
OH H
O
OH
OH
OH
OH
OH
-D-глюкоза
УДФ-глюкозо
дегидрогеназа
OH
O
OH
УДФ
L-гулоновая кислота
УДФ-глюкуронат
OH
HO
OH
OH
CH2 CH
O
O
Аскорбиновая кислота
30
31.
Отдельные представители производных моносахаридовАскорбиновая кислота
OH
HO
OH
OH
CH2 CH
O
(витамин С, g-лактон 2,3-дегидро-Lгулоновой кислоты)
O
Впервые в чистом виде витамин С был выделен в 1928 году, а в 1932 году
было доказано, что именно отсутствие аскорбиновой кислоты в пище
человека вызывает цингу (scorbutus)
31
32.
Аскорбиновая кислотаПолинг предполагал, что высокие дозы витамина С
способны защитить человека от многих заболеваний (ОРВИ, онкозаболевания). Даже в то время его
ортодо́ксальная теория не нашла подтверждения.
Дозы аскорбиновой кислоты, превышающие
потребность, могут приводить к физиологическим
расстройствам.
Медицинское применение
Лайнус Карл Полинг
Витаминное средство, оказывает метаболическое
действие, поступает в организм только с пищей.
Участвует в регулировании окислительно-восстановительных процессов, углеводного обмена, свёртываемости крови, регенерации тканей; повышает устойчивость организма к инфекциям, уменьшает сосудистую
проницаемость. Обладает антиагрегантными и
антиоксидантными свойствами
32
33.
Аскорбиновая кислотаФизиологическая потребность — 90 мг/сутки
Верхний допустимый уровень потребления — 2000 мг/сутки
Продукт
Плоды шиповника
Грецкий орех
Черная смородина
Красный перец
Укроп
Клубника
Цитрусовые
Капуста
Картофель
Томаты
Яблоки
Лук
Виноград
Молоко
Витамин С,
мкг/100г
2000-4500
До 3000
100-400
100-400
135
60
25-55
30-40
20-40
20-40
5-40
16-33
0,4-12
0,7-2,6
33
34.
Некоторые представители моносахаридов,играющие важную роль в биохимических процессах
Основное распространение
древесина хвойных, как
полисахариды камеди и
OH гумиарабик
OH
OH
O
OH
OH
Сахарный компонент
сердечных гликозидов
O
OH
OH
OH
OH
L-Арабиноза
HO
H2
C
D-Дигитоксоза
OH
O
HO
H2
C
O
O
OH
CHO
H3C
OH
OH
OH
D-Рибоза
2-Дезоксирибоза
Структурный элемент
коферментов (НАД+, АТФ),
гликозидов и т.д.
Структурный элемент
дезоксирибонуклеиновых
кислот (ДНК)
OH
OH
OH
L-стрептоза
Структурный элемент
антибиотика стрептомицина
34
35.
Некоторые представители моносахаридов,играющие важную роль в биохимических процессах
H2C OH
Структурный фрагмент
полисахарида хитина
H2C
OH
O
OH
OH
Структурный фрагмент
полисахарида
хондроитинсульфата
OH
O
OH
OH
OH
NH2
NH2
D-Глюкозамин
D-Галактозамин
NH2
O
COOH
(CHOH)2
CH2OH
OH
OH
Встречается в виде ацилированих производных по аминои гидроксильной группе. Ацильными фрагментами являются
остатки уксусной и гликолевой кислот. Отмеченные производные
– сиаловые кислоты. Они входят в состав гликопротеидов,
специфических веществ крови, ганглиозидов мозга.
Кроме того, являются нейромедиаторами.
Нейраминовая кислота
35
36.
Дисахариды (биозы)Из природных олигосахаридов по распространению доминируют дисахариды.
Дисахаридами называют углеводы, молекулы которых
состоят из двух остатков моносахаридов одинаковой или
разной природы, соединенных между собой гликозидной
связью
В зависимости от способа образования гликозидной связи
Дисахариды
восстанавливающие
невосстанавливающие
У восстанавливающих дисахаридов гликозидная связь образуется за счет
полуацетальной (гликозидной) гидроксильной группы одного и любой
спиртовой гидроксильной группы (чаще у С4) другого моносахарида. При
этом в молекуле остается одна свободная полуацетальная гидроксильная
группа.
36
37.
Мальтоза (солодовый сахар)-1',4-гликозидная свяя зь
CH2OH
H
O H
H
H
1' + 4
OH H
HO
OH H O
H
OH
-D-глюкопираноза
CH2OH
O
H
OH H
H
6'
OH
OH
D-глюкопираноза
6
CH2OH
CH2OH
O H
O
H 5'
H 5
H
H
1'
OH + H2O
4'
4
OH H
OH H 1
HO
O
2'
2
3'
3
H
OH
H
OH
мальтоза;
4-O-( -D-глюкопиранозил)-D-глюкопираноза
Входит в состав крахмала. В 3 раза мене сладкая, чем сахар. Расщепляется
-амилазой (мальтазой), которая содержится в слюне.
CH2OH
O
CH2OH
O
OH
OH
O
HO
OH
OH
OH
37
38.
Мальтоза. Химические свойства.Растворы мальтозы способны к мутаротации
CH2OH
O H
H
Н
Н
OH H
HO
O
H
OH
-форма
CH2OH
O H
Н
OH H
OH
H
OH
CH2OH
CH2OH
O H
OH
H
Н
O
Н
Н
C
OH H
OH H
H
HO
O
H
OH
H
OH
альдегидная форма
CH2OH
O H
H
Н
Н
OH H
HO
O
H
OH
-форма
CH2OH
O OH
Н
OH H
H
H
OH
38
39.
Мальтоза. Химические свойства.Восстанавливает реактив Толленса, реактив Фелинга
С участием альдегидной формы мальтоза вступает в характерные
для моносахаридов реакции
CH2OH
CH2OH
O
OH OH
H
Н
H
Н
Н
C CN
HCN
OH H
OH H
H
HO
O
оксинитрил
H
OH
H
OH
CH
OH
CH
OH
мальтозы
2
2
CH2OH
CH2OH
O H
OH
H
Н
O H
OH
H
Н
O
Н
Н
H2N OH
Н
Н
H
C
OH
H CH N OH
OH
H
OH
OH H
HO
O
H
HO
O
оксим
H
OH
H
OH
мальтозы
H
OH
H
OH
CH2OH
CH2OH
3 H2 N NH C6 H5 , t
мальтоза
O H
OH
H
Н
- H2O
Н
Н
CH N NH C6 H5
OH H
OH
- C6H5NH2
HO
O
- NH3
H
OH
H
N NH C6 H5
озазон
мальтозы
39
40.
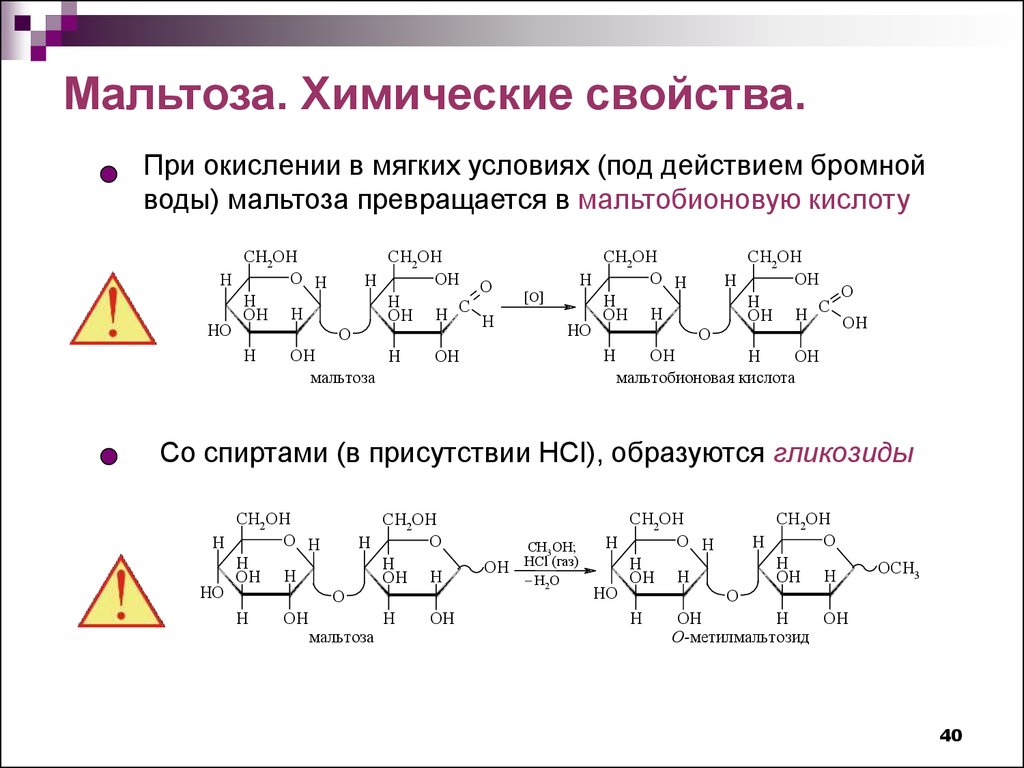
Мальтоза. Химические свойства.При окислении в мягких условиях (под действием бромной
воды) мальтоза превращается в мальтобионовую кислоту
CH2OH
O H
H
Н
Н
OH H
HO
O
H
OH
мальтоза
CH2OH
OH O
Н
C
OH H
H
H
OH
[O]
CH2OH
CH2OH
O
OH
H
Н
H
O
Н
Н
C
OH H
OH H
ОH
HO
O
H
OH
H
OH
мальтобионовая кислота
Со спиртами (в присутствии HCl), образуются гликозиды
CH2OH
O H
H
Н
Н
OH H
HO
O
H
OH
мальтоза
CH2OH
O
Н
OH H
H
OH
CH2OH
CH2OH
O
O H
Н
H
CH3OH;
HCl
(газ)
Н
Н
OH _
OH H
OH H
H2O
HO
O
H
OH
H
OH
O-метилмальтозид
OCН3
40
41.
Мальтоза. Химические свойства.С алкилирующими реагентами образует простые эфиры
CH2OH
CH2OH
O
O
H
Н
H
Н
Н
OH H
OH H
HO
O
H
OH
H
OH
мальтоза
CH2OCH3
CH2OCH3
O
O H
Н
H
CH3I или (CH3)2SO4
Н
Н
OH
OCН3
OCН3 H
OCН3 H
H3CO
O
OCН3
H
OCН3
H
1,2,3,6,2',3',4',6'-окта-О-метилD-мальтозид
С ацилирующими реагентами образует сложные эфиры
CH2OH
CH2OH
O H
O
H
H
H
H
OH H
OH H
HO
O
H
OH
H
OH
CH2OAc
CH2OAc
O
O
H
H
H
(CH3CO)2O
H
H
OH _
OAc H
OAc H
8CH3COOH
AcO
O
OAc
H
OAc
H
OAc
, где (Ac = CH3CO-)
мальтоза
1,2,3,6,2',3',4',6'-окта-Оацетил-D-мальтозид
41
42.
ЦеллобиозаЦеллобиоза является бесцветным кристаллическим веществом, легко
растворяется в воде. Расщепляется -глюкозидазой (нет в организме
человека), не может быть использована в качестве продукта питания.
Входит в состав целлюлозы.
-1',4-гликозидная свяя зь
CH2OH
H
O OH
H
H
4
1' +
OH H
HO
HO
H
H
OH
-D-глюкопираноза
CH2OH
O
H
OH H
H
6'
OH
OH
D-глюкопираноза
6
CH2OH
CH2OH
O
H 5
O
H 5'
H
H
1' O 4
4'
OH H
OH H
HO
2' H
3'
H
OH
3
H
1
OH + H2O
2
OH
целлобиоза;
4-O-( -D-глюкопиранозил)- D-глюкопираноза
42
43.
Целлобиоза. Химические свойства.Растворы целлобиозы способны к мутаротации
Восстанавливает реактив Толленса, реактив Фелинга
При окислении в мягких условиях (под действием бромной
воды) целлобиоза превращается в целлобионовую кислоту
С участием альдегидной формы целлобиоза вступает в
характерные для моносахаридов реакции
Со спиртами (в присутствии HCl), образуются гликозиды
С алкилирующими реагентами образует простые эфиры
С ацилирующими реагентами образует сложные эфиры
43
44.
Целлобиоза. Строение.Различие между мальтозой и целлобиозой - в конфигурации
гликозидной связи, что отражается на их строении.
Гликозидная связь в мальтозе имеет аксиальное, в
целлобиозе – экваториальное положение. Конформационное
строение этих дисахаридов служит первопричиной
линейного строения макромолекул целлюлозы и
спиралеобразного строения амилозы (крахмал),
структурными элементами которых они являются.
44
45.
Лактоза (молочный сахар)Lactum-молоко. Содержание в коровьем молоке 4-5%, женском молоке 8%.
В 4-5 раз менее сладкая, чем сахароза. Лактоза обладает низкой гигроскопичностью, не поддается спиртовому брожению. Применяется в фармации
при изготовлении порошков и таблеток.
-1',4-гликозидная свяя зь
CH2OH
O OH
H
HO
H
1' +
4
OH H
H
H
HO
H
OH
-D-галактопираноза
CH2OH
O
H
OH H
H
6'
OH
OH
D-глюкопираноза
6
CH2OH
CH2OH
O
H 5
O
HO 5'
H
H
1' O 4
4'
OH H
OH H
H
2' H
3'
H
OH
3
H
1
OH + H2O
2
OH
D-лaктоза;
4-O-( -D-глюкопиранозил)-D-глюкопираноза
Ценный пищевой компонент новорожденных. При гидролизе – глюкоза +
галактоза – важна для функционирования головного мозга, развития
нервных клеток, входит в состав суставной жидкости.
45
46.
Лактоза. Химические свойства.Для лактозы характерен ряд реакций, присущий
восстанавливающим дисахаридам
CH2OH
CH2OH
O
H
O
HO
H
H
O
OH H
OH H
H
H
H
OH
H
OH
[O]
OH
лактоза
CH2OH
CH2OH
O
H
OH
HO
H
H
COOH
O
OH H
OH H
H
H
H
OH
H
OH
лактобионовая кислота
Лактоза гидролизуется под действием кислот и ферментов галактозидаз (лактаз), содержащихся в некоторых видах бактерий
и грибов, в кишечнике млекопитающих.
CH2OH
CH2OH
H
O
O
HO
H
H
O
OH H
OH H
H
H
H
OH
H
OH
D-лaктоза
OH
гидролиз
CH2OH
HO
O
H
OH H
H
H
OH
D-галактопираноза
CH2OH
H
O
H
OH +
OH H
HO
H
OH
OH
D-глюкопираноза
46
47.
Невосстанавливающие дисахариды (биозиды)У невосстанавливающих дисахаридов гликозидная связь
образуется за счет полуацетальной (гликозидной) гидроксильной
группы обоих моносахаридов. Эти дисахариды не содержат
свободного полуацетального гидроксила, поэтому в растворах
существуют только в циклических формах.
CH2OH
O H
H
H
OH H
HO
OH
H HO
-D-глюкопираноза
OH
HO CH2 O
+
H
H
OH
HO
CH2OH
H
-D-фруктофураноза
-H2O
CH2OH
H
O H HO CH2 O
H
H
H HO
OH H
CH2OH
HO
O
OH H
H HO
сахароза
47
48.
Сахароза. Содержание в некоторых растенияхРастение
Cвекла сахарная
Сахарный тросник
Сорго
Cвекла столовая
Лук
Свекла кормовая
Морковь
Кукуруза сахарная
Пшеница
Ячмень
Просо
Рис
Овес
%
16-22
15-20
11-15
10
8,5-9,5
8
7
6-7
2,1
2,0
1,9
1,8
1,0
48
49.
Сахароза. Химические свойства.Растворы сахарозы не способны к мутаротации
Не восстанавливает реактив Толленса, реактив Фелинга
Не вступает в характерные для моносахаридов реакции с
участием альдегидной группы
Гидролизуется
С алкилирующими реагентами образует простые эфиры
С ацилирующими реагентами образует сложные эфиры
49
50.
Сахароза. Химические свойства.6'
CH2OH
O H
H 5'
H
1'
4'
OH H
HO 3'
2'
H HO O
6
HO CH2 O
5
H
H
4
HO
3
H2O, H+
2
1CH2OH
H
CH2OH
O OH
H
O H
H
H
H
+
OH H
OH H
HO
CH2OH
HO
OH
H HO
H HO
-D-глюкопираноза
-D-фруктопираноза
OH H
[+52,5]
сахароза
2-О-( -D-глюкопиранозил)- -D-фруктофуранозид
[-92]
[+66,5]
“Инверсия” - изменение в процессе гидролиза
сахарозы знака удельного вращения. Смесь
равных количеств D-глюкозы и D-фруктозы инвертный сахар.
50
51.
ПОЛИСАХАРИДЫК полисахаридам относят соединения, молекулы которых содержат
более десяти моносахаридных звеньев, связанных О-гликозидной
связью.
полисахариды
гомополисахариды
(состоят из остатков
только одного моносахарида)
пентозаны
гетерополисахариды
(состоят из разных
моносахаридных единиц)
гексозаны
51
52.
Крахмал. СтроениеАмилопектин 80%
Нерастворим в Н2О
Амилоза 20%
Растворима в Н2О
Гидролиз крахмала
(C6H10O5)n
(C6H10O5)x
C12H22O11
C6H12O6
крахмал
декстрины
(x < n)
мальтоза
D-глюкоза
В фармации крахмал используется в производстве таблеток, для
приготовления присыпок и паст
52
53.
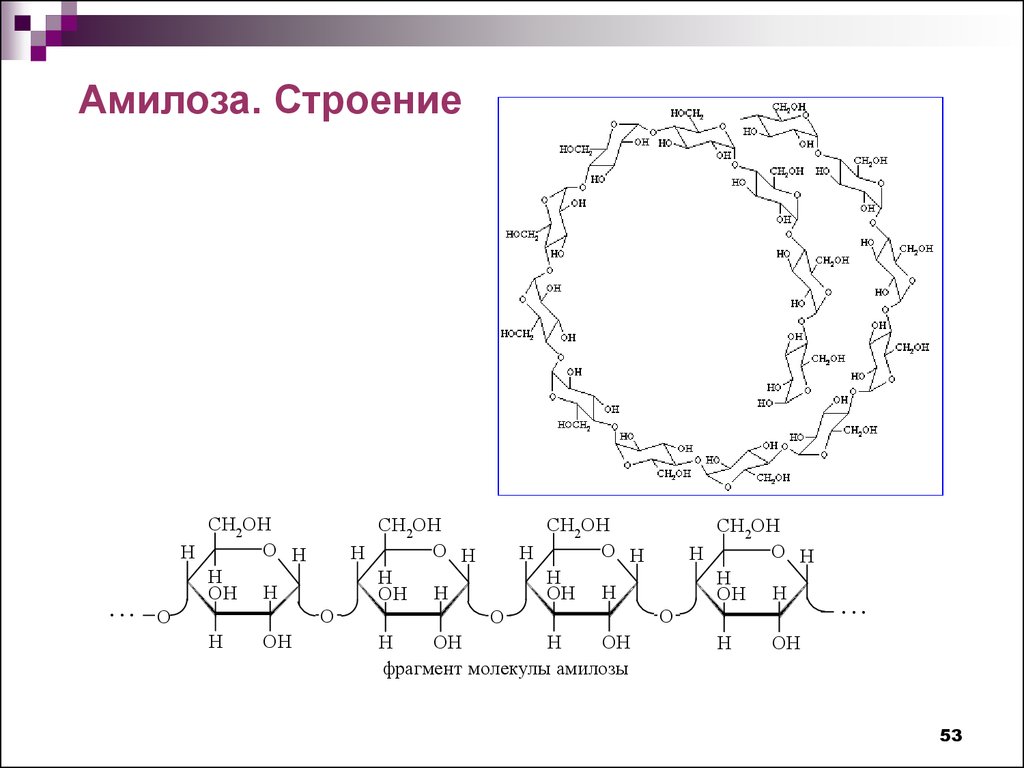
Амилоза. Строение...
CH2OH
O H
H
Н
OH H
O
O
H
OH
CH2OH
O H
H
Н
OH H
CH2OH
O H
Н
Н
OH H
O
H
OH
H
OH
фрагмент молекулы амилозы
CH2OH
O H
Н
Н
OH H
O
H
...
OH
53
54.
Амилопектин. Строение...
CH2OH
O H
H
Н
OH H 1
O
O
H
...
CH2OH
O H
Н
Н
1
4'
OH H
O
O
OH
-1,6-гликозидная свя зь
OH
H
OH
O
-1,4'-гликозидная свя зь
CH2OH
O H
H
Н
OH H 1
H
CH2OH
O H
Н
Н
1
4'
OH H
6CH
2
H
4'
Н
OH
CH2OH
O H
Н
Н
4'
OH H
O H
H
1
O
H
OH
H
OH
фрагмент молекулы амилопектина
O
H
...
OH
54
55.
ЦеллюлозаЦеллюлоза – полисахарид, являющийся составной частью оболочек
растительных клеток. В состав древесины входит от 50 до 70 %, а в состав
хлопка – до 98 % целлюлозы.
..
.
O
CH2OH
O
H
Н
OH H
H
1
H
OH
O
CH2OH
O
Н
Н
4
OH H
1
H
O
CH2OH
O
H
Н
4
OH H
1
H
H
OH
H
OH
фрагмент молекулы целлюлозы
O
CH2OH
O
Н
Н
4
OH H
H
..
.
H
OH
Гидролиз целлюлозы при нагревании в присутствии серной кислоты
(C6H10O5)n
(C6H10O5)x
C12H22O11
C6H12O6
целлюлоза
амилоид
(x < n)
целлобиоза
D-глюкоза
55
56.
ЦеллюлозаHO CH2
O
HO
H
O
OH
O
O
HO CH2
OH
O
H2C OH
O
H
H
O
O
OH
O
O
OH
O
O
H2C OH
Конформация целлюлозы
[C6H7O2(OH)3]n + nHNO3
[C6H7O2(OH)2ONO2]n + nH2O
[C6H7O2(OH)3]n + 2nHNO3
[C6H7O2(OH)(ONO2)2]n + 2nH2O
[C6H7O2(OH)3]n + 3nHNO3
[C6H7O2(ONO2)3]n + 3nH2O
целлюлозы тринитрат
56
57.
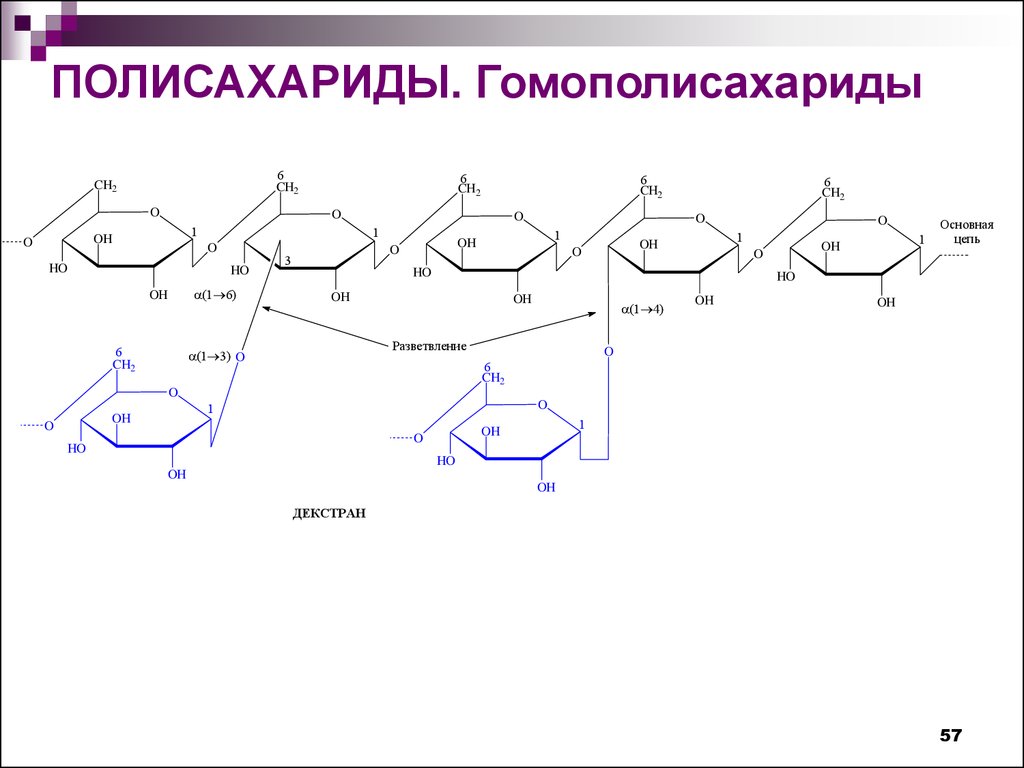
ПОЛИСАХАРИДЫ. Гомополисахариды6
CH2
CH2
O
6
CH2
O
1
OH
O
6
CH2
O
HO
HO
(1 6)
OH
6
CH2
O
1
O
1
OH
O
3
6
CH2
OH
O
1
OH
O
HO
Основная
цепь
HO
OH
OH
(1 4)
Разветвление
(1 3) O
O
1
OH
OH
O
6
CH2
O
O
O
1
OH
HO
1
OH
O
HO
OH
OH
ДЕКСТРАН
57
58.
ПОЛИСАХАРИДЫ. ГомополисахаридыCH2OH
CH2OH
CH2OH
O
O
O
OH
1
O
4
CH2OH
OH
1
O
4
O
OH
1
O
4
OH
O
NHCOCH3
NHCOCH3
NHCOCH3
NHCOCH3
ХИТИН
COOH
O
H
COOH
CH2OSO3H
O
H
H
H
OH
H
O
O
H
OH
NHSO3H
OH
H
H
O
O
H
H
H
OH
H
O
H
H
H
H
OH
O
H
H
CH2OSO3H
H
OSO3H
O
H
NHSO3H
гепарин
58
59.
ПОЛИСАХАРИДЫ. ГомополисахаридыCOOH
HO3SO
O
H
COOH
CH 2OH
H
O
H
OH
H
H
O
O
H
OH
H
O
H
CH 2OH
HO3SO
O H
H
O
H
OH
H
H
O
O
H
H
NHAc
OH
H
NHAc
хондроитинсульфат А
COOH
HO
O
H
H
O
H
O
H
O
OH
H
O
H
H
OH
H
COOH
CH 2OSO3H
O
H
CH 2OSO3H
O
H
H
OH
H
H
O
H
NHAc
HO
H
OH
H
O
NHAc
хондроитинсульфат C
59
60.
Дякую за увагу!60
























































 chemistry
chemistry








