Similar presentations:
Белки. Структура. Уровни организации
1.
Белки. Структура.Уровни
организации
Подготовила: студентка 205503
группы Бобровская Елена
2.
Белковые молекулы представляют собой линейные гетерополимерыразличной длины, мономерами которых являются аминокислоты. В
состав белков входят углерод, водород, кислород и азот. Кроме того,
почти все они содержат серу, так как она входит в состав аминокислот
цистеина и метионина. К некоторым белкам после синтеза могут
присоединяться остатки фосфорной кислоты, а также неаминокислотные
группы, содержащие железо, магний, цинк, медь, марганец и другие
микроэлементы. Такие белки называют сложными. В них выделяют
полипептидную часть и небелковую часть, или простетическую группу.
3.
Среди сложных белков в зависимостиот природы простетической группы
выделяют
хромопротеины
(содержат
пигменты)
металлопротеины
(содержат
металлы)
липопротеины
(содержат
липиды)
нуклеопротеины
(содержат
нуклеиновые
кислоты)
4.
Полипептид и белокПептид, содержащий более 40–50 аминокислотных
остатков, обычно называют полипептидом или белком.
Молекулы белка могут содержать сотни и даже тысячи
аминокислотных остатков: молекулярная масса белков
колеблется в пределах от нескольких тысяч до сотен
тысяч и даже миллионов дальтон.
5.
Синтез белкаКаждая белковая молекула в живом
организме характеризуется определенной
последовательностью аминокислот, которая
задается последовательностью нуклеотидов
в структуре гена, кодирующего данный белок.
Таким образом, в организме синтезируются
белки с точно определенной химической
структурой, которые были отобраны для
выполнения определенных функций в
процессе эволюции.
6.
Первичнаяструктура белка
Каждая белковая молекула в живом организме характеризуется определенной
последовательностью аминокислот, которая задается последовательностью
нуклеотидов в структуре гена, кодирующего данный белок. Таким образом, в
организме синтезируются белки с точно определенной химической структурой,
которые были отобраны для выполнения определенных функций в процессе
эволюции.
Последовательность аминокислотных остатков в молекуле белка определяет его
первичную структуру, то есть его химическую формулу. Общее число белков с
различной первичной структурой, встречающихся в организме человека,
оценивается примерно в 50 000, а у всех видов живых организмов составляет
величину порядка .
7.
Первичная структура белка8.
Пептидная связьАминокислотные остатки в белке связаны между собой пептидной связью.
Пептидная связь имеет ряд особенностей, которые в значительной степени влияют
на укладку полипептидной цепи в пространстве.
Благодаря особенностям пептидной связи шесть атомов пептидной группировки
оказываются расположенными в одной плоскости. Таким образом, полипептидную
цепь можно представить как набор относительно жестких плоских структур,
имеющих общую точку вращения при С-атоме.
Пептидная связь достаточно прочна, ее расщепление происходит лишь при
использовании химических катализаторов в жестких условиях, либо при катализе
специфическими ферментами — пептидазами.
9.
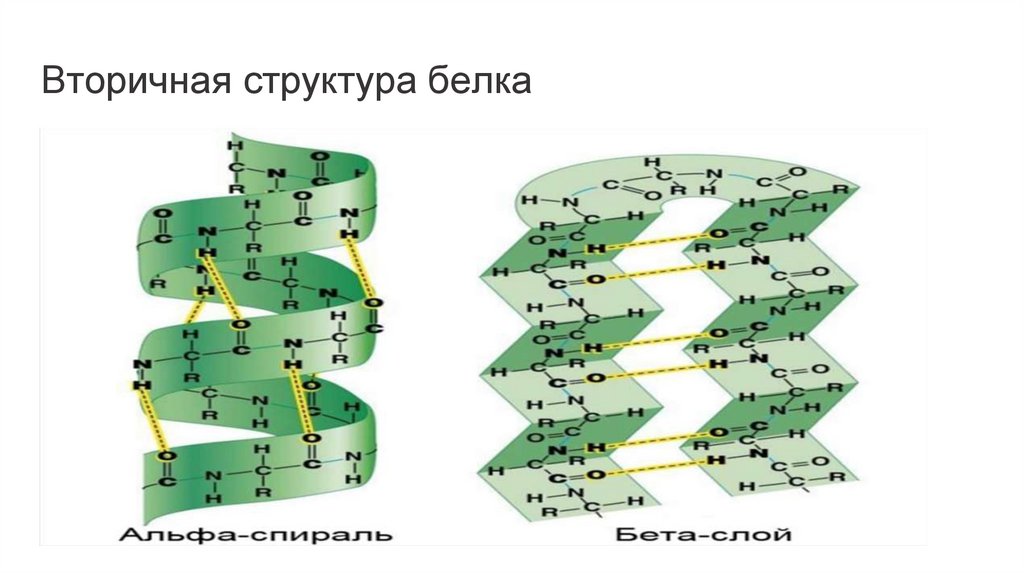
Вторичная структураВторичной структурой белка называют пространственное
Основными элементами вторичной структуры,
встречающимися в различных белках, являются -спираль
и -складчатый слой (или лист), хотя встречаются и другие
элементы вторичной структуры.
10.
Типы вторичных структурбелка
Альфа спирали
Бета слои
При формировании -спирали происходит
закручивание скелета полипептидной цепи в
виде спирали вокруг воображаемой оси,
сопровождающееся сближением пептидных
связей, что благоприятствует образованию
внутримолекулярных водородных связей
между NH-группами, находящимися на
одном витке, и CO-группами,
расположенными на другом витке спирали.
Направление этих связей параллельно оси
спирали. Боковые цепи аминокислот
располагаются с наружной стороны
спирали.
Второй элемент вторичной структуры,
который часто встречается в белках,
называется -слоем (листом), или складчатым слоем (листом). Структура типа
складчатого слоя формируется двумя
параллельно или антипараллельно
расположенными участками полипептидной
цепи. Она стабилизируется за счет
водородных связей, которые образуются
между расположенными рядом остовами
полипептидной цепи. Боковые цепи
аминокислот располагаются
перпендикулярно по отношению к плоскости
остова цепи, который при этом изгибается,
образуя плоский лист.
11.
Вторичная структура белка12.
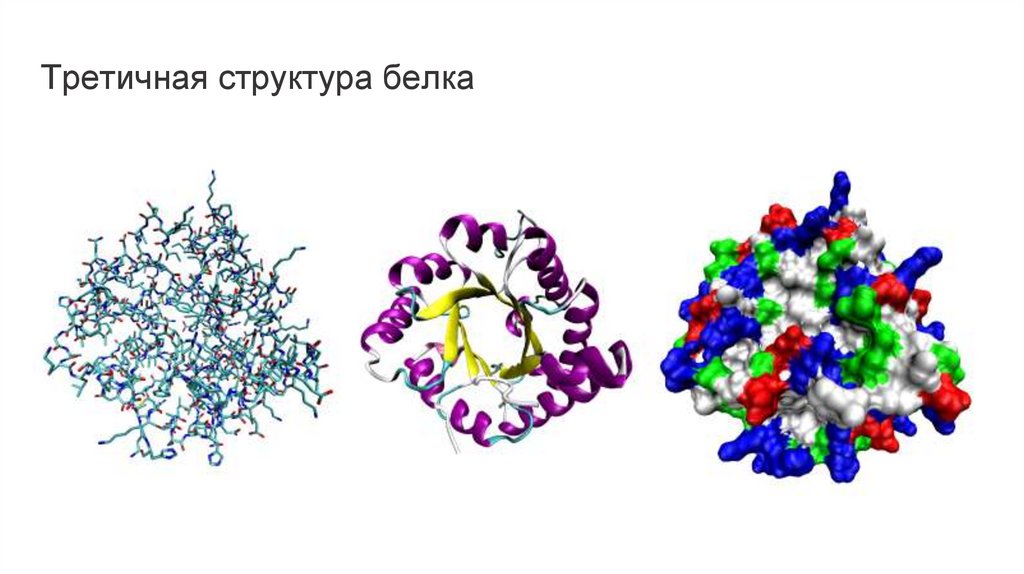
Третичнаяструктура белка
Спиральные участки и -структуры типа складчатого слоя подвергаются дальнейшей
упаковке, в результате чего формируется третичная структура белка. Если
вторичная структура характеризует укладку какого-либо участка полипептидной
цепи, то третичная структура — это структура всей полипептидной цепи в целом.
Растворимые белки обычно бывают глобулярными, то есть их молекулы имеют
округлые или эллиптические очертания, хотя среди них встречаются
и фибриллярные белки — имеющие форму волокна, или фибриллы, возможно
также сочетание глобулярной и фибриллярной структур.
В некоторых случаях для обеспечения большей стабильности третичной структуры
происходит образование ковалентных связей.. Образование таких связей особенно
характерно для белков, выделяемых из клетки наружу или находящихся в
плазматической мембране с наружной стороны, поскольку эти белки оказываются в
условиях, значительно отличающихся от тех, что существуют внутри клетки.
13.
Третичная структура белка14.
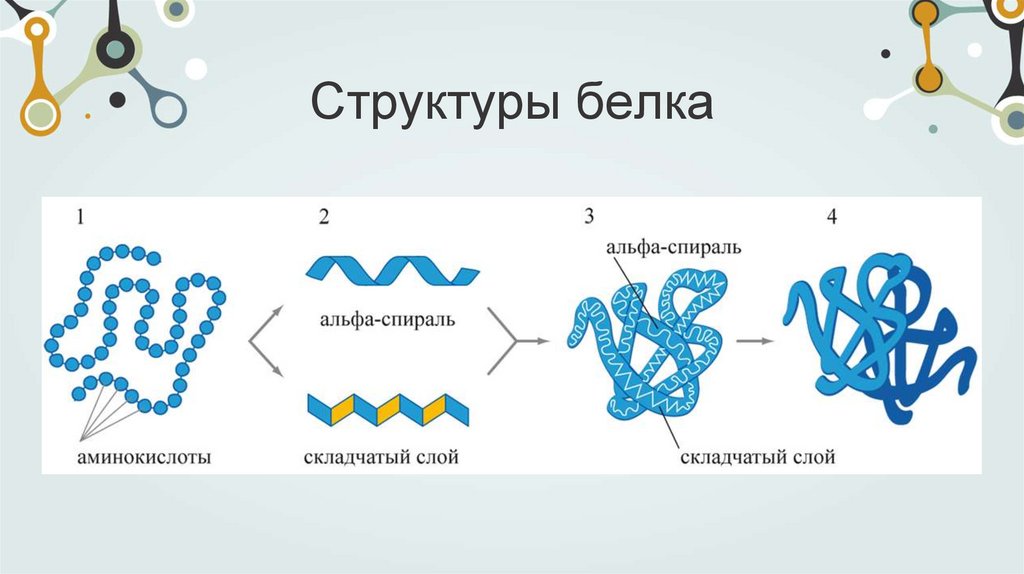
Четвертичнаяструктура белка
Многие белки состоят из нескольких полипептидных цепей
одинаковой или различной структуры. Объединение
белков становится возможным в том случае, если на
поверхности белка образуется центр связывания для того
же самого или другого белка. При объединении
нескольких полипептидных цепей образуется белок, для
которого характерна четвертичная структура.
Благодаря определенной последовательности аминокислот
в полипептидной цепи отдельные ее части сворачиваются
в -спирали или формируют -складки,
которые соединяются гибкими участками. Эти элементы
вторичной структуры укладываются в пространстве,
образуя глобулы или фибриллы, то есть формируют
третичную структуру белка. И наконец, отдельные
глобулы или фибриллы взаимодействуют друг с другом с
образованием комплексов, состоящих из нескольких
молекул, что приводит к формированию четвертичной
структуры.
15.
Структуры белка16.
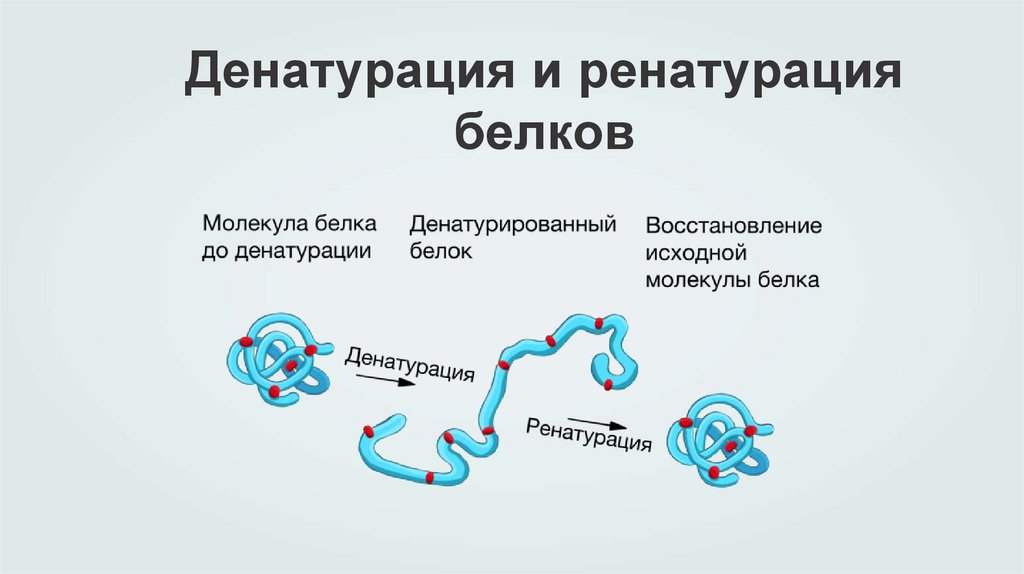
Денатурация иренатурация белков
Большая часть белковых молекул способна сохранять свою
биологическую активность, то есть выполнять свойственную им
функцию только в узком диапазоне температур и кислотности среды.
При повышении температуры, изменении кислотности до
экстремальных значений, добавлении гидрофобных агентов или при
значительном увеличении концентрации солей в структуре белков
происходят изменения, которые приводят к их денатурации — потере
белком своей нативной пространственной структуры. Разрыва
пептидных связей при денатурации не происходит, то есть сама
полипептидная цепь сохраняется, однако способ ее укладки
изменяется.
17.
Денатурация иренатурация белков
Денатурация бывает обратимой и необратимой. В случае
обратимой денатурации при возвращении в исходные условия
пространственная структура белка восстанавливается.
В клетке также происходит ренатурация белков, обычно
поврежденных, отслуживших свой срок. Такие белки либо
разрушаются, либо, если это еще возможно, ренатурируют —
самостоятельно или при помощи белков-шаперонов,
своеобразных помощников, способствующих восстановлению
структуры других белков. Шапероны играют большую роль в
восстановлении клетки после теплового шока.
18.
Денатурация и ренатурациябелков















 biology
biology








