Similar presentations:
Иерархия основных классов технологических процессов. Выражение составов фаз
1. Дисциплины читаемые кафедрой
1 Аналитическая химия и ФХМА.2 Общая и неорганическая химия.
3 Органическая химия и основы биохимии.
4 Поверхностные явления и дисперсные системы.
5 Физическая химия.
6 Экология.
7 Инженерные расчеты физико-химических свойств веществ.
8 Промышленная экология.
9 Техническая химия. Химия нефти.
10 Общая химическая технология.
11 Процессы и аппараты химической технологии.
12 Системы управления химико-технологическими процессами.
13 Техническая термодинамика и теплотехника.
14 Моделирование в химической технологии и расчет реакторов.
15 Кинетика и катализ в промышленности.
16 Основы научных исследований и проектирования.
17 Теоретические основы химической технологии топлива и
углеродных материалов.
18 Химическая технология топлива и углеродных материалов.
19 Технология нефти и природных газов
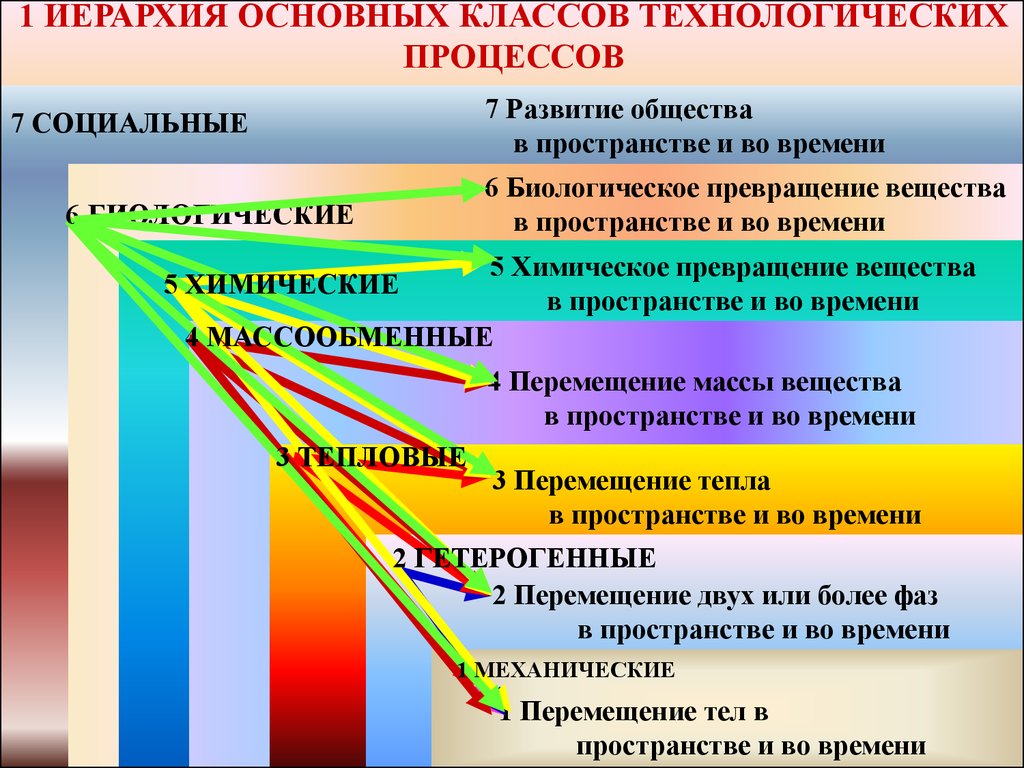
2. 1 ИЕРАРХИЯ ОСНОВНЫХ КЛАССОВ ТЕХНОЛОГИЧЕСКИХ ПРОЦЕССОВ
7 Развитие обществав пространстве и во времени
7 СОЦИАЛЬНЫЕ
6 Биологическое превращение вещества
в пространстве и во времени
6 БИОЛОГИЧЕСКИЕ
5 Химическое превращение вещества
в пространстве и во времени
4 МАССООБМЕННЫЕ
5 ХИМИЧЕСКИЕ
4 Перемещение массы вещества
в пространстве и во времени
3 ТЕПЛОВЫЕ
3 Перемещение тепла
в пространстве и во времени
2 ГЕТЕРОГЕННЫЕ
2 Перемещение двух или более фаз
в пространстве и во времени
1 МЕХАНИЧЕСКИЕ
1 Перемещение тел в
пространстве и во времени
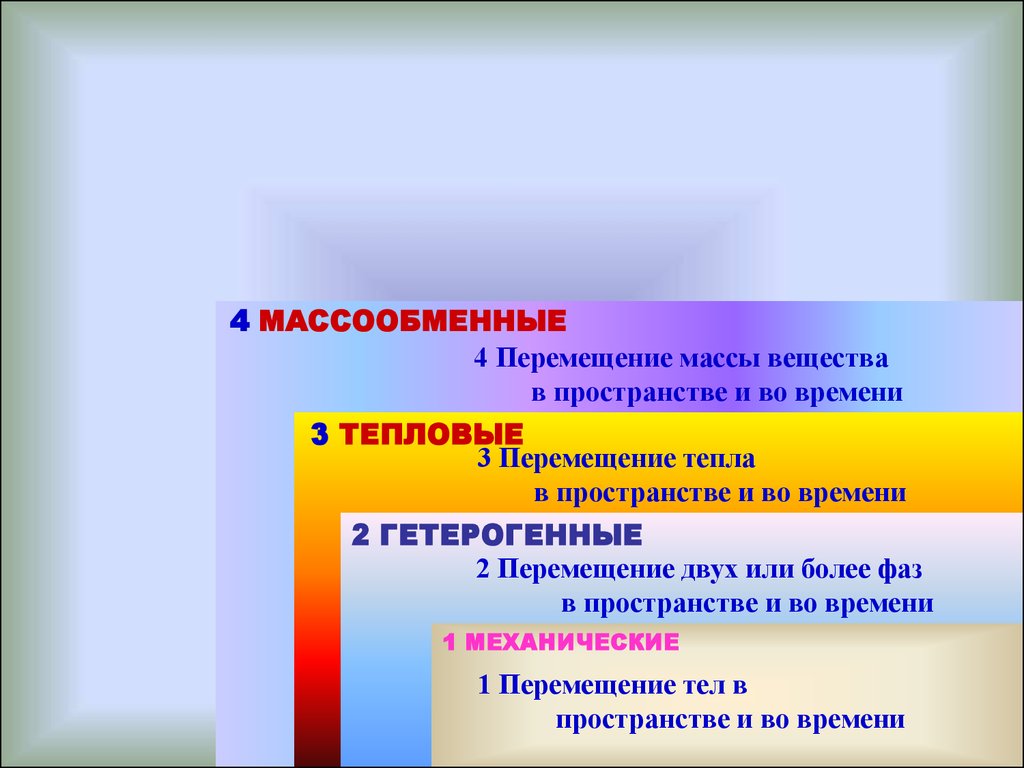
3.
4 МАССООБМЕННЫЕ4 Перемещение массы вещества
в пространстве и во времени
3 ТЕПЛОВЫЕ
3 Перемещение тепла
в пространстве и во времени
2 ГЕТЕРОГЕННЫЕ
2 Перемещение двух или более фаз
в пространстве и во времени
1 МЕХАНИЧЕСКИЕ
1 Перемещение тел в
пространстве и во времени
4. 2. ВЫРАЖЕНИЕ СОСТАВОВ ФАЗ
2.1 Мольная доляОбозначим через n1, n2, …, ni, …,nm – количество молей
соответственно 1, 2,… i,… m компонента в смеси.
n1
n2
ni
Sn
nm
То есть
n1 + n2+…+ni+ …+nm = S n .
Поделим уравнение (2.1) на S n, получим
(2.1)
n1/S n + n2/S n +…+ni /S n + …+nm/S n = 1.
(2.2)
Обозначим через
xi = ni /S n ,
(2.3)
где xi - мольная доля i-ого компонента в смеси.
Очевидно
x1 + x2+…+ xi + …+ xm = 1.
(2.4)
5.
2. ВЫРАЖЕНИЕ СОСТАВОВ ФАЗ2.2 Массовая доля
Обозначим через g1, g2, …, gi, …,gm – масса соответственно
1, 2,… i,… m компонента в смеси.
g1
То есть
g2
gi
g1 + g2+…+gi+ …+gm = S g.
gm
Sg
(2.5)
Поделим уравнение (2.5) на S g, получим
g1/S g + g2/S g +…+gi/S g + …+gm/S g = 1.
Обозначим через
xmi = gi /S g ,
(2.6)
(2.7)
где xmi - массовая доля i-ого компонента в смеси.
Очевидно
xm1 + xm2+…+ xmi + …+ xmm = 1. (2.8)
6. 2 ВЫРАЖЕНИЕ СОСТАВОВ ФАЗ
2.3 Объёмная доляОбозначим через v1, v2, …, vi, …,vm – объёмы соответственно
1, 2,… i,… m компонента в смеси.
v1
vi
v2
vm
То есть v1 + v2+…+vi+ …+vm = Sv.
Sv
(2.9)
Поделим уравнение (2.9) на Sv, получим
v1/Sv + v2/Sv +…+vi /Sv + …+vm/Sv = 1.
Обозначим через
xoi = vi /S v ,
(2.10)
(2.11)
где xoi - объёмная доля i-ого компонента в смеси.
Тогда
xo1 + xo2+…+ xoi + …+ xom = 1
(2.12)
7.
3 Пересчёт концентрацийОБОСНОВАНИЕ
xi = ni /S n
Мольные доли используются при технологических
расчётах, а технологические расчёты используют
законы справедливые для мольных долей.
xmi = gi /S g
Массовые доли используются при покупке и
продаже сырья и продуктов.
xoi = vi /S v
Объёмные доли используются при расчётах
размеров технологического оборудования.
8.
3 Пересчёт концентраций3.1 Из мольных долей в массовые и обратно
xmi = gi /S g
Так как по уравнению (2.7) имеем
Определим значение
gi = Mi ∙ ni
, из
Мi = g i / n i
Подставим его в уравнение (2.7), предварительно,
поделив и помножив последнее на Sn
Единица деленная на
Mi ∙n
молекулярную массу
смеси
i
gi
xm i =
∙Sn
Sg ∙ Sn
Мольная доля i-го
компонента в смеси
После преобразований получим пересчёт:
Из мольных долей в массовые xmi = Mi∙x i /Мсм
и обратно
xi = Mсм ∙ xmi / Мi
(2.13)
(2.14)
9.
3.1 Из мольных долей в массовые и обратно3.1.1 Расчет молекулярной массы смеси при известной
мольной доле для уравнения (2.13)
Так как
gi = Mi ∙ ni
,а
Мсм = S g / Sn
То подставив их в
Получим
S g = g1+g2+….+gi+…+gn
Мсм = S (Mi ∙ ni ) / Sn
Каждое n i поделим на Sn, тогда
Или получим
Mсм = S (Mi ∙ xi )
Мсм = S (Mi ∙( ni / Sn))
(2.15)
10.
3.1 Из мольных долей в массовые и обратно3.1.2 Расчет молекулярной массы смеси при
известной массовой доле для уравнения (2.14)
Так как
ni = gi / Mi
То подставив их в
получим
,
а
S n = n1+n2+….+ni+…+nn
1/ Mсм = S n / Sg ,
1/Mсм = S (gi / Mi )/(Sg ).
Каждое g i поделим на S g , тогда
1/Mсм = S (gi / (Sg) / Mi)
получим
1/Mсм = S (xmi / Mi)
или
Mсм = 1/ S (xmi /Mi)
(2.16)
11.
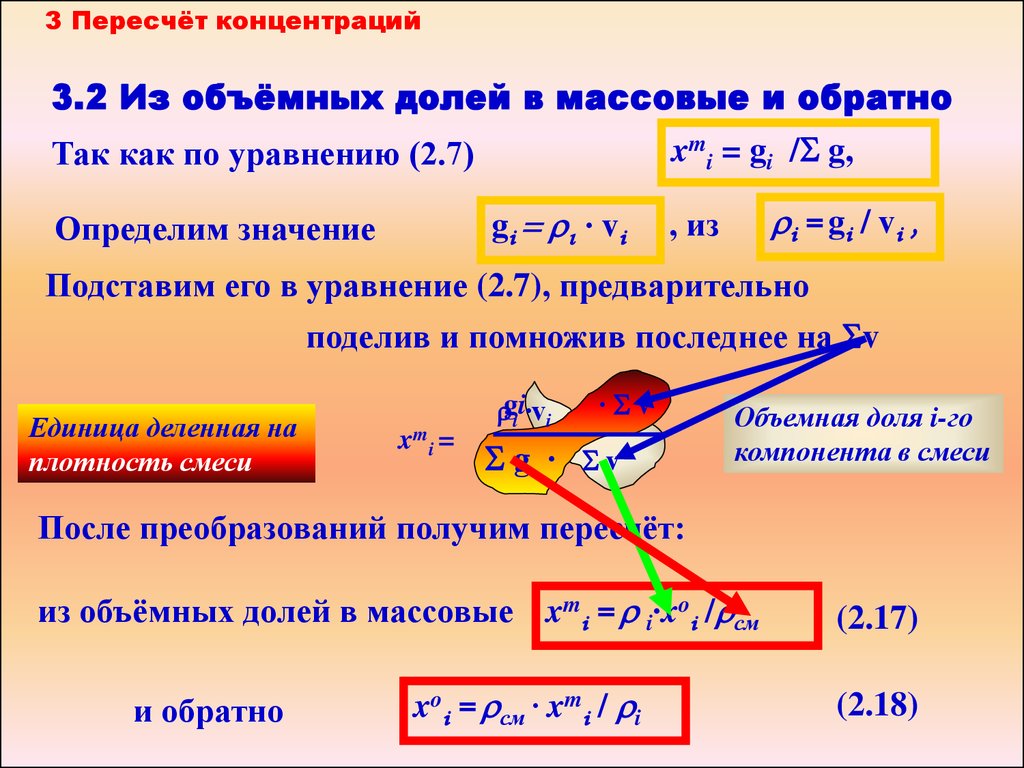
3 Пересчёт концентраций3.2 Из объёмных долей в массовые и обратно
Так как по уравнению (2.7)
xmi = gi /S g,
gi = ri ∙ vi
Определим значение
ri = gi / vi ,
, из
Подставим его в уравнение (2.7), предварительно
поделив и помножив последнее на Sv
Единица деленная на
плотность смеси
xm i =
rgii ∙vi
∙Sv
Sg ∙ Sv
Объемная доля i-го
компонента в смеси
После преобразований получим пересчёт:
из объёмных долей в массовые xmi = r i∙xoi /rсм
и обратно
xoi = rсм ∙ xmi / ri
(2.17)
(2.18)
12.
3.2 Из объёмных долей в массовые и обратно3.2.1 Расчет плотности смеси при известной объемной
доле для уравнения 2.17
Так как
gi = ri ∙ vi
то подставив их в
получим
, а
S g = g1+g2+….+gi+…+gn,
rсм = S g / Sv,
rсм = S (ri ∙ vi ) / Sv.
Каждое v i поделим на Sv , тогда
или получим
rсм = S (ri ∙ xoi )
rсм = S (ri ∙( vi/ Sv)),
(2.19)
13.
3.2 Из объёмных долей в массовые и обратно3.2.2 Расчет плотности смеси при известной
массовой доле для уравнения 2.18
Так как
vi= gi /ri
То подставив их в
Получим
,а
1/rсм = Sv /S gi
1/rсм = S (gi /ri ∙) / Sg
Каждое g i поделим на S g , тогда
Или получим
S v = v1+v2+….+vi+…+vn
1/rсм = S (( gi/ Sg)/ ri )
rсм = 1/S (xmi /ri )
(2.20)
14. Пример 3.1 к пересчёту концентраций
Смесь аммиака с воздухом имеет массовый состав yim. Вычислитьсостав этой смеси в объемных и мольных долях, молекулярную массу
смеси, а также плотность газа, если смесь находится при давлении 196,2
кПа и температуре 30 оС.
Компоненты
O2
N2
NH3
yim M y m / M
i i
i
yi
0,211 32 0,0065938 0,1788
0,6760
0,698 28 0,0249286
0,091 17 0,0053529 0,1452
roi=Mi/22,4 ymi/roi
yiо
1,4286
0,1477
0,1788
1,2500
0,5584
0,6760
0,7689
0,1199
0,1452
0,8260
S
0,0368753 1,0000
1,0000
1,000
Решение.
1 Мольную долю найдем из уравнения (2.14) с помощью уравнения (2.16).
2 Молекулярная масса газа равна Мсм=1/0,0368753=27,1185.
3 Для индивидуального компонента в газе r0i=Mi/22,4.
4 Объемную долю найдем по уравнению (2.18) с помощью уравнения (2.20).
5 Плотность смеси газа равна r0см= 1/S(ymi/roi)=1,2106
6 Плотность газа при условиях задачи равна rсм= r0см∙Р/Ро∙То/Т=1,8457











 chemistry
chemistry








