Similar presentations:
Кислоты, их классификация и свойства
1.
Законспектироватьфизические свойства,
слабые кислоты,
химические свойства.
Сделать в конце
презентации задание в
тетради.
2.
Физические свойстваПо агрегатному состоянию:
Газообразные (HCl, НВr, H2S)
Жидкие (HNO3, H2SO4)
Твердые (H3PO4, H2SiO3)
Цвет кислот – ?
Самостоятельно
Запах – ?
найти и записать
Вкус – ?
в тетрадь
3.
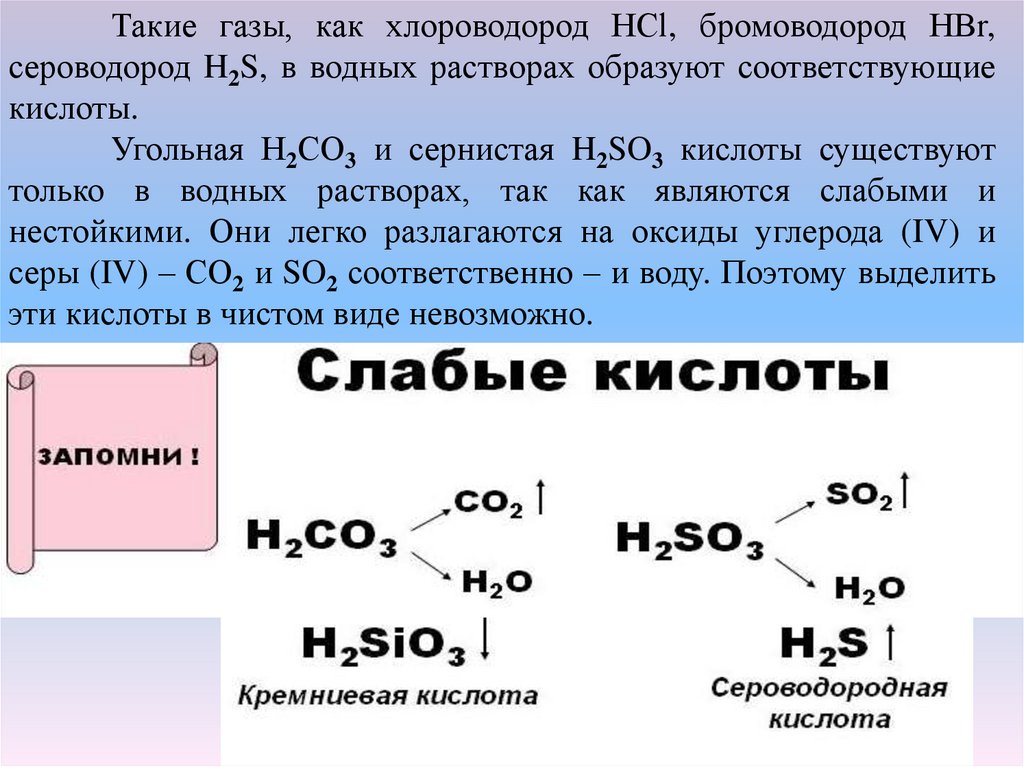
Такие газы, как хлороводород НСl, бромоводород НВr,сероводород H2S, в водных растворах образуют соответствующие
кислоты.
Угольная Н2СO3 и сернистая H2SO3 кислоты существуют
только в водных растворах, так как являются слабыми и
нестойкими. Они легко разлагаются на оксиды углерода (IV) и
серы (IV) – СO2 и SO2 соответственно – и воду. Поэтому выделить
эти кислоты в чистом виде невозможно.
4.
Химические свойстваПервая реакция протекает между любыми
кислотами и основаниями (как с растворимыми, так и с
нерастворимыми).
Например, реакция кислоты с щёлочью (реакция
нейтрализации): НСl + NaOH = NaCl + Н2O
или Н+ + ОН- = Н2O.
Аналогично
протекает
эта
реакция
и
с
нерастворимыми основаниями, например:
2HNО3 + Fe(OH)2↓= Fe(NO3)2 + 2Н2O
или 2Н+ + Fe(OH)2 = Fe2+ + 2Н2O.
5.
Химические свойстваВторая реакция протекает между
оксидами металлов и большинством
кислот, например:
H2SO4 + FeO = FeSO4 + Н2O
или FeO + 2Н+ = Fe2+ + Н2O.
6.
Химические свойстваЧтобы прошла третья реакция,
необходимо выполнить несколько условий:
1) Металл должен находиться в ряду напряжений до
водорода:
К, Са, Na, Mg, Al, Zn, Fe, Ni, Pb, H2, Cu, Hg, Ag, Au
• Например, Zn + 2HCl = ZnCl2 + H2↑
Сu + HCl ≠
2) Должна получиться растворимая соль. Во многих
случаях взаимодействие металла с кислотой практически
не происходит потому, что образующаяся соль
нерастворима и покрывает поверхность металла защитной
плёнкой, например: Pb + H2SO4 ≠ PbSO4↓ + Н2↑
7.
Химические свойства• 3) Реакция характерна для растворов кислот,
поэтому нерастворимые кислоты, например
кремниевая, не вступают в реакции с
металлами.
• 4) Концентрированный раствор серной кислоты
и раствор азотной кислоты любой концентрации
взаимодействуют с металлами иначе, поэтому
уравнения реакций между металлами и этими
кислотами записывают по другой схеме.
8.
Химические свойстваЧетвёртая реакция – типичная реакция
ионного обмена, протекающая только в случае,
если образуется:
9.
Закончите молекулярные уравнениявозможных реакций, если реакция не
может быть осуществлена, объясните
почему. И запишите соответствующие им
ионные уравнения:
10.
Спасибо завнимание!!!









 chemistry
chemistry








