Similar presentations:
Буферные растворы. (Лекция 5)
1.
ОМСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙУНИВЕРСИТЕТ
КАФЕДРА ХИМИИ
Лекция 5. Буферные системы
1. Протолитическая теория кислот и оснований.
2. Классификация буферных систем.
3. Механизм буферного действия.
4. Водородный показатель среды буферных
растворов.
5. Буферная емкость.
6. Буферные системы крови.
Лектор: доктор биологических наук, профессор,
зав. кафедрой химии Ирина Петровна Степанова
2.
ЦЕЛИ ЛЕКЦИИОБУЧАЮЩАЯ: сформировать знания о
составе, механизме действия, расчете
водородного показателя буферных системах.
РАЗВИВАЮЩАЯ: расширить кругозор
обучающихся на основе интеграции знаний,
развить логическое мышление.
ВОСПИТАТЕЛЬНАЯ: содействовать
формированию у обучающихся устойчивого
интереса к изучению дисциплины.
3.
Протолитическая теория кислот и основанийArrhenius 1884 г. (ТЭД):
кислота
это
электролит,
диссоциирующий
с
образованием протона
H+; основание – с
образованием
гидроксид-аниона OH-.
Lewis, 1923 г.
Brønsted
and
Lowry 1923 г.
Положения ТЭД справедливы только
для
водных
растворов
и
не
объясняют поведения веществ в
неводных средах. Например: хлорид
аммония (NH4Cl) в водном растворе
ведет себя как соль, а в жидком
аммиаке проявляет свойства кислоты
– растворяет металлы с выделением
водорода. Как основание ведет себя
азотная кислота, растворенная в
безводной серной кислоте.
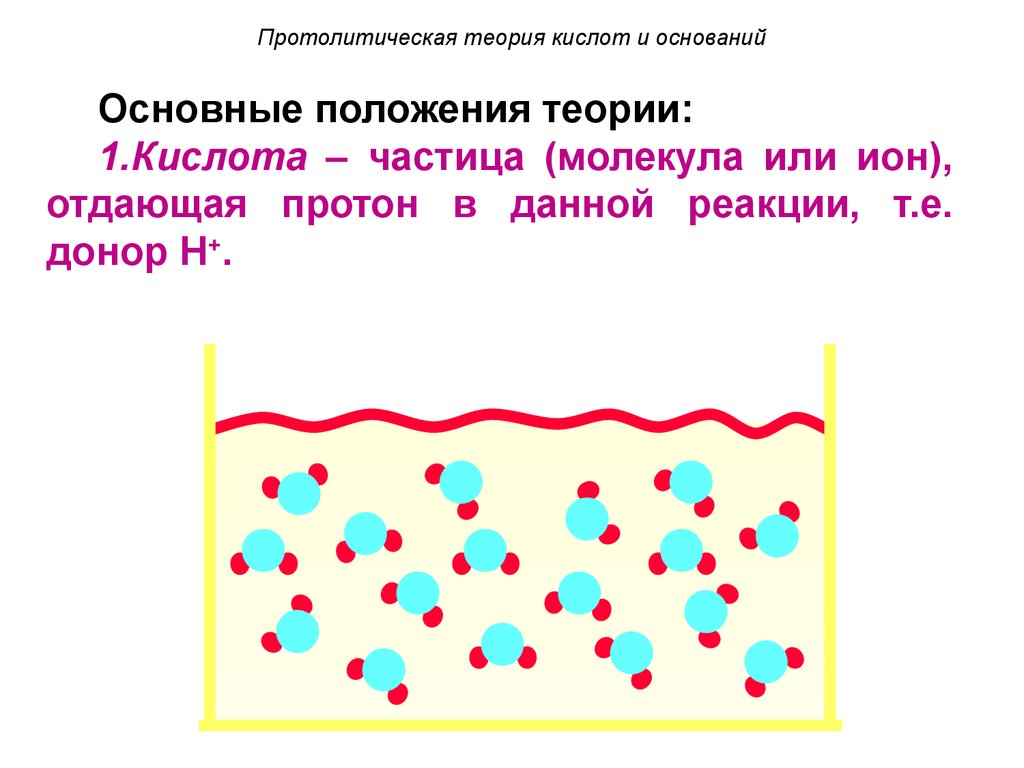
4. Протолитическая теория кислот и оснований
Основные положения теории:1.Кислота – частица (молекула или ион),
отдающая протон в данной реакции, т.е.
донор H+.
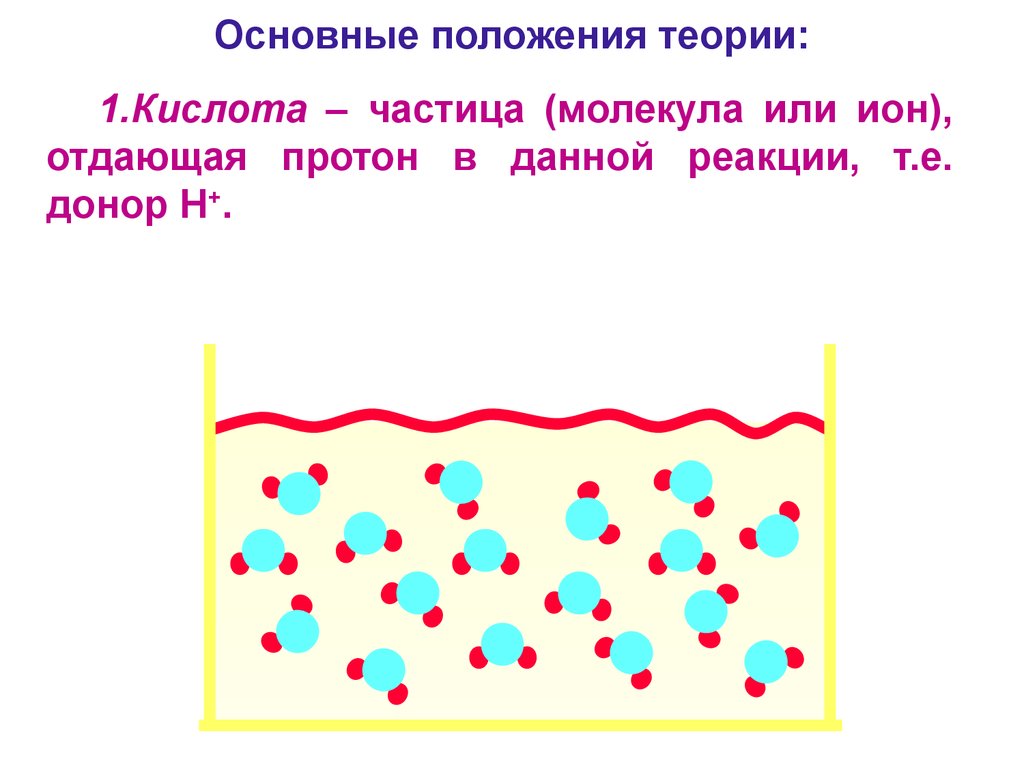
5. Основные положения теории:
1.Кислота – частица (молекула или ион),отдающая протон в данной реакции, т.е.
донор H+.
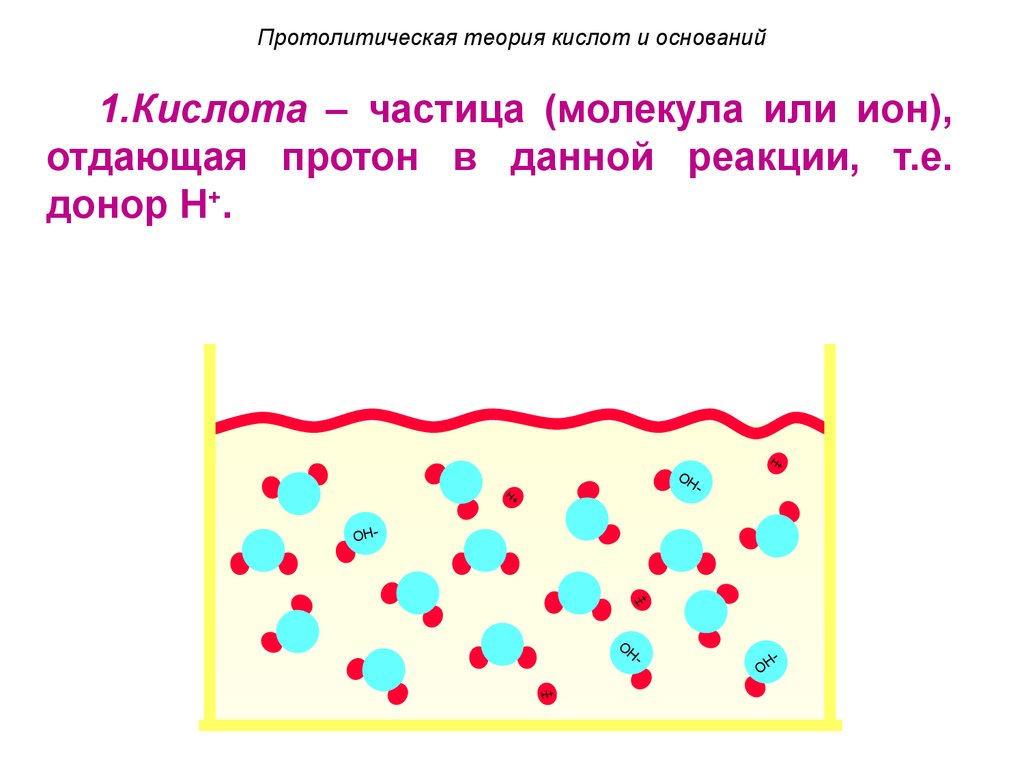
6. Протолитическая теория кислот и оснований
1.Кислота – частица (молекула или ион),отдающая протон в данной реакции, т.е.
донор H+.
OH
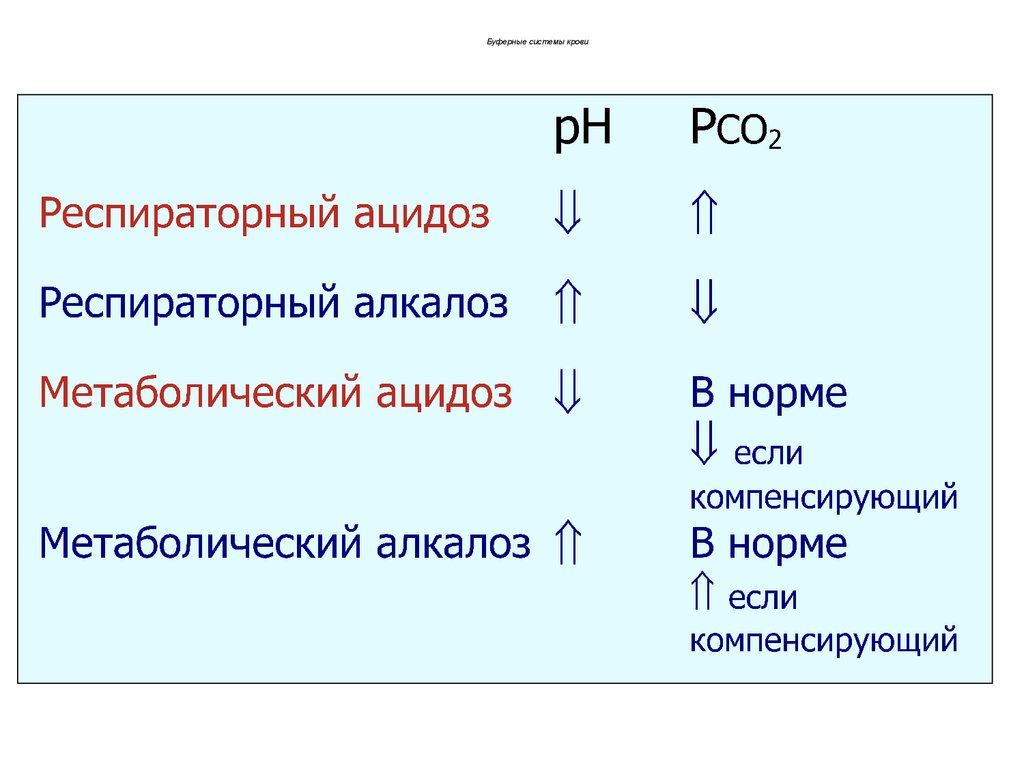
-
H+
H+
OH-
H+
O
HH+
OH
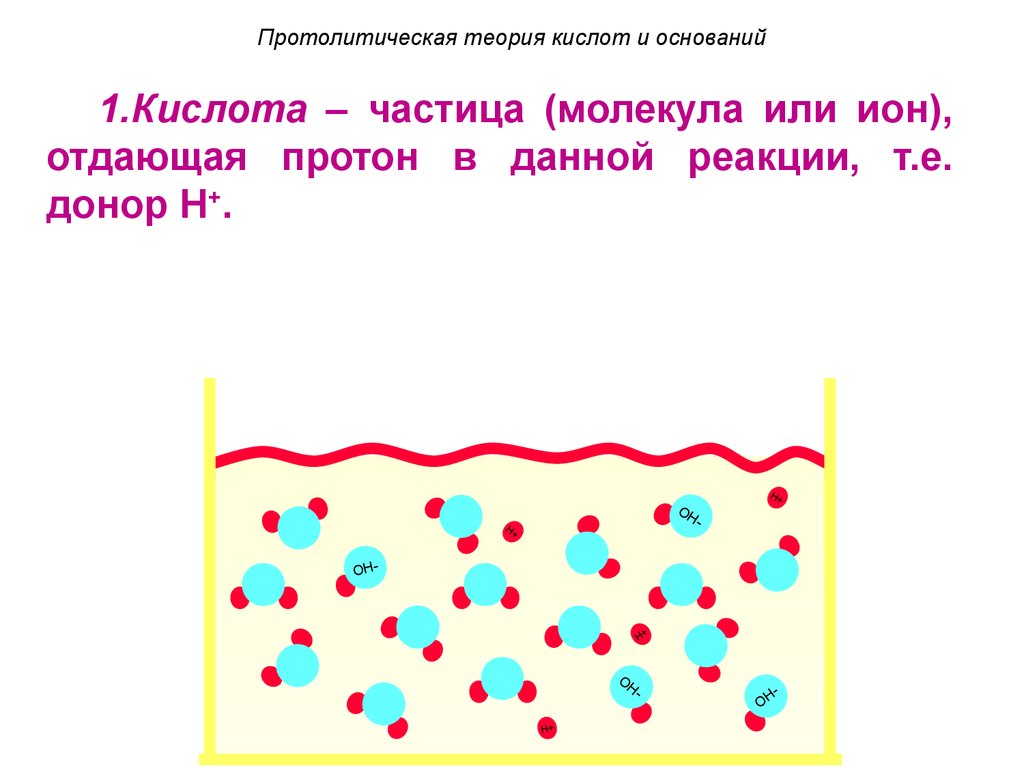
7. Протолитическая теория кислот и оснований
1.Кислота – частица (молекула или ион),отдающая протон в данной реакции, т.е.
донор H+.
OH
-
H+
H+
OH-
H+
O
HH+
OH
8. Протолитическая теория кислот и оснований
Физиологически важные кислоты:– Угольная кислота (H2CO3)
– Фосфорная кислота (H3PO4)
– Пировиноградная кислота (C3H4O3)
– Молочная кислота (C3H6O3)
Эти кислоты растворяются в жидкостях
организма.
Молочная к-а
Пировиноградная
к-та
8
Фосфорная кислота
9. Протолитическая теория кислот и оснований
2. Основание – частица (молекула или ион),присоединяющая протон в данной реакции,
т.е. акцептор H+.
10. Протолитическая теория кислот и оснований
Основание – частица (молекула илиион), присоединяющая протон в данной
реакции, т.е. акцептор H+.
11. Протолитическая теория кислот и оснований
Основание – частица (молекула илиион), присоединяющая протон в данной
реакции, т.е. акцептор H+.
OH
-
H+
H+
OH-
H+
O
HH+
OH
12. Протолитическая теория кислот и оснований
Физиологически важные основания:– Гидрокарбонат-ион (HCO3- )
– Гидрофосфат-ион (HPO4-2 )
Гидрофосфат
12
13. Протолитическая теория кислот и оснований
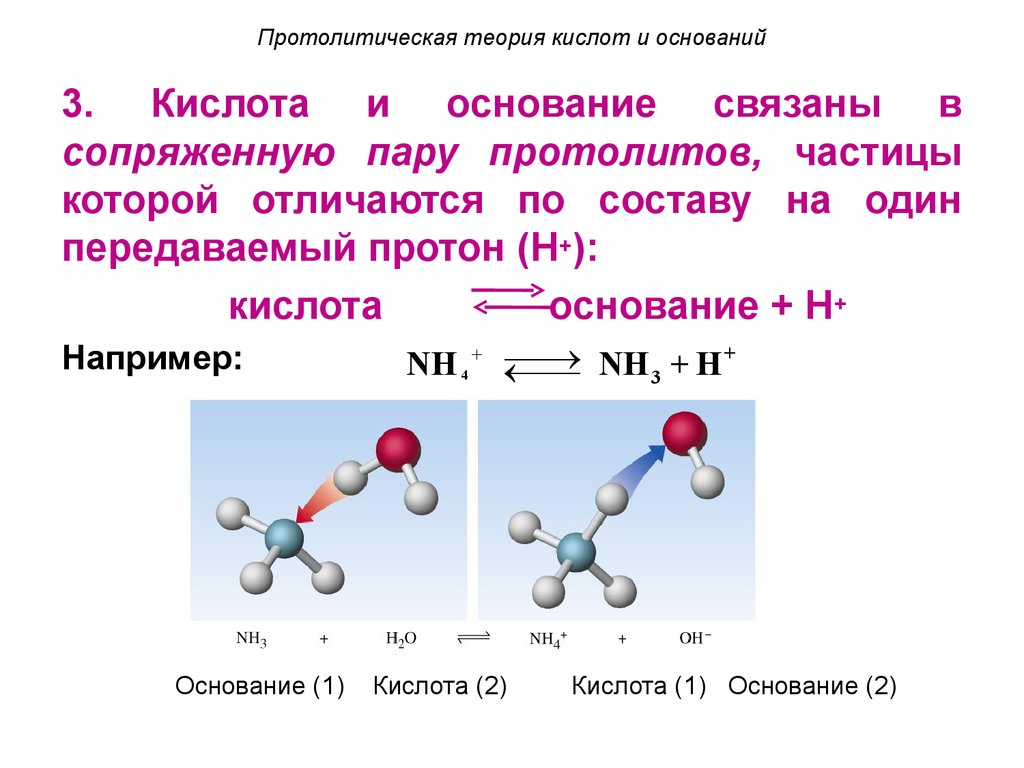
3. Кислота и основание связаны всопряженную пару протолитов, частицы
которой отличаются по составу на один
передаваемый протон (H+):
кислота
основание + Н+
Например:
Основание (1)
+
¾¾
®
NH 4 + ¬¾
NH
+
H
¾
3
Кислота (2)
Кислота (1) Основание (2)
14.
Протолитическая теория кислот и основанийКислота
Основание
Кислота
Основание
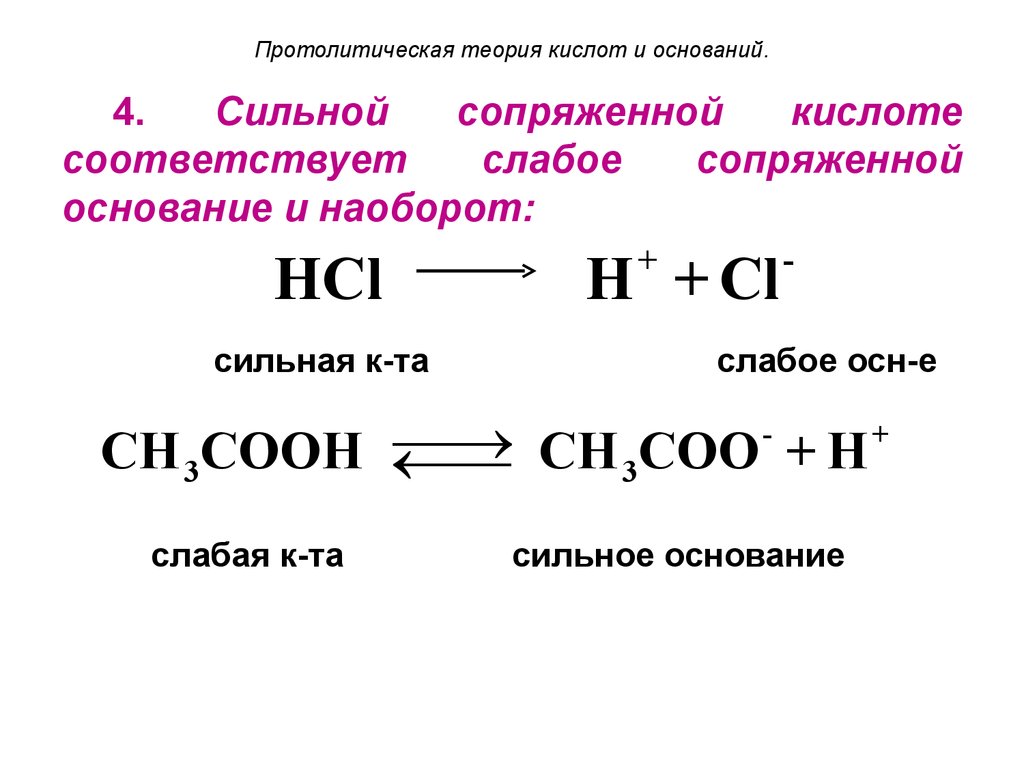
15. Протолитическая теория кислот и оснований.
4.Сильной
сопряженной
кислоте
соответствует
слабое
сопряженной
основание и наоборот:
+
¾¾
®
HCl ¬¾
¾ H + Cl
сильная к-та
слабое осн-е
+
¾¾
®
CH 3COOH ¬¾
¾ CH 3COO + H
слабая к-та
сильное основание
16. Протолитическая теория кислот и оснований.
5. Кислоты-протолиты делят на 3 класса:+
¾¾
®
HNO 3 ¬¾
А) нейтральные
¾ H + NO 3
В) катионныеNH 4
+
¾¾
®
¬¾
¾ H + NH 3
+
С) анионные HSO 4
-
+
2¾¾
®
¬¾
¾ H + SO 4
17.
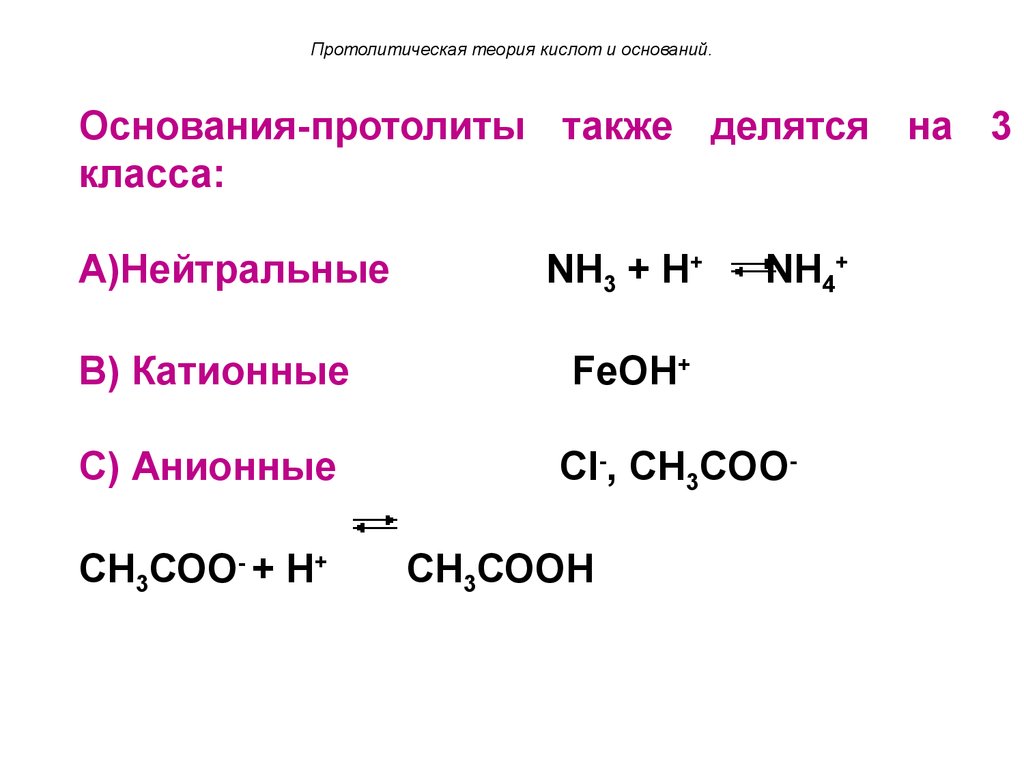
Протолитическая теория кислот и оснований.Основания-протолиты также делятся на 3
класса:
A)Нейтральные
B) Катионные
C) Анионные
СН3СОО- + Н+
NH3 + Н+
NH4+
FeOH+
Сl-, CH3COOСН3СООН
18.
Протолитическая теория кислот и оснований.6.
Амфолиты
–
протолиты,
способные как принимать, так и
отдавать протоны:
+
¾¾
®
H 2O ¬¾
H
+
OH
¾
Кислота
Основание
+ ¾¾
+
®
H 2O + H ¬¾
¾ H 3O
Основание
Кислота
Кис
лота
Осно
вание
Сопряж.
осн-е
Сопряж.
К-та
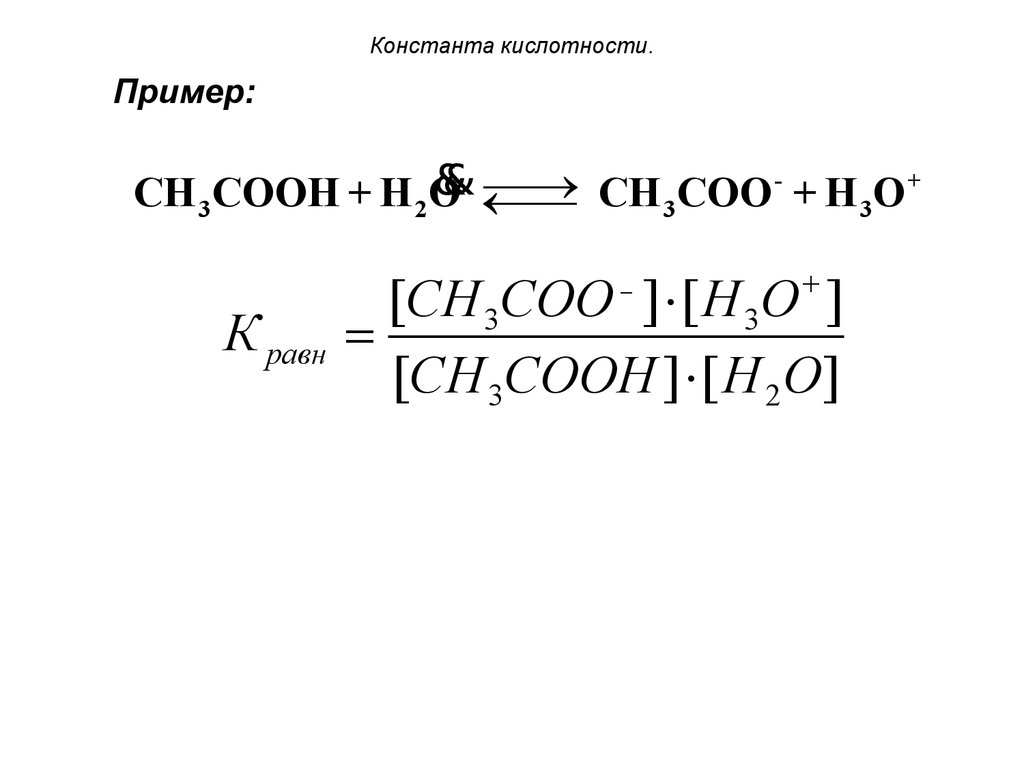
19. Константа кислотности.
7. Количественно сила кислот-протолитовхарактеризуется вероятностью переноса
протона от кислоты к воде как основанию и
оценивается
величиной
константы
кислотности (Ка).
Ка характеризует момент химического
равновесия в процессе переноса протона и
определяется
на
основании
закона
действующих масс.
20. Константа кислотности.
Пример:+
&
&
¾¾
®
CH 3COOH + H 2O ¬¾
¾ CH 3COO + H 3O
К равн
+
[CH 3COO ] [ H 3O ]
[CH 3COOH ] [ H 2O]
-
21. Константа кислотности.
Перемножим обе части уравнения на постояннуювеличину молярной концентрации воды:
+
[CH 3COO ] [ H 3O ] [ H 2O ]
К равн [ H 2O ]
,
[CH 3COOH ] [ H 2O ]
-
+
[CH 3COO ] [ H 3O ]
К равн [ H 2O ]
,
[CH 3COOH ]
-
К a K равн H 2O
Таким образом, чем выше концентрация
сопряженных частиц продуктов протонного
переноса, тем больше значение Ка, а значит тем
сильнее кислота-протолит.
22. Протолитическая теория кислот и оснований.
На практике используют показательконстанты кислотности (pKa):
pK a = - lgK a
Чем меньше значение pKa, тем сильнее
кислота.
23.
Например:1) Ka(HCl)=103
pKa(HCl) = -3 (сильная кислота)
2) Ka(CH3COOH) = 1,75∙10-5
pKa= 4,75 ( слабая кислота)
Протолитическая
теория позволила
выявить разницу в
силе минеральных
кислот,
а
также
объяснить
кислотно-основные
свойства
органических
веществ.
0.1 M HCl
0.1 M CH3COOH
24.
Буферные системыПостоянство кислотности сред, наряду с
физиологическими механизмами поддерживается
буферными системами организма.
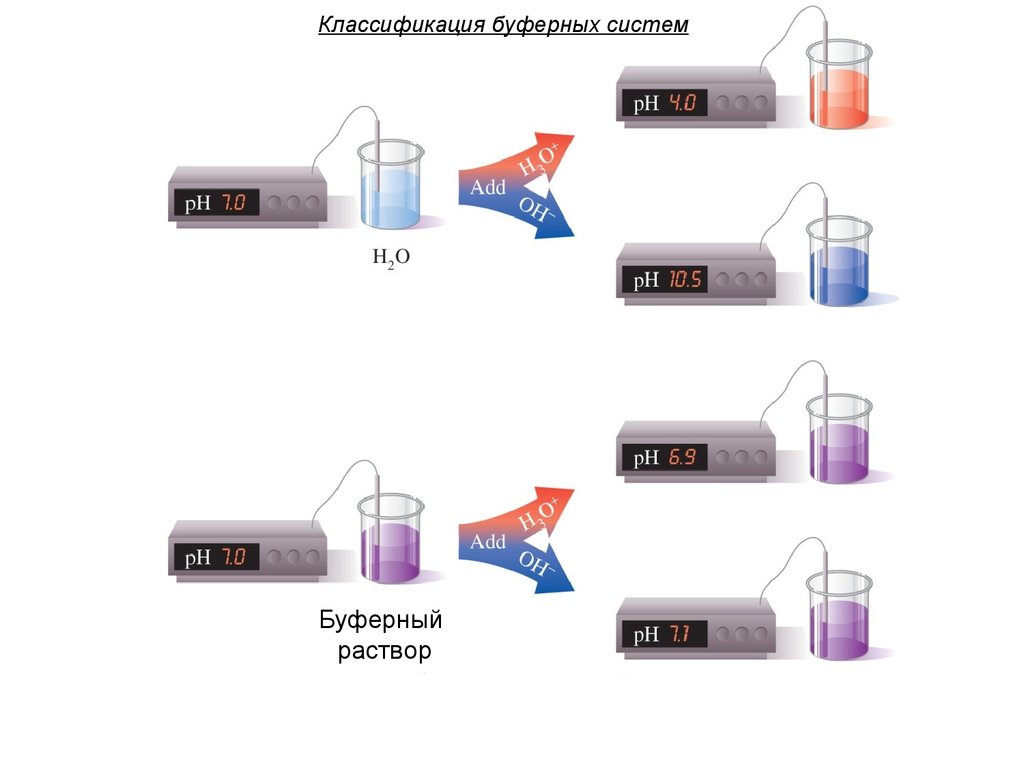
25. Классификация буферных систем
Буферныйраствор
26. Классификация буферных систем
Способность буферных систем сохранятьпостоянство pH называется буферным
действием.
По составу, с точки зрения протонной
теории, буферные системы делят на кислые
и основные.
27. Классификация буферных систем
Кислые буферные системы состоят изслабой кислоты и сопряженного с ней
избытка сильного основания, создаваемого
солью этой кислоты.
Например: ацетатная буферная система:
СН3СООН – слабая кислота;
СН3СООNa – растворимая соль (содержит
сопряженное сильное основание СН3СОО- ).
28. Классификация буферных систем
Карбонатная буферная система:Н2СО3
NaНСО3
Фосфатная буферная система:
NaН2РО4
Na2НРО4
Белковая буферная система:
Белок-Н или Prot-Н
Белок-Na
Prot-Na
29. Классификация буферных систем
Основные буферные системы состоят изслабого основания и сопряженного с ним
избытка кислоты, создаваемого солью этого
основания.
Например, аммиачная буферная система:
NН4ОН – слабое основание;
NН4Сl –растворимая соль (содержит
сопряженную сильную кислоту NН4+).
30. Классификация буферных систем
Буферные системы в растворенномсостоянии образуют буферные растворы.
Буферные растворы, в
отличие от буферных систем,
могут быть
многокомпонентными.
Кровь относят к буферным
растворам.
31. Механизм буферного действия
Механизм буферного действия можнорассмотреть на примере ацетатной
буферной системы:
СН3СООН
СН3СОО- + Н+
СН3СООNa
СН3СОО- + Na+
32. Механизм буферного действия
При добавлении сильной кислоты,например HCl, в реакцию с ней вступает
компонент буферной системы, выполняющий
роль сопряженного основания:
СН3СОО– + Н+ → СН3СООН
СН3СООNa + НСl → СН3СООН + NaСl
То есть, избыток ионов Н+ связывается в
малодиссоциирующее соединение – слабую
кислоту – СН3СООН.
33. Механизм буферного действия
При добавлении сильного основания,например NaОН, в реакцию с ним вступает
компонент буферной системы – слабая
кислота:
СН3СООН + ОН- → СН3СОО- + Н2О
СН3СООН + NaОН → СН3СООNa + Н2О,
То есть, избыток ионов ОН– связывается
в малодиссоциирующее соединение – Н2О.
34. Механизм буферного действия
Таким образом, постоянство pHподдерживается за счет того, что
избыток свободных ионов H+ или OHсвязывается одним из компонентов
буферной системы в
малодиссоциирующее соединение.
35. Водородный показатель среды буферных растворов
В основе расчета pH буферных системлежит закон действующих масс для
кислотно-основного равновесия.
Вывод этого уравнения можно показать
на примере ацетатной буферной системы:
СН3СООН
СН3СООNa
СН3СОО- + Н+,
СН3СОО- + Na+.
36. Водородный показатель среды
Константа кислотности кислотно-основногоравновесия диссоциации уксусной кислоты
равна:
H CH COO
+
Ka
Отсюда:
-
3
CH 3COOH
CH 3COOH
+
H K
a
CH COO
-
3
37. Водородный показатель среды
Согласно принципу Ле Шателье-Брауна,присутствие в растворе СН3СООNa создает
избыток ацетат-ионов СН3СОО- и кислотноосновное равновесие диссоциации уксусной
кислоты СН3СООH сдвинуто влево.
В результате из 10 тысяч молекул СН3СООH
диссоциирует только одна. Поэтому:
[СН3СООН] = [кислота],
[СН3СООNa] = [СН3СОО-] = [соль]
38. Водородный показатель среды
Уравнение принимает вид:кислота
+
H Ka
соль
Уравнение в логарифмической форме:
[соль ]
- lg[ H ] - lg К а + lg
[кислота]
+
pH
- lg H
+
- lg К а pK а
39. Водородный показатель среды
[соль]pH pK а + lg
[кислота ]
уравнение Гендерсона - Гассельбаха,
где pH - водородный показатель среды,
pK а - показатель кислотности слабой кислоты,
[соль]
- буферное соотношени е.
[кислота ]
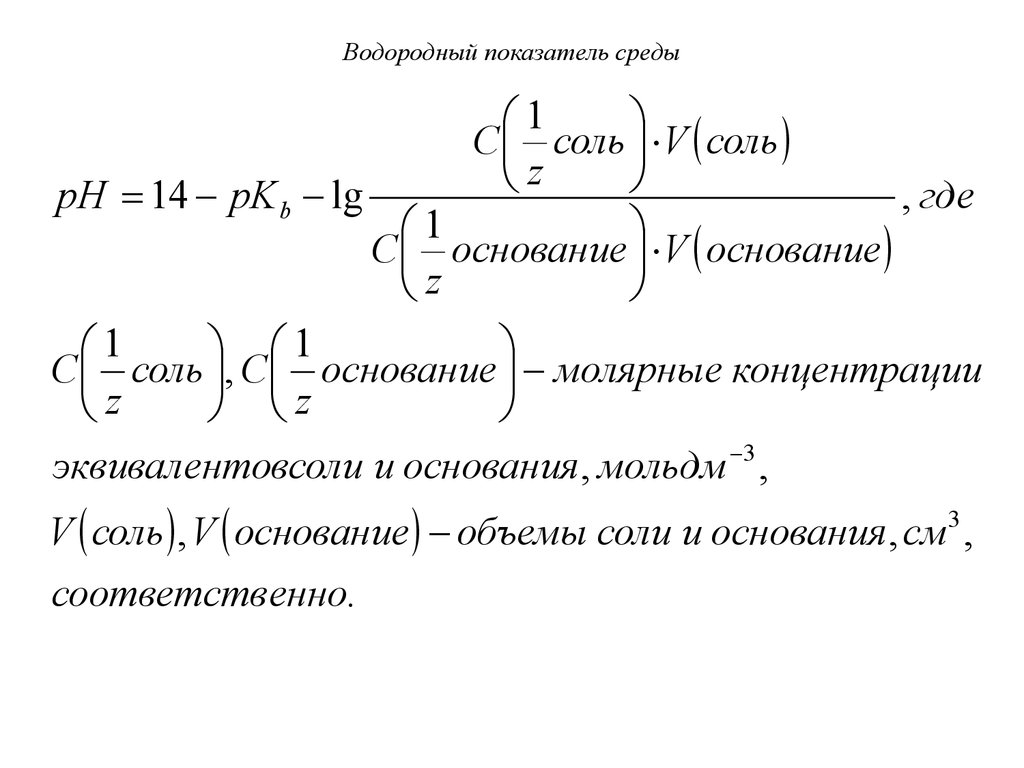
40. Водородный показатель среды
Уравнение Гендерсона-Гассельбаха дляосновных буферных систем:
[соль]
pH 14 - pK b - lg
,
[основание]
где pK b - показатель константы
основности слабого основания.
41. Водородный показатель среды
При разбавлении водой меняютсяконцентрации соли и кислоты в
одинаковой степени, соотношение
же этих концентраций остается
постоянным, поэтому при
разбавлении водой рН в
определенных пределах не меняется.
42. Водородный показатель среды
Рабочие формулы уравнения ГендерсонаГассельбаха:1
C соль V соль
z
pH pK a + lg
, где
1
C кислота V кислота
z
1
1
C соль , C кислота молярные концентрации
z
z
эквивалентов соли и кислоты, мольдм -3 ,
V соль , V кислота - объемы соли и кислоты, см 3 ,
соответственно.
43. Водородный показатель среды
1C соль V соль
z
pH 14 - pK b - lg
, где
1
C основание V основание
z
1
1
C соль , C основание - молярные концентрации
z
z
-3
эквивалентовсоли и основания , мольдм ,
V соль , V основание - объемы соли и основания , см 3 ,
соответственно.
44. Водородный показатель среды
Задача 1. Рассчитайте рН ацетатной буфернойсистемы, состоящей из 100 см3 раствора
уксусной кислоты с концентрацией 1 моль/дм3 и
200 см3 раствора ацетата натрия с
концентрацией раствора 0,5 моль/дм3,
Ка СН3СООН = 1,75· 10-5.
Решение: рКа = - lg (1,75 · 10-5) = 4,75.
рН = 4,75 + lg (200 · 0,5)/(100 ·1) = 4,75 + lg1 = 4,75.
45. Зона буферного действия
Способность буферных растворовпротиводействовать резкому изменению рН
при прибавлении к ним кислоты или щелочи
является ограниченной.
Буферное действие прекращается, если
буферное соотношение превышает 10/1 или
становится меньше 1/10.
Тогда, lg10 = 1; lg0,1 = -1.
46. Зона буферного действия
Зона буферного действия – интервал значенийpH, в пределах которого буферная система
сохраняет свои свойства:
pH = pKа ± 1.
Пример: для ацетатного буфера
K а 1,75 10
-5
рК а - lg K а 4,76
pH 4,76 1
47. Буферная емкость
Величину, характеризующую способностьбуферной системы противодействовать
смещению реакции среды при добавлении
кислот и щелочей, называют буферной
емкостью (B).
Буферную ёмкость можно определить по
кислоте или по основанию.
Буферная ёмкость показывает, сколько
моль-эквивалентов кислоты или щелочи
следует добавить к 1 дм3 буферного
раствора, чтобы изменить его рН на
единицу.
48. Буферная емкость
1V ( X ) C( X )
z
B
pH V1
V(X) – объем кислоты или основания, см3.
V1 – объем исходного буферного раствора, см3.
1
C( X )
z
– молярная концентрация эквивалента
кислоты или основания, мольдм-3,
ΔрН – изменение pH.
49.
Буферная емкостьЕсли V1 = 1 дм3, ΔрН = 1, тогда
1
B V ( X ) C( X )
z
Величина буферной емкости зависит от
природы и концентрации буферных
компонентов.
Она возрастает по мере увеличения
концентрации буферных компонентов и
приближения буферного соотношения к
единице.
50. Буферные системы крови
Биологическая роль буферных системБуферные системы участвуют в
поддержании кислотно-основного гомеостаза.
Внутриклеточные и внеклеточные
жидкости живых организмов характеризуются
постоянством значений pH.
pH большей части внутриклеточных
жидкостей находится в интервале 6,8 -7,8 ( в
том числе плазмы крови 7,34 -7,36).
51. Буферные системы крови
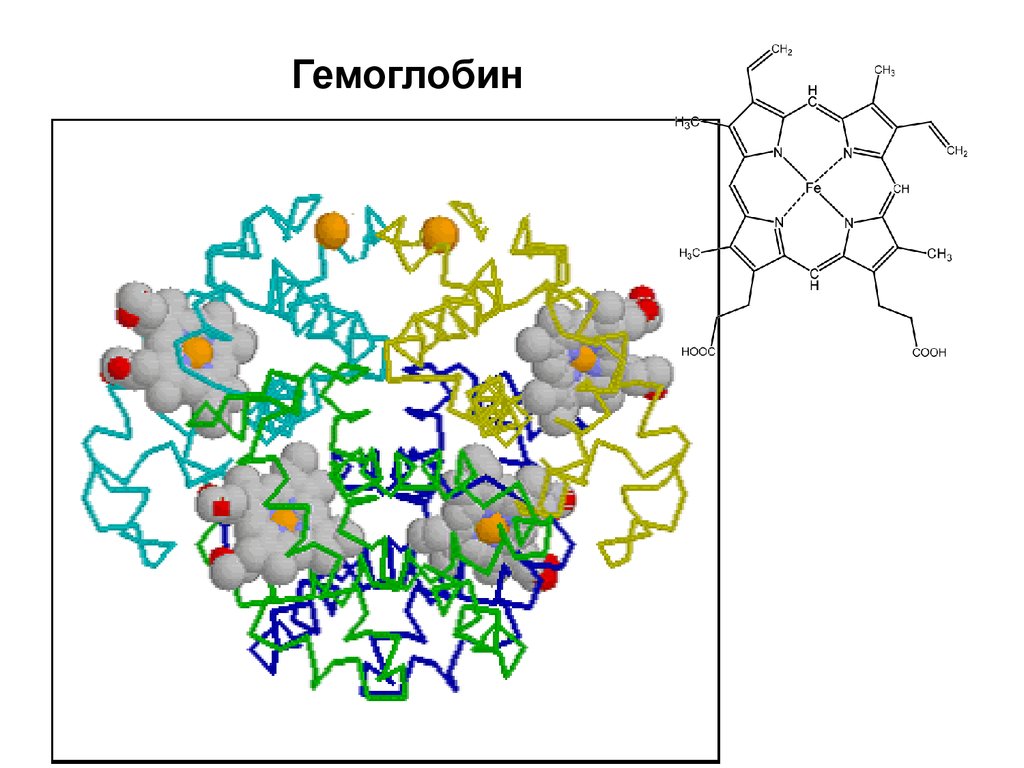
Кровь содержит шесть буферныхсистем.
Буферные системы крови:
1. Гемоглобиновая:
HHb
H+ + HbKHb
K+ + Hb2.Оксигемоглобиновая:
HHbO2 H+ + HbO2KHbO2
K+ + HbO2-
52.
Гемоглобин53. Буферные системы крови
В сумме эти две системы обладают 75%буферной емкости крови.
Они играют важную роль в процессе
дыхания - осуществляют транспортную
функцию по переносу кислорода к тканям и
органам.
Участвуют в поддержании постоянства pH
внутри эритроцитов и в крови целом.
54. Буферные системы крови
3. Белковая буферная система:Prot H H+ + ProtProt Na Na+ + ProtЭта система может нейтрализовать как
кислые, так и основные продукты.
Буферная емкость, определяемая белками
плазмы, зависит от концентрации белков и
их природы, состава.
Буферная емкость по кислоте для
альбуминов составляет 10 ммоль· дм-3,
для глобулинов – 3 ммоль · дм-3.
55. Буферные системы крови
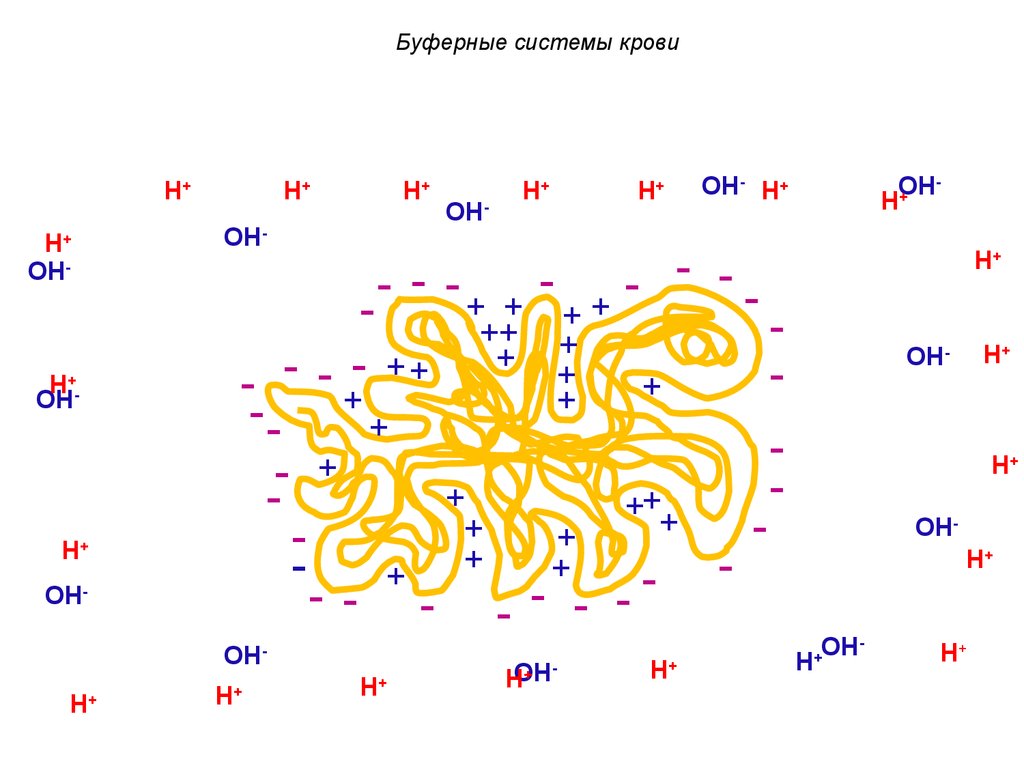
В макромолекуле белка многочисленнымиотрицательные заряды сосредоточены на
внешней стороне, и положительные заряды в
щелях молекулы.
- - -+
-
- - --
+ ++
++ +
+ +
++
+
+
+
-+
- +
+
+++
+
+
+
+
+
- - - - - - -
-
-
56. Буферные системы крови
H+ ионы притягиваются котрицательным зарядам.
H+
H+
H+
H+
- - -+
-
H+
H+
H
+
H+
H+
H+
- - --
+ ++
++ +
+ +
++
+
+
+
-+
- +
+
+++
+
+
+
+
+
- - - - - - -
H+
H+
H+
H
+
-
H+
H+
-
H+
-
H+
H+
H+
H+
57. Буферные системы крови
OH- ионы притягиваются к положительнымзарядам.
OHOH-
OH-
OH-
OH-
OH-
- - -+
-
- - --
+ ++
++ +
+ +
+
+
- -+
+
+
-+
- +
+
+++
+
+
+
+
+
- - - - - - OH-
OH-
OH-
-
-
OH-
OH-
OH-
58. Буферные системы крови
H+H+
OH-
H+
H+
OH-
- - -+
-
OH- H+
H+
- - --
+ ++
++ +
+ +
+
+
- -+
+
+
-+
- +
+
+++
+
+
+
+
+
- - - - - - -
H+OH
H+
OH-
OHH+
OH-
H+
H
+
H
+
+ HOH
H
+
-
OH
+
H
H+
-
H+
OH-
-
H+
OHH+
H
OH-
+
H+
59. Буферные системы крови
4. Система эфиров глюкозы и фосфорнойкислоты
O
Глюкоза P OH
ONa
O
Глюкоза P ONa
ONa
Глюкоз-эфирная буферная система
действует в клетке.
60. Буферные системы крови
5. Карбонатная буферная системаН2СО3
Н+ + НСО3 –
NaHCO3 Na+ +HCO3–
Характеризует кислотно-щелочной резерв
крови, который измеряется объемом СО2,
химически связанным со 100 мл плазмы
крови, насыщенной газом с парциальным
давлением СО2 53,3 кПа.
Действует в плазме крови и в эритроцитах.
Имеет незначительную буферную емкость
(В = 40 ммоль/л плазмы крови), но играет
первостепенную роль в регуляции дыхания.
61. Буферные системы крови
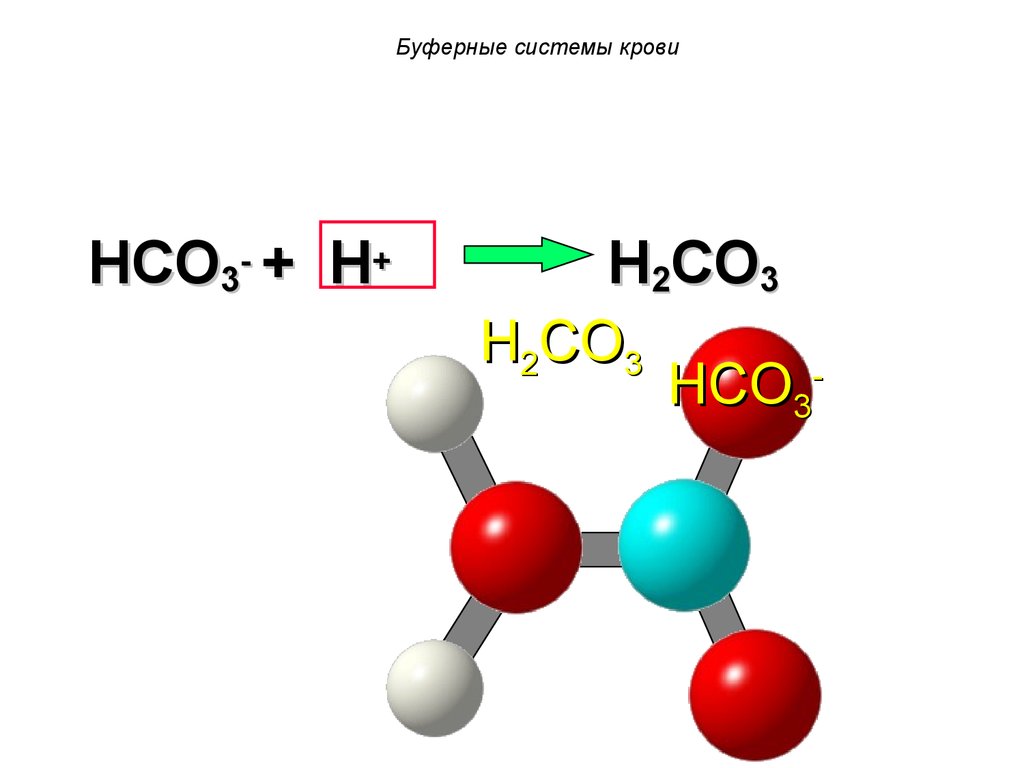
HCO3- + H+H2CO3
H2CO3
HCO3-
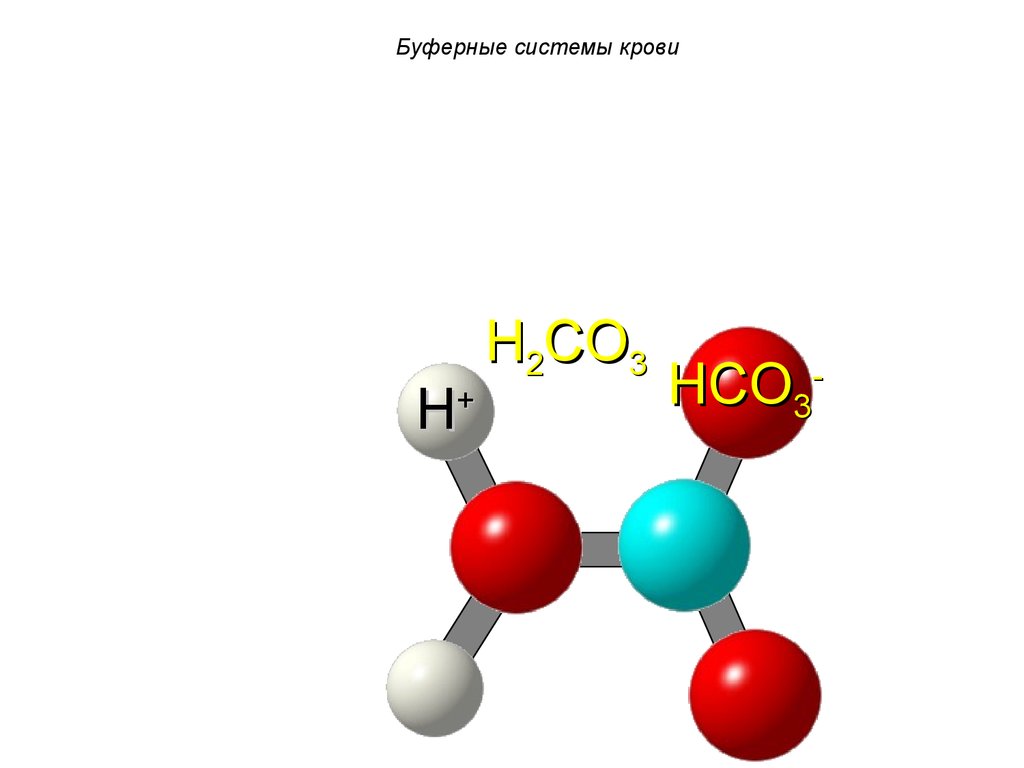
62. Буферные системы крови
H+H2CO3
HCO3-
63. Буферные системы крови
Кислотно-щелочное (кислотно-основное)состояние организма оценивают с помощью
уравнения Гендерсона-Гассельбаха,
выведенного для гидрокарбонатного
буфера крови.
-
[ HCO3 ]
pH pK а + lg
[ H 2CO3 ]
рКа ( для крови) = 6,11.
рН (крови здорового человека) = 7,34-7,36.
64.
Буферные системы кровиВ крови Н2СО3 полностью разлагается на СО2 и
Н2О, поэтому [Н2СО3] = [СО2], а
[NaHCO3]
= [HCO3-].
Рабочая формула для организма
человека:
[ HCO3 ]
pH 6,11 + lg
[CO2 ]
Измерив рН с помощью прибора (рН-метра),
можно рассчитать по этому уравнению величину
буферного отношения, которая для нормы:
[ HCO3 ] 20
[CO2 ]
1
65.
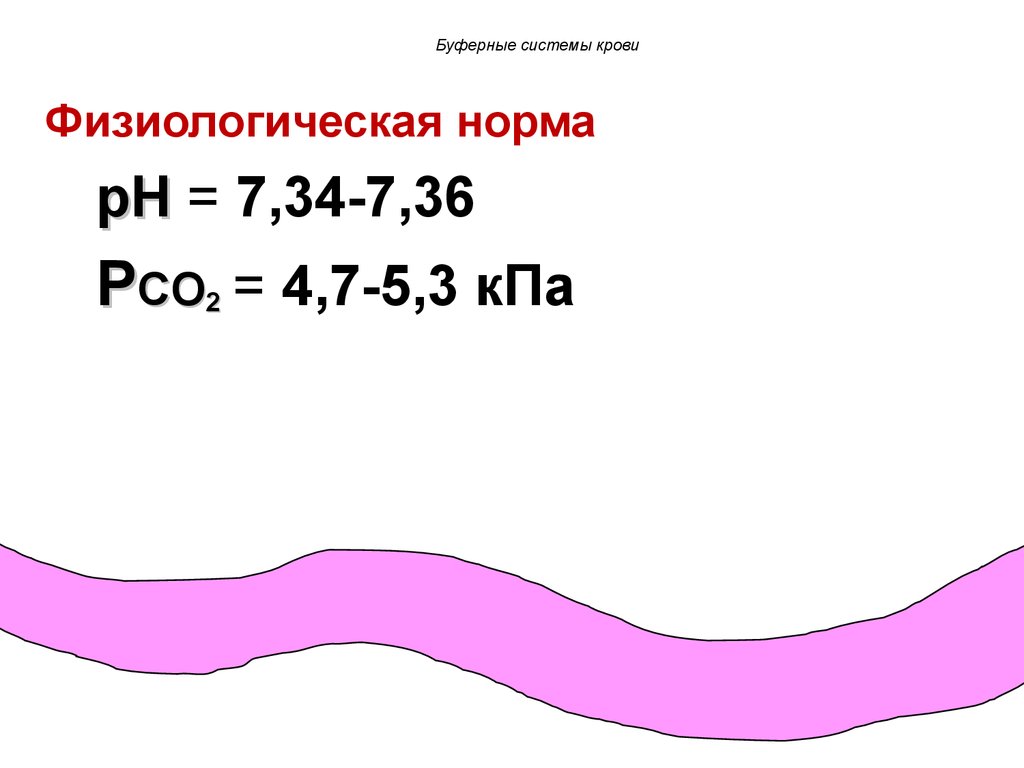
Буферные системы кровиФизиологическая норма
pH = 7,34-7,36
PCO2 = 4,7-5,3 кПа
66.
Буферные системы кровиПри задержке СО2 в крови, буферное
[ HCO3 ] 20 ,
отношение станет:
[CO2 ]
1
т.е. кислотно-щелочное равновесие смещается в
сторону повышения кислотности.
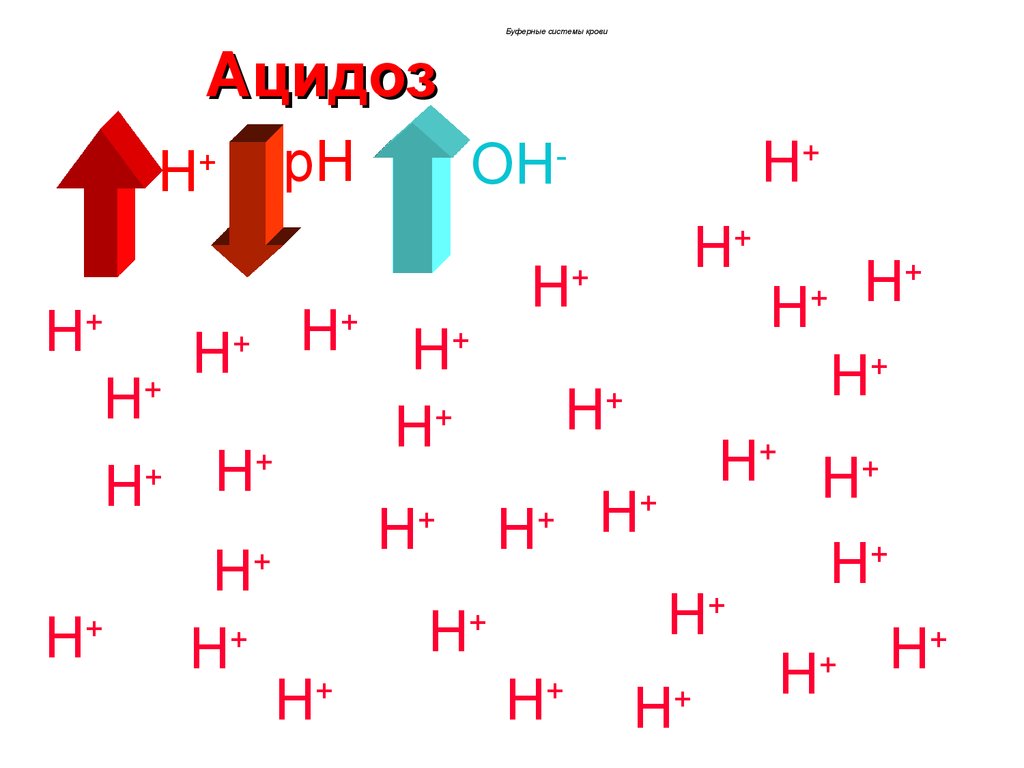
Возникает состояние ацидоза.
Если рН крови <7,34 , то говорят о
некомпенсированном ацидозе.
Если рН крови находится в пределах 7,34-7,36,
то ацидоз компенсированный.
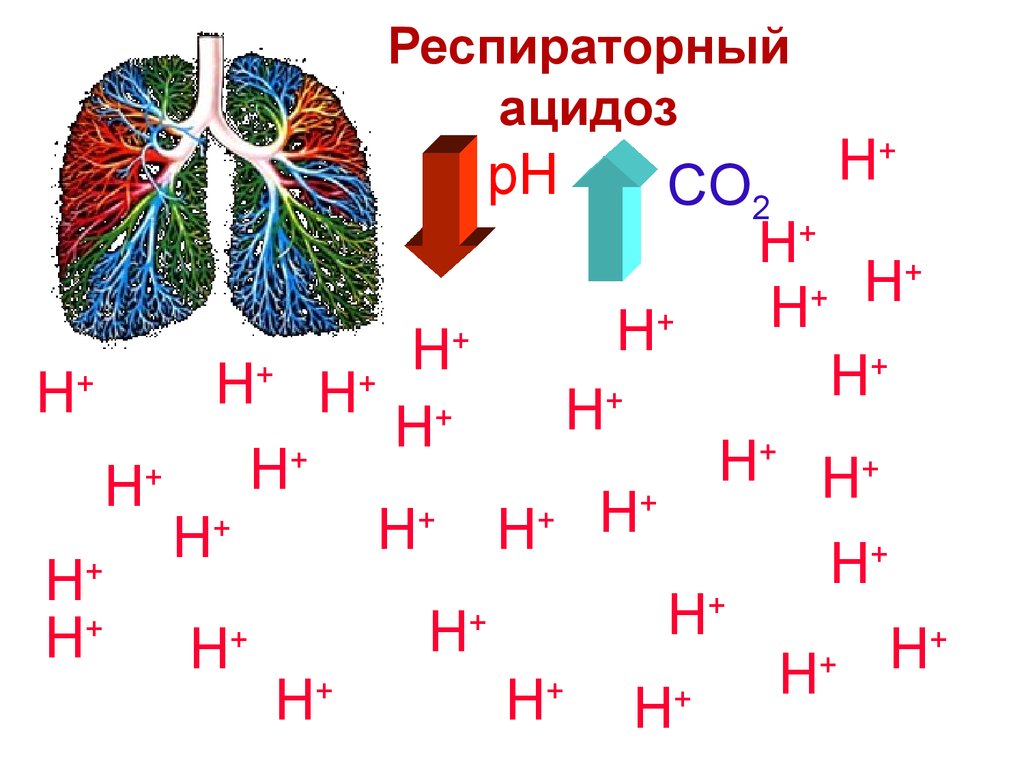
67. Ацидоз
Буферные системы кровиАцидоз
H
+
pH
H+
OH
-
H
+
H+
+
H
H+
H+
+
H
H+
+
+
H
H
+
H+
+
H
H
+
+
H
+
+
H
H
H
+
+
+ H
H
H
+
+
H
H
+
+
H
H
+
H+ H+
H
+
H
H+
H+ H+
68.
Буферные системы кровиЕсли из организма очень быстро выводится
[
HCO
20
СО2, то
3 ]
[CO2 ]
1
В этом случае кислотно-основное равновесие
смещается в сторону подщелачивания с
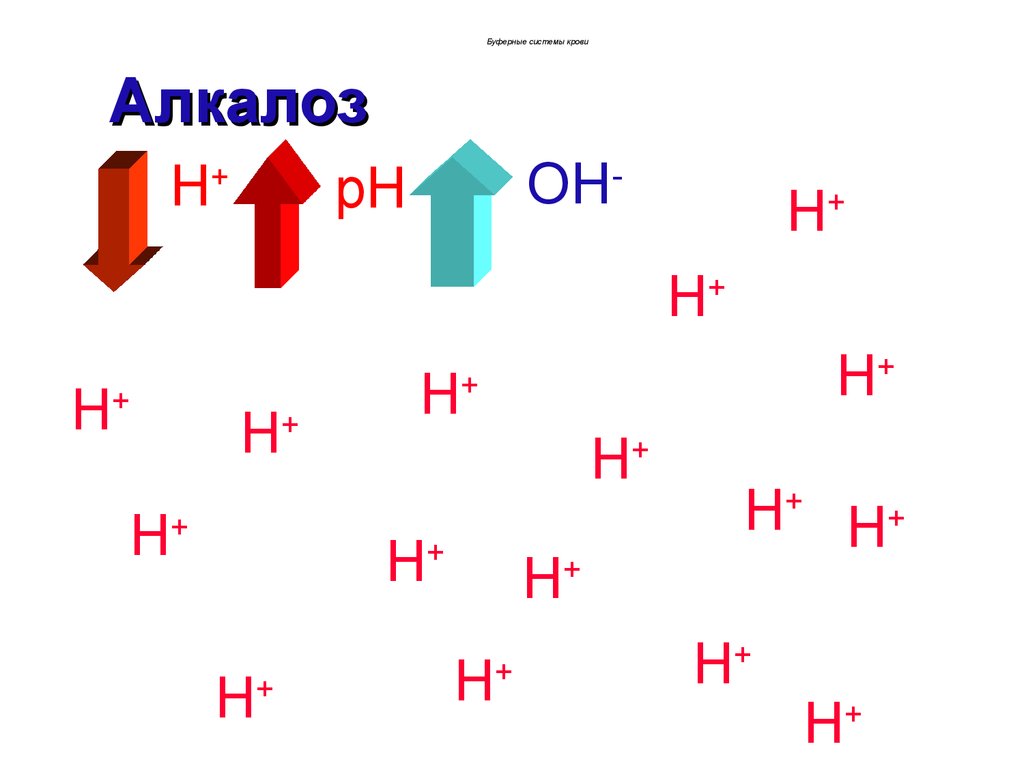
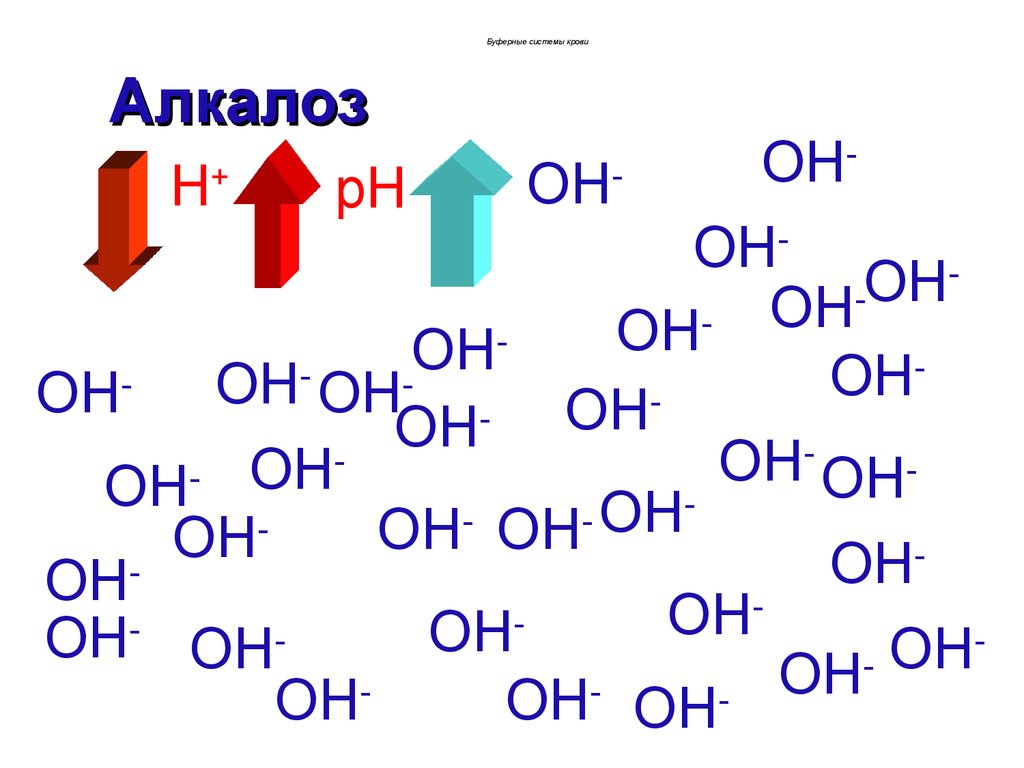
развитием алкалоза.
Если рН крови >7,36, то алкалоз
некомпенсированный.
При рН 7,34-7,36 алкалоз компенсированный.
69.
Буферные системы кровиАлкалоз
H
OH-
pH
+
H+
H+
H+
H+
H+
H+
H
+
H+
H+
H+
H+
H
+
H+ H+
H+
H+
70.
Буферные системы кровиАлкалоз
OH
+
OH
H
pH
OHOH
OH
OH
OH
OH
OH OH - OHOH
OH
OH
- OH
OH
OH
OH
OH OH
OH
OH
OH
OH
OH
OH- OHOH
OH
OHOH- OH-
71.
Буферные системы кровиТаким образом, кислотно-щелочное
состояние крови определяется
величиной pH, концентрацией ионов
HCO3- и давлением СО2 в крови.
72. Регуляция кислотно-щелочного состояния
73.
Буферные системы кровиПоскольку
в
регуляции
кислотно-щелочного
состояния крови принимают участие легкие и почки, то
различают метаболический и респираторный ацидоз
и алкалоз. При нормальной вентиляции легких
давление СО2 в артериальной крови 4,7-5,3 кПа.
Респираторные
нарушения
кислотно-щелочного
равновесия крови клинически легко определяются, а
метаболические могут протекать бессимптомно. В
таких
случаях
необходим
дополнительный
лабораторный контроль.
Показатели, характеризующие кислотно-щелочное
состояние в детском возрасте, мало отличаются от
показателей взрослых людей.
74.
Буферные системы крови75.
Буферные системы кровиCO2 + H2O
H2CO3
H+ + HCO3-
Респираторный ацидоз
Респираторный алкалоз
76. Респираторный ацидоз
pHH+
CO2
H+
+
H
+
H
+
H
+
H
+
+
+
+
H
H H +
H
+
H
H
+
+
H
+
+
H
H
H
+
+
+
H
+
H H
H
+
+
H
H
+
+
H
H
+
H+ H+
H
+
H
H+
H+ H+
77. Респираторный ацидоз
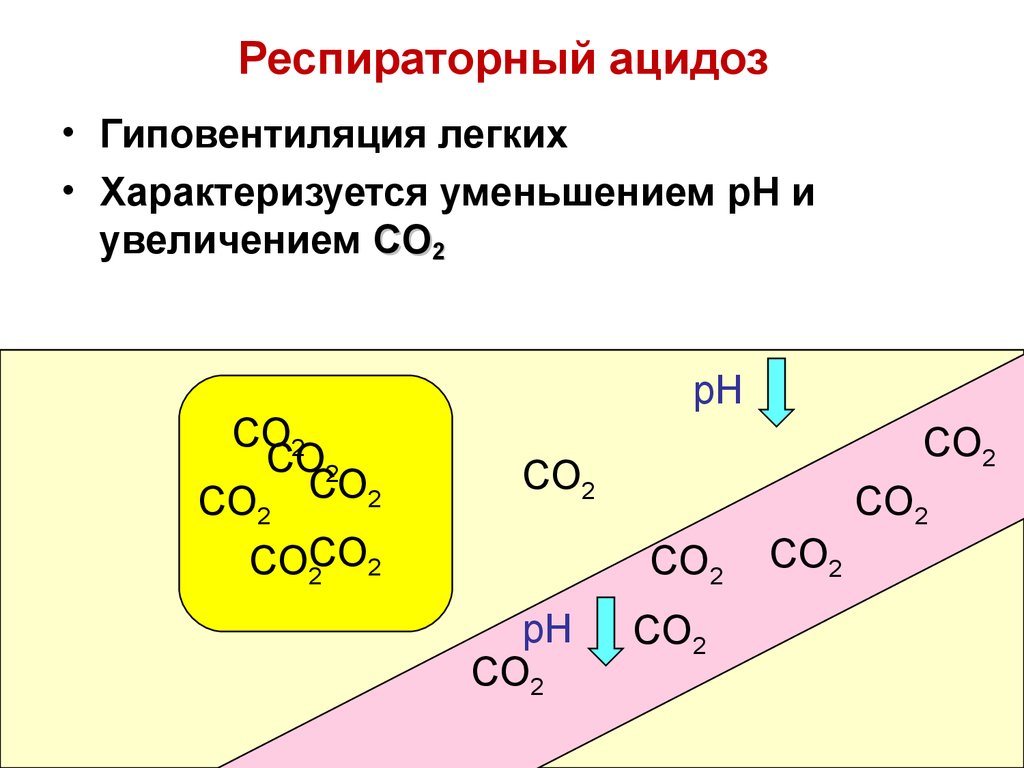
• Гиповентиляция легких• Характеризуется уменьшением pH и
увеличением CO2
CO2
CO2
CO CO2
2
pH
CO2
COCO
2
2
CO2
CO2
pH
CO2
77
CO2
CO2
CO2
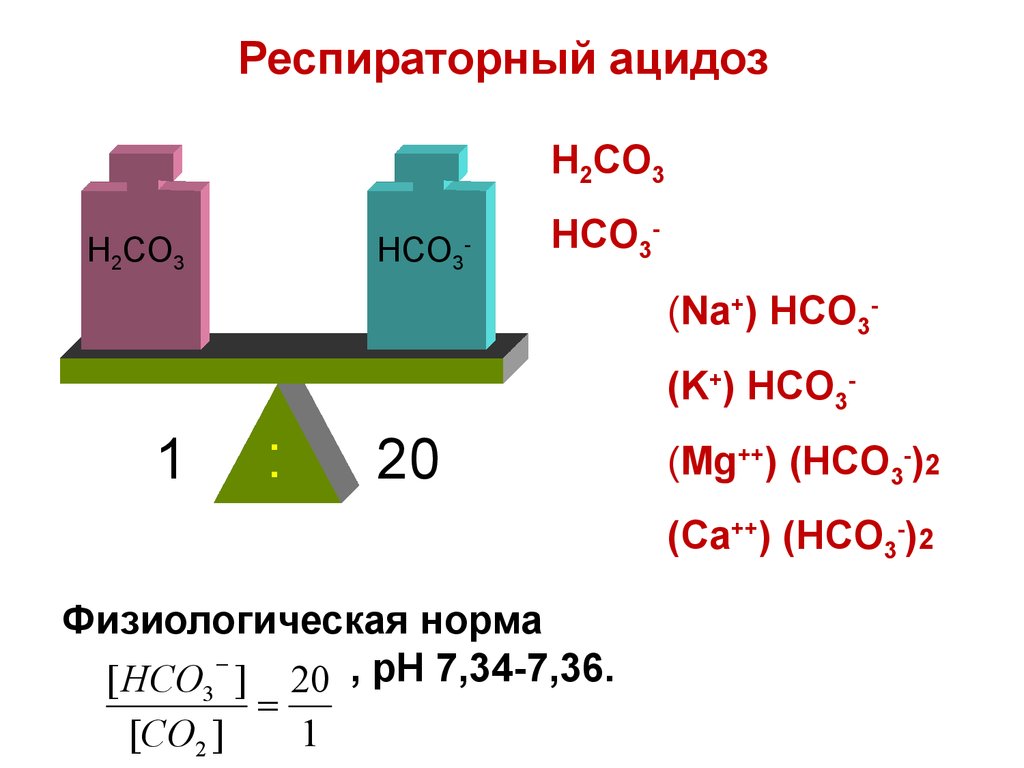
78. Респираторный ацидоз
H2CO3H2CO3
HCO3
-
HCO3(Na+) HCO3(K+) HCO3-
1
:
20
(Mg++) (HCO3-)2
(Ca++) (HCO3-)2
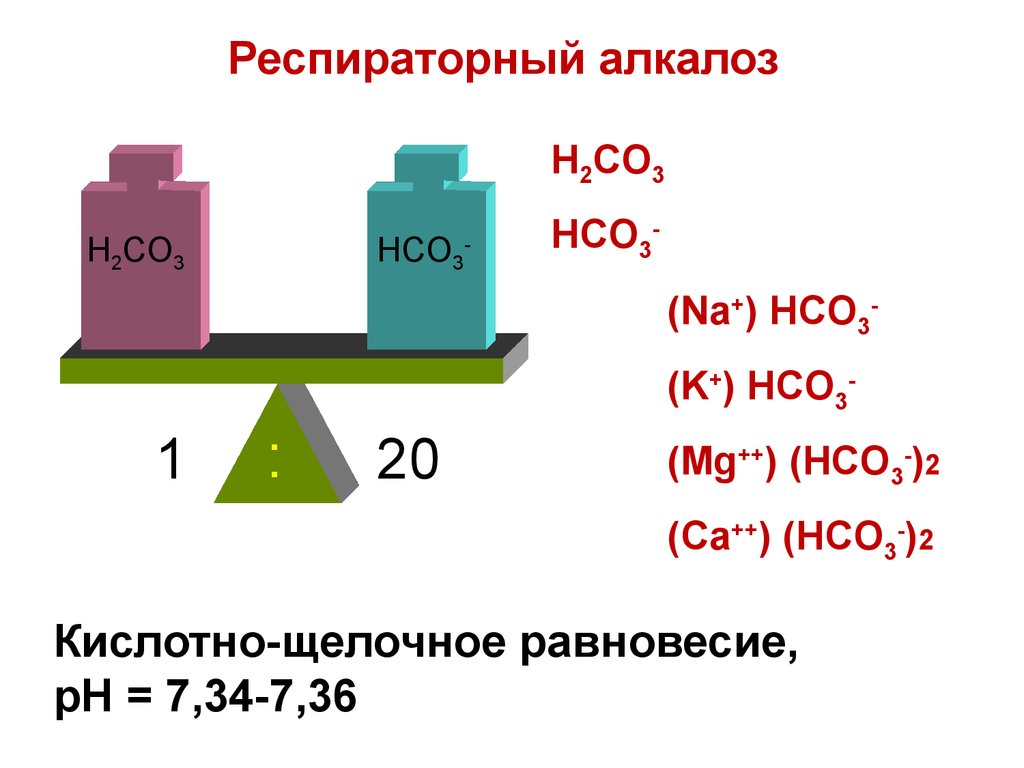
Физиологическая норма
[ HCO3 ] 20 , pH 7,34-7,36.
[CO2 ]
1
79. Респираторный ацидоз
CO2CO2
-
HCO 3
CO2
H 2CO 3
1
:
10
CO2 задерживается в крови, pH < 7,34
CO2
80. Респираторный ацидоз
H2CO3O
C
3
H
H 2CO 3
1
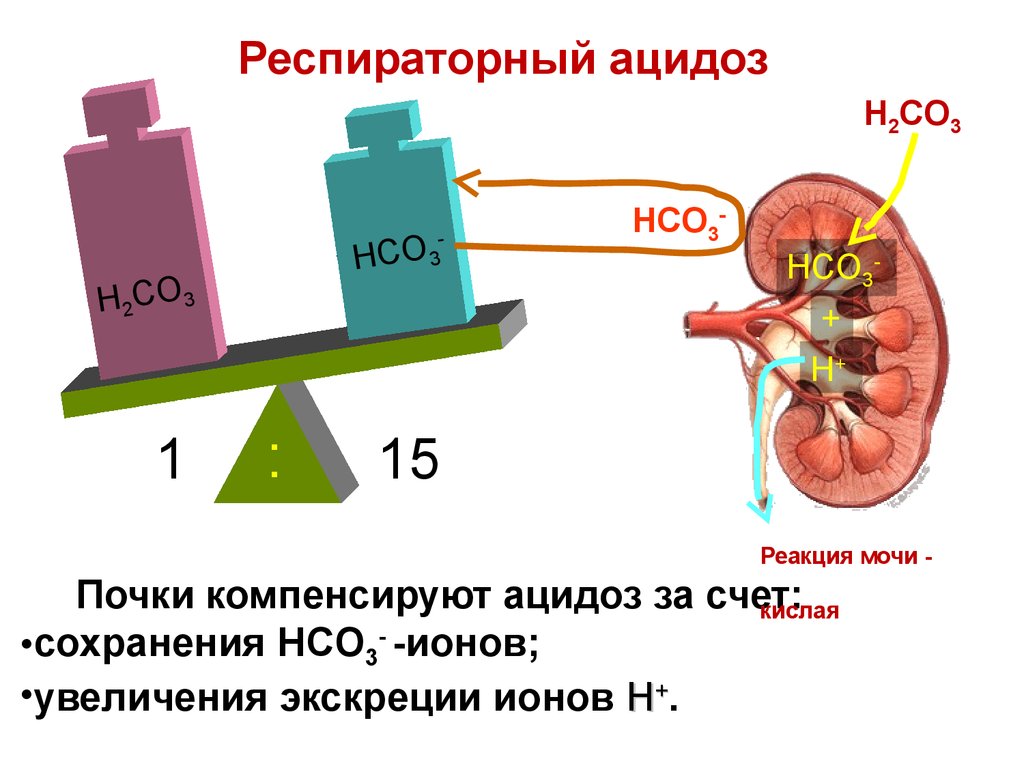
:
HCO3HCO3+
H+
15
Реакция мочи -
Почки компенсируют ацидоз за счет:
кислая
•сохранения HCO3- -ионов;
•увеличения экскреции ионов H+.
81. Респираторный ацидоз
Экскреция ионов водорода почками в нормеПеритубулярные
капилляры
K+
Тубулярная
жидкость
Na+
H+
81
Клетки
почечных
канальцев
K+
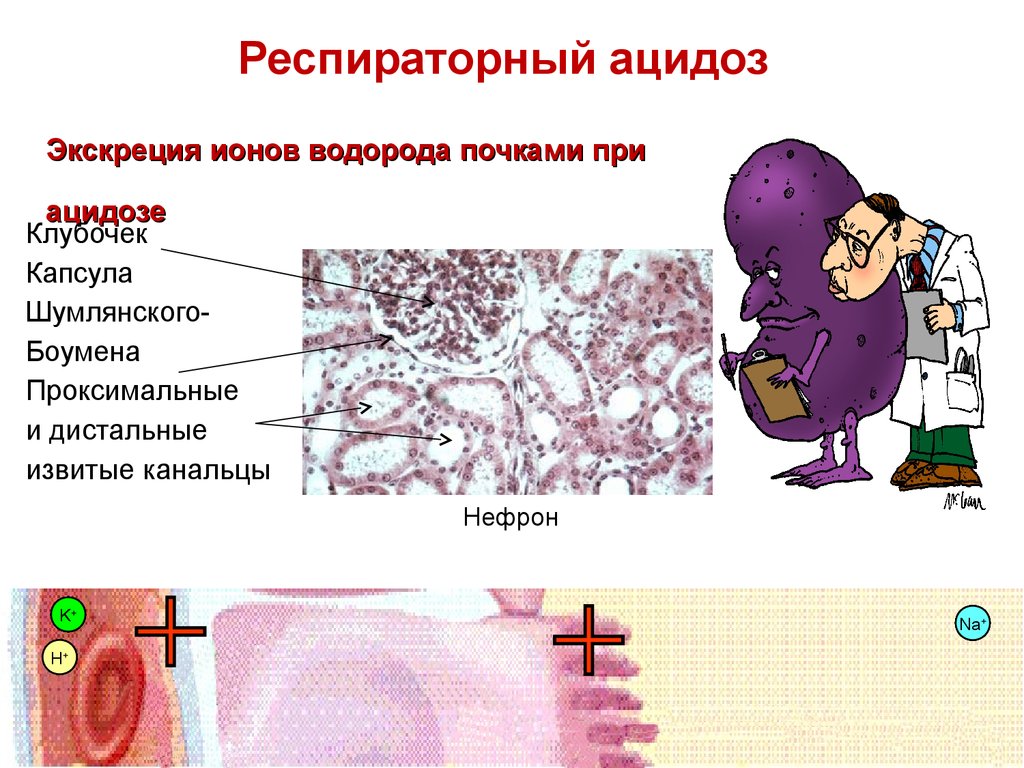
82. Респираторный ацидоз
Экскреция ионов водорода почками приацидозе
Клубочек
Капсула
ШумлянскогоБоумена
Проксимальные
и дистальные
извитые канальцы
Нефрон
K+
H+
82
Na+
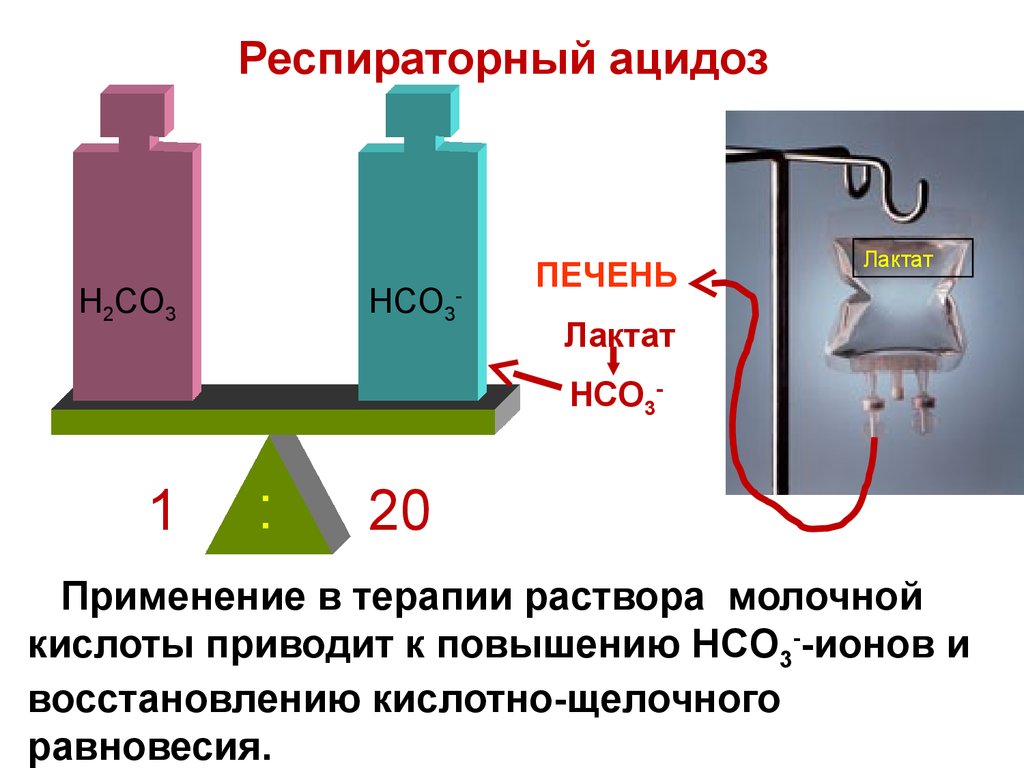
83. Респираторный ацидоз
H2CO3HCO3
-
ПЕЧЕНЬ
Лактат
Лактат
HCO3-
1
:
20
Применение в терапии раствора молочной
кислоты приводит к повышению HCO3--ионов и
восстановлению кислотно-щелочного
равновесия.
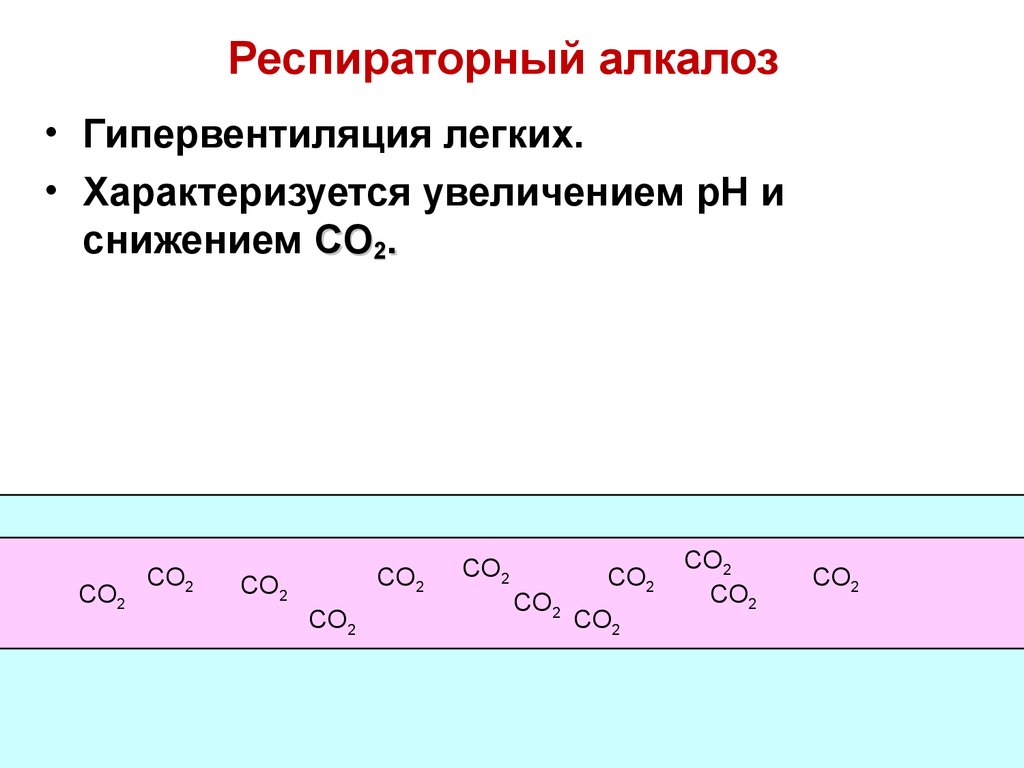
84. Респираторный алкалоз
OHpHCO2
OHOH
OH
OH
OH
OH
OH OH - OHOH
OH
OH
- OH
OH
OH
OH
OH OH
OH
OH
OH
OH
OH
OH- OHOH
OH
OHOH- OH-
85. Респираторный алкалоз
• Гипервентиляция легких.• Характеризуется увеличением pH и
снижением CO2.
CO2
85
CO2
CO2
CO2
CO2
CO2
CO2
CO2
CO2
CO2
CO2
CO2
86. Респираторный алкалоз
H2CO3H2CO3
HCO3
-
HCO3(Na+) HCO3(K+) HCO3-
1
:
20
(Mg++) (HCO3-)2
(Ca++) (HCO3-)2
Кислотно-щелочное равновесие,
pH = 7,34-7,36
87. Респираторный алкалоз
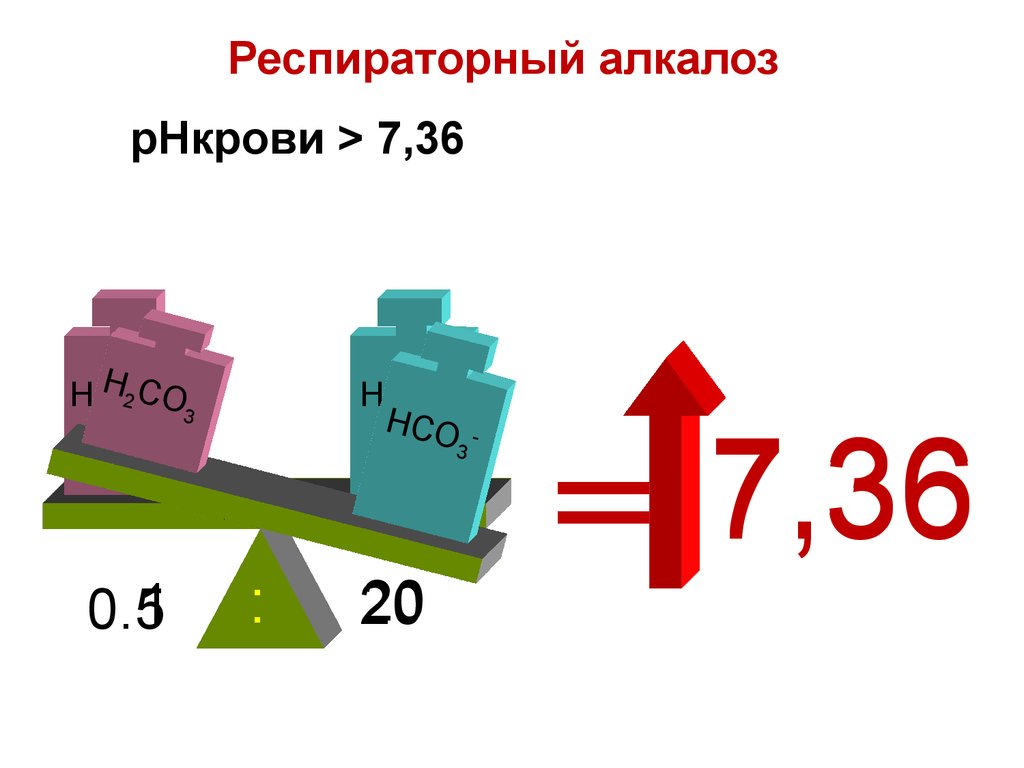
pHкрови > 7,362 C3O
H2H
CO
3
0.51
HCO3HCO 3
:
20
7,36
== 7.36
88. Респираторный алкалоз
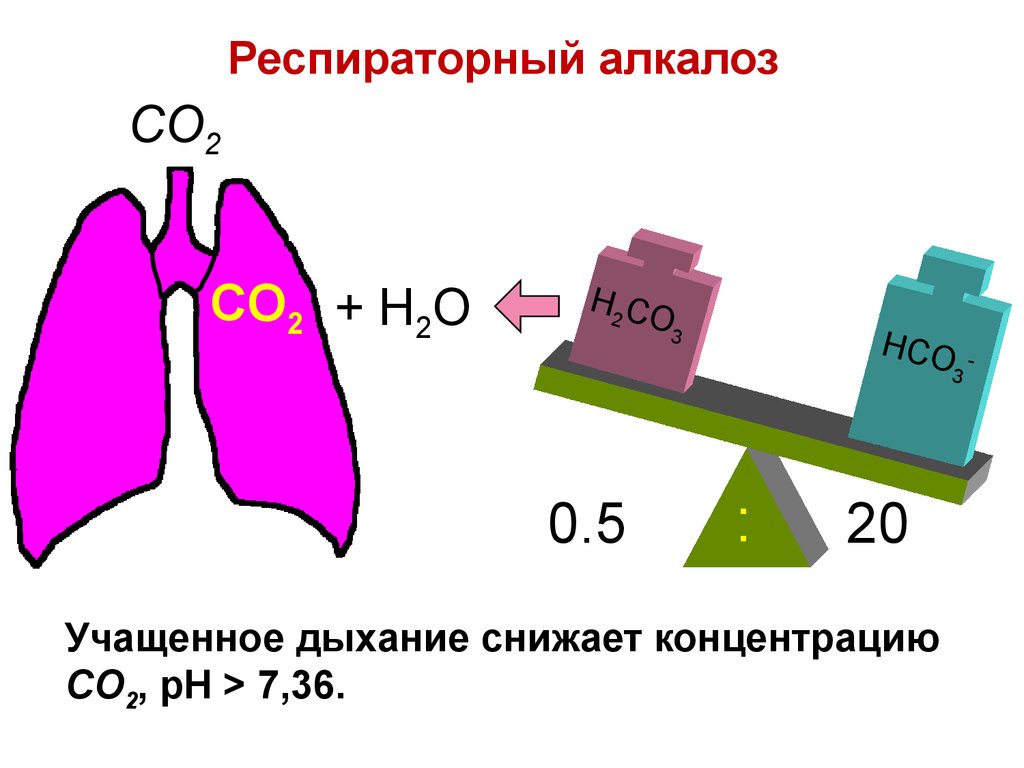
CO2CO2 + H2O
H2 CO
HCO
3
3
0.5
:
20
Учащенное дыхание снижает концентрацию
CO2, pH > 7,36.
-
89. Респираторный алкалоз
HCO3H2 COHCO 3
3
0,5
:
15
Реакция мочи щелочная
90. Респираторный алкалоз
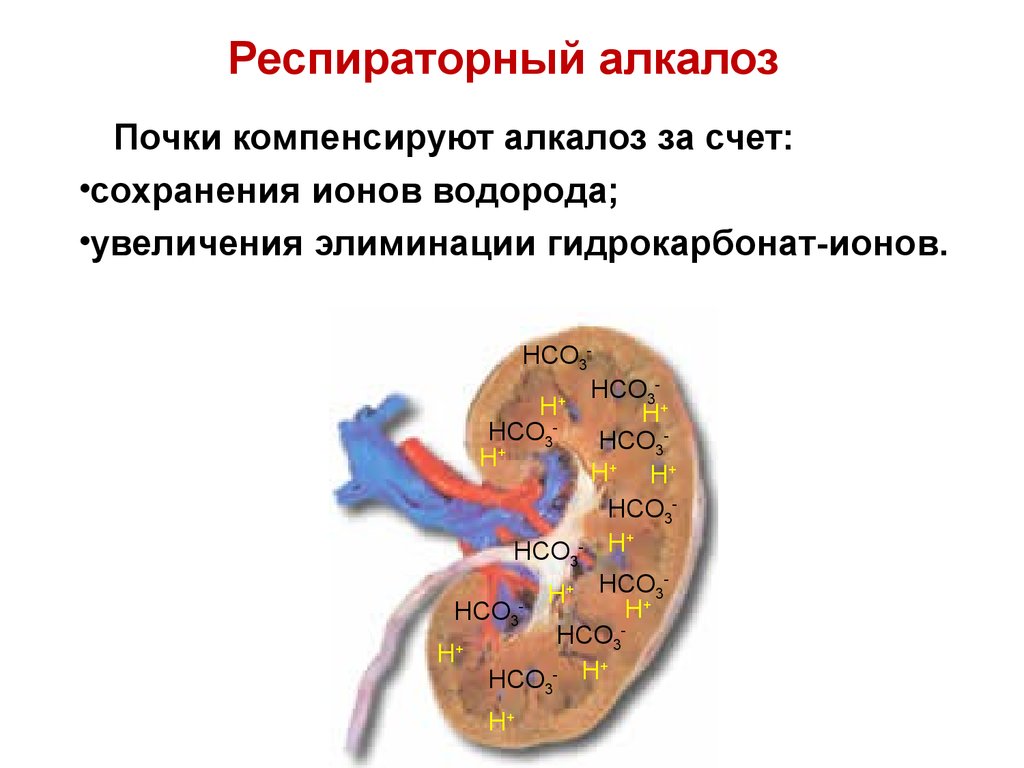
Почки компенсируют алкалоз за счет:•сохранения ионов водорода;
•увеличения элиминации гидрокарбонат-ионов.
HCO3HCO3+
+
H
H
HCO3HCO3+
H
H+ H+
HCO3+
HCO - H
3
HCO3+
H
H+
HCO3HCO
3
H+
+
HCO - H
3
H+
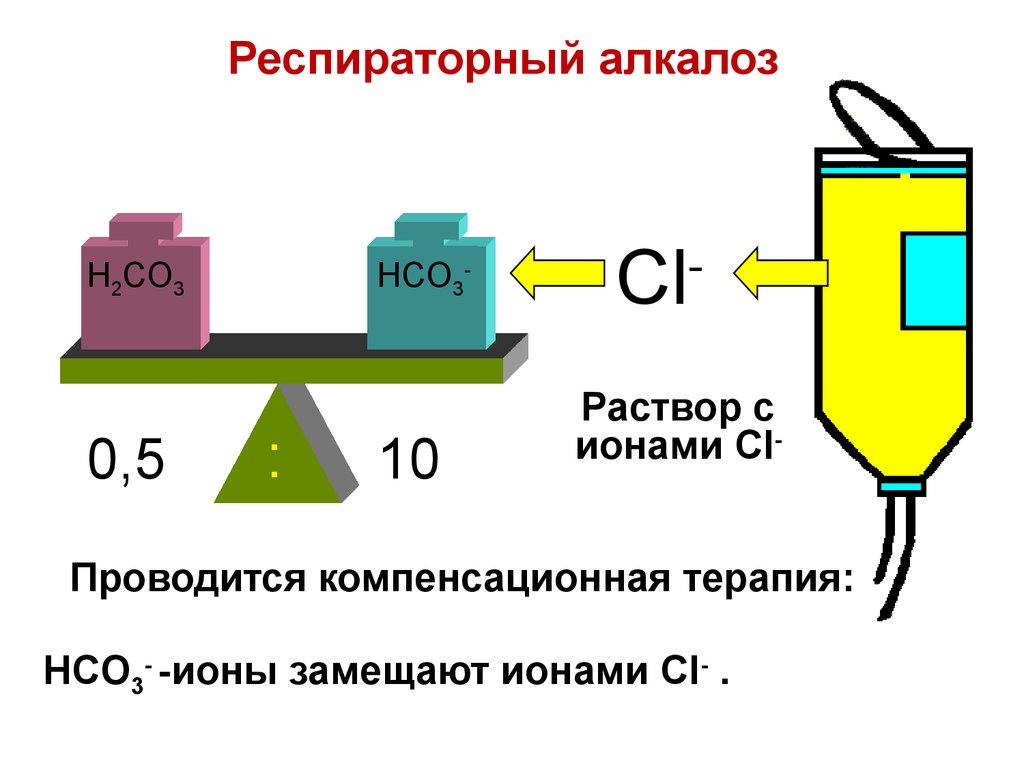
91. Респираторный алкалоз
H2CO30,5
HCO3-
:
10
Cl
-
Раствор с
ионами Cl-
Проводится компенсационная терапия:
HCO3- -ионы замещают ионами Cl- .
92. Буферные системы крови
6) Фосфатная буферная системаКH2PO4 ↔ К+ + H2PO4 - - слабая кислота
Na2HPO4 ↔ 2Na+ + HPO4 2- - сопряж. основание.
Фосфатная буферная система способна
сопротивляться изменению рН в интервале 6,28,2.
93. Буферные системы крови
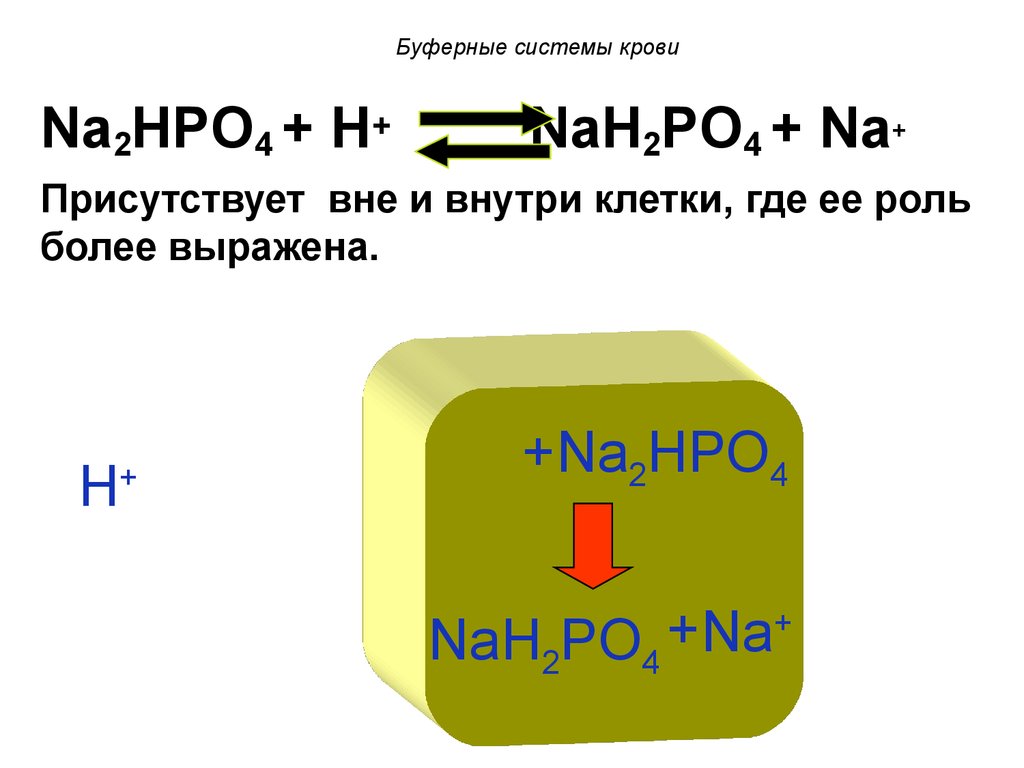
Na2HPO4 + H+NaH2PO4 + Na+
Присутствует вне и внутри клетки, где ее роль
более выражена.
H
+
+Na2HPO4
+
+
Na
NaH2PO4
94. Буферные системы крови
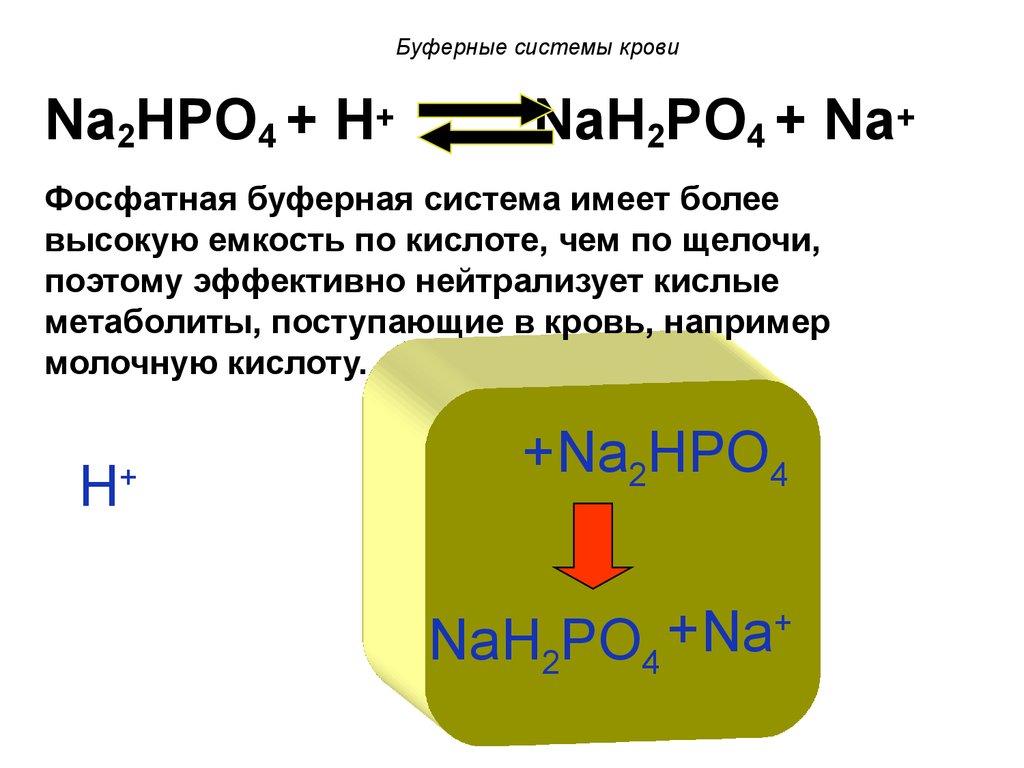
Na2HPO4 + H+NaH2PO4 + Na+
Фосфатная буферная система имеет более
высокую емкость по кислоте, чем по щелочи,
поэтому эффективно нейтрализует кислые
метаболиты, поступающие в кровь, например
молочную кислоту.
H
+
+Na2HPO4
+
+
Na
NaH2PO4
95. Буферные системы крови
Фосфатная буфернаясистема имеет наибольшее
значение в таких
биологических жидкостях, как
моча, соки пищеварительных
желез, слюна.
Во внутренней среде
эритроцитов в норме
поддерживается рН= 7,25.
Здесь также действуют все
буферные системы крови,
обеспечивающие кислотноосновной гомеостаз
организма.
HPO4
-2
96.
Благодарю заВаше внимание!

























































 medicine
medicine biology
biology chemistry
chemistry








