Similar presentations:
Основное неравенство и основное уравнение термодинамики. Понятие о термодинамических потенциалах
1. Лекция 14-2020
Основное неравенство и основноеуравнение термодинамики
Понятие о термодинамических
потенциалах
Эффект Джоуля – Томпсона
Принцип Ле-Шателье - Брауна
Введение в термодинамику необратимых
процессов
2.
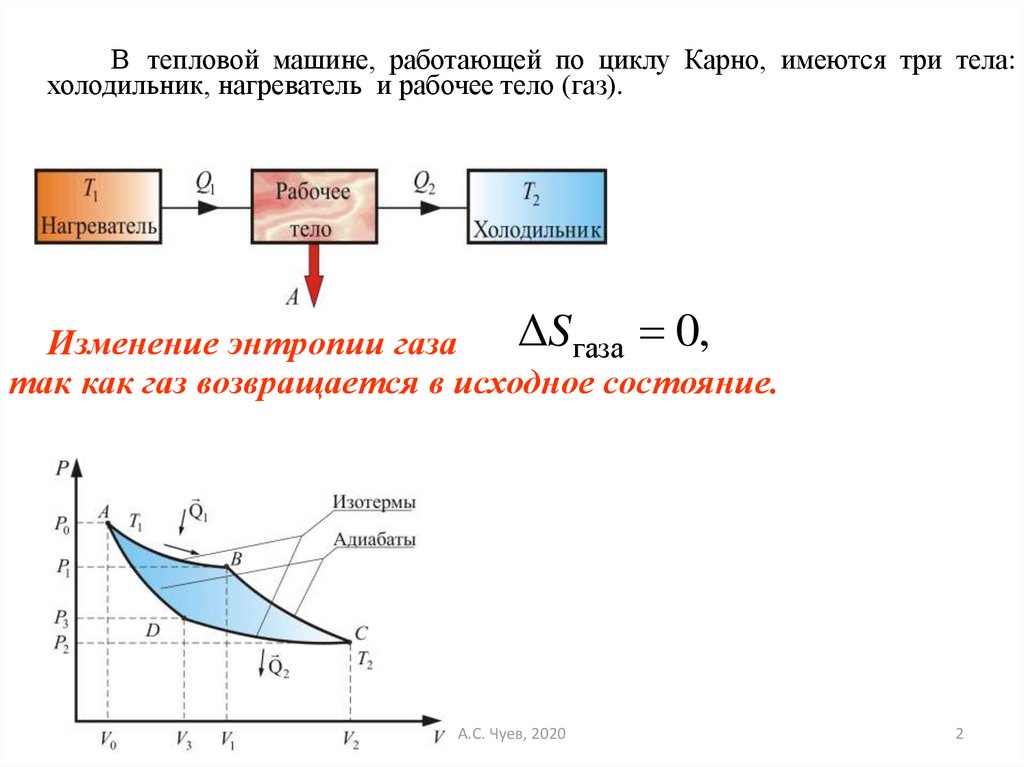
В тепловой машине, работающей по циклу Карно, имеются три тела:холодильник, нагреватель и рабочее тело (газ).
ΔSгаза 0,
Изменение энтропии газа
так как газ возвращается в исходное состояние.
А.С. Чуев, 2020
2
3.
Рассмотрим обратимый и необратимый циклыКарно
Обратимый цикл Карно.
Для обратимого цикла коэффициент полезного действия
можно вычислить по формулам
Q2
T2
η 1
1
Q1
T1
Q2 Q1
T2 T1
Для случая отвода тепла можно сказать, что к
системе подведено Q2 тепла. Тогда: Q2 Q2
n
Q1 Q2
0
T1 T2
Q
T
- приведенная теплота.
Qi
0
i 1 Ti
А.С. Чуев, 2020
3
4.
Так как любой замкнутый цикл можно представитькак сумму бесконечного числа циклов Карно, то для
любого замкнутого обратимого цикла
dQi
L Ti 0
или
dQобр
T
0
Это выражение называют равенством Клаузиуса.
Таким образом, сумма приведенных теплот при переходе
из одного состояния в другое не зависит от формы (пути)
перехода в случае обратимых процессов. Последнее
утверждение носит название теоремы Клаузиуса.
А.С. Чуев, 2020
4
5.
Математическое доказательствоОба интеграла равны независимо от пути интегрирования.
А.С. Чуев, 2020
5
6. Это неравенство Клаузиуса
При наличии тепловых потерьdQ
0
T
Это неравенство Клаузиуса
Оно характеризует необратимые
циклы
А.С. Чуев, 2020
6
7. или Вывод: При любом необратимом процессе в замкнутой системе энтропия возрастает (dS > 0).
dQT 0
или
ΔSнеобр 0
Вывод: При любом необратимом
процессе в замкнутой системе
энтропия возрастает
(dS > 0).
А.С. Чуев, 2020
7
8. При обратимом процессе При необратимом процессе, как доказал Клаузиус изменение энтропии больше приведенной теплоты. Тогда
При обратимом процессеdQ TdS
При необратимом процессе, как
доказал Клаузиус
dS dQ / T
изменение энтропии больше приведенной
теплоты.
Тогда тогда эти выражения можно
объединить:
dQ TdS
А.С. Чуев, 2020
8
9. Первое и второе начала термодинамики в объединенной форме имеют вид:
TdS dU dA.Это основное соотношение термодинамики
А.С. Чуев, 2020
9
10. Понятие о термодинамических потенциалах
Весь раздел факультативноПонятие о термодинамических
потенциалах
Все расчеты в термодинамике основываются на
использовании функций состояния, называемых
термодинамическими потенциалами. Каждому
набору независимых параметров соответствует
свой термодинамический потенциал.
Изменения потенциалов в ходе процессов
определяют либо совершаемую системой работу,
либо получаемое системой тепло.
А.С. Чуев, 2020
10
11. Понятие о термодинамических потенциалах
Из сравнения двух формул получаем:Таким образом, энтропия представима как функция двух переменных Т и Р
А.С. Чуев, 2020
11
12.
А.С. Чуев, 202012
13.
А.С. Чуев, 202013
14.
А.С. Чуев, 202014
15.
Рекомендуется зарисоватьH
(энтальпия)
U
PV
(потенциал Гельмгольца)
TS
F
PV
(энергия Гиббса)
TS
TS - связанная энергия. А.С. Чуев, 2020
G
F
- свободная энергия.
15
16. Свободная и связанная энергии
Как следует из первого и второго началатермодинамики в объединенной форме в
обратимом процессе:
d' A (dU TdS )
Это равенство можно переписать в виде
d' A d(U TS ) SdT.
А.С. Чуев, 2020
16
17. Обозначим, , где F – разность двух функций состояний, поэтому сама является также функцией состояния. Ее назвали свободной
Обозначим, U TS F , где F – разность двухфункций состояний, поэтому сама является также
функцией состояния. Ее назвали свободной
энергией (энергией Гельмгольца).
Тогда
d' A dF SdT
Если тело совершает обратимый
изотермический процесс, то dT 0
2
d' A dF dF F2 F1 F2 F1 ,
1
А.С. Чуев, 2020
17
18. следовательно свободная энергия есть та работа, которую могло бы совершить тело в обратимом изотермическом процессе или,
Aизотерм F1 F2следовательно свободная энергия есть та
работа, которую могло бы совершить тело
в обратимом изотермическом процессе
или, свободная энергия – есть максимальная
возможная работа, которую может
совершить система, обладая каким-то
запасом внутренней энергии.
А.С. Чуев, 2020
18
19. Связанная энергия – та часть внутренней энергии, которая не может быть превращена в работу – это обесцененная часть внутренней
Внутренняя энергия системы U равна суммесвободной (F) и связанной энергии (TS):
U F TS
Связанная энергия – та часть внутренней энергии,
которая не может быть превращена в работу – это
обесцененная часть внутренней энергии.
При одной и той же температуре, связанная
энергия тем больше, чем больше энтропия.
Таким образом, энтропия системы есть мера
обесцененности ее энергии (т.е. мера той энергии,
которая не может быть превращена в работу).
А.С. Чуев, 2020
19
20.
Соотношения термодинамических потенциаловdU TdS PdV
d ( PV ) PdV VdP
1. Прибавляя к обеим частям
получим
dH TdS VdP
d ( ST ) TdS SdT
2. Вычитая из обеих частей
получим
dF SdT PdV
т.е.
3. Вычитая из обеих частей
получим
H U PV
H H ( S , P)
т.е.
dG SdT VdP
F U TS
F F (T ,V )
d (ST )
т.е.
и прибавляя
d (PV )
G G (T , P )
А.С. Чуев, 2020
G U TS PV
20
21.
Пять параметров состояния ТДС: U, P, V, T, Sнет
T,S и P,V
А.С. Чуев, 2020
21
22. Соотношения Максвелла
TP
V S
S V
T
V
P S
S P
S P
V T T V
S
V
P T
T P
А.С. Чуев, 2020
Конец
факультативного
раздела
22
23.
КонспектироватьЭффект Джоуля-Томсона
Если идеальный газ адиабатно расширяется и
совершает при этом работу, то он охлаждается, так
как работа в данном случае совершается за счет его
внутренней энергии.
Подобный процесс, но с реальным газом –
адиабатное расширение реального газа с совершением
внешними силами положительной работы –
осуществили английские физики Дж.Джоуль и
У.Томсон (лорд Кельвин) в 1865г.
24. Эффект Джоуля-Томсона состоит в изменении температуры газа в результате медленного протекания газа под действием постоянного
перепада давления сквозь дроссель – локальноепрепятствие газовому потоку, например пористую
перегородку, расположенную на пути потока.
А.С. Чуев, 2020
24
25.
Первоначально в качестве дросселяиспользовалась мелкопористая
перегородка из ваты.
А.С. Чуев, 2020
25
26. Эффект Джоуля-Томсона свидетельствует о наличии в газе сил межмолекулярного взаимодействия. Газ совершает внешнюю работу –
последующие слои газа проталкиваютпредыдущие, а над самим газом совершают
работу силы внешнего давления,
обеспечивающие стационарность потока.
Работа проталкивания через дроссель
порции газа объемом V1 при давлении Р1
равна Р1V1, за дросселем эта порция газа
занимает объем V2 и совершает работу Р2V2 .
А.С. Чуев, 2020
26
27. Совершенная над газом результирующая внешняя работа равна В адиабатических внешних условиях эта работа идет на изменение его
Совершенная над газом результирующаявнешняя работа равна
A P1V1 P2V2 .
В адиабатических внешних условиях эта
работа идет на изменение его внутренней энергии
U 2 U1 P1V1 P2V2 .
Из этого условия следует, что
P1V1 U1 P2V2 U 2
А.С. Чуев, 2020
27
28. Таким образом, в опыте Джоуля-Томсона сохраняется (остается неизменной) величина Она является функцией состояния и называется
Таким образом, в опыте Джоуля-Томсонасохраняется (остается неизменной) величина
H PV U
Она является функцией состояния и
называется энтальпией.
Энтальпия – термодинамический
потенциал характеризующий состояние
системы в равновесии при выборе в качестве
независимых переменных энтропии S и давления P
Полный дифференциал имеет вид:
dH= VdР + TdS
А.С. Чуев, 2020
28
29. Эффект Джоуля-Томсона принято называть положительным, если газ в процессе дросселирования охлаждается и отрицательным, если газ
Эффект Джоуля-Томсона принятоназывать положительным, если газ в
процессе дросселирования охлаждается
ΔT 0
и отрицательным, если газ нагревается
ΔT 0
А.С. Чуев, 2020
29
30.
Сжижение газовПревращение любого газа в жидкость –
сжижение газа – возможно лишь при
температуре ниже критической.
Критические температуры
Газ
He
H2
N2
O2
ТК, К
5,3
33
126,1
154,4
31. Схема установки для сжижения газов, в которой используется эффект Джоуля-Томсона – машина Линде. Воздух в компрессоре (1)
сжимается до давления вдесятки мегапаскалей и охлаждается в холодильнике (5).
Затем сжатый воздух проходит по внутренней трубке
теплообменника(6) и пропускается
через дроссель (3).
А.С. Чуев, 2020
31
32. Второй метод сжижения газов основан на охлаждении газа при совершении им работы. Сжатый газ, поступая в поршневую машину
(детандер) расширяется исовершает при этом работу по
передвижению поршня.
Так как работа совершается за счет
внутренней энергии газа, то его
температура при этом понижается.
А.С. Чуев, 2020
32
33. Принцип Ле-Шателье - Брауна
Термодинамическая система устойчива, еслиS max
2S < 0
т. е.
S 0
(первая вариация),
необходимое условие
(вторая вариация), достаточное условие
34. Введение в термодинамику необратимых процессов
Принцип локального (детального) равновесия:внутри малых объемов выполняются основные
уравнения ТД (используют величины: удельный
объем, удельная плотность, удельная энтропия и
т.п.) (на единицу массы)
Tds = du +Pdv
U (r , t )u (r , t )dV
V
S (r , t )s(r , t )dV
V
35.
Ключевую роль в термодинамике неравновесныхпроцессов играет величина, численно равная скорости
увеличения энтропии в единице объема
d ( s)
S
dt
- производство
энтропии
Если в качестве ТД параметров выступают N параметров
d ( s) N ( s) dai N
S
X i ji
dt
dt i 1
i 1 ai
( s)
Xi
ai
- ТД силы.
ai
ji
t
- плотности ТД потоков.
36.
При небольших отклонениях от равновесного состояниямежду термодинамическими потоками и термодинамическими
силами может быть установлена линейная зависимость
N
ji Li k X k
k 1
Это соответствует наиболее простому случаю
термодинамики линейных необратимых процессов
Таким образом, для линейных необратимых процессов
производство энтропии определяется выражением:
N
S Lik X i X k
i , k 1
N
или
S (1 / Lik ) ji jk
i , k 1
37.
КоэффициентыLi k
называются кинетическими
Эти коэффициенты характеризуют интенсивность
явлений переноса. В 1931 г. американский физико-химик
Л.Онсагер установил, что для них выполняется условие:
Li k Lki
Данное соотношение указывает на симметрию их матрицы.
Это соотношение получило название соотношения
взаимности Онсагера.
И. Пригожин установил принцип минимума производства
энтропии: стационарные необратимые процессы протекают
таким образом, чтобы производство энтропии было
минимальным.
Диссипативные структуры: ячейки Бенара, РБЖ - реакция в химии.
А.С. Чуев, 2020
37
38.
Размерность производства энтропии = давлениюА.С. Чуев, 2020
38
39.
Конец лекции 14 – 2019 г.А.С. Чуев, 2020
39






































 physics
physics


![II Закон термодинамики. Энтропия “S”- термодинамическая функция состояния [Дж/моль К] (Клаузиус) II Закон термодинамики. Энтропия “S”- термодинамическая функция состояния [Дж/моль К] (Клаузиус)](http://cf3.ppt-online.org/files3/thumb/s/shTr2KkzXY6Gb1DP9c5MVIEZmtq4nJoUfBC7Ll.jpg)





