Similar presentations:
Свойства растворов. Протолитическая теория кислот и оснований Бренстеда-Лоури
1. Свойства растворов
2.
• Растворы – гомогенные системыпеременного состава, состоящие из
растворителя (S), растворенного вещества (X)
и продуктов их взаимодействия.
• Идеальный раствор – раствор, образование
которого не сопровождается химическим
взаимодействием, изменением объема и
тепловыми эффектами
• ΔVсмешения = 0
• ΔHсмешения = 0
• ES-S = ES-X = EX-X
3.
Термодинамика растворения G= H-T· SHдестр >0
Нсольв<0
∆Sв-ва ≥ 0
∆Sводы <0
4.
.H2O (тв) → H2O(ж) → H2O(пар)
ΔG = ΔG0 + RT lnх(H2O)
Изменение энергии Гиббса при нагревании воды (1) и раствора (2)
5.
где b (х) – моляльная концентрация растворенноговещества (моль/кг);
К(S) – криоскопическая постоянная растворителя
Е(S) – эбулиоскопическая постоянная растворителя
Эти постоянные характеризуют растворитель и не
зависят от природы растворенного вещества.
6. осмос
1 – раствор, 2 - полупроницаемая мембрана (а) иосмотическое давление (б)
7. уравнение Вант-Гоффа:
π = сRTКоллигативными называются такие свойства
растворов, которые зависят только от
концентрации растворенных частиц и не зависят
от их природы.
8. Биожидкости организма
9. Отклонения коллигативных свойств растворов электролитов
ΔТз = iK· bΔТк = iE· b
π = iсRT
10.
закон разбавления ОствальдаКонцентрация [A+] = [B– ] = с·α, концентрация
недиссоциированных молекул [AB] = c – с·α = c(1 – α)
11.
Для слабых электролитов (или
Степень диссоциации слабого электролита
возрастает с разбавлением раствора
12. Теория сильных электролитов
• активность a – эффективная концентрация, всоответствии с которой электролит участвует в
различных процессах.
где a – активность иона ; с – его концентрация;
f – коэффициент активности иона
• Коэффициент активности f выражает
отклонение раствора с концентрацией c от
поведения идеального раствора
13.
Ионная сила (I) раствора - величина,равная полусумме произведения
концентраций всех находящихся в растворе
ионов ( ci ) на квадрат их заряда ( zi )
Для очень разбавленных водных растворов (с
ионной силой I ≤ 0,01):
кажущаяся степень диссоциации:
14. Протолитическая теория кислот и оснований Бренстеда - Лоури
• кислота ( а) – это молекула или ион – донорпротона;
• основание ( b) – это молекула или ион –
акцептор протона.
15.
• Амфолит – молекула или ион, способныйбыть как донором, так и акцептором протона:
HCO3- + H3O+ = H2CO3 + H2O
(b1)
(a2)
(a1)
(b2)
HCO3- + OH- = CO32- + H2O
(a1)
(b2)
(b1)
(a2)
16.
Любая протолитическая реакция представляетсобой конкуренцию оснований за протон.
Кислотно-основные свойства вещества
проявляются только при взаимодействии его с
другими веществами или растворителем.
CH3COOH + H2O = CH3COO- + H3O+
CH3COOH + H2SO4 (безводн)= CH3COOH2 + HSO4-
В водном растворе самой сильной кислотой
является ион гидроксония H3O+ , а самым
сильным основанием – гидроксильный ион ОН-
17. Типы протолитических процессов
ПроцессНейтрализация
Уравнение реакции (пример)
H3O+ + OH- = 2H2O
CH3COOH + CH3NH2= CH3COO- + CH3NH3+
Ионизация
NH3 + H2O = NH4+ + OHCH3COOH + H2O = CH3COO- + H3O+
Автоионизация
H2O + H2O = H3O+ + OH-
(автопротолиз)
NH3 + NH3 = NH4+ + NH2-
Гидролиз
CO32- + H2O = HCO3- + OH-
(ионный)
Cu(H2O)2+ + H2O = Cu(OH)+ + H3O+
18.
Н2О + Н2О = Н3О + ОН-Константа автопротолиза воды:
Условие нейтральности:
Водородный показатель:
Гидроксильный
показатель:
19. Расчет рН в растворах слабых кислот и оснований
НА + Н2О ↔ А- + Н3О+-lg c(H3O+) = 0,5 (-lgKa – lg c(A))
pH = 0,5 (рKa – lg c(НA))
20.
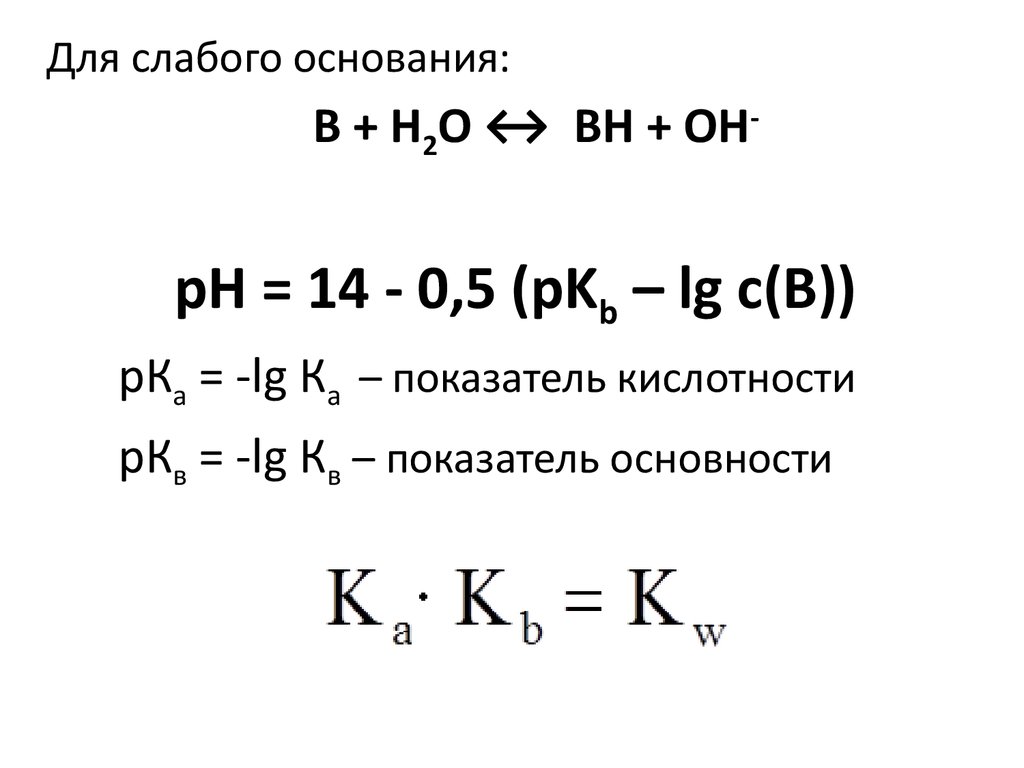
Для слабого основания:В + Н2О ↔ ВН + ОН-
pH = 14 - 0,5 (рKb – lg c(B))
рКа = -lg Ка – показатель кислотности
рКв = -lg Кв – показатель основности
21. Ионный гидролиз
CO32- + H2O = HCO3- + OH(b)(a)
рН в растворе соли, гидролизующейся по
аниону
pH = 7+0,5 (pKa + lg c(An ))
-
22.
Cu(H2O)2+ + H2O = Cu(OH)+ + H3O+(a)
(b)
рН в растворе соли, гидролизующейся по
катиону
pH = 7 - 0,5 (pKb - lg c(Kat ))
n+
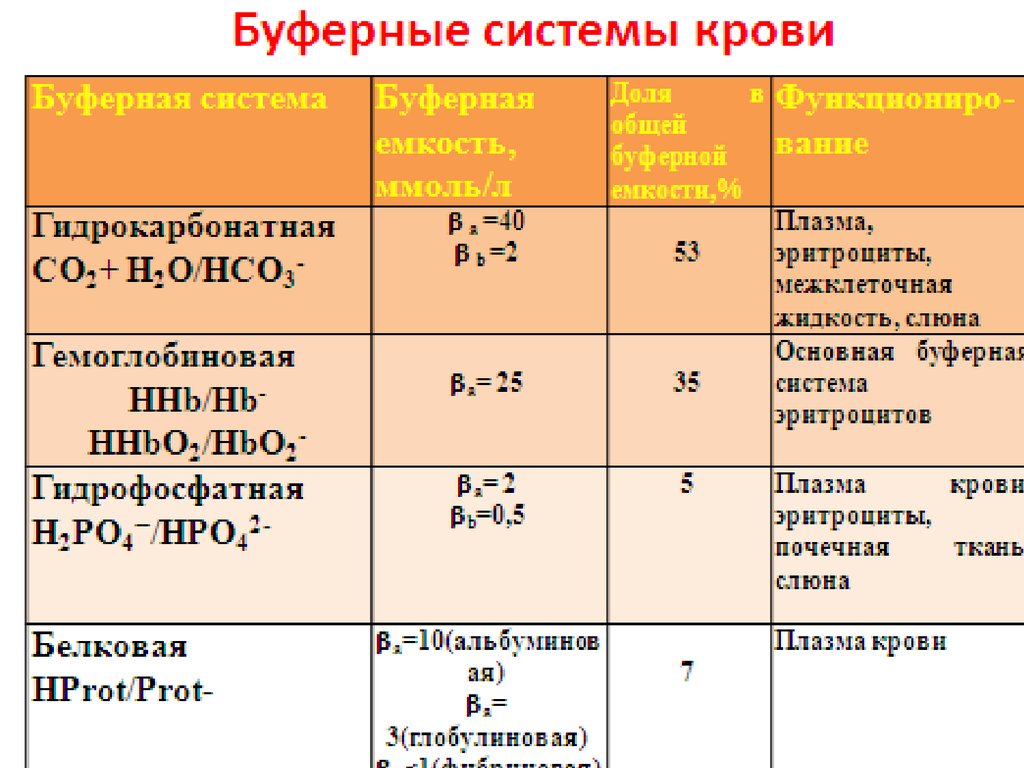
23. Буферные системы
• Буферная система – это равновесная система, способнаяподдерживать на постоянном уровне рН при разбавлении
или добавлении небольших количеств сильных протолитов
Классификация кислотно-основных буферных систем:
• Слабая кислота и ее анион НА/А–. Например, ацетатная
CH3COO–/CH3COOH, гидрокарбонатная
HCO3–/H2CO3.
• Слабое основание и его катион B/BH+. Например,
аммиачная буферная система NH3/NH4+.
• Ионы и молекулы амфолитов.
HPO42–/H2PO4–.
24. Механизм буферного действия
25.
В общем виде :Интервал значений водородного показателя
( рН), в котором буферная система обладает
буферными свойствами, называется зоной
буферного действия: рН = pKa ± 1
Или:
26. Буферная емкость
Величина, характеризующая способность буфернойсистемы противодействовать изменению рН при
добавлении сильных протолитов
Буферная емкость (β) измеряется количеством сильной
кислоты или щелочи, добавление которого к 1 л
буферного раствора изменяет его рН на единицу
Буферная емкость по кислоте (моль/л):
27.
Буферная емкость по основанию (моль/л):28.
29. Гетерогенные равновесия
Константа растворимостиРастворимость (S)
30.
В общем виде для малорастворимогоэлектролита AnBm
31. Условие образования и растворения осадков
П с > Ks -образование осадка
Пс < Ks - растворение осадка
Пс = Ks - образование насыщенного
32. Гетерогенные процессы в организме
основным минеральным веществом костной тканиявляется кристаллическая основная соль –
пентакальций трифосфат гидроксид Ca5(PO4)3OH
или
гидроксиапатит
Изоморфизм - замещение ионов в узлах
кристаллической решетки другими ионами, имеющими
схожие кристаллохимические характеристики
Ca5(PO4)3OH + F- Ca5(PO4)3F + OHфторапатит
33. Поверхностные явления
34. Поверхностные явления
• Поверхностные явления – совокупностьявлений и процессов на границе раздела фаз,
обусловленных свойствами поверхности.
• поверхностная энергия Гиббса
35.
Gs = · S∆GS = σ · ∆S
- поверхностная плотность энергии Гиббса
поверхности раздела фаз –
поверхностное натяжение
36.
•самопроизвольные поверхностные явления(Δ Gs< 0) возможны:
за счет уменьшения площади поверхности
раздела фаз (ΔS<0) – коалесценция и
коагуляция
за счет уменьшения поверхностного натяжения
(Δ <0) - адсорбция
Поверхностная активность () – способность
растворенного вещества изменять величину
поверхностного натяжения растворителя
=-
37.
•1) ПАВ:σр-р<σo ; > 02) ПИВ: σр-р>σo ; < 0
3) ПНВ: σр-р= σo ; = 0
38. Поверхностно-активные вещества
Дифильное строение молекул• ИОНОГЕННЫЕ (электролиты)
лаурилсульфат натрия
cтеарат натрия (мыла)
(СН3(СН2)11-SO3)-Na+
СН3(СН2)16 СОО- Na+
Цетилтриметиламмония бромид
(СH3(CH2)15-N(CH3)3)+Br• НЕИОНОГЕННЫЕ (неэлектролиты)
Cпаны
39. Классификация поверхностей раздела фаз
НеподвижныеТ–Г
Т–Ж
Подвижные
Ж–Ж
Ж–Г
40. Адсорбция на подвижной поверхности
• Адсорбция (Г, моль/м2) –самопроизвольное перераспределение
молекул растворенного вещества между
объемом фазы и поверхностным слоем.
• Уравнение изотермы адсорбции Гиббса:
41. Изотерма адсорбции
42.
• Длина молекулы ПАВl м олек
M
• Площадь поперечного сечения молекулы
ПАВ
S м ол ек
1
N A
43. Правило Траубе
• В гомологических рядах ПАВ поверхностнаяактивность увеличивается в 3 – 3,5 раза при
переходе к каждому следующему гомологу
44. Адсорбция на неподвижной поверхности
Адсорбент – твердое тело, на поверхности которогопроисходит адсорбция
Адсорбат – вещество, которое адсорбируется на
поверхности адсорбента
Молекулярная адсорбция
Определяется количеством вещества адсорбата,
приходящимся на единицу массы адсорбента (моль/г)
45. Правило Ребиндера
Адсорбция идет в сторону выравниванияполярностей контактирующих фаз и тем
сильнее, чем больше исходная разность
полярностей
На полярных адсорбентах лучше
адсорбируются полярные адсорбаты из
малополярных растворителей; на неполярных
адсорбентах – неполярные адсорбаты из
полярных растворителей.
Чем лучше в данном растворителе
растворяется данный адсорбат, тем он хуже
адсорбируется;
46. Адсорбция ПАВ
47. Ионная адсорбция
• Чем выше заряд и радиус иона, тем лучше онадсорбируется (исключение составляет ион Н +).
• По способности к адсорбции ионы образуют
лиотропные ряды:
Катионы: Na+< K+ < NH4+< Mg2+< Ba2+< Al3+< H+
Анионы: F- < Cl- < Br- < I- < SCN- < SO42-
Правило избирательной адсорбции
(правило Панета – Фáянса):
из раствора преимущественно адсорбируются ионы,
которые входят в состав кристаллической решетки
твердой фазы (адсорбента), или изоморфные им













































 biology
biology chemistry
chemistry








