Similar presentations:
Характеристика металлов. Физические свойства
1.
Общая характеристика металловФизические свойства
1.
2.
3.
4.
5.
6.
Металлический блеск.
Высокая отражательная способность в видимой части
спектра.
Непрозрачны даже в очень тонких слоях.
Плотная структура.
Пластичность, ковкость. Структуры металлов нежесткие,
сдвигаются друг относительно друга (кроме Sb, Bi).
Высокие тепло- и электропроводность
Классификация
1. По удельной плотности (тяжелые, легкие)
2. По температурам плавления (тугоплавкие, легкоплавкие)
3.По твердости(самый мягкий – Li, самый твердый – Cr). 1
2.
Нахождение металлов в природе2
3.
Нахождение металлов в природеМеталлы с высоким ПИ находятся как в виде соединений,
так и в свободном состоянии (Au). Активные металлы
только в виде мало растворимых соединений,
устойчивых к выветриванию.
1. Металлы I и II групп ПС в виде солей (но не оксидов).
2. Ti, Mn, Cr, Fe, Cu, Zr, Th, Al – в виде оксидов, т.к. они
не растворимы в воде и не взаимодействуют с
углекислым газом.
3. Hg, Cd, Zn, Sn, Sb, Bi, Ni, Co, Fe – в виде сульфидов.
Руды представляют в основном смеси минералов или
сложных химических соединений.
3
4.
Способы обогащения руд1. Сепарация руд по удельной массе (Fe, Pb –тяжелые,
Al, Mg – легкие). Используют суспензии на основе
кварцевого песка.
2. Магнитная сепарация ( В основном для Fe-Ni-Co
руд). Основана на магнитной восприимчивости.
3. Флотация. Основана на различной смачиваемости.
4
5.
Способы получения металлов1. Пирометаллургический
ЭО + С = СО + Э
(вместо С можно СО).
Так получают чугун, сталь, Bi, Sn, Pb, Zn, Cu.
Если руда сульфидная, то вначале обжигают.
2. Металлотермия
ЭХ + М → МХ + Э
Х = Hal, O, M = Mg, Al, Na
Так получают Cr, Ti, U, Th, РЗЭ
3. Гидрометаллургический (извлечение М из руд в виде их соединений
водными растворами реагентов с последующим выделением).
Используют в цветной металлургии (Au, Ag, Cu).
4. Электрометаллургический (электролиз растворов и расплавов). Получают
Na, K, Al, Ti, Nb, Ta.
5. Порошковая металлургия
а. Восстановление соединений М водородом с последующим пресованием до
слитка.
б. Термическое разложение карбонилов металлов.
5
Получают Ni, Co, Mn, Mo, Nb, Ge.
6.
Физико-химический анализ• Сущность ФХА состоит в изучении какого-либо физического
свойства системы как функции состава или внешних условий.
• Термины и понятия ФХА.
• Система – это совокупность тел (или 1 тело) в ограниченном
объеме.
• Различают гомогенные и гетерогенные системы.
• Фаза – совокупность гомогенных частей системы с одинаковым
составом и свойствами, отделенных от других частей системы
поверхностями раздела. Сохранить фазу можно только при
определенных условиях.
• Компонент – химически однородная часть системы, которая при
выделении из системы может существовать самостоятельно без
изменения.
• Число степеней свободы – число независимых переменных,
которые можно изменять без нарушения состояния равновесия
(без изменения числа фаз, количество каждой фазы изменяется).
Переменные: давление (Р), температура (Т), концентрация
компонента (с).
6
7.
Физико-химический анализЭвтектика – расплав, находящийся в
равновесии с двумя или более твердыми фазами.
Это смесь мелких кристаллов компонентов, которые
обычно плохо растворяются друг в друге в твердом
состоянии. Эвтектика характеризуется более низкой
температурой плавления по сравнению с
компонентами.
Правило фаз Гиббса:
Ф + С = К + 2.
Применимо к равновесным системам.
•С = 0 - система нонвариантна (инвариантна)
•С = 1 - система моновариантна
•С = 2 - система бивариантна
•Если компоненты не летучи, то Ф + С = К + 1
7
8.
1. Диаграмма состояния двухкомпонентной системы сэвтектикой (Е)
t0C A
t0C
В
Ж
t0″
К=1
Ф=1
С=1
К=2
Ф=1
С=2
t0′
К=2
Ф=1
С=2
1
2
b
5
ус
д
и
в
ик
Л
4
а
A
А+Ж
Солидус
Е+В
0.25
0.5
0.75
0.75
0.5
0.25
Е+А
Время
A
В+Ж
3
Е
B
8
9.
2. Диаграмма с взаимной неограниченнойрастворимостью в твердом состоянии
t0C
Твердые растворы
А >В
Жидкость
Л
дус
и
в
ик
1. Растворы замещения
ост
к
д
Жи
Р.
д
р
образуются в том случае, если
кристаллические решетки
компонентов однотипны и
размеры частиц компонентов
близки.
р
Тве
+
ь
с
иду
л
о
С
2. Растворы внедрения
образуются, если размеры
частиц одного компонента не
превышают 2/3 другого.
Твердый раствор
В >А
A
B
9
10.
3. Диаграмма в случае образования химическогосоединения (интерметаллическое соединение)
Диаграмма соединения двух диаграмм с эвтектиками:
А и AmBm
B и AmBm
10
11.
МеталлохимияНа основе анализа диаграмм можно выделить несколько типов
металлов:
1. М взаимно растворяются в жидком состоянии, а в твердом
образуют эвтектику (Е).
2. М не взаимодействуют друг с другом ни в жидком, ни в
твердом состояниях.
3. М образуют друг с другом жидкие и твердые растворы
любого состава.
4. М образуют между собой одно или несколько металлических
соединений (ИМС).
В основе геометрического анализа диаграмм лежат два принципа:
1. Принцип непрерывности. При непрерывном изменении
параметров системы изменяются непрерывно свойства фаз и
системы в целом (не возникают новые фазы и не исчезают
старые).
2. Принцип соответствия. Каждой фазе, фазовому равновесию
на диаграмме соответствует определенный геометрический
образ.
11
12.
Элементы I А подгруппыЩелочные металлы
Электронная конфигурация
– ns1 ,
с.о. = 0, +1
Ионизация Э0 - е = Э+
облегчается сверху вниз в подгруппе.
ПИ уменьшается от Li к Cs.
Пары ЩМ имеют характерное окрашивание:
лития – красное,
натрия – желтое,
калия – фиолетово-розовое,
рубидия – светло-розовое,
цезия – фиолетово-розовое.
Катионы ЩМ (Э+) не могут образовывать ковалентные
связи, т.к. имеют оболочку инертного газа (n-1)
s2p6ns1, кроме Li 1s22s1. Поэтому в гетероатомных
соединениях преобладает ионный тип связи.
12
13.
Элементы I А подгруппыЭ + 2 Н2О = 2 ЭОН + Н2
Li - спокойно, Na - горение, K - горение со взрывом
Э + О2
Li2O (Na2O2) (нагревание),
Оксид Пероксид
ЭО2 (загораются самопроизвольно)
Надпероксиды (Э = K, Rb, Cs)
Э + Нal2 = 2 ЭHal (галогениды)
6 Э + N2 = 2 Э3N (нитриды)
2 Э + S = Э2S (сульфиды)
13
14.
Элементы I А подгруппыГидроксиды – сильные основания
(LiOH – средней силы)
Соли: средние и кислые, многие хорошо растворимы.
Малорастворимы: Li2CO3, Li2SiO3, Li3PO4, LiF.
В противоположность Li и Na соли K, Rb, Cs
следующего состава труднорастворимы:
ЭClO4, Э2PtCl6, Э3[Co(NO2)6]
Промышленное значение имеют:
Na2CO3 – сода,
NaHCO3 – питьевая сода,
K2CO3 - поташ
14
15.
Элементы II А подгруппыns2 , с.о. = 0, +2
Ионизация: Э0 – 2е = Э2+ (n-1)s2(n-1)p6
Электронная конфигурация –
(конфигурация инертного газа)
Ве амфотерен:
Ве + 2 Н3О+ + 2 Н2О
=
[Be(H2O)4]2+
+
H2
Be + 2 OH-
=
[Be(OH)4]2-
+
H2
+ 2 H2O
В концентрированных кислотах Ве пассивируется
(HNO3, H2SO4).
«Бериллиевые» лучи: 94Be + 42He = 10n +
12 C.
6
15
16.
Соединения элементов II А подгруппыСоединения с кислородом:
Э + О2
ВеО, MgO, CaO (оксиды),
BaO2, SrO2 (пероксиды).
Гидроксиды: растворимость возрастает от магния к барию.
Гидроксид магния не выпадает в осадок в присутствии
солей аммония.
Соли однозарядных анионов растворимы хорошо или
удовлетворительно, двух- и трехзарядных – плохо.
В присутствии солей аммония:
Be2+ + 2 (NH4)2CO3
= (NH4)2[Be(CO3)2] + 2 NH4+
Реакцию используют для отделения Ве 2+ от Al3+
Be2+
+ Na2CO3
xBe(OH)2yBeCO3
16
17.
Соединения элементов II А подгруппыМагний образует основный, средний и кислый карбонаты.
Для получения MgCO3 надо понизить рН до 8-9:
MgCl2 + 2 NaHCO3 = MgCO3 + 2 NaCl + H2O + CO2
MgCO3 + H2O + CO2 = Mg(HCO3)2
Ca2+, Sr2+, Ba2+ не образуют основных карбонатов.
В ряду Ве – Ва растворимость сульфатов убывает,
понижается энергия гидратации, поэтому Ca, Sr , Ba
образуют безводные сульфаты.
В природе:
CaSO4 (ангидрит),
CaSO4 2H2O (гипс),
CaSO4 0.5H2O (алебастр).
17
18.
Химия d-элементов«Аномальные» электронные конфигурации
Элемент
Cr
Mo
Cu
Ag
Au
Ожидаемые
конфигурации
[Ar]3d44s2
[Kr]4d45s2
[Ar]3d94s2
[Xe]4d95s2
[Xe]4f145d96s2
Наблюдаемые
конфигурации
[Ar]3d54s1
[Kr]4d55s1
[Ar]3d104s1
[Xe]4d105s1
[Xe]4f145d106s1
Наиболее энергетически стабильными оказываются
электронные конфигурации с наполовину или полностью
заполненными d- или f-орбиталями.
18
19.
В атомах La (5d16s2) и Ac(6d17s2) последнийэлектрон занимает 5d и 6d-орбитали.
В следующих за ними лантаноидах и актиноидах
происходит последовательное заполнение 4f- или 5fорбиталей, а 5d (6d)-орбитали остаются свободными.
Группы лантаноидов (актиноидов) вклиниваются
между двумя d-элементами La и Hf (Ac и Rf). Поэтому
формально лантаноиды и актиноиды относятся к III В
подгруппе.
19
20.
Примеры нарушения последовательности заполненияодноэлектронных орбиталей связаны с близостью для
d(f)-элементов значений энергий ns-, (n-1)d-, (n-2)f-орбиталей.
Определенную роль при формировании электронной
конфигурации играет межэлектронное взаимодействие.
Энергия межэлектронного взаимодействия (Еээ) равна:
Еээ = Ротт +
Робм
Ротт > 0, достигает максимального значения для пары
электронов на одной атомной орбитали, приводит к повышению
общей энергии атома.
Робм < 0 для электронов с одинаковым направлением
спинов. Приводит к уменьшению полной энергии атома.
Робм = - Рсп (для 2-х электронов)
20
21.
Если в электронной оболочке атома имеется более 2-хэлектронов, то для расчета Робм необходимо определить общее
число пар электронов с одинаковыми направлениями спинов:
2
Bi = [∑ ni(ni – 1)] /2
i=1
где ni – число электронов с одинаковым направлением
спинов: i = 1 ( ), i = 2 ( ) .
В этом случае обменная энергия электронов на n l-оболочке
равна:
Конфигурации с наполовину заполненными электронными
nl-оболочками характеризуются теми же значениями обменной
энергии, что и конфигурации, в которых одна из орбиталей
полностью заполнена (d6, f8).
21
22.
[(5 × 4) + (0 × 0)]B1 =
= 10
2
d5
Pобм = – 10 Pсп
[(5 × 4) + (1 × 0)]
B2 =
= 10
2
d6
d4: Pобм = – 6 Pсп
Pобм = – 10 Pсп
В связи с тем, что Pобм стабилизирует электронную
оболочку, выгоден переход от d4 к d5:
5
4
ΔE = Pобм – Pобм = – 10 Pсп + 6 Pсп = – 4 Pсп (< 0)
22
23.
Магнитные свойстваЭлектрон – заряженная частица. При его вращении
«вокруг собственной оси» создаётся электрический
ток, который обуславливает собственный магнитный
момент:
Количественной характеристикой магнитных свойств
атомов (ионов) служит магнитный момент:
Чем больше µэфф, тем больше сила с которой частица
втягивается во внешнее магнитное поле.
23
24.
Магнитные свойства зависят не только от природы металла, но и лиганда.Спектрохимический ряд:
I- < Br- < Cl- < SCN- < F- < OH- < H2O < NCS- < NH3 < NO2- < CO < CN-.
В случае слабого поля (небольшая энергия расщепления) энергетически более
выгодным оказывается равномерное распределение электронов на всех d-орбиталях
(правило Гунда):
[Co(CN)6]3-
[CoF6]
3eg
Δo'
Δo
t2g
Высокоспиновый,
парамагнитный
Низкоспиновый,
диамагнитный
Δo
Δo'
<
Р СП
Δo
<
Δ o'
>
Р СП
24
25.
Оптические свойства соединений d-элементов:На основании ТКП можно упрощенно объяснить не
только магнитные свойства КС переходных металлов,
но и их окраску.
В КС [Ti(H2O)6]3+ ион Ti3+ имеет один d-электрон.
В невозбужденном состоянии этот электрон находится
на t2g-орбитали.
При затрате энергии = 238 кДж/моль электрон
возбуждается и переходит на eg – орбиталь. Длина
волны света, поглощаемого при этом переходе, равна
500 нм. Это обуславливает фиолетовую окраску.
25
26.
[Ti(H2O)6]3+А
eg
Δ=238
кДж/моль
пропускание
поглощение
пропускание
t2g
Ti3+ (3d1)
400
500
КС Cu+, Ag+, Zn2+, Cd2+,Hg2+ бесцветны
(d10).
600 λ, нм
26
27.
Элементы III В подгруппыВ эту подгруппу входят 32 элемента: 17 РЗЭ, Ас и 14
актиноидов (РЗЭ: Sc, Y, La + 14 лантаноидов).
La и Ас – предшественники Ln.
Лантаноиды и сходные с ними
элементы скандий, иттрий и лантан образуют
группу редкоземельных элементов (в литературе её
обозначают сокращённо РЗЭ). Такое название
объясняется тем, что все эти элементы встречаются
редко и дают тугоплавкие, нерастворимые в воде
окислы, по старинной терминологии, — «земли».
Редкоземельные элементы входят в побочную
подгруппу III группы периодической системы
27
28.
Лантаноиды весьма сходны между собой, что объясняетсястроением электронных оболочек их атомов: по мере
увеличения заряда ядра структура двух внешних
электронных оболочек не меняется, т.к. происходит
заполнение электронами 3-й снаружи оболочки —
глубоколежащего 4f-уровня. Максимально возможное число
электронов на f-уровне равно 14, что определяет число
элементов семейства
Лантаноиды подразделяются на 2 подгруппы:
1
–
цериевую
(La
+
церий Се, празеодим Pr,
неодим Nd, прометий Pm, самарий Sm, европий Eu)
2
иттриевую
(Y
+
гадолиний Gd, тербий Tb,
диспрозий Dy, гольмий Но, эрбий Ег,
тулий Tm, иттербий Yb, лютеций Lu)
28
29.
Лантаноиды (Ln)Подгруппа
Скандия
Sc 2s23p63d14s2
Подгруппа
Церия
Ce 5s25p64f15d16s2
21
58
2 6 1 2
39 Y 4s 4p 4d 5s
25p65d16s2
La
5s
57
3
59 Pr 4f
4
Nd
4f
60
5
61 Pm 4f
6
Sm
4f
62
7
Eu
4f
63
Gd и Lu в невозбужденном состоянии не
являются f-элементами, т.к. следующий
электрон занимает 5d-подуровень.
Подгруппа
Иттрия
75d1
Gd
4f
64
9 0
65 Tb 4f 5d
10
66 Dy 4f
11
Ho
4f
67
12
Er
4f
68
13
Tm
4f
69
14
Yb
4f
70
14 1
71 Lu 4f 5d
29
30.
1- подгруппа ТорияАктиноиды (An)
Ac 6d17s2
89
2 2
90 Th 6d 7s
2 1 2
1 2 2
91 Dy 5f 6d 7s или 5f 6d 7s
47s2
U
5f
92
57s2
Np
5f
93
67s2
Pu
5f
94
77s2
Am
5f
95
7 1 2
96 Cm 5f 6d 7s
2 - подгруппа Берклия
97s2
Bk
5f
97
107s2
Cf
5f
98
117s2
Es
5f
99
12 2
100 Fm 5f 7s
137s2
Md
5f
101
147s2
No
5f
102
146d17s2
Lr
5f
103
3 - элементы, следующие за ураном, называют трансурановыми.
В семействе An формальный подход требует не распространять понятие «fэлемент» на Th и Lr, в атомах которых застраивается d-подуровень.
30
31.
Деление внутри семейства Лантаноиды названия подгрупп возникло исторически.В 1788 в шведском селении Иттербю был найден минерал иттербит
(позднее переименованный в гадолинит).
В нём Ю. Гадолин обнаружил в 1794 новую «землю», названную иттриевой.
В 1803 И. Я. Берцелиус и В. Гизингер (1766—1852) и независимо от них М. Клапрот (1743—1817) в «тяжёлом камне из
Бастноса» открыли цериевую«землю» (названную по малой планете Церере).
Первоначально обе эти «земли» считались окисями неизвестных прежде металлов — иттрия и церия.
В 1843 шведский химик К. Г. Мосандер (1797—1858) разложил иттриевую «землю» на собственно
иттриевую, эрбиевую и тербиевую (все три названия — от Иттербю).
Ж. Мариньяк (1878) выделил из эрбиевой «земли» ещё иттербиевую, а шведский химик П. Т. Клеве (1879)
— гольмиевую (от Holmia — латинское название Стокгольма) и тулиевую (от Thúlë — древне-греческое название стран,
лежащих на Крайнем Севере).
В 1886 П. Э. Лекок де Буабодран разделил гольмиевую «землю» на собственно гольмиевую и диспрозиевую (от
греческого dysprósitos — труднодоступный).
В 1907 французский химик Ж. Урбен (1872—1938) нашёл в иттербиевой «земле»лютециевую (от Lutetia — латинское
название Парижа).
В 1839—41 Мосандер разложил цериевую «землю» на лантановую (от греческого lanthánö — скрываюсь), дидимовую (от
греческого dídymos — близнец) и собственно цериевую «земли».
Лекок де Буабодран, исследуя дидимовую «землю», полученную из уральского минерала самарскита [названного так в
1847 Генрихом Розе (1795—1864) в честь начальника штаба Корпуса горных инженеров В. Е. Самарского-Быховца
(1803—70), от которого Розе получил значительное количество этого минерала], выделил из неё в
1879 самариевую «землю», а в 1886 — гадолиниевую (по имени Гадолина); она оказалась тождественной с «землёй»,
которую Мариньяк открыл в 1880 в самарските.
В 1885 австрийский химик К. Ауэр фон Вельсбах (1858—1929) разделил дидимовую «землю» на празеодимовую (от
греческого prásios — светло-зелёный) и неодимовую (от греческого néos — новый).
В 1901 французский химик Э. Демарсе (1852—1904) разделил самариевую«землю» на
собственно самариевую и европиевую.
Так, к первым годам 20 в. были открыты все Лантаноиды за исключением радиоактивного элемента с атомным номером
61, который в природе не встречается. Его получили только в 1947 американские физики Дж. Маринский,
Лантаноиды Гленденин и Ч. Кориелл из осколков деления урана в ядерном реакторе и назвали прометием
31
32.
Физические свойства.Лантаноиды —
металлы серебристо-белого цвета
(некоторые слегка желтоваты, например Pr иNd).
Лантаноиды высокой чистоты пластичны и легко
поддаются
деформации
(ковке,
прокатке).
Мехапические свойства сильно зависят от содержани
примесей, особенно
кислорода, серы, азота и углерода.
32
33.
Подгруппа скандияВалентные электроны: (n-1)d1ns2, CO = +3
КЧ: Sc – 6, Y – 8,9, La – 9
В ряду Sc – Y – La – Ac усиление признаков металличности (усиливаются
основные и ослабевают кислотные свойства).
Э(III) очень активные металлы (напоминают Mg, Ca).
Cоединения Sc с водой не реагирует (пассивируется).
La разлагает воду:
2 La
+
6 H2O
2 La(OH)3
+
Ti3+
3 H2.
Э легко реагируют с разб. кислотами (азотную кислоту восстанавливают
до нитрата аммония).
Sc + HNO3
=
=
Sc(NO3)3
+
NH4NO3 + H2O
Нитраты, сульфаты, галогениды (кроме ЭF3) растворимы. (Растворимость
сульфатов уменьшается сверху вниз в п/г.)
• Не растворимы гидроксиды, карбонаты, фосфаты, сульфиты, фториды.
Sc(OH)3 - слабое основание с признаками амфотерности
Sc(OH)3 + 3 NaOH = Na3[Sc(OH)6]
• La(OH)3 - сильное основание (напоминает гидроксид кальция).
33
34.
Подгруппа титана (IVB)Ti, Zr, Hf, Rf (изучен мало)
Валентные электроны: (n-1)d2 s2.
r(M0) и r(M+): Ti < Zr > Hf (лантанидное сжатие)
Степени окисления: Ti(+3,+4), Zr(+4), Hf(+4) .
Образование Э4+ связано с достаточно большой затратой
энергии. Стабильны в основном в кристаллических
структурах.
• У элементов, имеющих под валентными электронами
оболочку типа благородного газа, с ростом радиуса
уменьшается поляризующее действие и у Zr и Hf
валентные электроны удерживаются менее прочно, чем у
Ti.
• С увеличением r уменьшается поляризующее действие и
валентные электроны удерживаются менее прочно.
34
35.
• На поверхности металлов образуется тонкая ипрочная пленка оксидов (малоактивны на холоду).
• Ti, Zr, Hf образуют твердые растворы
замещения (V, Cr), а также ИМС (Fe, Co, Ni, Cu,
Zn).
• Введение Ti и Zr в сплавы увеличивает их
твердость.
35
36.
Растворение металлов IV B подгруппы2 Ti
Ti
+
+
6 HClгор = 2 TiCl3 + 3 H2
6 HF
= H2[TiF6] + 2 H2
(Э = Zr, Hf Условие: окисление, образование анионных КС)
Э + 5 H2SO4 (конц) = H2[Э(SO4)3] + 2 SO2 + 4 H2O
3 Э + 4 HNO3 + 18 HX = 3 H2[ЭХ6] + 4 NO + 8 H2O
(X = F-, Cl-)
При наличии F- - ионов все Э постепенно реагируют даже со
слабыми кислотами:
Э + 4 СН3СООН + 6 NH4F = (NH4)2[ЭF6] + 4CH3COONH4 + 2H2 ↑
Ti растворим в концентрированных щелочах (Zr и Hf - нет)
Ti + 2 NaOHконц + Н2О = Na2TiO3 + 2 H2 ↑
титанат
36
37.
Бинарные соединения элементов IV B подгруппыс О, Н, С, N, Si имеют переменный состав (их формулы условны).
ЭО2 с Н2О истинных растворов не образуют.
В кислотах и разбавленных щелочах ЭО2 не растворяются
(полимеризация, коллоидные растворы).
Гидроксиды ЭО2 nH2O тоже имеют переменный состав.
Ti(OH)4 - -форма
TiO(OH)2 - -форма (результат старения).
Гидроксид титана растворим в конц. щелочи, а цирконий и гафний
нет.
37
38.
Гидратированные ионы Ti4+, Zr4+, Hf4+ вследствие большого заряда врастворах не существуют.
Склонность к гидролизу Э4+ снижается в ряду Ti4+ > Zr4+ > Hf4+.
При взаимодействии оксидов и гидроксидов с кислотами образуются не
средние соли, а оксо- и гидроксопроизводные:
Ti(OH)4
+
2 HCl
= TiOCl2
+
3 H2O.
хлорид титанила
ЭО2+ (титанил, цирконил, гафнил)
дегидратации дигидроксокомплекса
продукта гидролиза ЭХ4 (Х = Cl-,Br-):
можно представить как результат
[Э(ОН)2]2+, как промежуточного
H2[TiCl4(OH)2] = [Ti(OH)2]2+ + 4 Cl- +
[Ti(OH)2]2+ =
TiO2+ + H2O.
2 H+
38
39.
СоединенияTi(III)
получают
химическим
или
электрохимическим восстановлением соединений Ti(IV).
12000 C
2 TiO2 +
4 TiCl3
+
H2
O2
+
Ti2O3
2 H2O
+
=
H2O
4 TiOCl2
+
4 HCl
Реакции диспропорционирования:
4000 C
2 TiCl3
> 4000 C
2 TiCl2
TiCl2
Ti0
+
+
TiCl4 (жидкость при комн.t)
TiCl4
39
40.
Подгруппа V B(n-1)d3ns2
Растворение металлов
2V
+ 12 HF
V
+
2V
+
3V
+
=
2 H[VF6]
+
5 H2
6 HNO3 гор =
VO2NO3
+ 5 NO2 + 3 H2O
6 H2SO4 конц = (VO2)2SO4 + 5 SO2 + 6 H2O
5 HNO3 + 3 HCl = 3VO2Cl + 5 NO + 4H2O
40
41.
Растворение Nb и Та(химическая устойчивость связана с тонкой оксидной пленкой)
2Э
+ 12 HF = 2 H[ЭF6]
Э + 5 HNO3 + 7 HF
+
5 H2
= H2[ЭF7] + 5 NO2
+
5 H2O
Оксиды
ЭnО
Мет.
ЭО
Э2О3
Мет.блеск, электропроводность
ЭО2
п/п, кластер
Э2О5
д/э
С увеличением атомов кислорода растет доля ковалентной
связи
41
42.
Диаграмма Латимера для VVO2+
+1.0
VO2+
+0.36
V3+
V2O5 + 2 NaOH = 2 NaVO3 + H2O
Соединения V(V) V2O5
+
6 HClконц
=
4 NaVO3 + 18 HClконц + Pt
-0.26
V2+
-1.19
V0
(Na3VO4)
сильные окислители
2 VOCl2
+
Cl2
+
= H2[PtCl6] + 4 VOCl2
3 H2O
+ 4 NaCl
+
8H2O
Nb2O5,
Ta2O5
-
химически инертны, не реагируют
с Н2О, кислотами и щелочами.
42
43.
Ванадиевые кислоты, ванадаты и изополиванадатыВ кислом растворе в зависимости от конц. кислоты присутствуют:
V2 O5 nH2O,
HVO3,
VO2+ (ванадин-ион)
Метаванадиевая (HVO3), пированадиевая (H4V2O7) и ортованадиевая
(H3VO4) кислоты являются стехиометрическими аналогами мета-, пиро- и
ортофосфорных кислот.
Кислоты ванадия в твердом виде не выделены .
Схему кислотно-основного равновесия можно
представить следующим образом:
+ OHVO2+
- OH-
HVO3
- H+
+H+
VO3-
В схеме не учтены промежуточные изополисоединения, предшествующие
выпадению в кислой среде V2O5 nH2O.
43
44.
В растворах в зависимости от рН существуютсложные равновесия:
VO43- + H+ = HVO42 HVO42= H2O + V2O742 V2O74- + 4 H+ = 2 H2O + V4O1245 V4O124- + 8 H+ = 2 H2O + 2 V10O286V10O286- + 16 H+ = 10 VO2+ + 8 H2O
H6V10O28
V2O5 nH2O (красный осадок)
44
45.
Соединения V(IV):VO2, в растворах образуется ванадил-ион VO2+.
2 NaVO3
H2O
+ Zn
+
4 H2SO4
= 2 VOSO4
+ ZnSO4 + Na2SO4 + 4
син.
2VOSO4
+ Zn
+
V2(SO4)3
2 H2SO4
+ ZnSO4 + 2 H2O
2 VSO4 + ZnSO4
фиол.
V(II) в этой системе является самым сильным восстановителем. В
отсутствие восстановителя окисляется даже водой:
2 V(OH)2 +
Обратный переход V(II)
+ Zn
= V2(SO4)3
зел.
2 H2O
=
=
2 V(OH)3
+
H2
V(V) возможен, если по каплям добавлять KMnO4.
45
46.
В кислой среде для V(IV) характерна катионная формаVO2+.
В щелочной среде V(IV) в форме ванадатов (IV)
различного состава:
VO32- (мета-), V2O52- (пиро-), VO44- (орто-), V4O92- (тетра-).
VO2+ в ходе реакций сохраняется и входит в комплекс [VO
(H2O)5]2+.
46
47.
Соединения Nb, Ta.Ta2O5
Ta2O5
+
+
5 PCl5 = 2 TaCl5 + 5 POCl3
5 Cl2 + 5 C
= 2 TaCl5 +
5 CO
ЭHal5 - легкоплавкие, легколетучие, легко гидролизуются
Образование КС:
KF + ЭF5
= K[ЭF6]
(Э = V, Nb, Ta)
Nb2O5 + 4 KF + 6 HF = 2 K2[NbOF5] + 3 H2O
Ta2O5 + 4 KF + 10 HF = 2 K2[TaF7] + 5 H2O
V(IV, V), Nb(IV), Ta(IV)
-
6 (4,5)
Nb(V), Ta(V)
-
6, 7 (8)
47
48.
Подгруппа VI B(n-1)d5ns1 (Cr, Mo),
(n-1)d4s2
(W)
Растворение металлов:
2Cr + 6HClразб (H2SO4 разб) = 2CrCl3 + 3 H2
(пассивируется в конц. H2SO4, HNO3).
Э + 8 HF + 2 HNO3 = H2[ЭF8] + 2 NO + 4 H2O (Э = Мо,
W)
(Мо в смеси HCl + HNO3).
При высоких температурах взаимодействуют с:
O2
Cr2O3, MoO3, WO3
F2
CrF4,
MoF6,
WF6
Cl2
CrCl3, MoCl6, WCl6
спл.
Э + Na2CO3 + O2
Na2ЭО4 + СО2
48
49.
• В ряду Cr(VI) >Mo(VI) >
W(VI)
ослабление окислительных и кислотных свойств.
наблюдается
• Увеличение с.о. приводит к усилению кислотных свойств:
Cr(OH)2 - слабое основание, Cr(OH)3 - очень слабое
основание (амфотерен), H2CrO4 -сильная кислота (CrO3 –
ангидрид).
• Усиление кислотности с увеличением с.о. означает рост
ковалентности связи.
• Снижение силы кислоты:
H2SO4 > H2CrO4 > H2MoO4
> H2WO4.
49
50.
Соединения Cr(III), Mo(III), W(III).С.о. +3 наиболее характерна для хрома.
Cr2O3 - тугоплавкое вещество, растворяется только при
сплавлении со щелочами.
Cr2(SO4)3 + 6 NaOH = 2 Cr(OH)3 + 3 Na2SO4
Cr(OH)3 + 3 HCl = CrCl3 + 3 H2O
Cr(OH)3 + NaOH = Na[Cr(OH)4] (хромиты, изумруднозеленые)
Cr(OH)3 + 3 NaOH = Na3[Cr(OH)6]
спл.
Cr(OH)3 + NaOH = NaCrO2
+ 2 H2O (метахромит)
Минерал хромистый железняк Fe(CrO2)2
Соли хромистых кислот гидролизуются.
(FeO Cr2O3).
50
51.
Соли хрома(Ш) с анионами слабых кислот в водных растворахгидролизуются:
Cr2(SO4)3 + 3 Na2S = Cr2S3 + 3 Na2SO4
Cr2S3 + 6 H2O = 2 Cr(OH)3 + 3 H2S
Cr2(SO4)3 + 3 Na2CO3 + 3 H2O = 2 Cr(OH)3 + 3 Na2SO4 +
3CO2
Характерно образование квасцов:
KCr(SO4)2 12H2O, NaCr(SO4)2 12 H2O
Окисление:
2Na[Cr(OH)4] + 3Br2 + 8NaOH = 2Na2CrO4 + 6NaBr +
8H2O
Cr2(SO4)3 + 3Na2S2O8 + 7H2O = Na2Cr2O7 + 2Na2SO4 +
7H2SO4
Mo(III), W(III) окисляются кислородом воздуха.
51
52.
Соединения Cr(VI), Mo(VI), W(VI)K2Cr2O7 + H2SO4 конц =
2CrO3 + 2KHSO4
+ H2O
t
2Э + 3О2 2ЭО3 (Мо – белый, W – желтый, устойчивы в
воде)
ЭО3 + 2NaOH = Na2ЭО4 + Н2О
ЭО3 - ангидриды: CrO3 + H2O = H2CrO4
Na2ЭO4 + 2HCl =
H2ЭО4
+ 2NaCl
(Э = Мо, W)
ЭО3 Н2О склонны к коллоидообразованию и не способны
давать истинные растворы в воде и кислотах (а только в
щелочах). Полимерное строение обусловлено водородными и
оловыми связями, а также оксомостиками.
52
53.
ПОЛИКИСЛОТЫИзополикислоты - содержат остатки одной и той же кислоты
[CrO3 - O - CrO3]2H2[CrO4CrO3] (Cr, Mo, W)
2K2CrO4 + H2SO4 = K2CrO7 + K2SO4 + H2O
3K2Cr2O7 + H2SO4 = 2K2Cr3O10 + K2SO4 +
H2O
4K2Cr3O10 + H2SO4 = 3K2Cr4O13 + K2SO4 +
H2O
t
K2Cr2O7
2HCl
+ 14HCl
2CrCl3 + 3Cl2
+ H2O
+
Степень полимеризации ниже, чем V, Mo, W, из-за меньшего
размера Cr.
t
53
(NH4)2Cr2O7 N2 + Cr2O3 + 4H2O (вулкан)
54.
Гетерополикислоты (ГПК) - остатки разных кислот(Mo3O10)4] (Mo, W)
Н3[P
Основные формы изополимолибдатов:
рН > 7
MoO42- - молибдат
рН = 5-7
Мо7О246- - гептамолибдат (парамолибдат)
рН < 5
Мо8О264- - октамолибдат
Анализ на содержание фосфора
7H3PO4 + 12(NH4)6Mo7O24 + 51HNO3 7(NH4)3[PMO12O40] nH2O +
51NH4NO3 + (36-7n)H2O ( Й.Берцелиус, 1826 г.)
В щелочной среде ГПС разрушаются до МоО42- или WO42-.
54
55.
Подгруппа VII B(n-1)d5ns2
Степень окисления: II (Mn), III, IV, V, VI, VII (Mn, Tc, Re)
Растворение металлов
Mn:
Re, Tc:
в разбавленных кислотах, реагирует с Hal2, с О2
(при нагревании) и с др.неметаллами.
3Э + 7HNO3 = 3HЭO4 + 7NO + 2H2O
t
Э
+ О2
Э2О7
(Э =
Tc, Re)
Mn2O3
MnO2
MnO3 – неизвестен
Mn2O7
Mn(OH)2 Mn(OH)3 Mn(OH)4
H2MnO4
Марганцоватистая
(основные)
(амф.)
Марганцовистая
HMnO4
Марганцевая
(кислоты)
55
56.
Соединения Mn(II)Окисление:
3MnSO4 + 2KClO3 + 12KOH
= 3K2MnO4 + 2KCl +
3K2SO4 + 6H2O
2MnSO4 + 5PbO2 + 6HNO3 = 2HMnO4 + 3Pb(NO3)2 +
2PbSO4 + 2H2O
Mn(CN)2
MnF2
+
4 KCN
+ 4 KF
=
K4[Mn(CN)6]
=
K4[MnF6]
56
57.
Соединения Mn(IV), Tc(IV), Re(IV)2MnO2
+
2H2SO4 = 2MnSO4 + O2
+ 2H2O
[O]
ReO2 {Re(OH)4} ReO3
H2ReO3 (соли рениты)
H2MnO3 (метамарганцоватистая кислота, соли манганиты)
H2ReO3 (соли рениты), Н2ТсО3 (соли технетиты),
Tc(IV) устойчивее Mn(IV), Re(IV)
Кластеры [Re3Cl12]3- (межатомное расстояние 2.47 А, в металле 2.75
А)
6 дважды заполненных связывающих МО, расположенных
вдоль трех сторон треугольника, что эквивалентно трем
двойным связям.
57
58.
Соединения Mn(VI), Tc(VI), Re(VI)H2MnO4 (соли манганаты), H2ReO4 (ренаты),
(технетаты)
H2TcO4
Диспропорционирование:
3 H2MnO4
=
2 HMnO4 +
MnO2
+
2 H2O
Получение манганатов:
MnO2
+ NaNO3 +
2KOH =
H2O
K2MnO4 + NaNO2 +
В случае Re используют ReO3, Tc - TcO2.
MnO4-
+ 1.5
-
+0.56
+2.26
+0.95
+1.51
-1.18
MnO42-
MnO2
Mn0
Mn3+
Mn2+
58
59.
Соединения Mn(VII), Tc(VII), Re(VII)Кислая среда:
MnO4- + 8H+ + 5e = Mn2+ + 4H2O
Нейтральная среда: MnO4- + 2H2O + 3e =
MnO2 +
4OHЩелочная среда:
MnO4- + e = MnO42HMnO4 разрушается в растворах с концентрацией выше 20%:
4HMnO4 = 4MnO2 + 3O2 + 2H2O (в тв. виде выделяется при
низкой t).
Диспропорционирование манганатов происходит уже при
разбавлении водой конц. щелочных растворов (гидролиз):
3MnO42- + 2H2O = 2MnO4- + MnO2 + 4OH-.
Неустойчивость MnO42- объясняет наличием электрона на
*- орбитали.
59
60.
Интенсивную окраску MnO4- можно объяснитьследующим образом:
1.
Это тетраэдр:
t = 4/9 o.
Поэтому
d-d-переход
осуществляется более легко, чем в случае Mn(II) (октаэдр).
2. (Mn) < (Tc) < (Re), т.к. протяженность электронных
облаков возрастает.
3.
Тетраэдрическое строение снимает запрет по спину и по
четности с d–d – переходов, характерного для октаэдрического
строения.
4.
Вносит вклад перенос заряда четырех -электронов каждого из
атомов кислорода. Перенос заряда освобождает переход
электронов от запрета по спину.
60
61.
VIII B - подгруппаСемейство Fe
Cемейство Pt
Fe VI, III, II, 0
Co III, II, 0
Ni II,
0
3d8s2
(Fe, Co, Ni)
(Ru, Rh, Pd,
Os, Ir, Pt)
E0
Fe
-0.44
Co
-0.27
3d64s2
Ni
-0.23
3d74s2
61
62.
Растворение металловFe0
2Fe +
6H2O
+ H2SO4 разб
=
FeSO4 +
H2
6H2SO4 конц = Fe2(SO4)3 + 3SO2
+
С конц. HNO3 и 100% H2SO4 на холоду Fe пассивируется. С
разб. HNO3 реагирует:
Fe0
+
4HNO3 =
Fe(NO3)3 + NO
+
2H2O.
В обычных условиях не взаимодействует со щелочами. С гор.
конц. NaOH Na2[Fe(OH)4] + H2.
62
63.
Соединения Fe(II):FeS, FeCO3.
Соли растворимы в воде, кроме Fe3(PO4)2,
На воздухе Fe(II) устойчиво в составе соли Мора:
(NH4)2[Fe(SO4)2] и K4[Fe(CN)6].
Другие соли окисляются кислородом воздуха. Гидроксид тоже
окисляется:
2Fe(OH)2 + ½ O2
+ H2O
=
2Fe(OH)3
Fe(OH)2
+ 4NaOH
=
Na4[Fe(OH)6]
Катионные разрушаются в воде:
[Fe(NH3)6]Cl2 + 2H2O = Fe(OH)2
+ 2NH4Cl + 4NH3
Анионные КС более устойчивы, чем катионные:
[Fe(CN)6]4- - желтая кровяная соль (наиболее устойчива), реактив
на Fe(III).
63
64.
ТКП прогнозирует, что КС Fe(II) с L слабого полядолжны значительно различаться по т/д устойчивости.
В сильном поле (CN-) Fe(II)
t2g6eg0
(н/с),
(SCN-) Fe(II)
t2g4eg2
(в/с).
В слабом поле
Для [Fe(CN)6]4ЭСКП
[Fe(SCN)6]4- ЭСКП
2
=
2.4 0, lg 6 = 37
= 0.4 0, lg 6 =
64
65.
Энергетическая диаграмма [Fe(CN)6]4-4p
4s
3d
Fe2+
6CN-
65
66.
Соединения Fe(III). [Fe(H2O)6]3+ в Н2ОFe(OH)3 имеет переменный состав: Fe2O3 nH2O3.
Галогениды: FeCl3, FeF3, FeBr3 (Fe3+ + 2I- = Fe2+ +
I2).
Соли слабых кислот гидролизуются. Из-за гидролиза растворы
солей железа(Ш) имеют кислую реакцию
(рН = 2-3):
[Fe(H2O)6]3+
=
[Fe(H2O)5OH]2+ =
[Fe(H2O)5)OH]2+
[Fe(H2O)4(OH)2]+
+
+
H+
H+.
Добавление сильных кислот (до рН < 1) подавляет гидролиз. В
щелочной среде гидролиз усиливается. По способности
гидролизоваться соли Fe(III) сходны с солями Cr(III), Al(III), Fe
(II) c Mg(II).
66
67.
Координационные соединения Fe(III)Катионные КС малоустойчивы, например, [Fe(NH3)6]Cl3.
Анионные КС более устойчивы, чем у Fe(II):
K3[Fe(OH)6], K3[Fe(CN)6], K3[FeF6]
Na2[Fe(NO)(CN)5] 2H2O - нитропруссид натрия
разделения РЗЭ).
(для
Известны ферриты, которые получают сплавлением:
Fe2O3 +
Na2CO3
=
2NaFeO2
+
CO2.
Соединения Fe(VI):
спл.
Fe2O3
2H2O
+
3KNO3
+
4KOH 2K2FeO4 + 3KNO2
t
4K2FeO4
+ 10H2O 4Fe(OH)3 + 3O2 + 8KOH
+
67
68.
Соединения Co (II,III), Ni(II).Металлы растворяются в разбавленных кислотах. В щелочах
устойчивы.
3000
2 Со + О2 2СоО
2 Ni
+
5000
O2 2NiO
Нерастворимы в щелочах, но растворимы в
кислотах
Оксиды образуются также при термическом
разложении гидроксидов и карбонатов.
Со(ОН)2 и Ni(OH)2 растворяются в кислотах (преобладают основные
свойства).
В избытке аммиака образуются координационные соединения [Co(NH3)6]
Cl2, [Ni(NH3)6]Cl2.
Аммиакат Со(П) со временем разлагается водой:
[Co(NH3)6]Cl2 +
2H2O
=
Co(OH)2 +
4NH3
+
2NH4Cl.
Аммиакат Со(П) легко окисляется кислородом воздуха за счет перехода в 68н/с
КС Со(Ш).
69.
Октаэдрическая (t2g5eg2)и тетраэдрическая (eg4t2g3)
конфигурации практически равновероятны. Например, розовый
раствор [Co(H2O)6]2+ изменяет окраску при действии избытка
щелочи или кислоты на светло-синюю в результате образования
тетраэдрического КС [Co(OH)4]2- или [CoX4]2- (X – Cl-, Br, I- и др.).
Co(SCN)2 + 2NH4SCN = (NH4)2[Co(SCN)4] (уст. в смеси амил.
сп. с эфиром).
В воде устойчив аммиакат Со(Ш): [Co(NH3)6]Cl3 (ж.цв.)
t2g6eg0 (н/с). Устойчив даже в конц. НСl. Разрушить можно
H2S, NaOH.
Co(III) образует также достаточно устойчивые анионные КС:
Na3[CoF6],
Na3[Co(CN)6], Na3[Co(NO2)6] (соли калия и
аммония плохо растворимы).
69
70.
Ряд Ирвинга-УильямсаМ:
ЭСКП:
Mn(II) < Fe(II) < Co(II) < Ni(II) < Cu(II) > Zn(II)
0
0.4
0.6
0.8
0.6
0
70
71.
d-Элементы VIII группы.Металлы платиновой группы (МПГ).
Ru, Rh,Pd, Os, Ir, Pt
Металлические радиусы близки. Это обеспечивает
сходство в физических и химических свойствах. В
рудах присутствуют совместно.
Потенциалы процессов Э2+ → Э0 сдвинуто вправо, в
сторону металла. Это соответствует их положению в
ряду напряжений (после водорода). Характеризуются
высокими значениями ПИ.
Осмий имеет самую высокую удельную плотность (22.7 г/см 3).
Это объясняется образованием большого числа ковалентных
связей М – М. Плотная упаковка характерна также для триады
платины.
71
72.
Растворение платиновых металловPd + HNO3 (p) = Pd(NO3)2 + 2 NO2 + 2 H2O (80 0C)
Pt (Pd) + 4 HNO3 + 18 HCl = 3 H2[PtCl6] + 4 NO + 8 H2O
Ru, Os (Э):
tспл
Э + 3 KNO3 + 2 KOH = К2ЭО4 + 3 KNO2 + H2O
Rh, Ir в раствор можно перевести хлорированием при
нагревании:
2 Rh + 3 Cl2 + 6 NaCl = 2 Na3[RhCl6]
Ir + 2 Cl2 + 2 NaCl = Na2[IrCl6]
72
73.
Химические свойства металлов платиновой группыМПГ в обычных условиях малореакционноспособны. При
высоких температурах взаимодействуют с большим числом
простых и сложных веществ.
Окисляются кислородом с образованием соответствующих
оксидов рутения(IV), осмия(VIII), иридия(IV), родия(Ш),
палладия(П).
Os +2O2 = OsO4
Ru + O2 = RuO2
2Pd + O2 = 2PdO
Платина не реагирует с кислородом ввиду низкой термической
нестабильности соответствующего оксида.
73
74.
При нагревании образуются галогениды, халькогениды,фосфиды, бориды, силициды, но не гидриды платины.
Pt + Cl2 = PtCl2
Os + 2Cl2 = OsCl4
2Ru + 3Cl2 = 2RuCl3
74
75.
Комплексообразование металловплатиновой группы
В растворах платиновые металлы существуют
только в виде комплексных соединений.
Способность к образованию КС выражена
сильнее, чем у элементов семейства железа.
Валентные орбитали МПГ имеют большую
протяженность, что способствует донорноакцепторному взаимодействию и увеличению
расщепления d-орбиталей кристаллическим
полем
лиганда.
Вследствие
этого
значительная часть КС МПГ (даже с
лигандами
слабого
поля)
являются75
76.
Э(0): карбонилыДля МПГ одной подгруппы ПС КС одинаковы
по составу, свойствам и строению
(тригональная бипирамида):
Fe(CO)5, Ru(CO)5, Os(CO)5.
Полиядерные КС: Os6(CO)18, Э3(СО)12.
Pd(0), Pt(0) в отличие от Ni(0)
образуют [Э(СО)2]n, а не Э(СО)4.
76
77.
Э(IV) : реализуется в соединениях всехсоединений МПГ. Но особенно характерно для
соединений платины.
H2[PtCl6] - реактив на щелочные М
в растворе – желтого цвета
в кристалле - красно-коричневого цвета
Э(VI): проявляется в комплексах, которые ряду с
ацидолигандами содержат кислород
Ru, Os наряду с ацидолигандами содержат кислород
Na4[OsO4F2]
77
78.
Э(VIII): характерно для оксидов осмия ирутенияOsO4, RuO4 (оранж.).
Оксид осмия(VIII) образует при взаимодействии с
фторидом калия комплекс :
OsO4 + 2 KF = K2[OsO4F2]
(крас.-кор. осадок)
78
79.
Особенностью координационных соединенийМПГ является их кинетическая инертность.
Инертность возрастает в ряду
никель(II) → палладий(II) → платина(II).
Это связано с увеличением ∆ КП лигандов и
увеличением прочности ковалентной связи
металл – лиганд вследствие повышения
деформируемости электронных оболочек у
МПГ,
а
также
проявления
эффекта
дополнительной поляризации.
80.
Разница в кинетических характеристиках семействажелеза и МПГ увеличивается еще и потому, что
реализуются разные симметрии одного и того же
состава: [NiCl4]2- - тетраэдр, а [ЭCl4]2- (Э = МПГ) –
квадрат.
При больших энергиях расщепления
кристаллическим полем в октаэдрических комплексах
два электрона оказываются сильно разрыхляющих
молекулярных орбиталях σd*, поэтому выгодна их
потеря и переход в состояние окисления +4 или
перерождение
октаэдрического
комплекса
в
плоскоквадратный.
80
81.
В 1926 г. советский химик И.И.Черняев на примерекоординационных соединений платины(II) установил правило,
согласно которому каждый лиганд в координационном
соединении характеризуется определенным влиянием на другой
внутрисферный лиганд, находящийся в тарнсположении. Сила
этого влияния увеличивается в ряду:
H2O < OH– < NH3 < F– < Cl– < Br– < SCN– < I– < NO2– < CO < C2H4 <
Ряд дает возможность делать важные предсказания о
направлении реакций замещения лигандов во внутренней
координационной сфере.
С помощью этой закономерности легко объяснить
установленные ранее правила замещения лигандов в
комплексных соединениях платины(II).
81
82.
Взаимодействие аминов и комплексных ионов типа [PtX4]2-,где Х = Cl-, Br-, I-, SCN-, CN-, NO2-,
приводит к образованию диаминов [PtA2X2] цис-конфигурации.
Стереохимическую трактовку это правило получило в работах А.
Вернера.
Cl
Cl
Pt
K2
Cl
Cl
K
+ NH
3
NH3
Cl
Pt
+ NH3
Cl
Cl
K
NH3
Cl
Pt
+ KCl
Cl
Cl
NH3
Cl
Pt
+ KCl
Cl
NH3
82
83.
Взаимодействие галоидоводородной кислоты и комплексныхионов типа [PtA4]2-, где А – амины, приводит к образованию
диаминов [PtA2X2] транс-конфигурации.
H3N NH3
Pt
Cl2
H3N NH3
Cl
H3N
Pt
Cl
H3N NH3
Cl
H3N
Pt
Cl
H3N NH3
Cl
H3N
Pt
Cl
NH3
+ NH
3
+ NH
3
83
84.
X''Y
+
–
–
+
+ –
–
+
X'''
X'
+ –
+
–
X'
–
–
+
+
X''''
X''''
–
+
X'''
84
85.
Схема объяснения трансвлияния в комплексныхсоединениях двухвалентной платины по Чатту и Оргелу
Орбитали,
образующие σ–связи,
заштрихованы.
а – лиганд L1 не образует
π–связь с
комплексообразователем
б – лиганд L1 образует
π–связь с
комплексообразователем
85
86.
IB группаПодгруппа меди
Электронная конфигурация ( n-1)d10ns1
Cu
+1,
+2
Ag
+1,
+2
Au
+1,
+3
Минералы: СuFeS2 - медный колчедан (халькопирит)
Cu2S - медный блеск
Cu2O - куприт
(СuOH)2CO3 - малахит
86
87.
Подгруппа IB:Cu (II, I) < Ag (I, II) < Au (III, I)
инертность
O2
S
Hal2
I2
t
→
t
→
→
CuO
Cu2S ,
Cu и
t
→
Cu2O
Ag2S
Ag , Au
t
→ Cl2 ,
87
88.
РастворениеCu +
HNO3
→
Cu(NO3)2
(Ag, Cu - растворимы в конц. НNO3 и конц. H2SO4).
Можно в соляной кислоте растворить, но в присутствии
Cu
+ 4 HCl + ½ O2 → 2[CuCl4] + H2O
Au
растворимо в горячей селеновой кислоте (более сильный
окислитель, чем азотная и серная кислоты) и в царской водке:
Au + 4 HCl + HNO3 → H[AuCl4] + NO + 2 H2O,
а также в насыщенном растворе соляной кислоты хлором:
2 Au + 3 Cl2
+
2 HCl
→
2 H[AuCl4]
88
89.
Соединения Cu(I), Ag(I), Au(I)Cu(I) - образует диамагнитные соединения (d10s0).
Является не только Ϭ-акцептором, но и π-донором
электронных пар.
Прочность π-дативной связи увеличивается в ряду:
Cu(I) → Ag(I) → Au(I).
КЧ = 2,4, а для Ag(I) - 6
AкваКС для Э(I) неустойчивы.
89
90.
Гидроксиды ЭОН тоже неустойчивы:2AgOH → Ag2O + H2O
Устойчивее [Cu(NH3)2]OH в результате снижения
поляризующего действия Э+ на ионы ОН- за счет
экранирования молекулами NH3
Соединения Cu(I), Ag(I) растворяются за счет
комплексообразования в растворах аммиака:
CuCl
+ 2 NH3
= [Cu(NH3)2]Cl
AgCl
+ 2 NH3
= [Ag(NH3)2]Cl
90
91.
Галогениды растворяются в избытке реактива:CuCl
+ HCl = H[CuCl2]
AgCl
+
KI
=
K[AgI2]
Растворимость уменьшается в ряду: ЭF → ЭCl → ЭBr → ЭI
Галогениды склонны к диспропорционированию.
Кислородсодержащие соли устойчивы в случае:
AgNO3, AgClO4, AgClO3 (растворимы)
Ag2SO4, Ag2CO3 (малорастворимы)
Кислотная природа бинарных соединений Э(I)
проявляется при реакциях с основными партнерами:
Cu2O + 2 NaOH + H2O → 2 Na[Cu(OH)2] (купрат)
91
92.
КС Э(I) наиболее устойчивы с цианид-ионами:[Cu(CN)2] → [Ag(CN)2] → [Au(CN)2]
(усиление π-дативного взаимодействия).
Соединения меди(I) и золота(I) окисляются
кислородом воздуха.
Соединения Э(I) светочувствительны.
92
93.
Cоединения меди(II)Cu(OH)2
4 CuO
t
→
t
→
CuO
2 Cu2O
+
H2O
+
O2
При растворении оксида в кислотах и солей меди(II) в
воде образуется акваКС [Cu(H2O)6]2+ синего цвета.
Если в координационную сферу входят другие
лиганды цвет может быть другим, например, зеленым
в случае хлорида.
93
94.
Гидролиз солей меди(II) ведет к образованиюмалорастворимых основных солей: Cu(NO3)2•3Cu(OH)
2.
Cu(OH)2 обладает слабой амфотерностью:
Cu(OH)2
+ 2 NaOHконц → Na2[Cu(OH)4]
Cu(OH)2 + 4 NH3 + 2 H2O → [Cu(NH3)4(OH2)2]
(OH)2
Растворимость галогенидов в воде уменьшается в ряду:
CuF2 → CuCl2 → CuBr2 → CuI2.
94
95.
Катионные КС меди(II):[Cu(H2O)6]2+
-
светло-синий (800 нм)
[Cu(NH3)4(H2O)2]2+ - синий (600 нм)
[Cu(en)2(H2O)2]2+
- интенсивно синий (400 нм)
Сила поля лиганда увеличивается в ряду:
H2O → NH3 → en
CuSO4 - бесцветный, т.к. сульфат-ион является
лигандом очень слабого поля (d-d – переходы отвечают
95
поглощению в ИК-области)
96.
Анионные КС меди(II):[Cu(CN)4]2- , [CuCl4]2- , [Cu(OH)4]2-,
2- - купраты
[Cu(CO3)]
Соединения меди(III), серебра(III) и золота(III):
Золото(Ш) 5d8: квадратные КС
Из бинарных соединений растворимы в воде:
AuCl3 и
ABr3 существуют в виде полимеров.
96
97.
Оксид и гидроксид золота(III) амфотерны спреобладанием кислотных признаков:
Au(OH)3
+
NaOH
=
Na[Au(OH)4]
Au(OH)3 + 4 HNO3 = H[Au(NO3)4] + 3H2O
H[Au(CN)4], H[Au(SO4)2], H[AuS2]
Исходный продукт для получения других
соединений AuCl3
2000C
Au
+ Cl2 → AuCl3
97
98.
Cu(III) и Ag(III) - известны фторпроизводные:K3[CuF6]
и
K[AgF4]
При окислении Cu(OH)2 в щелочной среде
образуются гидрооксокупраты(III) K[Cu(OH)4]
Cu(III) и
Ag(III) -
сильные окислители
98
99.
Подгруппа IIB:Zn (II) < Cd (II) < Hg (II)
Рост поляризующего действия из-за увеличения
деформируемости электронной оболочки.
Hg (II) < Cd (II) < Zn (II)
Рост поляризующего действия из-за уменьшения радиуса
атома.
Hg (I)
:
[-Hg-Hg-]2+
99
100.
Подгруппа цинкаZn(II), Cd(II), Hg(II) эффект стабилизации КП
10
nd ,
отсутствует
(ЭСКП = 0)
Деформируемость электронной d-оболочки
увелич












































































































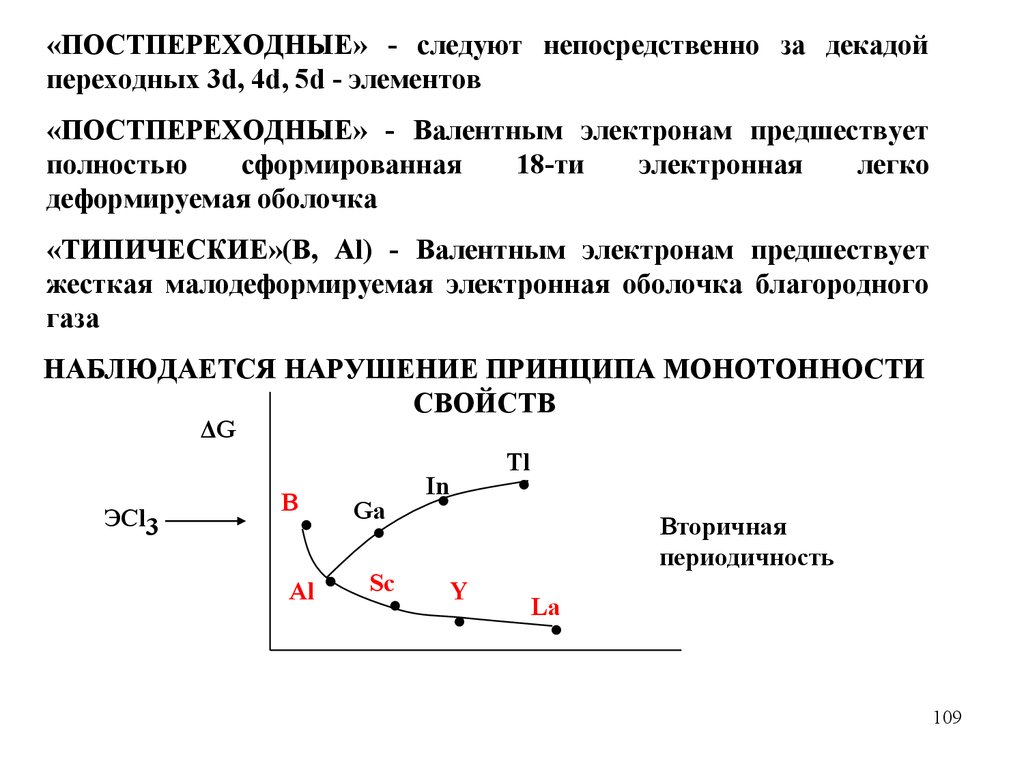




























 chemistry
chemistry








