Similar presentations:
Кальциевые каналы
1.
КАЛЬЦИЕВЫЕ КАНАЛЫ2.
ГРАДИЕНТ ИОНОВ КАЛЬЦИЯВНЕКЛЕТОЧНАЯ СРЕДА
10 -8 М
10 -3 М
3.
РОЛЬ ИОНОВ КАЛЬЦИЯ1. СОПРЯЖЕНИЕ ПРОЦЕССОВ ВОЗБУЖДЕНИЯ СОКРАЩЕНИЯ
4.
2. ИОНЫ КАЛЬЦИЯ – ВТОРИЧНЫЕ ПОСРЕДНИКИУЧАСТВУЮТ В
•АГРЕГАЦИИ ТРОМБОЦИТОВ
•ВЫСВОБОЖДЕНИИ НЕЙРОМЕДИАТОРОВ
•ПРОЦЕССАХ СЕКРЕЦИИ
Са2+
5. КАЛЬЦИЕВЫЕ КАНАЛЫ
ПО РАСПОЛОЖЕНИЮЦИТОПЛАЗМАТИЧЕСКИЕ (НА ЦИТОПЛАЗМАТИЧЕСКОЙ
МЕМБРАНЕ)
ВНУТРИКЛЕТОЧНЫЕ (НА МЕМБРАНАХ
СПР)
6.
КАЛЬЦИЕВЫЕ КАНАЛЫПО СПОСОБУ УПРАВЛЕНИЯ
ПОТЕНЦИАЛОЗАВИСИМЫЕ
РЕЦЕПТОРУПРАВЛЯЕМЫЕ
7.
ПОТЕНЦИАЛОЗАВИСИМЫЕ КАЛЬЦИЕВЫЕКАНАЛЫ
8.
Классификация каналов по потенциалуправляемостиВысокопороговые каналы
(HVA)
Низкопороговые
каналы (LVA)
Порог активации значительно
выше ПП
Порог активация при
деполяризации чуть выше
потенциала покоя (ПП)
КАНАЛЫ
L-ТИПА
NТИПА
КАНАЛЫ –
КАНАЛЫ
P/Q типа
КАНАЛЫ
T-ТИПА
9.
HVA каналыКАНАЛЫ
L-ТИПА
(МЕДЛЕННЫЕ КАНАЛЫ) ВЫСОКОВОЛЬТАЖНЫЕ:
АКТИВИРУЮТСЯ ПРИ ОТНОСИТЕЛЬНО ВЫСОКИХ ЗНАЧЕНИЯХ
МП
(свыше 10 мВ)
ВЫСОКАЯ ПРОВОДИМОСТЬ (25
пСм = 25х10-12 См)
МЕДЛЕННО ИНАКТИВИРУЮТСЯ (t 500 мс)
ЛОКАЛИЗАЦИЯ: НЕЙРОНЫ ЦНС И ПЕРИФЕРИЧЕСКОЙ НС,
КАРДИОМИОЦИТЫ, КЛЕТКИ СКЕЛЕТНОЙ, ГЛАДКОЙ МУСКУЛАТУРЫ
БЛОКИРУЮТСЯ ОРГАНИЧЕСКИМИ СОЕДИНЕНИЯМИ (ВЕРАПАМИЛ
ДИГИДРОПИРИДИН, БЕНЗОТИАЗЕПИН,)
10.
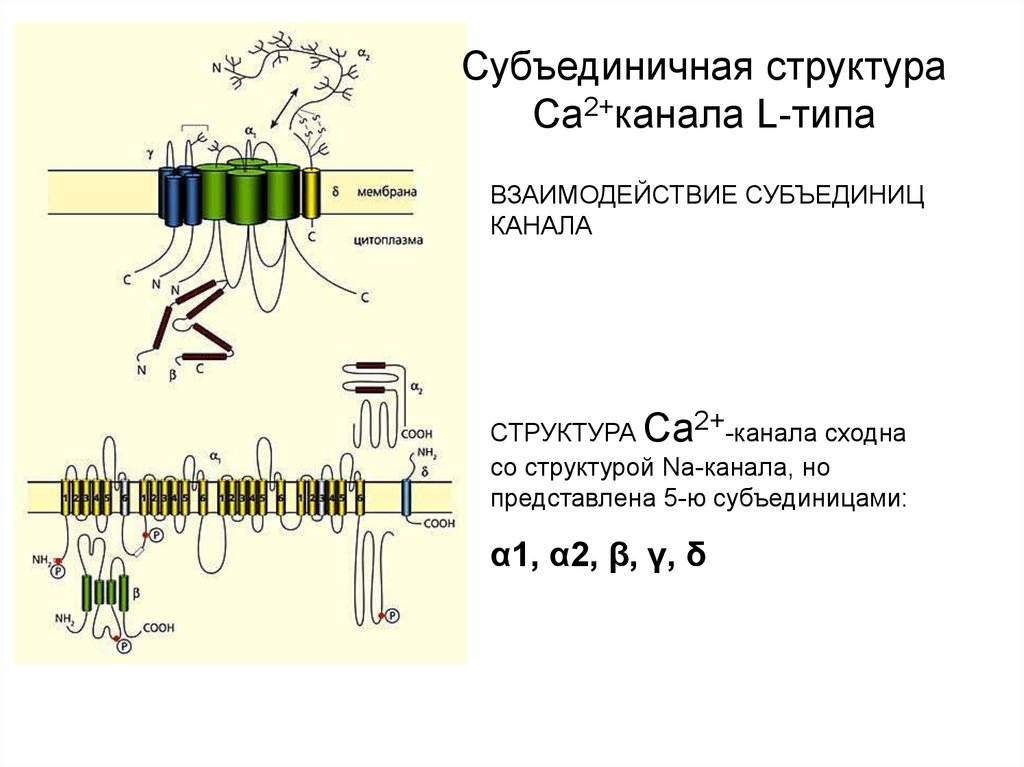
Субъединичная структураСа2+канала L-типа
ВЗАИМОДЕЙСТВИЕ СУБЪЕДИНИЦ
КАНАЛА
СТРУКТУРА Са2+-канала сходна
со структурой Na-канала, но
представлена 5-ю субъединицами:
α1, α2, β, γ, δ
11.
Мембранная локализациясубъединиц Са2 +канала и
формирование
ионопроводящей поры
α1субъединицей
При этом сегменты S5 и S6 каждого из четырех доменов обращены
внутрь и формируют стенки поры. В β-субъединице, непосредственно
примыкающей к α1 субъединице на внутренней стороне канала,
имеется участок фосфорилирования
12.
ДВА МЕХАНИЗМАИНАКТИВАЦИИ Са2+- каналов
L-типа
1.
Потенциалозависимая
инактивируются деполяризацией
2.
Кальцийзависимая
(токозависимая) инактивируются
ионами Са2+, вошедшими в
клетку во время развития этого
тока.
13.
ИЗУЧЕНИЕ ПОТЕНЦИАЛОЗАВИСИМЫХКАЛЬЦИЕВЫХ КАНАЛОВ – РАБОТЫ
ХАГИВАРА С СОАВТ. НА
МЫШЦАХ МОРСКОГО ЖЕЛУДЯ (усоногие
ракообразные)
14.
ПРОНИЦАЕМОСТЬ Са 2+-КАНАЛА ДЛЯДВУХВАЛЕНТНЫХ КАТИОНОВ
Ba2+ Sr2+ Ca2+ Co2+ Ni2+ Cd2+
БЛОКАТОРЫ
ЭТОТ РЯД СОВПАДАЕТ СО СПОСОБНОСТЬЮ ПЕРЕЧИСЛЕННЫХ
КАТИОНОВ СВЯЗЫВАТЬСЯ С КАРБОКСИЛЬНОЙ ГРУППОЙ
15.
МОДЕЛЬ: ИОН КАЛЬЦИЯ СВЯЗЫВАЕТСЯ С ОПРЕДЕЛЕННОЙСТРУКТУРОЙ КАНАЛА
X + Caex
J Са
X Ca
J Са max Е
К Са Е
1
2
Са 0
X + Cain
Jca(E) –кальциевый ток, зависящий
от МП
Jcamax (Е) – предельное значение
кальциевого тока
Kca (Е)– константа диссоциации
16.
РОЛЬ КАЛЬЦИЕВЫХ КАНАЛОВL-ТИПА
ОСНОВНОЙ ПУТЬ ДЛЯ ВХОДА ИОНОВ КАЛЬЦИЯ В КЛЕТКУ (ВАЖНО
ДЛЯ СОКРАЩЕНИЯ МЫШЦ, ВЫДЕЛЕНИЯ НЕЙРОМЕДИАТОРОВ)
УЧАСТВУЮТ В ПОДДЕРЖАНИИ ЭЛЕКТРИЧЕСКОЙ И МЕХАНИЧЕСКОЙ
АКТИВНОСТИ КАРДИОМИОЦИТОВ И ГЛАДКОМЫШЕЧНЫХ КЛЕТОК
СОСУДОВ
17.
18.
HVA каналыКАНАЛЫ -
NТИПА
АКТИВИРУЮТСЯ ПРИ ВЫСОКИХ ЗНАЧЕНИЯХ
МП (более
20 мВ)
ОТНОСИТЕЛЬНО БЫСТРО ИНАКТИВИРУЮТСЯ (t 50-80 мс)
СРЕДНЯЯ ПРОВОДИМОСТЬ (13 пСм)
ЛОКАЛИЗАЦИЯ: СИНАПТОСОМЫ МОЗГА КРЫСЫ,
НЕЙРОНЫ КОРЫ ГОЛОВНОГО МОЗГА, В ОКОНЧАНИЯХ
СЕНСОРНЫХ НЕЙРОНОВ
БЛОКИРУЮТСЯ La
3+
СПЕЦИФИЧЕСКИЙ БЛОКАТОР - ТОКСИН ИЗ
МОРСКОЙ УЛИТКИ Conus
- ω conotoxin
geographus
19.
РОЛЬ КАЛЬЦИЕВЫХ КАНАЛОВN-ТИПА
Регулируют высвобождение медиаторов
20.
HVA каналыКАНАЛЫ P И QТИПОВ
КАНАЛ Р ТИПА
ПОРОГ АКТИВАЦИИ СОСТАВЛЯЕТ –50МВ,
КИНЕТИКА ИНАКТИВАЦИИ ОЧЕНЬ МЕДЛЕННАЯ (t ≈1с)
ЛОКАЛИЗАЦИЯ: КЛЕТКИ ПУРКИНЬЕ МОЗЖЕЧКА (КАНАЛЫ РТИПА)
НЕЧУВСТВИТЕЛЬНЫ К ДИГИДРОПИРИДИНАМ,
БЛОКИРУЮТСЯ ТОКСИНОМ ЯДА ПАУКА AGELENOPSIS (FTX).
ВПОСЛЕДСТВИИ ОБНАРУЖИЛИ, ЧТО ЕСТЬ ЕЩЕ ОДИН ТИП
ЧУВСТВИТЕЛЬНОГО К НАПРЯЖЕНИЮ КАЛЬЦИЕВОГО КАНАЛА:
КАНАЛ
QТИПА
РАЗЛИЧИЕ МЕЖДУ P И QТИПАМИ КАЛЬЦИЕВЫХ КАНАЛОВ
НЕЗНАЧИТЕЛЬНЫ, И ОНИ ЧАСТО ГРУППИРУЮТСЯ КАК
P/QКАЛЬЦИЕВЫЕ КАНАЛЫ.
21.
LVA каналыКАНАЛЫ
T-ТИПА (БЫСТРЫЕ КАНАЛЫ)
НИЗКОВОЛЬТАЖНЫЕ:
АКТИВИРУЮТСЯ ПРИ НИЗКИХ ЗНАЧЕНИЯХ
МП (МП
более положителен, чем -70 мВ)
БЫСТРО ИНАКТИВИРУЮТСЯ (t 50-80 мс)
ЛОКАЛИЗАЦИЯ: НЕЙРОНЫ, ПРОВОДЯЩАЯ СИСТЕМА
СЕРДЦА, ФИБРОБЛАСТЫ, В-ЛИМФОЦИТЫ
НЕ БЛОКИРУЮТСЯ НЕОРГАНИЧЕСКИМИ
АНТАГОНИСТАМИ КАЛЬЦИЕВЫХ КАНАЛОВ,
СПЕЦИФИЧЕСКИЙ БЛОКАТОР МИБЕФРАДИЛ
22.
РОЛЬ КАЛЬЦИЕВЫХ КАНАЛОВТ-ТИПА
В ЭМБРИОНАЛЬНЫХ КЛЕТКАХ ЗАПУСКАЮТ ПРОЦЕССЫ
ДИФФЕРЕНЦИРОВКИ
ОБЕСПЕЧИВАЮТ ЗАКОНОМЕРНЫЕ ПЕРИОДИЧЕСКИЕ КОЛЕБАНИЯ
МП (НАПРИМЕР, В ПЕЙСМЕКЕРАХ)
23.
Фармакологическаяклассификация
По чувствительности к дигидропиридинам (DHP)
HVA
DHP-чувствительные
кальциевые каналы Lтипа
LVA
DHP-нечувствительные
кальциевые каналы
DHP-нечувствительные
кальциевые каналы Nтипа.
DHP-нечувствительные
кальциевые каналы P и Qтипа
T-ТИПА
24. ВНУТРИКЛЕТОЧНЫЕ КАЛЬЦИЕВЫЕ КАНАЛЫ
25.
26.
ИЗОФОРМЫ РИАНОДИНОВЫХ РЕЦЕПТОРОВобнаружены в
мозге
27.
28.
29.
IP3-РЕЦЕПТОРЫ:Активируются при увеличении
внутриклеточной концентрации IP3
вызывают высвобождение внутриклеточных
запасов Ca2+ после стимуляции рецепторов на
поверхности клетки.
Локализуются в мембранах ЭПР клеток мозга
30.
31. АКТИВНЫЙ ТРАНСПОРТ
32.
ОБЩИЕ СВОЙСТВА:ТРАНСПОРТ СОПРЯЖЕН С ГИДРОЛИЗОМ
АТФ
ПЕРЕНОС ИОНОВ ОСУЩЕСТВЛЯЮТ ТРАНСПОРТНЫЕ
АТФАЗЫ
ТРАНСПОРТ ОСУЩЕСТВЛЯЕТСЯ ПРОТИВ ГРАДИЕНТА
КОНЦЕНТРАЦИИ
ФУНКЦИЯ:
ПОДДЕРЖАНИЕ ИОННЫХ ГРАДИЕНТОВ
33. ТИПЫ АТФАЗ
АТФаза V-типаАТФаза F-типа
АТФаза Р-типа
34. АТФазы V типа
ЛОКАЛИЗАЦИЯ:•МЕМБРАНЫ ВАКОЛЕЙ
ДРОЖЖЕЙ
•ТОНОПЛАСТЫ РАСТЕНИЙ
• ЛИЗОСОМЫ
•ЭНДОСОМЫ
•СЕКРЕТОРНЫЕ ГРАНУЛЫ
35.
V0 – ГИДРОФОБНАЯ ЧАСТЬ(УЧАСТВУЕТ В ТРАНСЛОКАЦИИ
ПРОТОНОВ)
V1 – ВОДОРАСТВОРИМАЯ ЧАСТЬ
ОБЛАДАЕТ КАТАЛИТИЧЕСКОЙ
АКТИВНОСТЬЮ, КАТАЛИЗИРУЕТ КАК
СИНТЕЗ, ТАК И ГИДРОЛИЗ
АТФ
36.
ФУНКЦИИ•ПЕРЕНОСЯТ ПРОТОНЫ
•УЧАСТВУЮТ В ТРАНСПОРТЕ
АНИОНОВ, АМИНОКИСЛОТ И
РЕПАРАЦИИ МЕМБРАН ПРИ ЭНДО- И
ЭКЗОЦИТОЗЕ
ИНГИБИТОРЫ: НИТРАТЫ, SHРЕАГЕНТЫ, KSCN, ДЦКД
(дициклогексилкарбодиимид)
37.
ТРАНСПОРТ ПРОТОНОВ ВТОНОПЛАСТЕ КЛЕТОК
РАСТЕНИЙ
ПРОТОНЫ ПОСТУПАЮТ ВНУТРЬ
ВАКУОЛИ И СОЗДАЮТ
ЭЛЕКТРИЧЕСКИЙ (от +20 до +50
мВ) И ХИМИЧЕСКИЙ (от 1,5 до 4,5
единиц рН) ГРАДИЕНТЫ.
ЭТА ЭНЕРГИЯ ИСПОЛЬЗУЕТСЯ
ДЛЯ ТРАНСПОРТА ДРУГИХ
ИОНОВ И ВЕЩЕСТВ.
38. АТФаза F ТИПА
ЛОКАЛИЗАЦИЯ:МЕМБРАНЫ БАКТЕРИЙ, ХЛОРОПЛАСТОВ И
МИТОХОНДРИЙ
СТРОЕНИЕ:
F0 – ГИДРОФОБНАЯ ЧАСТЬ
(ТРАНСЛОКАЦИЯ ПРОТОНОВ)
F1 – ВОДОРАСТВОРИМАЯ ЧАСТЬ
ОБЛАДАЕТ КАТАЛИТИЧЕСКОЙ
АКТИВНОСТЬЮ
ИНГИБИТОРЫ: ОЛИГОМИЦИН, ДЦКД, ИОНЫ КАДМИЯ
ФУНКЦИЯ: СОЗДАНИЕ ГРАДИЕНТА ПРОТОНОВ
39. АТФазы Р ТИПА
ОБЩЕЕ СВОЙСТВО: ОБРАЗОВАНИЕФОСФОРИЛИРОВАННОГО ПРОДУКТА, КОТОРЫЙ
УЧАСТВУЕТ В РЕАКЦИОННОЙ ЦИКЛЕ
ПРИМЕРЫ: Na/K-АТФаза, Ca-АТФаза, H-АТФаза
ПЛАЗМАТИЧЕСКИХ МЕМБРАН ЭУКАРИОТИЧЕСКИХ
КЛЕТОК
ИНГИБИТОР: ВАНАДАТ-ИОН
40. Na/K АТФаза
ЛОКАЛИЗОВАНА НА ЦИТОПЛАЗМАТИЧЕСКОЙ МЕМБРАНЕСОЗДАЕТ ГРАДИЕНТ ИОНОВ НАТРИЯ И КАЛИЯ
41. СТРУКТУРА Na+/K+ АТФазы: состоит из 2 полипептидных цепей и
СТРУКТУРА Na+/K+ АТФазы: состоит из 2полипептидных цепей и
1 – участок
связывания ионов
1
2
Формула уабаина
2 – участок
связывания АТФ
* - участки
связывания
уабаина
42. УАБАИН – ингибитор Na,K-АТФазы
Строфант43.
РЕАКЦИОННЫЙ ЦИКЛ Na/K АТФазы44.
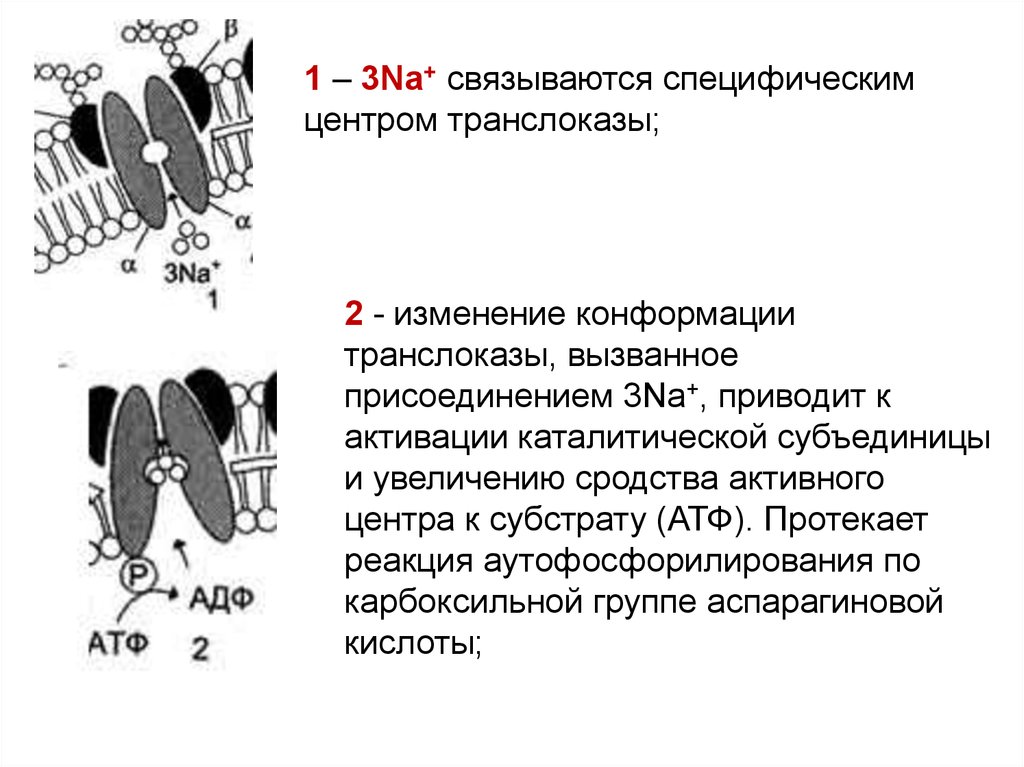
1 – 3Na+ связываются специфическимцентром транслоказы;
2 - изменение конформации
транслоказы, вызванное
присоединением 3Na+, приводит к
активации каталитической субъединицы
и увеличению сродства активного
центра к субстрату (АТФ). Протекает
реакция аутофосфорилирования по
карбоксильной группе аспарагиновой
кислоты;
45.
3 - аутофосфорилирование изменяет заряд иконформацию транслоказы, она закрывается
с внутренней стороны мембраны и
открывается с наружной, уменьшается
сродство к ионам натрия, и они
диссоциируют от переносчика;
4 - Na+, К+-АТФ-аза, открытая с наружной
стороны мембраны, имеет специфический
центр связывания для 2К+; Присоединение
двух ионов калия к фосфорилированной
транслоказе вызывает изменение
конформации и появление аутофосфатазной
активности. Протекает реакция
аутодефосфорилирования;
46.
5 - дефосфорилирование изменяетзаряд и конформацию транслоказы,
она закрывается с наружной
стороны мембраны и открывается с
внутренней, уменьшается сродство к
ионам калия и они диссоциируют от
Na+, К+-АТФ-азы;
6 - АТФ-аза возвращается в
первоначальное состояние.
47.
РЕГУЛЯЦИЯ АКТИВНОСТИ Na/KАТФазы
1. СООТНОШЕНИЕ Na/K И СОДЕРЖАНИЕ АТФ
(факторы краткосрочной регуляции)
2. ФОСФОРИЛИРОВАНИЕ ПРОТЕИНКИНАЗАМИ, ЧТО
ПРИВОДИТ К СНИЖЕНИЮ АКТИВНОСТИ (фактор
долгосрочной регуляции)
ИНГИБИТОР – УАБАИН И ДРУГИЕ СЕРДЕЧНЫЕ
ГЛИКОЗИДЫ
48. Са2+ АТФаза
ЛОКАЛИЗАЦИЯ:САРКО- (ЭНДО)ПЛАЗМАТИЧЕСКИЙ РЕТИКУЛУМ
ЦИТОПЛАЗМАТИЧЕСКАЯ
МЕМБРАНА
49.
Са2+ АТФазыВСЕ
– МОНОМЕРНЫЕ БЕЛКИ, Т.Е. СОСТОЯТ
ИЗ ОДНОЙ ПОЛИПЕПТИДНОЙ ЦЕПИ
Са2+ АТФаза СПР И
ЦИТОПЛАЗМАТИЧЕСКОЙ МЕМБРАНЫ
БЛИЗКИ ПО ФУНКЦИОНАЛЬНЫМ СВОЙСТВАМ, НО ОБРАЗУЮТСЯ ПРИ
УЧАСТИИ РАЗНЫХ ГЕНОВ
ОТЛИЧАЮТСЯ ПО МОЛЕКУЛЯРНОЙ МАССЕ, ПО МЕХАНИЗМАМ
РЕГУЛЯЦИИ
50.
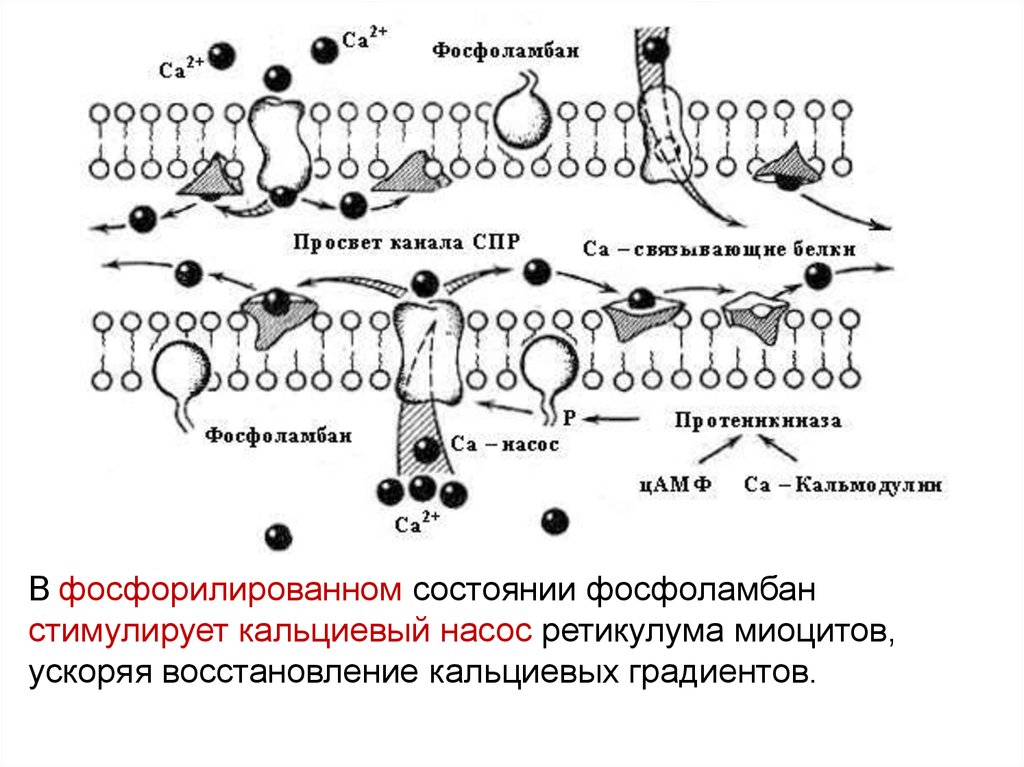
СПРСПР
ФЛБ – фосфоламбан (у Са АТФазы саркоплазматического
ретикулума),
51.
В фосфорилированном состоянии фосфоламбанстимулирует кальциевый насос ретикулума миоцитов,
ускоряя восстановление кальциевых градиентов.
52.
(цитозоль)(внеклеточная
среда)
КМ – кальмодулин (у Са АТФазы плазматической мембраны )
53. ЦИКЛ РАБОТЫ Са2+АТФазы
СТАДИИ ГИДРОЛИЗА АТФ ЧЕРЕДУЮТСЯ СО СТАДИЯМИПЕРЕНОСА ИОНОВ КАЛЬЦИЯ
54.
Н+АТФазаЛОКАЛИЗАЦИЯ: ПЛАЗМАТИЧЕСКИЕ МЕМБРАНЫ РАСТИТЕЛЬНЫХ
КЛЕТОК
55.
Н+-АТФаза – это интегральный белок,полипептидная цепь которого десять раз
пересекает поверхностную (плазматическую)
мембрану.
Полагают, что в мембране Н+-АТФаза
функционирует в виде олигомера и состоит из
двух субъединиц.
56.
+ЦИКЛ РАБОТЫ Н -АТФазы
57.
Роль Н+-АТФазы:поддерживает рН цитоплазмы близкий к
нейтральному
создает на мембране разность потенциалов
(∆ψ), во многом определяя электрические
свойства высших растений
обеспечивает вторичный активный транспорт
58.
Механизм возникновения ПД в проводящих пучках высших растений имеетбольшое сходство с таковым в нервах животных.
Он является ионным по природе, только в возникновении ПД у высших
растений принимают участие не Na+ и К+, как у животных, а Cl− и К+.
Большой выход ионов калия во
время ПД в растительных клетках
резко нарушает существующие
градиенты этого иона, поэтому во
время фазы реполяризации
мембранный потенциал не может
восстановиться до исходного уровня.
Достижение этой величины
осуществляется непосредственным
подключением протонной помпы (Н+
-АТФазы)
59.
Благодаря вторичному активному транспорту клетка активно поглощает (илиудаляет) многие вещества (ионы, углеводы, аминокислоты и др.).
Переносчики белковой природы образовывают комплекс с протоном на
наружной стороне мембраны. Такой комплекс приобретает
сродство (в зависимости от типа переносчика) к определенному веществу
(например, иону Na+, сахарозе).Образуется заряженное соединение типа
протон–переносчик–вещество. Перенося протон внутрь клетки как по
электрическому(∆ψ), так и по концентрационному (∆рН) градиентам,
переносчик за счет энергии этих двух составляющих
протонного потенциала переносит вещество внутрь (симпорт) или наружу
(антипорт).
60. ТРАНСПОРТ ВЕЩЕСТВ ЧЕРЕЗ МНОГОМЕМБРАННЫЕ СИСТЕМЫ ВТОРИЧНЫЙ АКТИВНЫЙ ТРАНСПОРТ
61. МНОГОМЕМБРАННЫЕ СИСТЕМЫ
микроворсинкибазолатеральная
поверхность
гликокаликс +
коллаген
62.
БАЗАЛЬНАЯ МЕМБРАНА – дополнительная мембрана запределами плазмалеммы эпителиоцита
ЕЕ СОСТАВ: гликопротеидный матрикс (гликокаликс) +
коллагеновый компонент
СВОЙСТВА:
•толще плазмалеммы
•диаметр ее пор около 3 нм
•отсутствуют системы активного транспорта
РОЛЬ: пассивный фильтр для проникновения веществ
63. Базолатеральная мембрана несет межклеточные контакты разного типа
64. ЭКСПЕРИМЕНТЫ УССИНГА
Объект исследованийУстановка Уссинга
65. ЭКСПЕРИМЕНТ УССИНГА: ИЗУЧЕНИЕ АСИММЕТРИЧНЫХ СВОЙСТВ ЭПИТЕЛИЯ
IK6
5
NaCl
В
1
7
NaCl
4
А
2
U
3
1 – кожа лягушки; 2 – вольтметр; 3 и 4 – внешний источник эдс и
прибор для измерения напряжения, подаваемого электродами 5 и 6;
7 – амперметр Ik – короткозамкнутый ток;
А – наружная (мукозная), В – внутренняя(серозная) сторона кожи
лягушки
66. МОДЕЛЬ УССИНГА
Серозная (внутренняя)поверхностькожи
Мукозная
(наружная)поверхность кожи
67.
ВТОРИЧНЫЙ АКТИВНЫЙТРАНСПОРТ
68. ВТОРИЧНЫЙ АКТИВНЫЙ ТРАНСПОРТ
ТРАНСПОРТ САХАРОВ И АМИНОКИСЛОТ ЗА СЧЕТ ЭНЕРГИИ ГРАДИЕНТАКОТОРЫЙ СОЗДАЕТСЯ БЛАГОДАРЯ РАБОТЕ
Na+ ,
Na/K НАСОСА
ХАРАКТЕРИСТИКИ
1. СТЕРЕОСПЕЦИФИЧНОСТЬ (стереоизомеры сахаров и
аминокислот транспортируются с разной скоростью)
2. СПЕЦИФИЧЕСКОЕ ИНГИБИРОВАНИЕ (флоридзин ингибирует
транспорт сахаров, но не аминокислот)
3. ВЗАИМНОЕ КОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ (вещества
одного класса тормозят перенос друг друга)
4. ЭФФЕКТ НАСЫЩЕНИЯ (транспорт с помощью переносчика)
69.
J max SJ
K S
Уравнение для транспорта сахаров
Jmax = 12 мкмоль / м2 с – одинакова для всех моносахаридов
К характеризует сродство переносчика к моносахариду и
различна для разных моносахаридов при нормальном
содержании ионов натрия в среде:
К для глюкозы 1,4 ммоль/л, галактозы – 0,35 ммоль/л, для
пентоз – от 2,8 до 19,6 ммоль/л
70. Графики Лайнуивера – Берка для транспорта 6-дезокси-D-глюкозы через эпителий кишки, показывающие зависимость транспорта сахара
Графики Лайнуивера – Берка для транспорта 6-дезокси-Dглюкозы через эпителий кишки, показывающие зависимостьтранспорта сахара от концентрации ионов Na в среде
1 KM 1
1
J J max S J max
1 [Na]e= 145 mmol/l
2 [Na]e= 0 mmol/l
71. ТРАНСПОРТ ГЛЮКОЗЫ, СОПРЯЖЕННЫЙ С ИОНАМИ НАТРИЯ
72. ТРАНСПОРТ АМИНОКИСЛОТ, СОПРЯЖЕННЫЙ С ИОНАМИ НАТРИЯ
73.
74.
В настоящее время выделяют 5 транспортныхсистем:
для крупных нейтральных, в том числе
алифатических и ароматических аминокислот,
для малых нейтральных – аланина, серина,
треонина,
для основных аминокислот – аргинина и лизина,
для кислых аминокислот – аспартата и глутамата,
для малых аминокислот – глицина, пролина и
оксипролина.







































































 biology
biology