Similar presentations:
Заболевания лёгких, молочной железы, органов средостения
1. Заболевания лёгких, молочной железы, органов средостения
2.
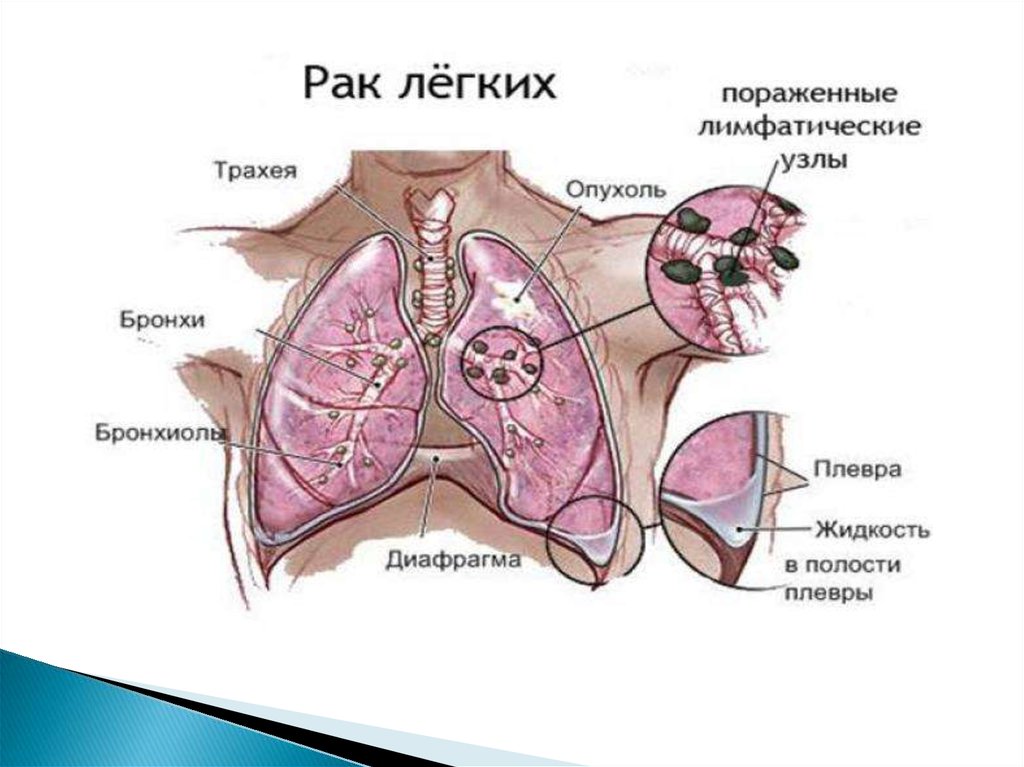
Рак лёгкого (бронхогенный рак, бронхогеннаякарцинома) — злокачественное
новообразование лёгкого, происходящее
из эпителиальной ткани бронхов различного
калибра. В зависимости от места появления
подразделяется на центральный,
периферический и массивный (смешанный).
3.
ЭпидемиологияРак лёгкого является серьёзной медицинской и социальной
проблемой, в развитых странах он является наиболее часто
встречающейся злокачественной опухолью и является
наиболее распространённой причиной смерти от
онкологической патологии. Согласно данным
международного агентства по изучению рака, ежегодно в
мире регистрируется около 1 миллиона новых случаев рака
лёгкого, и 60 % онкологических больных погибает в
результате данного заболевания.[1]
В России рак лёгкого также занимает 1 место среди
онкологических заболеваний и его доля в данной патологии
составляет 12 %, в 15 % случаев у умерших онкобольных был
выставлен диагноз рак лёгкого. Мужчины болеют раком
лёгкого значительно чаще, каждая 4-я злокачественная
опухоль у мужчин является раком лёгкого, у женщин же —
только каждая 12-я. По данным 2000 года рак лёгкого стал
причиной смерти 32 % мужчин, и 7,2 % женщин, у которых
были обнаружены какие-либо злокачественные
новообразования.[1]
4.
ЭтиологияПлоскоклеточный центральный рак лёгкого
К основным причинам любого рака
относят канцерогены (например, табачного
дыма), ионизирующее излучение и вирусную инфекцию. Их
воздействие вызывает кумулятивные изменения ДНК в
выстилающей ткани бронхов лёгкого
(бронхиальном эпителии). Чем больше тканей повреждено,
тем выше риск развития рака.[2]
Курение табака
Курение табака на сегодняшний день — основная причина
рака лёгкого[3]. Сигаретный дым содержит более 60
известных канцерогенов,[4] в том
числе радиоизотопы радона, нитрозамин и бензопирен.
Кроме того, полагают, что никотин подавляет иммунную
систему, что способствует озлокачествлению тканей[5]. В
развитых странах почти 90 % случаев смертельного рака
лёгкого вызваны курением[6]. Среди курящих мужчин,
пожизненный риск развития рака лёгкого составляет 17,2 %,
среди курящих женщин — 11,6 %. Этот риск значительно ниже
у некурящих: 1,3 % у мужчин и 1,4 % у женщин[7].
5.
Женщины, которые курят и получают гормональную терапию, имеютгораздо более высокий риск смерти от рака лёгкого. В исследовании,
проведённом в 2009 году, было показано, что женщины,
принимающие гормоны, имеют на 60 % выше вероятность смерти от
рака лёгкого, чем женщины, принимающие плацебо. Среди женщин,
которые курили (бывшие и нынешние курильщицы), 3,4 % из них, кто
принимал гормоны умерло от рака лёгкого по сравнению с 2,3 %
женщин, принимавших плацебо[8].
Со стажем курения табака увеличивается вероятность развития рака
лёгкого у человека. Если человек прекращает курить, эта вероятность
неуклонно уменьшается, так как повреждённые лёгкие
восстанавливаются, и загрязняющие частицы постепенно удаляются[9].
Кроме того, есть свидетельства, что рак лёгкого у никогда не
куривших имеет лучший прогноз, чем у курильщиков[10], и поэтому
пациенты, которые курят на момент установления диагноза, имеют
меньшую выживаемость, чем те, которые давно бросили курить[11].
Пассивное курение (вдыхание дыма табака от другого курильщика) —
причина рака лёгкого у некурильщиков. Исследования в США[12],
Европе[13], Великобритании[14], и Австралии[15] показали значительное
увеличение относительного риска среди тех, кто подвергается
пассивному курению. Последние исследования показали, что
выдыхаемый курильщиком дым более опасен, чем вдыхание его
прямо из сигареты[16]. 10-15 % больных раком лёгкого никогда не
курили[17].
6.
РадонРадон — газ без цвета и запаха, образующийся при распаде
радиоактивного радия, который в свою очередь является продуктом
распада урана, присутствующего в коре Земли. Радиоактивное излучение
способно повреждать генетический материал, вызывая мутации, которые
иногда приводят к возникновению злокачественных опухолей. Воздействие
радона — вторая причина рака лёгкого в общей популяции, после курения[18] с
увеличением риска от 8 % до 16 % на каждые 100 Бк/м³ увеличения
концентрации радона[19]. Концентрация радона в атмосфере зависит от
местности и состава основных пород почв и камней. Например, в зонах, таких
как Корнуолл в Великобритании (где имеются запасы гранита), радон —
большая проблема, и здания должны быть хорошо вентилируемыми для
снижения концентрации радона.
Асбестоз
Ржавые тельца при асбестозе. Окраска гематоксилином и эозином
Асбест может вызывать различные лёгочные заболевания, включая рак лёгкого.
Существует взаимоусиливающий эффект курения табака и асбестоза в
возникновении рака лёгкого[20]. Асбестоз также может вызывать рак плевры,
называемый мезотелиома (который следует дифференцировать от рака
лёгкого).
Вирусы
Вирусы известны способностью вызывать рак лёгкого у животных,[21][22] и
последние данные свидетельствуют о способности его вызывать у человека. К
таким вирусам относят вирус папилломы человека[23], JC вирус[24], обезьяний
вирус 40 (SV40), BK вирус и цитомегаловирус[25]. Эти вирусы могут влиять
на клеточный цикл и подав
7.
Пылевые частицыИсследования Американского общества рака
выявили прямую связь воздействия пылевых частиц
с раком лёгкого. Например, если концентрация
пыли в воздухе увеличивается только на 1 %, риск
развития рака лёгкого возрастает на 14 %[26],[27].
Кроме того, установлено, что важен размер частиц
пыли, так как ультрадисперсные частицы способны
проникать в глубокие слои лёгкого[28].
8.
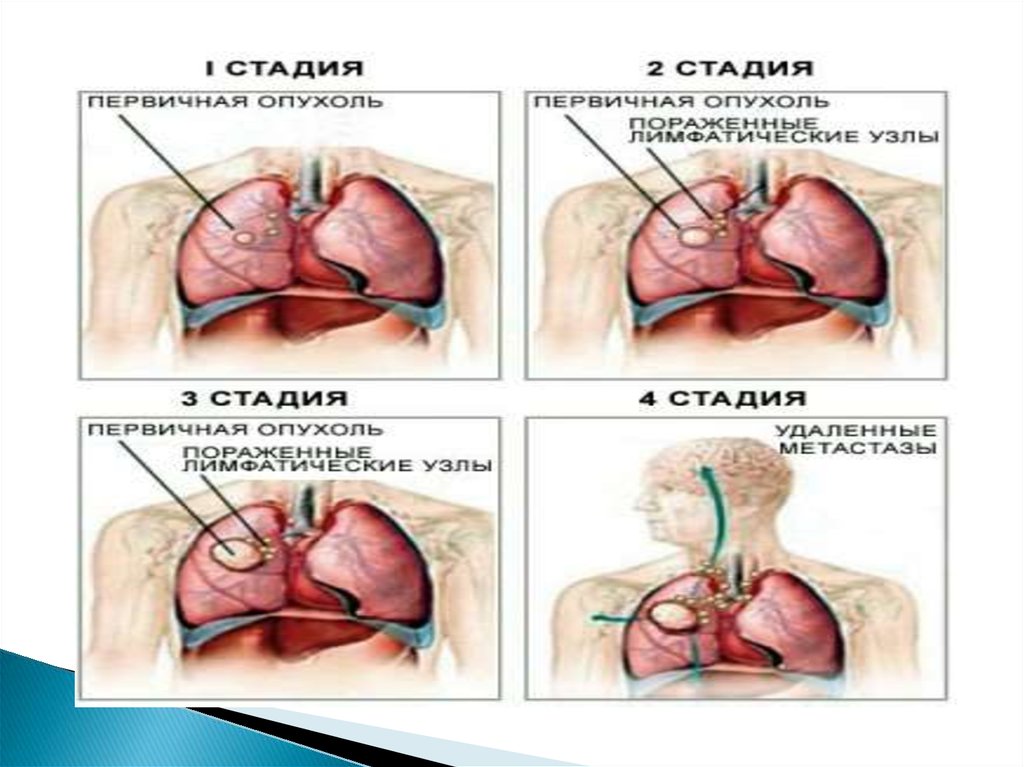
Классификация рака лёгкого по стадиямСогласно отечественной классификации, рак лёгкого
подразделяется на следующие стадии:
I стадия — опухоль до 3 см в наибольшем измерении,
расположена в одном сегменте лёгкого или в пределах
сегментарного бронха. Метастазов нет.
II стадия — опухоль до 6 см в наибольшем измерении,
расположена в одном сегменте лёгкого или в пределах
сегментарного бронха. Наблюдаются единичные метастазы в
пульмональных и бронхопульмональных лимфатических
узлах.
III стадия — опухоль больше 6 см с переходом на соседнюю
долю лёгкого или прорастанием соседнего бронха или
главного бронха. Метастазы обнаруживаются в
бифуркационных, трахеобронхиальных, паратрахеальных
лимфатических узлах.
IV стадия — опухоль выходит за пределы лёгкого с
распространением на соседние органы и обширными
местными и отдалёнными метастазами,
присоединяется плеврит и/или перикардит.
9.
Согласно TNМ-классификации, опухоли определяют:T — первичная опухоль:
Тх — недостаточно данных для оценки первичной опухоли либо
опухолевые клетки обнаружены только в мокроте или промывных
водах бронхов, но не выявлена бронхоскопией и/или другими
методами
Т0 — первичная опухоль не определяется
Тis — неинвазивный рак (carcinoma in situ)
Tl — опухоль до 3 см в наибольшем измерении, окружённая лёгочной
тканью или висцеральной плеврой без прорастания проксимальнее
долевого бронха при бронхоскопии (главный бронх не поражён)
Т2 — опухоль более 3 см в наибольшем измерении или опухоль
любого размера, прорастающая висцеральную плевру, или
сопровождающаяся ателектазом, или обструктивной пневмонией,
распространяющаяся на корень лёгкого, но не захватывающая всё
лёгкое; По данным бронхоскопии, проксимальный край опухоли
располагается не менее 2 см от карины.
ТЗ — опухоль любого размера, переходящая на грудную стенку (в том
числе опухоль верхней борозды), диафрагму, медиастинальную
плевру, перикард; опухоль, не доходящая до карины менее чем на
2 см, но без вовлечения карины, или опухоль с сопутствующим
ателектазом или обструктивной пневмонией всего лёгкого.
Т4 — опухоль любого размера непосредственно переходящая на
средостение, сердце, крупные сосуды, трахею, пищевод, тела
позвонков, карину (отдельные опухолевые узлы в той же доле или
опухоль со злокачественным плевральным выпотом)
10.
N — регионарные лимфатические узлыNx — недостаточно данных для оценки состояния регионарных
лимфатических узлов
N0 — нет признаков метастатического поражения регионарных
лимфатических узлов
N1 — имеется поражение перибронхиальных и/или лимфатических
узлов корня лёгкого на стороне поражения, включая
непосредственное распространение опухоли на лимфатические узлы.
N2 — имеется поражение лимфатических узлов средостения на
стороне поражения или бифуркационных лимфатических узлов.
N3 — поражение лимфатических узлов средостения или корня
лёгкого на противоположной стороне: прескаленных или
надключичных узлов на стороне поражения или на противоположной
стороне
М — отдалённые метастазы
Мх — недостаточно данных для определения отдалённых метастазов
М0 — нет признаков отдалённых метастазов
M1 — имеются признаки отдалённых метастазов, включая отдельные
опухолевые узлы в другой доле
М1а-интраторакальные метастазы, отдельные опухолевые узлы в
контралатеральном, противоположном лёгком. Опухоль большого
размера, но локализованная в органах грудной полости.
М1в-экстраторакальные метастазы, метастатические опухоли за
пределами грудно
11.
G — гистопатологическая градацияGx — степень дифференцировки клеток не
может быть оценена
G1 — высокая степень дифференцировки
G2 — умеренная степень дифференцировки
G3 — низкодифференцированная опухоль
G4 — недифференцированная опухоль
12.
Гистологическая классификация рака лёгкогоЧастота гистологических типов злокачественных опухолей
лёгкого[29]Гистологический типЧастота (в %)Немелкоклеточный
рак лёгкого80.4Мелкоклеточный рак
лёгкого16.8Карциноид[30]0.8Саркома[31]0.1Неуточнённая
злокачественная опухоль
лёгкого1.9Согласно гистологической классификации рак
лёгкого подразделяется на следующие виды:
I. Плоскоклеточный (эпидермоидный) рак
а) высокодифференцированный
б) умеренно дифференцированный
в) малодифференцированный
Мелкоклеточная карцинома лёгкого.
II. Мелкоклеточный рак
а) овсяноклеточный, веретёноклеточный
б) плеоморфный
III. Аденокарцинома
а) высокодифференцированная
б) умеренно-дифференцированная
в) малодифференцированная
г) бронхоальвеолярная
13.
IV. Крупноклеточный рака) гигантоклеточный
б) светлоклеточный
V. Смешанный рак
плоскоклеточный и аденокарцинома
аденокарцинома и мелкоклеточный и т. д.
Гистологическая характеристика рака лёгкого
достаточно условна, поскольку клиническое течение
может сильно различаться даже для опухолей с
одинаковой структурой. Медленнее всего растёт
дифференцированный плоскоклеточный рак; для
недифференцированного рака характерно быстрое
течение с обширным метастазированием.
Мелкоклеточный рак лёгкого принадлежит к числу
самых злокачественных опухолей. Он отличается
коротким анамнезом, скрытым и быстрым протеканием,
ранним метастазированием, плохим прогнозом.
14.
Метастазирование[Рак лёгкого метастазирует тремя путями: лимфогенным,
гематогенным и имплантационным.
Наиболее характерен первый путь — в расположенные рядом
пульмональные, бронхопульмональные, бифуркационные,
трахеобронхиальные, паратрахеальные, околопищеводные
(параэзофагеальные) лимфатические узлы. На первом этапе
лимфогенного метастазирования поражаются лёгочные
лимфатические узлы у места деления долевого бронха на
сегментарные. Далее процесс распространяется на
бронхопульмональные лимфоузлы вдоль долевых бронхов. На
третьем этапе метастазы возникают в корневых лимфоузлах
вдоль главного бронха и сосудов корня лёгкого, верхних и
нижних трахеобронхиальных лимфоузлах и лимфоузлах у
нижней стенки непарной вены. На четвёртом этапе в процесс
вовлекаются паратрахеальные, ретрокавальные,
предаортокаротидные, перикардиальные, параэзофагеальные
лимфоузлы. На пятом — над/подключичные лимфатические
узлы.
Гематогенное метастазирование присоединяется при
прорастании опухолью кровеносных сосудов — в печень,
лёгкие, почки, кость, головной мозг и надпочечники.
При прорастании плевры возможен перенос опухолевых
клеток по плевре.
15.
Клиническая картинаКлинические проявления рака лёгкого существенно
зависят от локализации первичного опухолевого узла.
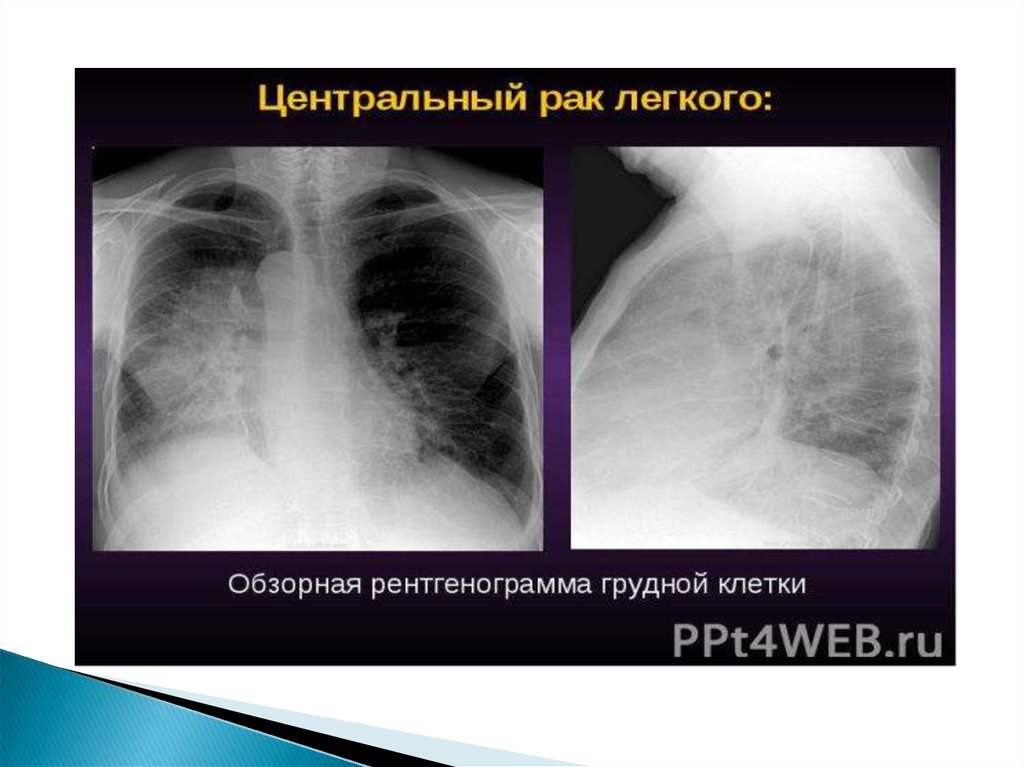
Центральный рак лёгкого. Опухоль, происходящая из
слизистой оболочки крупного бронха, проявляет себя
довольно рано. При своём росте она раздражает
слизистую оболочку бронха, вызывает нарушение
бронхиальной проходимости и вентиляции сегмента,
доли или всего лёгкого в виде гиповентиляции
и ателектаза. В дальнейшем прорастая нервные стволы
и плевру, опухоль вызывает болевой синдром и
нарушение иннервации соответствующего нерва
(диафрагмального, возвратного или блуждающего), а
также картину вовлечения плевры в опухолевый
процесс. Присоединяющееся метастазирование
приводит к появлению вторичных симптомов со
стороны поражённых органов и систем.
16.
Когда опухоль прорастает в бронх, появляется кашель,вначале сухой, затем со светлой мокротой, иногда с примесью
крови. Возникает гиповентиляция сегмента лёгкого и затем
его ателектаз. Мокрота становится гнойной, что
сопровождается повышением температуры тела, общим
недомоганием, одышкой. Присоединяется раковая пневмония,
которая сравнительно легко излечивается, но часто
рецидивирует. К раковой пневмонии может присоединиться
раковый плеврит, сопровождающийся болевым синдромом.
Если опухоль прорастает возвратный нерв, присоединяется
осиплость ввиду паралича голосовых мышц. Поражение
диафрагмального нерва вызывает паралич диафрагмы.
Прорастание перикарда проявляется болями в области
сердца.
Поражение опухолью или её метастазами верхней полой вены
вызывает нарушение оттока крови и лимфы из верхней
половины туловища, верхних конечностей, головы и шеи.
Лицо больного становится одутловатым, с цианотичным
оттенком, набухают вены на шее, руках, грудной клетке.
17.
Периферический рак лёгкого. Периферическая опухоль в начальнойстадии протекает бессимптомно ввиду отсутствия болевых окончаний
в лёгочной ткани. В дальнейшем опухолевый узел увеличивается,
прорастает бронхи, плевру и соседние органы; впоследствии в
центре опухоли могут возникнуть распад и кровотечение.
При раке лёгкого могут наблюдаться следующие местные симптомы:
кашель, выделение крови с мокротой, осиплость голоса, синдром
сдавливания опухолью верхней полой вены и смещения средостения,
симптомы прорастания опухолью соседних органов. Особенно
характерной клинической картиной, в связи с локализацией,
проявляется рак верхушки лёгкого с синдромом Панкоста.
При раковом плеврите присоединяется синдром сдавливания лёгкого
экссудатом.
К общим симптомам относятся общее ухудшение состояния
организма, характерное для развития злокачественных опухолей:
интоксикация, одышка, слабость, потеря веса, повышение
температуры тела. Для рака лёгкого добавляются также нарушение
обмена кальция, дерматит и деформация пальцев по типу
«барабанных палочек».
В запущенных стадиях присоединяются симптомы метастатического
поражения жизненно важных органов, а также присоединяющиеся к
опухолевому росту процессы распада опухоли и лёгочной ткани,
бронхиальной непроходимости, ателектазы, тяжёлые лёгочные
кровотечения.
18.
ДиагностикаКлиническое обследование
При клиническом обследовании определяют
внешнюю симптоматику развития рака лёгкого:
Первичные ранние симптомы (кашель,
кровохарканье, одышка и боль в груди)
Вторичные, более поздние симптомы,
обусловленные осложнениями при развитии
опухоли (воспалительные процессы,
прорастание соседних органов, метастазы)
Общие симптомы, характерные для влияния
злокачественных опухолей на организм (общая
слабость, утомляемость, снижение
работоспособности и т. д.)
19.
Рентгенологическая диагностикаРентгенологическое исследование является одним из
основных методов диагностики опухолей лёгкого и позволяет
своевременно обнаружить его у 80 % больных. В качестве
скринингового метода используется флюорография, которая
обычно проводится во время профилактических медосмотров.
При выявлении изменений (солитарный лёгочный
узел, ателектаз и т. д.) на флюорограмме или при наличии
клинических показаний применяют рентгенографию в двух
проекциях и компьютерную томографию. Кроме того,
компьютерная томография является наиболее информативным
методом диагностики метастазов в других органах.
Бронхоскопия[править | править вики-текст]
Бронхоскопия позволяет визуально исследовать трахею,
главные, долевые, сегментарные, субсегментарные бронхи и,
в некоторых случаях, бронхи 6-го, 7-го и более порядков.
При этом можно непосредственно увидеть опухоль и
осуществить её биопсию. Бронхоскопия считается
обязательной при подозрении на рак лёгкого.
20.
Трансторакальная биопсияТрансторакальная пункционная биопсия
применяется при невозможности проведения
других методов (бронхоскопия, катетеризация
бронхов, анализ мокроты). Показаниями к её
проведению являются:
округлое образование в любой зоне лёгкого
подозрение на метастаз в лёгком опухоли с другой
локализацией
множественные внутрилёгочные шаровидные тени
При трансторакальной пункции проводят прокол
грудной клетки, отбирают пробу непосредственно
из опухоли и исследуют клетки под микроскопом.
Такой метод диагностики позволяет подтвердить
диагноз у значительного числа больных (62-87 %
случаев в зависимости от локализации опухоли).
Наиболее частым осложнением (до 50 %) данной
процедуры является закрытый пневмоторакс,
требующий дренирования плевральной полости.
21.
Ультразвуковая диагностикаУльтразвуковое исследование является эффективным методом
выявления врастания злокачественной опухоли в структуры
стенки, масштабного затемнения лёгочной ткани (из-за её
уплотнения, плеврального выпота и др.), а через ткань
безвоздушного лёгкого получается увидеть непосредственно
опухолевый узел.
Такая диагностика является безопасной, простой и
сравнительно недорогой. Она позволяет определить
опухолевое поражение органов средостения: верхней полой
вены, перикарда и камер сердца, правой и левой лёгочных
артерий, лёгочных вен, аорты, пищевода, левого предсердия,
а также степень применимости хирургического лечения
опухоли.
Опухолевые маркеры
Изученные на текущий момент маркёры рака лёгкого не
показывают достоверной специфичности. Прогностическое
значение многих из них спорно и, главным образом, отражает
различия в методологии исследований, группах пациентов и
интерпретациях. Для мелкоклеточного рака лёгкого
предпочтительным опухолевым маркёром является нейронспецифическая энолаза (NSE), для немелкоклеточных
вариантов неоплазий специфического маркёра не найдено.
22.
Маркёры лёгочных карцином делятся на 2 группы —циркулирующие (серологические)
и тканевые (тиссюнальные). Большинство
циркулирующих маркёров не имеет никакого
прогностического или предиктивного значения.
Напротив, тканевые маркёры могут отражать генотип
опухоли и объединённые с другими характеристиками
(возраст, пол, раса, потеря веса, статус выполнения,
сопутствующие болезни, социально-бытовые факторы)
способны влиять на выбор режима лечения.
Циркулирующие маркёры для мелкоклеточных опухолей
включают раковоэмбриональный
антиген (CEA), мелкоклеточную
карциному и цитокератины (в том числе CYFRA 211), антиген тканевого полипептида (TPA), Ca 15-3, для
немелкоклеточных опухолей — NSE и хромогранин
A (CgA). Наиболее популярное клиническое
использование циркулирующих опухолевых маркёров
рака лёгкого заключается в мониторинге
заболевания. CgA, наряду с контролем течения
заболевания в процессе лечения, может быть полезен
для прогноза вероятности рецидива[32].
23.
Циркулирующие маркёры для мелкоклеточныхкарцином представляют более обширную группу и
их специфичность и прогностическое значение
намного выше. EA и Cyfra 21-1 являются самыми
чувствительными маркёрами для
немелкоклеточных неоплазий. Серологический
уровень Cyfra 21-1 наиболее высок для
плоскоклеточного рака, метастатической стадии
рака лёгкого и неудовлетворительного статуса
выполнения.
Тканевые опухолевые биомаркёры потенциально
используются для изменения режимов терапии
больных с немелкоклеточным раком лёгкого.
Наряду с другими факторами они являются важным
элементом персонифицированного лечения. Для
немелкоклеточного рака биомаркёров с
достоверным предиктивным или прогностическим
значением не найдено[32].
24.
KRAS мутации, как правило, ассоциируются снегативным прогнозом. Прогностическое
значение ERCC1 (Excision repair cross-complementing-1)
спорно, но International Adjuvant Lung Trial (IALT)
показала удлиненный период выживаемости больных
с ERCC1-негативными опухолями после адъювантной
химиотерапии.
Прогностической ценностью обладают сигнатуры
экспрессии определённых генов, хотя сообщенные
данные чрезвычайно гетерогенны. Наиболее
цитируемые из них включают сигнатуру из 5 генов —
DUSP6 (биспецифичная фосфатаза
6), MMD (дифференцирование моноцитов в макрофагиассоциированный протеин), STAT1 (сигнальный
трансдуктор и активатор транскрипции 1), ERBB3 (v-erb
b2 гомолог онкогена птичьего эритробластного лейкоза
3) и LCK (тирозинкиназа лимфоцит специфического
протеина) в самых достоверных прогностических генах
в хирургически резецированном немелкоклеточном
раке лёгкого.[32]
25.
Паттерн экспрессии BRAC1 генов, видимо,предсказывает выживаемость на резецированной
стадии I. Соматические активирующие мутации
в EGFR тирозинкиназных доменах (экзоны 18-21)
являются важной молекулярной детерминантой
клинического ответа на лечение с
тирозинкиназными ингиторами, Гефитинибом или
Ерлотинибом.
RRM1 представляет молекулярную мишень
гемцитабина и является компонентом
рибонуклеотид-редуктазы, необходимой для
продукции дезоксинуклеотидов.
Уровни RRM1 протеина в опухолевых образцах
предсказывают клинический ответ на терапию
больных немелкоклеточным раком лёгкого на
поздних стадиях и леченных с гемцитабином[32].
26.
Оценка мутационного статуса рецептораэпидермального фактора роста (EGFR)
В случае метастатического немелкоклеточного
рака лёгкого при выявлении мутации EGFR
эффективность таргетной терапии на основе
ингибиторов EGFR существенно возрастает. До
назначения препаратов (гефитиниб, эрлотиниб)
проводится молекулярно-генетическая
диагностика с целью выявления мутации
рецептора. В 2012—2013 годах в России
действовала Программа молекулярногенетической диагностики российского
Общества онкологов-химиотерапевтов, в
рамках которой тесты на мутацию выполнялись
всем пациентам бесплатно[33].
27.
Лечение[Хирургическое лечение
Хирургическое вмешательство подразделяется на:
радикальное
условно-радикальное
паллиативное
При радикальной операции удалению подвергается весь
опухолевый комплекс: первичный очаг, регионарные
лимфатические узлы, клетчатка с путями метастазирования.
Наиболее часто проводятся операции в объёме лобэктомии
(удаление одной доли лёгкого), билобэктомии только для
правого лёгкого (резекция двух долей лёгкого),
пульмонэктомии - удаление лёгкого целиком. Расширенные и
комбинированные пульмонэктомии - полное удаление
лёгкого с резекцией лимфатических узлов разных групп и
удалением соседних органов, проросших опухолью,
соответственно. На 1 и 2 стадиях выполняются лобэктомия. На
3А стадии обычно выполняют пульмонэктомию. К условнорадикальной операции добавляют лучевую и лекарственную
терапию. Следует учитывать также и то, что часть первичной
опухолевой ткани и метастазы иногда не могут быть
хирургически удалены ввиду угрозы кровотечения или
процессов распада в ателектазе.
28.
Противопоказаниями к радикальной операции являются:нерезектабельность — распространение опухоли на
соседние ткани и органы, при котором технически
невозможно радикально удалить опухоль.
нецелесообразность ввиду наличия отдалённых
метастазов.
недостаточность функций сердечно-сосудистой и
дыхательной систем
декомпенсированные заболевания внутренних органов
Хирургическому удалению опухоли часто сопутствует
широкое удаление корневых, трахеобронхиальных
лимфоузлов, клетчатки и лимфоузлов средостения,
резекция грудной стенки, перикарда, диафрагмы,
бифуркации трахеи, предсердия, магистральных
сосудов (аорты, верхней полой вены), мышечной стенки
пищевода и других тканей, проросших опухолью.
29.
Лучевая терапияЛучевое лечение рака лёгкого проводится в послеоперационный
период на ложе опухоли и пути регионального лимфотока. При
неоперабельных формах рака, в случае отказа больного от
оперативного лечения или при наличии серьёзных противопоказаний
к оперативному вмешательству лучевая терапия может проводиться
как самостоятельный метод лечения.
Лучевая терапия применяется как для радикального, так и
паллиативного лечения. При радикальном лучевом лечении
облучению подвергают как саму опухоль, так и зоны регионального
метастазирования, то есть корень лёгкого, средостение, зоны
регионального лимфотока общей дозой 50-70 Гр.
В последние время возможности лучевой терапии расширились с
использованием стереотаксической лучевой терапии тела с
синхронизацией с дыханием пациента. Такими возможностями
обладают некоторые современные медицинские
ускорители и КиберНож. При таком подходе достигаемая точность
облучения составляет порядка одного-трёх миллиметров, что
позволяет подводить на очаг абляционные дозы излучения, но не
требует хирургического доступа и анестезии. Этот метод облучения
наиболее востребован при единичных метастазах в лёгкое и при
неоперабельном первичном раке лёгкого.
30.
Химиотерапия[При немелкоклеточном раке лёгкого химиотерапия
проводится при наличии противопоказаний к хирургическому
и лучевому лечению. При этом назначаются следующие
препараты: доксорубицин, цисплатин, винкристин, этопозид,
циклофосфамид, метотрексат, блеомицин, нитрозомочевина,
винорелбин, паклитаксел, доцетаксел, гемцитабин и др.,
применяемые курсами с интервалами в 3-4 недели (до 6-7
курсов).
При мелкоклеточном раке лёгкого химиотерапия в составе
комплекса с лучевой терапией является наиболее
эффективным лечением. Препараты те же, что и при
немелкоклеточном раке лёгкого.
Противопоказание к химиотерапии РЛ: тяжелое состояние
пациента.
Частичное уменьшение размеров первичной опухоли и
метастазов наблюдается не у всех больных, полное
исчезновение злокачественного новообразования происходит
редко. Химиотерапия при отдалённых метастазах не
приводит к излечению (паллиативная химиотерапия), она
только снижает тяжесть проявлений заболевания, и
незначительно увеличивает продолжительность жизни.
31.
К методам лечение рака лёгкого такжеотносятся
Фотодинамическая терапия
Химиоэмболизация
Радиоэмболизация
Брахитерапия
Криодеструкция
Лазерная коагуляция
Радиочастотная абляция
Биотерапия
Иммунотерапия
Таргетная терапия
32.
Паллиативное лечениеПаллиативное лечение рака лёгкого применяется в том случае, когда
возможности противоопухолевого лечения ограничены или
исчерпаны. Такое лечение направлено на улучшение качества жизни
(уменьшение выраженности симптомов) и увеличение
продолжительности жизни неизлечимых больных и включает в себя:
обезболивание
кислородотерапию
симптоматическую терапию
психологическую помощь
переливание крови
борьба с анемией
детоксикацию
паллиативную лучевую терапию
паллиативное хирургическое вмешательство
(трахеостомия, гастростомия, энтеростомия, нефростомия и т. д.)
Паллиативная помощь при раке лёгкого применяется для борьбы с
одышкой, кашлем, кровохарканьем, болевыми ощущениями.
Проводится лечение присоединяющихся к опухолевому процессу
пневмонии и пневмонита, возникающих при лучевой и
химиотерапии.
Методы паллиативного лечения во многом индивидуальны и зависят
от состояния больного.
33.
ПрогнозВ случае нелеченного рака лёгкого умирают
87 % больных в течение 2 лет с момента
установления диагноза. При использовании
хирургического метода можно достичь 30%-й
выживаемости больных в течение 5
лет.[источник не указан 1098 дней] Раннее обнаружение
опухоли позволяет повысить шансы на
излечение: на стадии T1N0M0она достигает
80 %. Совместное проведение хирургического,
лучевого и медикаментозного лечения
позволяет поднять 5-летнюю выживаемость
ещё на 40 %.[источник не указан 1098 дней] Наличие
метастазов значительно ухудшает прогноз.
34.
35.
36.
37.
38.
Рак моло́чной железы́ — злокачественнаяопухоль железистой ткани молочной железы. В
мире это наиболее частая форма рака
среди женщин, поражающая в течение жизни
от 1/13 до 1/9 женщин в возрасте от 13 до 90
лет. Это также второе по частоте после рака
лёгких онкологическое заболевание в
популяции в целом (считая и мужское
население; поскольку молочная железа состоит
из одинаковых тканей у мужчин и женщин, рак
молочной железы (РМЖ) иногда встречается и у
мужчин, но случаи этого вида рака у мужчин
составляют менее 1 % от общего количества
больных данным заболеванием).
39.
По оценкам экспертов ВОЗ, в мире ежегоднорегистрируют от 800 тыс. до 1 млн новых
случаев заболевания раком молочной железы[1].
По числу смертей от рака у женщин эта
разновидность рака занимает второе место.
Наиболее высока заболеваемость
в США и Западной Европе; в России в 2005
году было выявлено 49 548 новых случаев
заболевания (19,8 % всех видов опухолей у
женщин), а число умерших составило 22 830[2].
В 2010 году рак молочной железы занимал 1-е
место как в структуре заболеваемости женского
населения России злокачественными
новообразованиями (20,5 %), так и в структуре
смертности от таких заболеваний (17,2 %); при
этом число впервые выявленных случаев рака
молочной железы выросло до 57 241
40.
За резкое увеличение количества случаев ракамолочной железы в развитых странах после 1970-х
годов считают частично ответственным
изменившийся стиль жизни населения этих стран (в
частности то, что в семьях стало меньше детей и
сроки грудного вскармливания сократились)[3]. Во
многом наблюдающееся в последнее время в
развитых странах возрастание числа
онкологических больных связано также с
обогащением популяции всё более пожилыми
людьми. При этом риск развития рака молочной
железы в возрасте после 65 лет в 5,8 раз выше, чем
до 65 лет, и почти в 150 раз выше, чем в возрасте
до 30 лет[4].
Рак молочной железы — многофакторное
заболевание, развитие которого связано с
изменением генома клетки под воздействием
внешних причин и гормонов[5].
41.
Этиология и факторы рискаВопросы этиологии рака молочной железы в настоящее время
исследованы недостаточно. В отличие от рака лёгкого или рака
мочевого пузыря, ни один из канцерогенов окружающей среды не
удаётся убедительно связать с провокацией рака молочной железы[4].
Согласно исследованию учёных из Университета Тафтса, риск
развития рака молочной железы повышает бисфенол А (BPA),
содержащийся в пищевом пластике. [6].
В ряде случаев рак молочной железы предстаёт как
классическое наследственное заболевание. Наиболее выраженными
генетическими факторами предрасположенности к раку молочной
железы исследователи считают геныBRCA1[en] (№ NM_007294 в базе
данных GenBank) и BRCA2[en] (№ NM_007294 в GenBank); вклад
наследственных мутаций в этих генах в частоту наследственный
заболеваний раком молочной железы — около 20 %. Подобную роль
играют и гены ATM, TP53 (ген белка p53), PTEN[7].
В настоящее время исследована экспрессия различных генов в
опухолях молочной железы и выделены различные молекулярные
типы опухоли. Клинически, они имеют существенно различный риск
развития метастазов и требуют различной терапии. Коллекция
данных[8] по экспрессии 17 816 генов в опухолях молочной железы
доступна онлайн[9] и используется не только для медикобиологических исследований, но и как ставший классическим
тестовый пример для визуализации и картографии данных.
42.
Основные факторы рискаФакторы риска развития рака молочной железы[10]:
отсутствие в анамнезе беременностей и родов;
курение (особенно, если оно начато в юном возрасте);
раннее менархе (до 12 лет);
поздняя менопауза (после 55 лет);
отягощенный семейный анамнез (онкозаболевания у
кровных родственников);
больные, леченные по поводу рака женских половых
органов;
ожирение[11];
сахарный диабет;
гипертоническая болезнь;
злоупотребление алкоголем;
употребление экзогенных гормонов — при
непрерывном употреблении экзогенных гормонов с
целью контрацепции или лечения — более 10 лет.
43.
Попрошу заметить, что от переохлаждения, ли любого другого видаохлаждения об онкологических заболеваниях молочной железы речи
быть не может.
По результатам недавних исследований Калифорнийского
университета в Беркли (University of California-Berkeley) 239 женщин,
удалось выявить дополнительный фактор риска рака молочной
железы, которым оказался вирус лейкоза коров (BLV) (англ.)русск..
Исследователями допускается, что наличие в организме человека
этого вируса связано с риском рака молочной железы больше, чем
традиционные факторы риска: ожирение, употребление алкоголя и
прием гормональных препаратов в постменопаузе. На данный
момент доказана лишь связь между раком молочной железы и
присутствием BLV в организме. Является ли вирус причиной развития
опухоли, неизвестно.[12][13]
В исследованиях института Гарвана в Австралии обнаружено, что
развитию метастазов опухоли молочной железы и прогрессированию
рака способствует белок ELF5 (англ.)русск..[14]
Симптомы рака молочной железы на ранних стадиях заболевания
могут отсутствовать или характеризоваться появлением в молочной
железе небольших малочувствительных подвижных масс. Рост
опухоли сопровождается нарушением её подвижности, фиксацией,
розоватыми или оранжевыми выделениями из соска.
44.
Классификация TNMТ – первичная опухоль:
ТХ – первичная опухоль недоступна оценке;
Т0 – нет признаков первичной опухоли;
Tis – рак in situ:
Тis (DCIS) – протоковая карцинома in situ;
Тis (LCIS) – дольковая карцинома in situ;
Тis (Paget) – болезнь Педжета соска, не связанная с
инвазивной карциномой в подлежащей паренхиме
молочной.
Т1 – опухоль до 2 см.
Т2 – опухоль от 2 см до 5 см.
Т3 – опухоль более 5 см;
Т4 – опухоль любого размера с распространением
на грудную стенку, кожу (изъязвление или узелки
на коже)
45.
N – регионарные лимфатические узлы:NХ – регионарные лимфатические узлы не могут быть
оценены.
N0 – нет метастазов в регионарных лимфатических
узлах;
N1 – метастазы в подмышечных лимфатических узлах I,
II уровня не спаянные между собой
N2 –а) метастазы в подмышечных лимфатических узлах
I, II уровня спаянные между собой; b) клинически
определяемый внутренний маммарный лимфатический
узел при отсутствии клинических признаков метастазов
в подмышечных лимфатических узлах;
N3 – а) метастазы в подключичных лимфатических узлах
III уровня; b) метастазы во внутренних маммарных и
подмышечных лимфатических узлах; метастазы в
надключичных лимфатических узлах.
М – отдаленные метастазы:
М0 – отдаленные метастазы не определяются;
М1 – имеются отдаленные метастазы.
46.
Гистологические типы РМЖВ гистологическом плане среди раковых опухолей молочной железы
выделяют следующие типы[15]:
Внутрипротоковый рак in situ
Дольковый рак in situ
Инвазивный протоковый рак
Инвазивный дольковый рак
Рак молочной железы с признаками воспаления
Тубулярная карцинома
Медуллярный рак
Коллоидный рак (слизистый рак, перстневидно-клеточный рак)
Папиллярный рак
Метапластический рак (плоскоклеточный рак)
Рак с остеокластоподобными клетками
Аденоид-кистозный рак
Секреторная карцинома (ювенильный рак)
Кистозная гипертсекреторная карцинома
Апокринный рак
Рак с признаками эндокринного новообразования (первичная
карциноидная опухоль, апудома)
Криброзный рак
47.
Молекулярная таксономия РМЖВ последние годы развивается молекулярная таксономия рака
молочной железы, позволившая выделить в рамках данного
заболевания четыре основных молекулярных подтипа. Эти подтипы
отличаются друг от друга характерными наборами молекулярных
маркеров и фактически представляют собой разные болезни — с
различной этиологией, молекулярным патогенезом и прогнозом,
требующие специфических терапевтических подходов. Указанные
подтипы опухолей различаются, во-первых, тем,
какие цитокератины в них экспрессируются (базальные или
люминальные), а во-вторых — наличием или
отсутствием амплификации гена HER2. Приведём перечень этих
подтипов (указывая в скобках частоту, с которой они встречаются)[16]:
Люминальный подтип A (30—45 %): эстроген-зависимые
малоагрессивные опухоли, избытка экспрессии рецепторов
белка HER2 нет, наилучший прогноз;
Люминальный подтип B (14—18 %): эстроген-зависимые агрессивные
опухоли, выражена амплификация онкогена HER2, значительно
худший прогноз;
HER2-позитивный подтип (8—15 %): эстроген-независимые
агрессивные опухоли, выражена амплификация онкогена HER2,
повышенная вероятность негативного исхода заболевания;
"Triple negative" подтип (27—39 %): эстроген-независимые
агрессивные опухоли, избытка экспрессии рецепторов
белка HER2 нет, наихудшие показатели выживаемости.
48.
СимптомыРак молочной железы на ранних стадиях (1-й и 2-й) протекает
бессимптомно и не причиняет боли. Могут иметь место очень
болезненные месячные, боли в молочных железах при мастопатии.
Обычно рак молочной железы обнаруживают до явного появления
непосредственных симптомов опухоли — либо на маммографии,
либо женщина чувствует появление уплотнения в груди. Любое
новообразование необходимо пунктировать для выявления раковых
клеток. Наиболее точная диагностика происходит по результатам
трепан-биопсии под контролем УЗИ. Много случаев диагностики
болезни лишь на 3-й и 4-й стадиях, когда опухоль уже видна
невооружённым глазом, имеет вид язвы или большой шишки. Может
появиться не исчезающее в течение менструального цикла
уплотнение в подмышечной ямке или над ключицей: эти симптомы
свидетельствуют о поражении лимфоузлов, т.е. метастазах в
лимфоузлы, явно выражающихся уже на поздних стадиях. Болевой
синдром связан с прорастанием опухоли в грудную стенку.
Прочие симптомы поздних (III-IV) стадий :
Прозрачные или кровянистые выделения из груди
Втяжение соска в связи с прорастанием опухоли в кожу
Изменение цвета или структуры кожи груди в связи с прорастанием
опухоли в кожу.
49.
ДиагностикаРегулярное посещение врача-маммолога — специалиста в
области заболеваний молочных желез (не реже одного раза в
1—2 года). Всем женщинам старше 20 лет ранее
рекомендовалось ежемесячно проводить самостоятельное
обследование молочной железы. Женщинам старше 40—50
лет необходимо каждые 1—2 года (даже при отсутствии
жалоб) проводить маммографические обследования[17][18].
Женщинам любого возраста с выявленными заболеваниями
молочных желёз показана маммография с целью
дифференциальной диагностики с использованием
ультразвуковых, патоморфологических методик, в том числе
интервенционной радиологии.
Самостоятельное обследование молочных желёз
Основная статья: самостоятельное обследование молочной
железы
Согласно мета-анализу, опубликованному в Cochrane
Collaboration, два больших исследования, проведённые в
России и Китае, не выявили положительного эффекта при
самостоятельном обследовании молочных желез с целью
ранней диагностики рака молочной железы. Результаты
исследований указали на возможность повышенного риска в
связи с увеличением количества биопсий молочной железы[19].
50.
Сигналы тревогиСигналы тревоги рака молочной железы:
наличие уплотнений или опухолевидных
образований в одной или обеих молочных
железах;
выделения из соска любого характера, не
связанные с беременностью или лактацией;
эрозии, корочки, чешуйки, изъязвления в
области соска, ареолы;
беспричинно возникающая деформация, отек,
увеличение или уменьшение размеров
молочной железы;
увеличение подмышечных или надключичных
лимфоузлов.
51.
Выявление врачом хотя бы одного из указанных «сигналов тревоги» требуетсрочного (в молодом возрасте от 1-й до 4-й стадии может пройти всего
несколько месяцев) направления больной к онкологу-маммологу терапевтом
или маммологом в онкологический диспансер, где должны быть проведены
УЗИ и пункция. Затем по результатам назначается либо операция с
последующей химиотерапией, либо сначала химиотерапия с последующей
операцией. Велик процент невнимательного (или задерживающего) отношения
медицинского персонала на районном уровне к новообразованиям, в
результате чего злокачественная опухоль диагностируется на поздних (3-4
стадиях). От времени обращения до дня УЗИ может пройти месяц, а это
недопустимо. Не стоит полагаться на то, что опухоль может быть
доброкачественной. Быстрое обследование в медицинском учреждении
поможет сохранить жизнь. Скрининг рака молочной железы проводится при
физикальном обследовании молочной железы врачом любой специальности
ежегодно, а также ежемесячного самообследования молочных желез.
Маммография проводится женщинам от 35 до 50 лет раз в 2 года (при
отягощённом личном и семейном анамнезе — 1 раз в год), женщинам после 50
лет — ежегодно. Профилактика рака молочной железы заключается в
устранении факторов, способствующих его развитию, а также в оптимальной
диспансеризации женщин с гиперпластическими процессами и своевременном
адекватном их лечении, включая оперативные методы. Диагностика данного
заболевания должна быть комплексная. Методами исследования
являются: УЗИ молочных желез, пункция новообразования и трепан-биопсия
под контролем УЗИ, МРТ, маммография, термомаммография - устаревший
метод. Велика роль анализа крови на онкомаркер. Для установления типа
опухоли делают гистологическое исследование тканей.
52.
Дифференциальная диагностика1.Дисгормональные заболевания
Мастодиния (основные отличия: выраженный
болевой синдром, невроз, связь с
предменструальным периодом, чаще
поражаются обе молочные железы у
нерожавших).
Мастопатия
Гинекомастия
2. Доброкачественные опухоли
Фиброаденома
Липома
Внутрипротоковая папиллома (наблюдаются
кровянистые или обильные серозные
выделения из одного протока)
3. Острый гнойный мастит
53.
Принципы леченияК основным методам лечения рака молочной железы
относятся: хирургическое лечение, лучевая
терапия, химиотерапия, иммунотерапия, таргетная терапия[20].
Хирургическое лечение остаётся ведущим методом лечения
рака молочной железы (остальные методы лечения, как
правило, применимы при локализованном процессе). В
большинстве случаев выполняется мастэктомия —
хирургическое удаление всей молочной железы (весьма
часто — наряду с окружающими тканями); профилактическая
мастэктомия показана пациенткам, у которых
диагностированы мутации в BRCA1 и BRCA2[21]. В последнее
время при малом размере опухоли применяют
также лампэктомию, когда удаляется только опухоль; однако
такая операция остаётся травматичной, ведёт к деформации
молочной железы, а её применимость ограничивается рядом
жёстких требований. Данных недостатков лишён недавно
разработанный метод криомаммотомии, при котором через
небольшой надрез кожи к опухоли подводят криозонд с
температурой наконечника минус 100—120 °C; при этом
опухоль замораживается и превращается в примёрзший к
криозонду «ледяной шарик», который удаляется из надреза
вместе с криозондом[22][23].
54.
Лучевая терапия обычно применяется как дополнение (адъювантная терапия) кхирургическому лечению и осуществляется после проведения мастэктомии или
лампэктомии с целью уничтожения раковых клеток, которые могут остаться на
месте удалённой опухоли, и снизить риск рецидива заболевания.
Химиотерапия нацелена на подавление клеток опухоли химическими
препаратами, к которым эти клетки особенно чувствительны. Может
применяться до, после и вместо хирургического лечения (когда отсутствуют
показания к хирургическому вмешательству).
Иммунотерапия заключается в стимулировании собственного иммунитета
пациента против клеток опухоли; применяется как дополнение к
химиотерапии.
Таргетная терапия применяется по отношению к пациентам, у которых
опухоль экспрессирует специфический ген HER2. Для такой терапии
применяют трастузумаб[en] — препарат моноклональных антител, способный
блокировать активность гена HER2 в клетках опухоли молочной железы,
замедляя рост данной опухоли. Обычно применяют либо в комбинации с
химиотерапией, либо в виде адъювантной терапии после хирургического
лечения рака молочной железы[24][25]. В последние годы для таргетной
терапии HER2-позитивного рака молочной железы применяют также
препараты лапатиниб, пертузумаб[en], нератиниб[en][26]. Для терапии ER- и HER2
- позитивного рака существует группа препаратов, известных как блокаторы
ферментного пути CDK 4/6. При тройном негативном раке молочной железы
ингибиторы CDK 4/6[27] не в состоянии заморозить рост опухоли, но могут
предотвратить метастазирование раковых клетов в другие части тела,
воздействуя на особый SNAIL-белок, который способствует метастазированию
рака.
55.
Виды оперативных вмешательствОрганосохраняющие операции
Органосохраняющие операции – радикальное удаление
опухоли в пределах здоровой ткани с удовлетворительным
косметическим результатом.
Лампэктомия.
Радикальная секторальная резекция (по Блохину).
Квадрантэктомия с лимфаденэктомией.
Гемимастэктомия с лимфаденэктомией.
Субтотальная резекция с лимфаденэктомией.
Подкожная мастэктомия с лимфаденэктомией.
Радикальные операции[править | править вики-текст]
Радикальная мастэктомия по Маддену.
Радикальная мастэктомия по Пэйти.
Радикальная мастэктомия по Холстеду.
Расширенная радикальная модифицированная мастэктомия.
Расширенная радикальная подмышечно-грудинная
мастэктомия.
Мастэктомия по Пирогову.
Простая мастэктомия
56.
ПрофилактикаПервичная профилактика рака проводится
по следующим направлениям:
Онкогигиеническая профилактика.
Биохимическая профилактика.
Медико-генетическая профилактика.
Иммунобиологическая профилактика.
Эндокринно-возрастная профилактика.
57.
58.
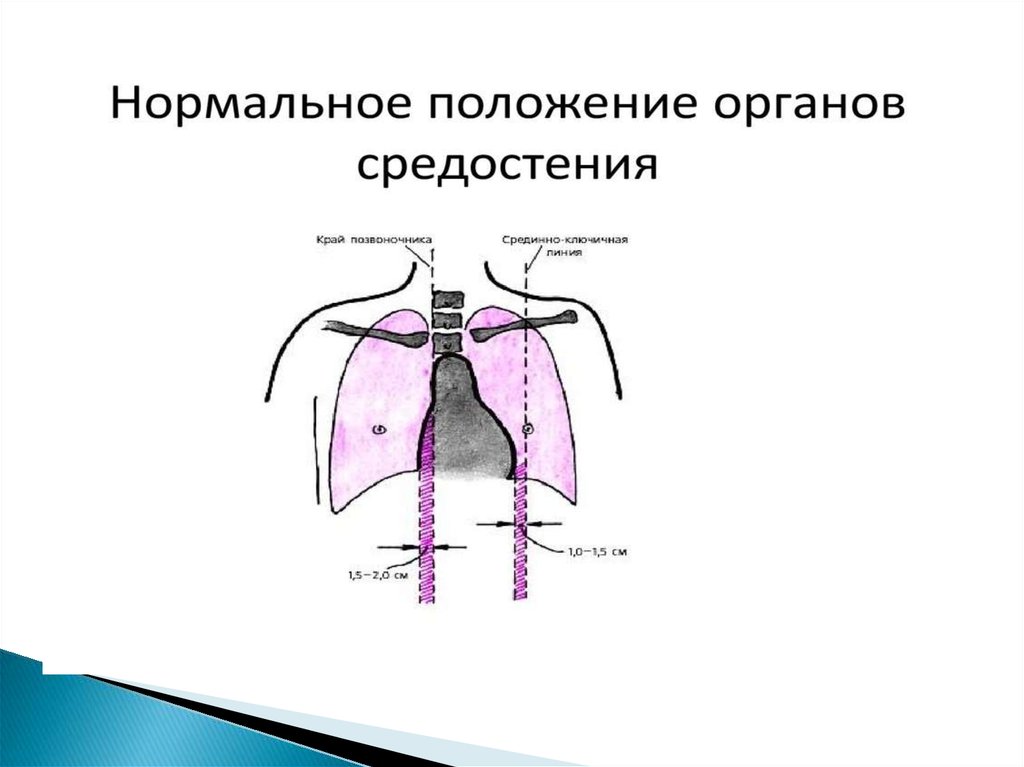
Средостение — анатомическое пространство в среднихотделах грудной полости. Разными авторами предлагаются
различные варианты разделения средостения на отделы в
зависимости от анатомических, патогенетических и диагностических
аспектов. Для оценки распространения опухолей было выбрано
разделение средостения на верхнее и нижнее. Верхнее средостение
включает в себя все анатомические образования, находящиеся
выше верхней границы перикарда. Нижнее средостение, в свою
очередь, подразделяется на передний, средний, и задний отделы.
Границей между передним и средним (центральным) отделами
средостения является вертикальная линия, проведённая от грудинноключичного сочленения к диафрагме. Границей между средним и
задним отделами средостения является линия, параллельная первой,
проходящая по задней поверхности трахеи. Заднее средостение, в
свою очередь, подразделяется на два отдела. Спереди
расположено ретрокардиальное пространство (Гольцкнехта),
ограниченное спереди задней стенкой трахеи, сзади — передней
поверхностью позвоночника. Задний отдел заднего средостения —
паравертебральное пространство — простирается от передней
поверхности позвоночника до задних отделов ребер.
59.
В группу опухолей средостения входят новообразованияразличной структуры и злокачественности, находящиеся
в анатомических пределах средостения и имеющих
внеорганное происхождение. К новообразованиям
заднего средостения относятся лимфомы, тимомы и
метастатические карциномы.
В число объёмных образований переднего средостения
входят тимома, лимфома, феохромоцитома и
дизэмбриогенетические опухоли (тератома и др.).
Объёмные образования переднего средостения имеют
более высокий риск злокачественности, чем объёмные
образования других локализаций.[1][2]
Среди опухолей среднего средостения выделяют
лимфому, метастатическую карциному,
тератодермоидную кисту, бронхогенную кисту и
перикардиальную кисту. Что касается новообразований
заднего средостения, то к таковым относятся
нейрогенные опухоли и лимфомы.
60.
Первичные новообразования средостенияТимомы[
Тимомы наблюдаются в любом возрасте, чаще в 30-40 лет.
Наиболее часто встречающаяся первичная опухоль
средостения (20 %). Различают лимфоидные, эпителиальные,
веретеноклеточные или смешанные тимомы. Злокачественная
форма, отличающаяся высокой инвазивностью в окружающие
ткани, встречается почти так же часто, как и
доброкачественная (35-50 % больных). Характерно
распространение тимомы по плевре, при этом гематогенные и
лимфогенные метастазы редки. Тимома выявляется у 15 %
пациентов с миастенией, при этом миастения выявляется у
50 % пациентов с тимомой. Описаны случаи тимом заднего
средостения.
Герминоклеточные опухоли
Экстрагонадные герминоклеточные опухоли чаще всего
развиваются в тимусе. Гистологически эти опухоли не
отличаются от тестикулярных опухолей — семиномы,
тератомы, эмбриональной карциномы, тератокарциномы,
хориокарциномы. Герминогенные опухоли средостения
встречаются у мужчин 20-30 лет.
61.
Дизэмбриогенетические опухолиТератобластомы встречаются почти столь же часто, как тимомы, и
составляют 11-17 % опухолей средостения. Малигнизация выявляется
в 25-30 % случаев. Тератомы содержат эктодермальные,
мезодермальные и эндодермальные компоненты; дермоидные
кисты — эпидермального происхождения. Заболевание выявляется
чаще всего в подростковом возрасте, в половине случаев опухоль
содержит кальцинаты. Быстрый рост характерен для малигнизации,
хотя также причиной быстрого увеличения объема опухоли может
послужить кровоизлияние в её ткань. Иногда при озлокачествлении
могут наблюдаться метастазы в лёгкие и регионарные метастазы.
Мезенхимальные опухоли
Мезенхимальные опухоли встречаются во всех трех отделах
средостения, однако чаще — в переднем средостении. Липомы и
липоматоз встречаются чаще в нижних отделах с одной из сторон
средостения. Они могут распространяться из средостения в
каудальном или краниальном направлении. С другой стороны,
сальниковый жир может проникать в нижние отделы заднего
средостения. Благодаря своей мягкой консистенции, липомы никак
не воздействуют на окружающие органы и часто оказываются
случайной находкой. Липоматоз может быть ятрогенно обусловлен
кортикостероидной терапией. Липо-(фибро-)саркомы являются
чрезвычайно редкими опухолями, обычно располагаются в заднем
средостении, где могут вызывать смещение прилежащих органов.
62.
Фибромы не вызывают жалоб до тех пор, пока не достигнутзначительных размеров. Наличие плеврального выпота иногда
может быть признаком фибросаркомы (обычно
располагающейся в заднем средостении) и фибромы.
Гемангиомы (кавернозная гемангиома, гемангиоэндотелиома,
гемангиосаркома) — в средостении встречаются редко, в 2/3
случаев локализуются в переднем средостении. Они имеют
разнообразную форму, окружены соединительнотканной
капсулой, могут быть множественными. Часто содержат
флеболиты.
Лимфангиомы (гигромы) — в большинстве своем встречаются
в детском возрасте. Они развиваются из лимфатических
сосудов, разрастаются в разные стороны с образованием
узлов. Могут распространяться до области шеи, вызывать
значительное смещение соседних органов; встречаются
кавернозные и кистозные варианты. Локализуются в нижнепереднем средостении; если не осложнены хилотораксом,
обычно протекают бессимптомно.
63.
Нейрогенные опухолиНаиболее часто встречающающиеся опухоли заднего
средостения, чаще располагаются в верхнем его отделе.
Развиваются из ветвей блуждающего нерва и межрёберных
нервов, симпатического ствола и оболочек спинного мозга;
множественные невриномы могут обнаруживаться в рамках
нейрофиброматоза (болезни фон Реклингхаузена). Протекают
чаще бессимптомно; при росте в просвет спинномозгового
канала появляется неврологическая симптоматика.
Лимфаденопатия
Увеличение лимфатических узлов средостения наблюдается
при лимфомах и метастазах карциномы, а также
неопухолевых заболеваниях (туберкулёз, саркоидоз и т. д.).
Поражение медиастинальных лимфатических узлов при
лимфомах может быть как изолированным, так и в сочетании
с лимфаденопатией других локализаций, а также поражением
различных органов. Для агрессивных лимфом характерно
прорастание опухоли в окружающие анатомические структуры
(сосуды, трахею, бронхи, плевру, лёгкие, пищевод и т.д.).
64.
Характер лимфогенного метастазирования злокачественной опухолисвязан с особенностями лимфооттока от пораженного органа.
Увеличение лимфатических узлов обусловлено метастазами опухолей
интраторакальных и экстраторакальных локализаций лишь в 20 %
случаев. Наиболее частой причиной является бронхогенный рак
лёгкого, при котором, в поздних стадиях, метастатическое
поражение лимфатических узлов происходит более чем в 80 %
случаев. Вовлечение лимфатических узлов при бронхогенном раке не
одностороннее — благодаря перекрестному лимфооттоку, правая
трахеобронхиальная группа лимфоузлов поражается даже при
левосторонней локализации опухоли. Менее часто источником
метастазов являются злокачественные опухоли желудочно-кишечного
тракта (пищевода, желудка, поджелудочной железы), молочных
желез, почек, яичек, предстательной, щитовидной желез и гортани). В
соответствии с характером лимфооттока, при раке молочных желез
внимание должно быть направлено на загрудинные лимфоузлы, при
опухолях желудочно-кишечного тракта, почек, яичек и простаты —
на задние медиастинальные группы лимфоузлов, при раке гортани и
щитовидной железы — на лимфоузлы верхнего средостения. При
лимфогенной диссеминации экстраторакальных опухолей, метастазы
поражают лимфатические узлы на протяжении в направлении
медиастинальных групп, характерно поражение забрюшинных и
шейных лимфатических узлов. Опухолевый лимфангит в лёгких
наблюдается при раке молочной железы, желудка, поджелудочной
железы, щитовидной железы и гортани, и обычно сочетается с
лимфаденопатией корней легких. По сравнению с раком, саркомы
реже метастазируют в средостение по лимфатическим путям.
65.
ЛечениеТактика специалиста при лечении
опухолей средостения зависит от варианта новообразования и
его локализации. Основным способом избавления от
подобных патологий является их оперативное иссечение в
пределах здоровых тканей.
Так как средостение ограничено грудной клеткой, любое
открытое хирургическое вмешательство
является очень травматичным. Поэтому сегодня во всех
медицинских центрах и онкологических диспансерах
предлагается минимально-инвазивное удаление опухолей
средостения. Конечно, такая терапия может быть
применена не для каждого пациента и некоторым все же
требуется открытая операция. Однако часть лиц с опухолями
средостения получают менее травматичное и более
современное минимально-инвазивное лечение.
Для того чтобы подкрепить полученный результат, операция
дополняется химиотерапевтическим, лучевым или
медикаментозным лечением, в зависимости от диагноза.






























































 medicine
medicine








