Similar presentations:
Химия элементов VIA группы
1. Химия элементов VIA группы
2.
Периодическая система элементов Д. И. Менделеева (длинная форма)Пе
ри
од
ы
1
2
3
4
5
6
7
Группы элементов
1
IA
2
IIA
3
IIIB
4
IVB
5
VB
6
7
VIB VIIB
8
9
VIIIB
10
11
IB
12
IIB
13
14
IIIA IVA
15
VA
16
17
18
VIA VIIA VIIIA
(1H)
3Li 4Be
5B
6C
7N
11Na 12Mg
13Al 14Si 15P
19K 20Ca 21Sc 22Ti 23V 24Cr 25Mn 26Fe 27Co 28Ni 29Cu 30Zn 31Ga 32Ge 33As
37Rb 38Sr 39Y 40Zr 41Nb 42Mo 43Tc 44Ru 45Rh 46Pd 47Ag 48Cd 49In 50Sn 51Sb
*
55Cs 56Ba 57La 72Hf 73Ta 74W 75Re 76Os 77Ir 78Pt 79Au 80Hg 81Tl 82Pb 83Bi
**
… …
87Fr 88Ra 89Ac 104Db 105Jl 106Rf 107Bh 108Hn 109Mt 110
111
112
s1
s2
d1
d2
d3
d4
s
d5
d6
d7
d8
d9
d10
p1
p2
d
8O
16S
1H
2He
9F
10Ne
17Cl 18Ar
34Se 35Br 36Kr
52Te
53I
54Xe
84Po 85At 86Rn
p3
p4
p5
p6
p
*Лантаноиды
58Сe
59Pr
60Nd
61Pm
62Sm
63Eu
64Gd
65Tb
66Dy
67Ho
68Er
69Tm 70Yb
71Lu
98Cf
99Es
100Fm
101Md 192No
103Lr
Актиноиды
**
90Th
91Pa
92U
93Np 94Pu
95Am
96Cm
97Bk
3. O, S, Se, Te, Po
r,Э0r,Э2–
Э.О.
Степени окисления
O
0,73
1,24
3,44
–2, –1, 0, (+2)
S
1,02
1,70
2,58
–2, 0, +4, +6
Se
1,17
1,84
2,55
–2, 0, +4, +6
Te
1,35
2,07
2,10
–2, 0, +4, +6
–
2,00
(–3), 0, +3, (+5)
Po 1,64
4. Содержание в земной коре и минералы
O – 1 место (49,3 масс.% земной коры; 21% атмосферы)S – 14 место (0,1 масс.%); самородная сера,
FeS2 – пирит (см. рисунок), ZnS – вюрцит,
PbS – галенит, CaSO4.2H2O – гипс и др.
Se – 62 место (8·10–5 масс.%); рассеянный,
сопутствует сульфидам.
Te – 79 место (10–6 масс.%); рассеянный,
сопутствует сульфидам.
Po – следы; в урановых рудах;
полоний радиоактивен:
210Po (t
1/2 = 138 дней).
5. Открытие элементов
O – 1774 г. англ. Пристли, 1772 г. швед Шееле,1775 г. француз Лавуазье;
от греч. «рождающий кислоты».
S – известна с с древнейших времен.
Se – 1817 г. швед Берцелиус,
от греч. «Селена» – Луна.
Te – 1798 г. немец Клапрот,
от греч. «Теллус» – Земля.
Po – 1898 г., Склодовская-Кюри и Кюри,
«Полония» – Польша.
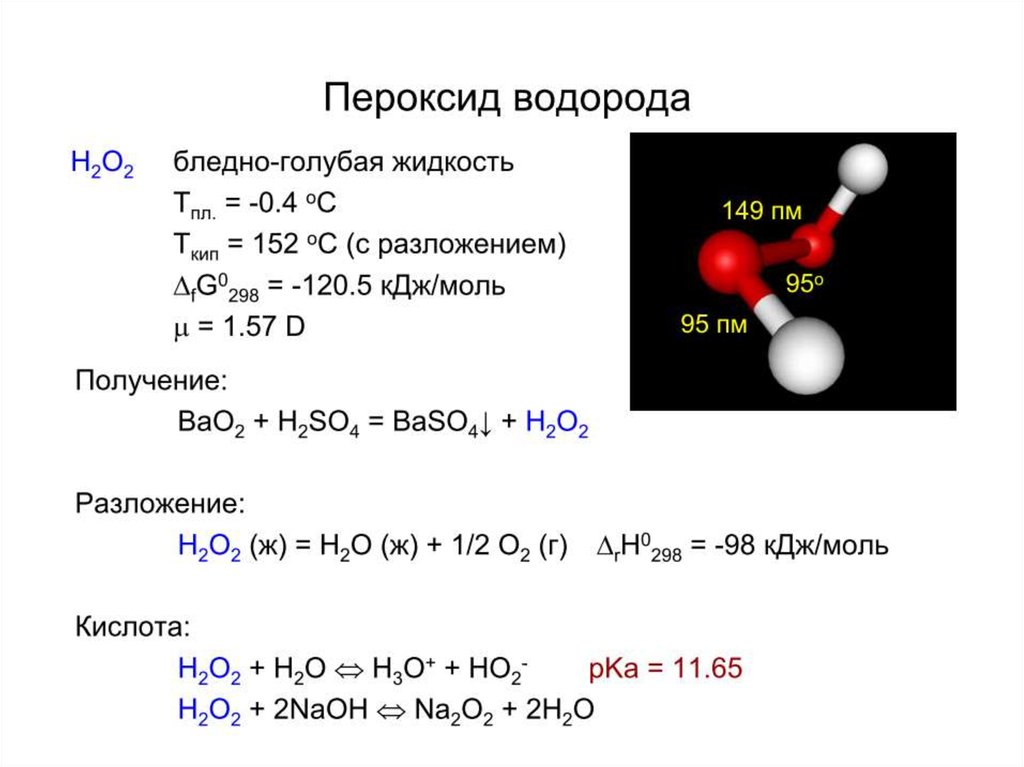
6. Кислород
Ст. ок.0
Примеры O2, O3
–1
–2
H2O2 и H2O,
произв. оксиды и
произв.
+2
OF2
7. Аллотропные модификации О
O2 – б/ц газ, Ткип = –183 оС, голубая жидкостьО3 – озон, синий газ, Ткип = –112 оС,
fG0 = +163 кДж/моль, взрывоопасен,
очень реакционноспособный
Ag + O2 = нет реакции
2Ag + O3 = Ag2O + O2
8. Получение О2
В природе: воздух, вода, оксидные минералы.ПОЛУЧЕНИЕ:
• В промышленности:
1) фракционная перегонка жидкого воздуха
2) электролиз воды
• В лаборатории:
2KMnO4 тв = K2MnO4 + MnO2 + O2
KClO3 тв = KCl + 3/2O2
KNO3 тв = KNO2 + 1/2O2
9. Свойства кислорода
• Кислород окислитель. Сильный!O2 + 4H+ + 4e = 2H2O ΔE°=1.23В
10. Свойства кислорода
• Восстановительные свойства(см. получение или химию фтора):
11. Вода и ее свойства
12.
13. Пероксиды, надпероксиды, озониды
2Na + O2 = Na2O2 (пероксид)Na + O2 (300 атм) = NaO2 (надпероксид
диоксид, супероксид)
M + O3 = MO3 (озонид) M = Na, K, Rb, Cs
Регенерация «воздуха»
(«проветривание» подлодок)
4KO2тв + 2CO2газ = 2K2CO3 + 3O2
Взаимодействие с водой:
M2O2 + 2H2O = 2MOH + H2O2
2MO2 + 2H2O = 2MOH + H2O2 + O2
2MO3 + 2H2O = 2MOH + H2O2 + 2O2
14.
(реставрация картин)15.
ПОДГРУППАСЕРЫ
16. Простые вещества S, Se, Te
S – ромбическая (S8), моноклинная (S8) при t > 95oC,в расплаве спирали Sx (катенация)
Se – Se8 (неустойчив), серый селен (Sex)
Te – Tex
17. Сера
ДОБЫЧАВручную
t
FeS2 → FeS + S
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
Из по земли
18. Серная кислота – кровь химической промышленности
19. Синтез серной кислоты (олеума)
S + O2 → SO22SO2 + O2 → 2SO3 (катализатор = Pt, V2O5)
SO3 + H2O → H2SO4
H2SO4 + SO3 → H2S2O7
20. Еще о серной кислоте
• H2SO4 (p-p)2H+ + SO42–
Cu2+ + SO2
CO2 + SO2
Не реагирует с неметаллами и металлами стоящими правее
водорода в ряду напряжений (Сu, Ag, Au и др.), но с активными
Cu
C
металлами:
t
H2SO4 + Zn (Fe,Sn) = ZnSO4 + H2
H2 SO4
Fe, Ni, Sn
Al, Mg, Zn
t
Me2+ + SO2
Al3+, Mg2+, Zn2+ + H2S
Концентрированная кислота окисляет за счет E°(SO42–/SO2) = 0.16 В
21. Свойства S, Se, Te
• Восстановительные:Э + О2 = ЭО2 (Э = S, Se, Te)
• Окислительные:
3Э + 2Al = Al2Э3 (Э = S, Se, Te)
• Диспропорционирование:
3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
(кипячение),
3S + 6OH– = 2S2– + SO32– +3H2O
E0 = +0.13 B
Se и Te не реагируют со щелочами ( E0 < 0)
22. Реакции с кислотами
• Кислоты–неокислители:Э + HCl = нет реакции (Э = S, Se, Te)
• Кислоты–окислители:
S + 6HNO3 конц. = H2SO4 + 6NO2 + 2H2O
Se – H2SeO3
Te – TeO2
23. Кислотно-основные свойства
Сила кислоты растетH2Э
H2O
H2S
H2Se
H2Te
pKa1
16
7
4
3
К-та
H2SO4
H2SeO4
H6TeO6 – орто
Св-ва сильная сильная pKa1= 8, pKa2= 11,
pKa3 = 15
К-та
H2SO3
H2SeO3
H2TeO3
Св-ва
pKa1= 2
pKa1= 3
pKa1= 6
pKb= 11
Сила кислоты уменьшается
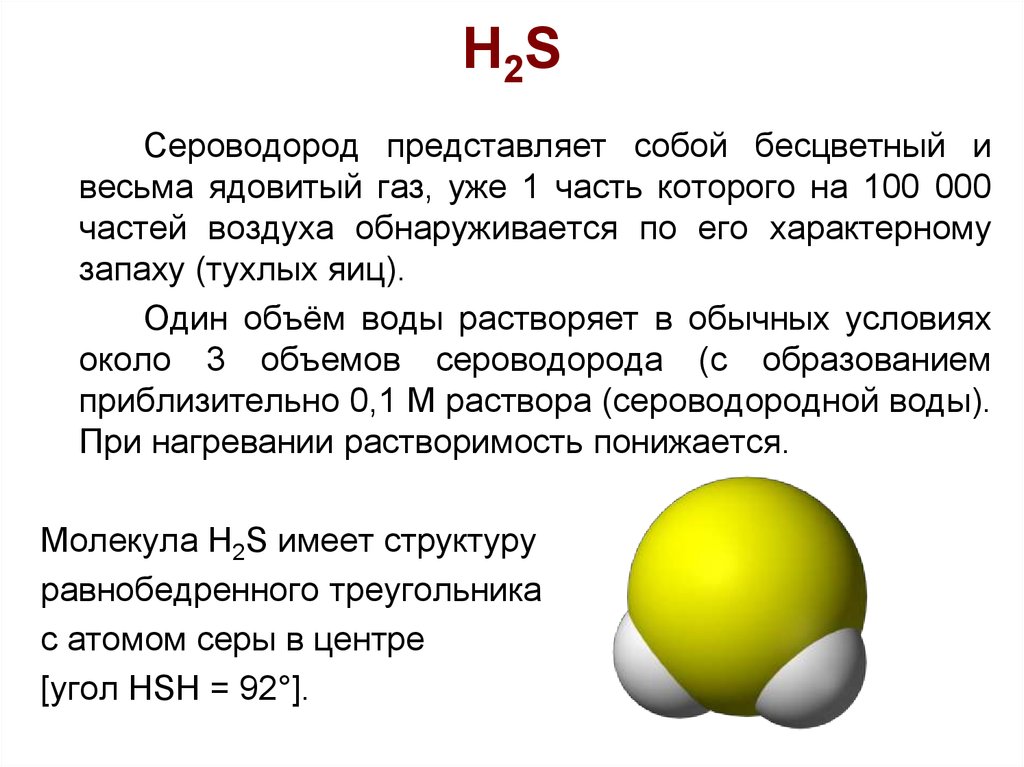
24. H2S
Сероводород представляет собой бесцветный ивесьма ядовитый газ, уже 1 часть которого на 100 000
частей воздуха обнаруживается по его характерному
запаху (тухлых яиц).
Один объём воды растворяет в обычных условиях
около 3 объемов сероводорода (с образованием
приблизительно 0,1 М раствора (сероводородной воды).
При нагревании растворимость понижается.
Молекула Н2S имеет структуру
равнобедренного треугольника
с атомом серы в центре
[угол HSH = 92°].
25.
H2SПолучение:
H2 + S = H2S (300 oC) (промышленное)
Al2S3 тв + 6H2O = 2Al(OH)3 + 3H2S (лаб.)
FeSтв + 2H+ = Fe2+ + H2S (лаб.)
Окисление сероводорода в водных растворах:
1) до S: MnO4–, Cr2O72–, Fe3+
2) до SO42–: HNO3 конц., PbO2, BiO33–, FeO42–
Растворимые соли гидролизуются.
Нерастворимые сульфиды часто окрашены:
CdS желтый, Sb2S3 оранжевый, PbS черный,
ZnS белый, CuS черный.

























 chemistry
chemistry








