Similar presentations:
Химическая связь. Взаимное влияние атомов в молекуле
1.
ХИМИЧЕСКАЯ СВЯЗЬ.ВЗАИМНОЕ ВЛИЯНИЕ АТОМОВ В МОЛЕКУЛЕ
СТРУКТУРА И ФУНКЦИИ БИОЛЕКУЛ. ЛЕКЦИЯ 1.
2.
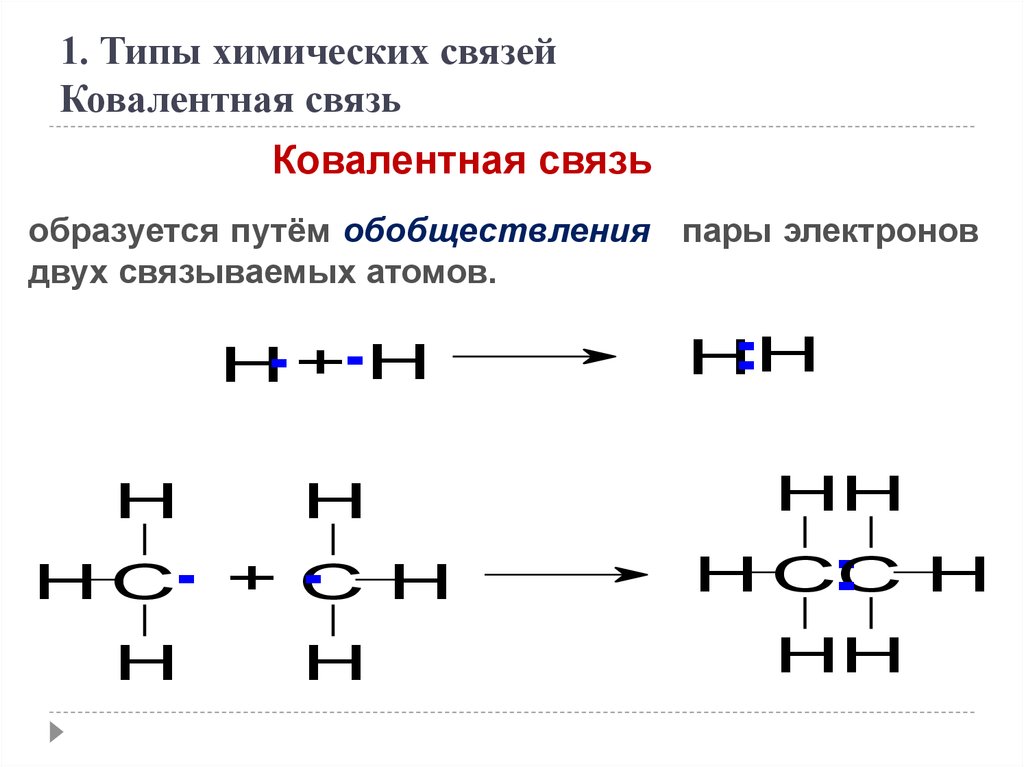
1. Типы химических связейКовалентная связь
Ковалентная связь
образуется путём обобществления пары электронов
двух связываемых атомов.
.+.H
H
.
.H
H
HH
H
H
.
H C.
C H
H
H
HH
H C. + .
C H
3.
1. Типы химических связейКовалентная связь
-связь – одинарная ковалентная связь, образованная при «осевом»
перекрывании АО вдоль оси, соединяющей ядра атомов с максимумом
перекрывания на этой прямой
3
4.
1. Типы химических связейКовалентная связь
-связь - ковалентная связь, возникающая при «боковом»
перекрывании негибридизованных p-орбиталей с максимумом
перекрывания по обе стороны от прямой, соединяющей ядра
атомов.
5.
1. Типы химических связейКовалентная связь. Характеристики
5
6.
7.
1. Типы химических связейКовалентная связь. Характеристики
7
8.
1. Типы химических связейКовалентная связь. Механизмы образования
обменный механизм
донорно-акцепторная связь
носители неподеленных пар
8
9.
1. Типы химических связейКовалентная связь. Водородная связь
9
10.
1. Типы химических связейКовалентная связь. Водородная связь
10
11.
2. Сопряжение. Сопряженные системы11
12.
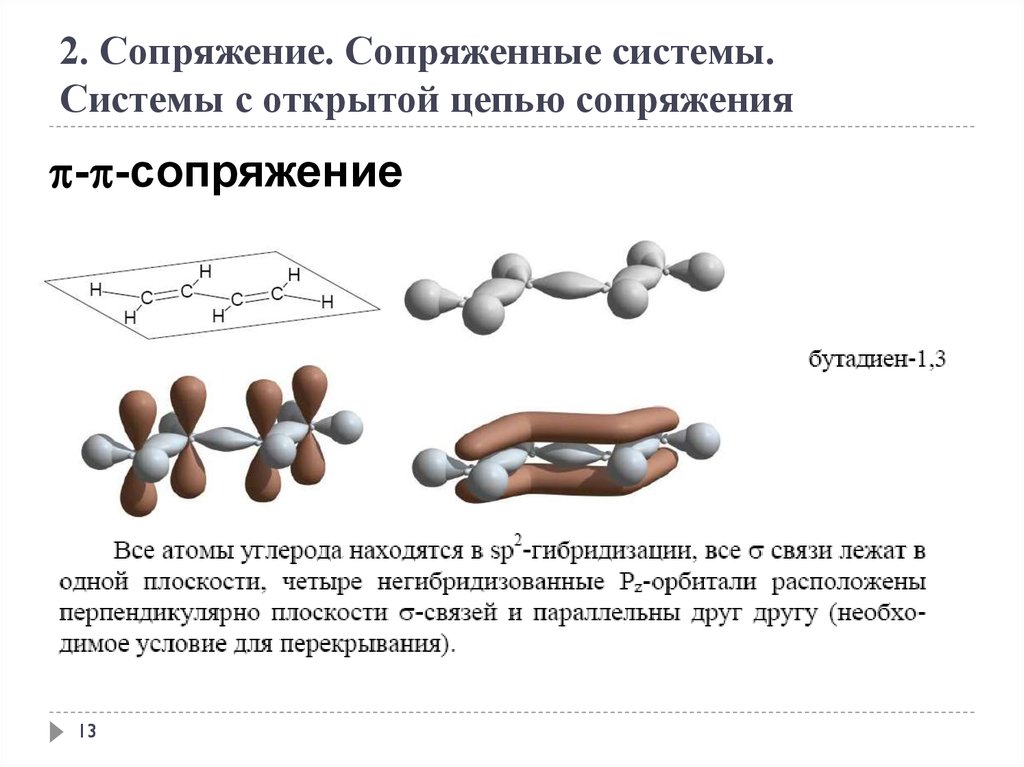
2. Сопряжение. Сопряженные системыСопряжение – это образование в молекуле единого делокализованного
электронного облака в результате перекрывания негибридизованных рорбиталей.
12
13.
2. Сопряжение. Сопряженные системы.Системы с открытой цепью сопряжения
- -сопряжение
13
14.
2. Сопряжение. Сопряженные системы.Системы с открытой цепью сопряжения
- -сопряжение
CH2=CH-CH=CH-CH=CH2
гексатриен-1,3,5
14
CH2=CH-C
акролеин
O
H
CH2=CH-C=CH
CH2=CH-C=N
винилацетилен
акрилонитрил
15.
2. Сопряжение. Сопряженные системы.Системы с открытой цепью сопряжения
р- -сопряжение
15
16.
2. Сопряжение. Сопряженные системы.Системы с открытой цепью сопряжения
р- -сопряжение
16
17.
2. Сопряжение. Сопряженные системы.Ароматичность
17
18.
2. Сопряжение. Сопряженные системы.Ароматичность
Ароматичность — особое свойство некоторых химических соединений,
благодаря которому сопряженное кольцо ненасыщенных связей
проявляет аномально высокую стабильность; большую, чем та, которую
можно было бы ожидать только при одном сопряжении.
Правило Хюккеля.
Система ароматична, если она обладает совокупностью
следующих признаков:
а) все атомы в цикле находятся в sр2-гибридизации
(следовательно, -скелет плоскостной);
б) молекула имеет циклическую систему сопряжения;
в) в сопряжении участвует (4n+2) - -электронов, где n —
целое число (n=0,1,2,3,4...).
18
19.
2. Сопряжение. Сопряженные системы.Ароматичность
N
H N
H
N
S
S
N
O
N
N
N.
Н
е
б
е
н
з
о
и
д
н
ы
е
г
е
т
е
р
о
ц
и
к
л
и
ч
е
с
к
и
е
а
р
о
м
а
т
и
ч
е
с
к
и
е
с
о
е
д
и
н
е
н
и
я
19
20.
3. Взаимное влияние атомов в молекуле.Эффекты заместителей. Индуктивный эффект
20
21.
3. Взаимное влияние атомов в молекуле.Эффекты заместителей. Индуктивный эффект
Электроноакцепторные
заместители
X,
т.е. атом или группа атомов, смещающие электронную плотность связи от атома углерода, проявляют отрицательный индуктивный
эффект (-I-эффект).
C
X
Электронодонорные заместители X, т. е. атом или группа атомов,
смещающие электронную плотность к атому углерода, проявляют
положительный индуктивный эффект
(+I-эффект).
C
Y
21
22.
3. Взаимное влияние атомов в молекуле.Эффекты заместителей. Индуктивный эффект
22
23.
3. Взаимное влияние атомов в молекуле.Эффекты заместителей. Индуктивный эффект
–I эффект проявляют
1. заместители, которые содержат атомы с большей ЭО, чем у
углерода:
-F, -Cl, -Br, -OH, -NH2, -NO2, >C=O, -COOH и др.;
2. катионы.
+I эффект проявляют заместители, содержащие атомы
с низкой электроотрицательностью:
1. - насыщенные углеводородные радикалы
(-CH3, -C2H5) и т.п.,
(СН3)3С- > (СН3)2 СН- > СН3 — СН2 - > CН3трет.бутил
изопропил
этил
метил
2. -металлы (-Mg-, -Li);
3. - анионы
23
24.
3. Взаимное влияние атомов в молекуле.Эффекты заместителей. Мезомерный эффект
24
25.
3. Взаимное влияние атомов в молекуле.Эффекты заместителей. Мезомерный эффект
+М-эффектом обладают заместители,
повышающие электронную плотность в
сопряжённой системе.
O
H
H
H
.
O
H
H
H
H
+ М: NH2, NHR, NR2, OH, OR, SH, SR, CH=CH2,
C CH.
26.
3. Взаимное влияние атомов в молекуле.Эффекты заместителей. Мезомерный эффект
-
М-эффект
проявляют
заместители,
которые
понижают
электронную плотность в сопряжённой системе.
C
O
O
H
H
H
.
O
H
O
H
H
H
-M: C=O, COOH, NO , C N, CH=NH, N=O, SO H, SO H.
2
3
2
27.
3. Взаимное влияние атомов в молекуле.Эффекты заместителей. Мезомерный эффект
27
28.
3. Взаимное влияние атомов в молекуле.Эффекты заместителей. Мезомерный эффект
28
29.
3. Взаимное влияние атомов в молекуле.Эффекты заместителей. Мезомерный эффект
29
30.
КЛАССИФИКАЦИЯ РЕАКЦИЙ И РЕАГЕНТОВ.КИСЛОТНЫЕ И ОСНОВНЫЕ СВОЙСТВА БИОМОЛЕКУЛ
СТРУКТУРА И ФУНКЦИИ БИОЛЕКУЛ. ЛЕКЦИЯ 2.
31.
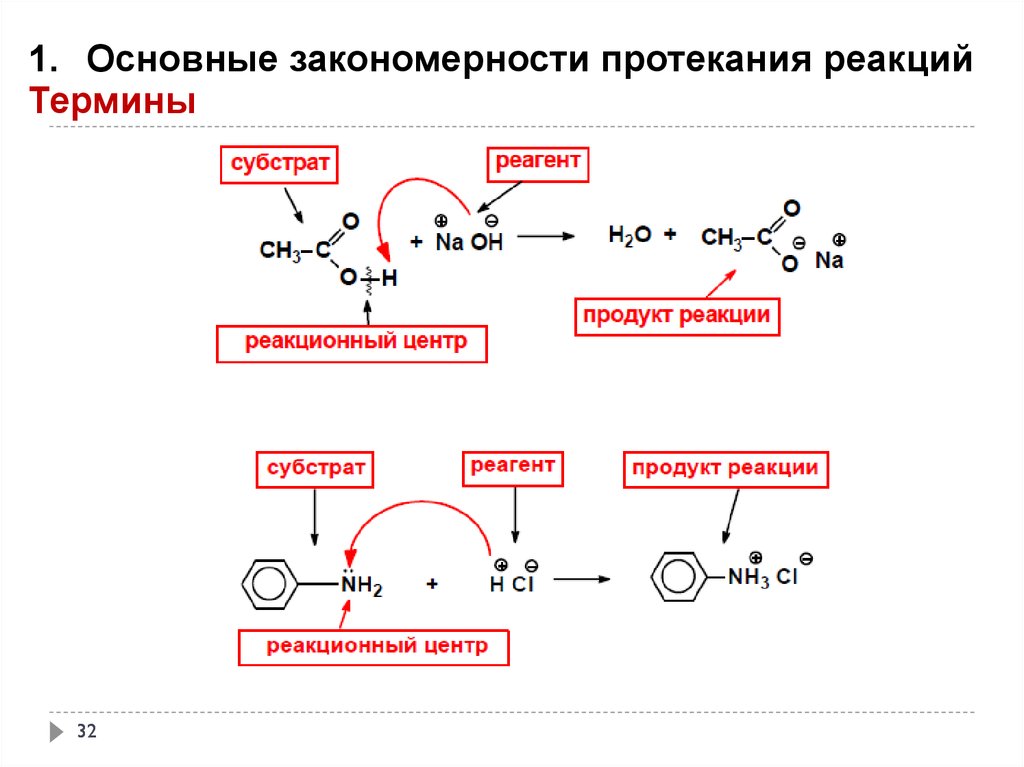
1. Основные закономерности протекания реакцийТермины
Реакционная способность – способность вещества вступать в химическую реакцию и
реагировать с большей или меньшей скоростью.
Субстрат – вещество, вступающее в реакцию.
Как правило, это вещество, в котором у атома углерода происходит разрыв старой и
образование новой связи.
Реагент – соединение, действующее на субстрат
Реакционный центр – это атом или группа атомов, непосредственно участвующие в данной
химической реакции.
В биохимических процессах реагентами считают ферменты (биокатализаторы), а вещества,
подвергающиеся их действию, называют субстратами.
31
32.
1. Основные закономерности протекания реакцийТермины
32
33.
1. Основные закономерности протекания реакцийМеханизм реакции
33
34.
2. Классификация реакций и реагентовТипы реагентов
34
35.
2. Классификация реакций и реагентовТипы реагентов
35
36.
2. Классификация реакций и реагентовТипы реагентов
36
37.
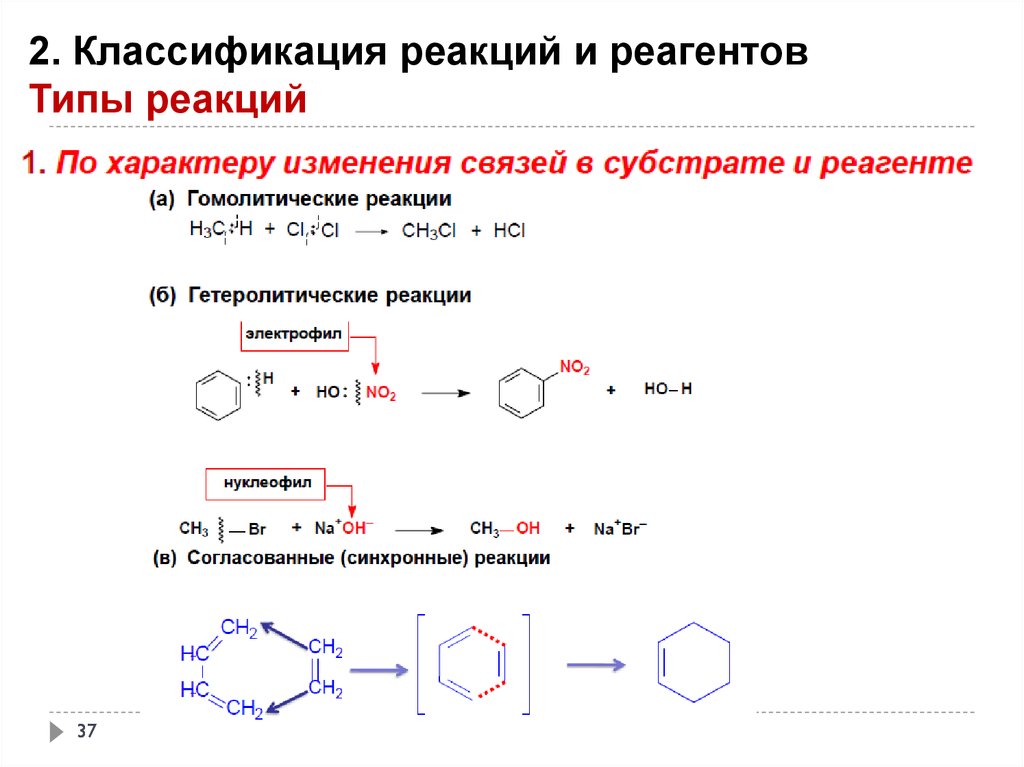
2. Классификация реакций и реагентовТипы реакций
37
38.
2. Классификация реакций и реагентовТипы реакций
38
39.
2. Классификация реакций и реагентовТипы реакций
39
40.
2. Классификация реакций и реагентовТипы реакций
40
41.
2. Классификация реакций и реагентовТипы реакций
Мономолекулярные (диссоциативные)
Бимолекулярные (ассоциативные)
41
42.
4. Кислотные и основные свойства биомолекулКислотность и основность по Бренстеду
42
43.
4. Кислотные и основные свойства биомолекулКислотность и основность по Бренстеду
Чем сильнее кислота, тем слабее сопряженное ей основание
43
44.
4. Кислотные и основные свойства биомолекулКислотность и основность по Бренстеду
44
45.
4. Кислотные и основныесвойства биомолекул
Кислотность и основность по
Бренстеду
45
46.
4. Кислотные и основные свойства биомолекулФакторы, определяющие кислотность
46
47.
РЕАКЦИОННАЯ СПОСОБНОСТЬ УГЛЕВОДОРОДОВСТРУКТУРА И ФУНКЦИИ БИОЛЕКУЛ. ЛЕКЦИЯ 3.
48.
4849.
4950.
1. Реакционнаяспособность насыщенных
углеводородов
50
51.
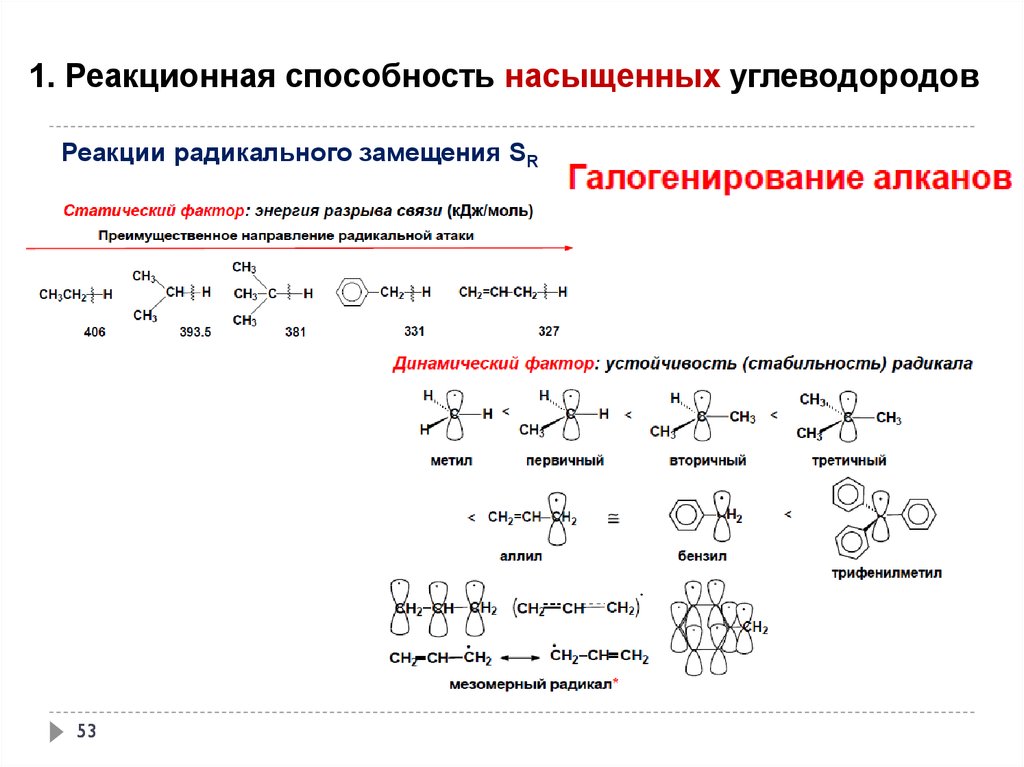
1. Реакционная способность насыщенных углеводородовРеакции радикального замещения SR
51
52.
1. Реакционная способность насыщенных углеводородовРеакции радикального замещения SR
52
53.
1. Реакционная способность насыщенных углеводородовРеакции радикального замещения SR
53
54.
1. Реакционная способность насыщенных углеводородовРеакции радикального замещения SR
54
55.
1. Реакционная способность насыщенных углеводородовРеакции радикального замещения SR
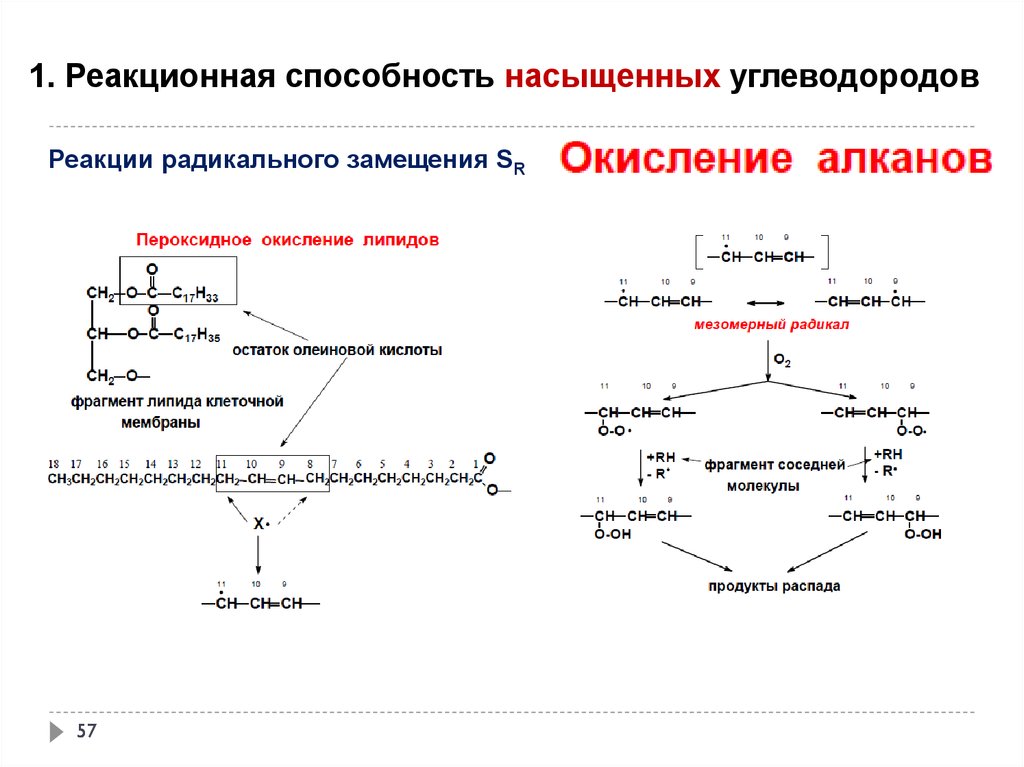
окисление под действием атмосферного кислорода
55
56.
1. Реакционная способность насыщенных углеводородовРеакции радикального замещения SR
56
57.
1. Реакционная способность насыщенных углеводородовРеакции радикального замещения SR
57
58.
2. Реакционная способностьненасыщенных углеводородов
58
59.
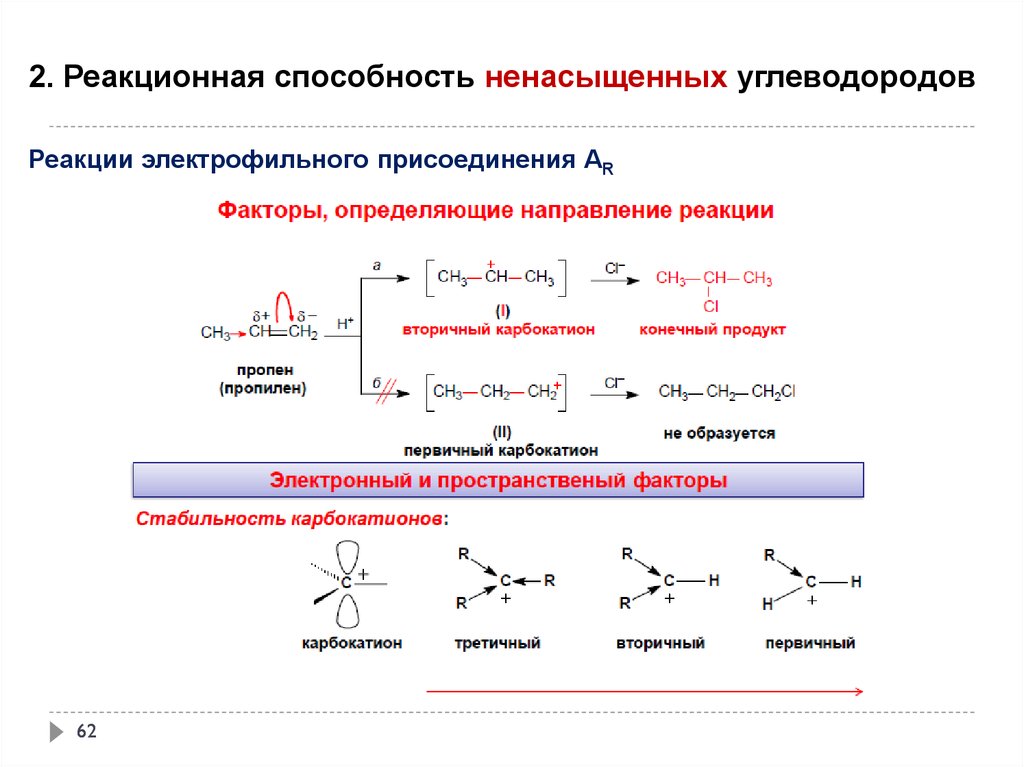
2. Реакционная способность ненасыщенных углеводородовРеакции электрофильного присоединения АR
59
60.
2. Реакционная способность ненасыщенных углеводородовРеакции электрофильного присоединения АR
60
61.
2. Реакционная способность ненасыщенных углеводородовРеакции электрофильного присоединения АR
61
62.
2. Реакционная способность ненасыщенных углеводородовРеакции электрофильного присоединения АR
62
63.
2. Реакционная способность ненасыщенных углеводородовРеакции электрофильного присоединения АR
63
64.
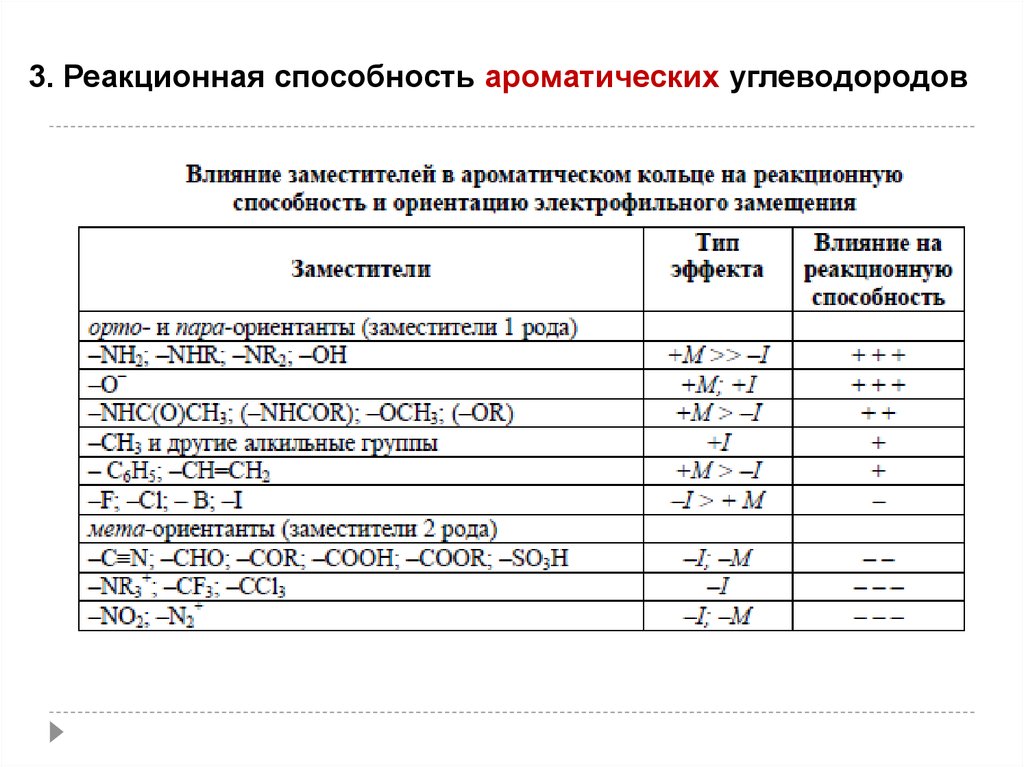
3. Реакционная способностьароматических углеводородов
64
65.
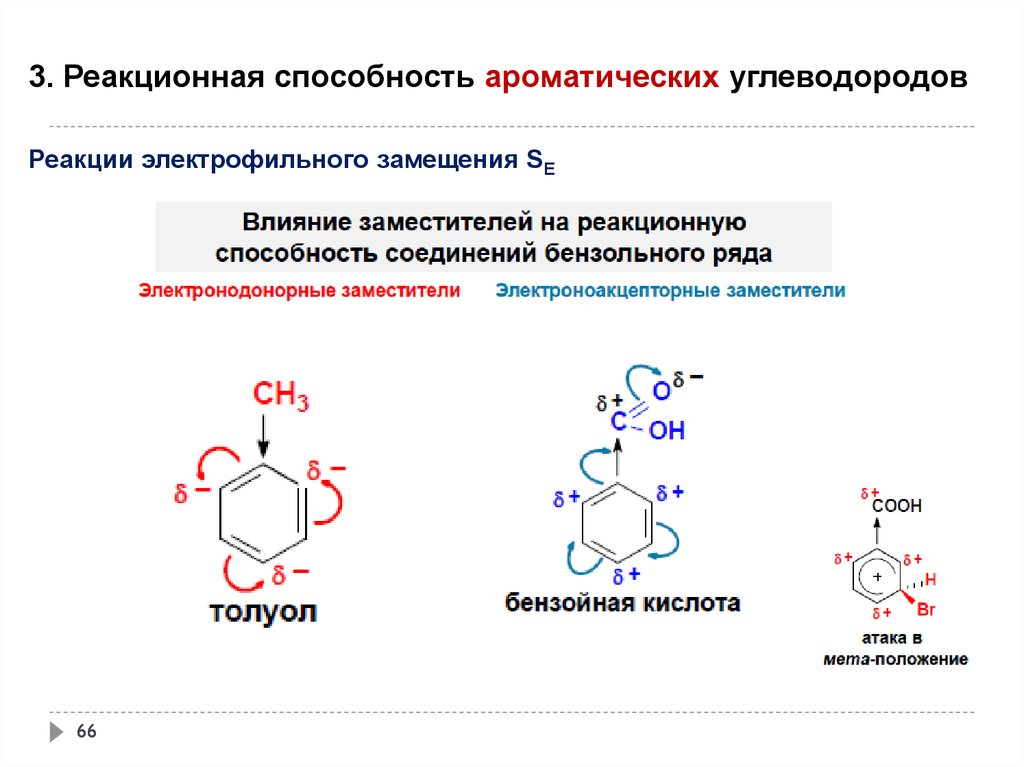
3. Реакционная способность ароматических углеводородовРеакции электрофильного замещения SE
65
66.
3. Реакционная способность ароматических углеводородовРеакции электрофильного замещения SE
66
67.
3. Реакционная способность ароматических углеводородовРеакции электрофильного замещения SE
67
68.
3. Реакционная способность ароматических углеводородовРеакции электрофильного замещения SE
68
69.
3. Реакционная способность ароматических углеводородов70.
БИОЛОГИЧЕСКИ ВАЖНЫЕ РЕАКЦИИМОНОФУНКЦИОНАЛЬНЫХ СОЕДИНЕНИЙ.
РЕАКЦИОННАЯ СПОСОБНОСТЬ
СПИРТОВ, ФЕНОЛОВ, ТИОЛОВ, АМИНОВ
СТРУКТУРА И ФУНКЦИИ БИОЛЕКУЛ. ЛЕКЦИЯ 4.
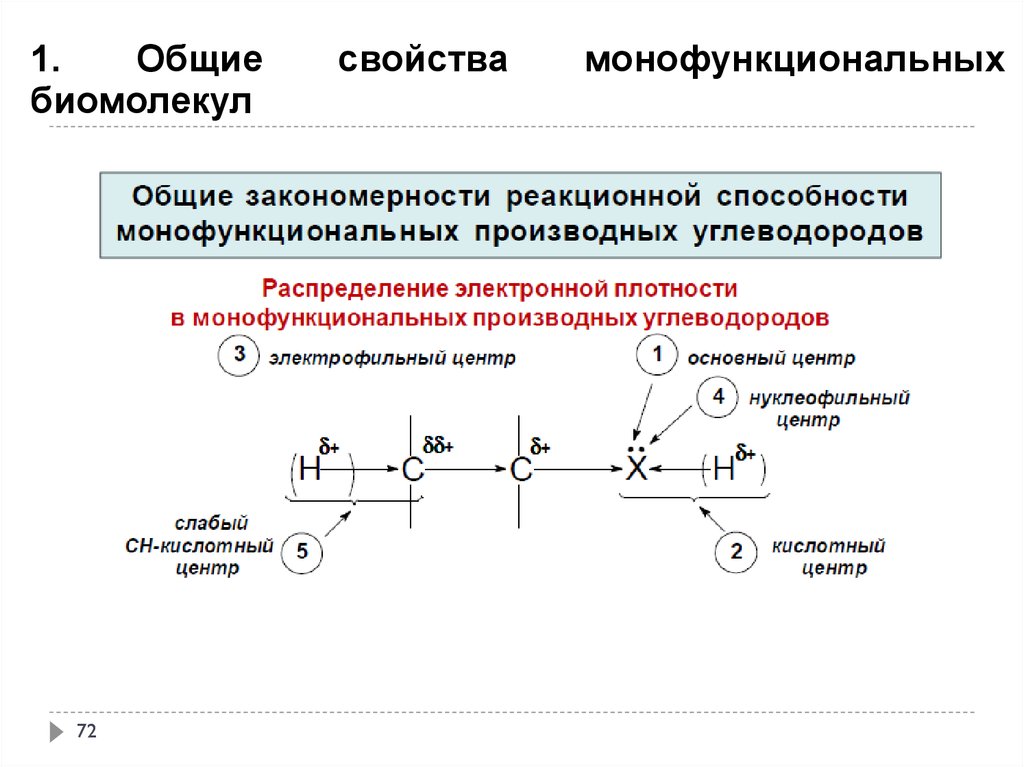
71.
1.Общие
биомолекул
71
свойства
монофункциональных
72.
1.Общие
биомолекул
72
свойства
монофункциональных
73.
1.Общие
биомолекул
73
свойства
монофункциональных
74.
1.Общие
биомолекул
74
свойства
монофункциональных
75.
1.Общие
биомолекул
75
свойства
монофункциональных
76.
1.Общие
биомолекул
76
свойства
монофункциональных
77.
1.Общие
биомолекул
77
свойства
монофункциональных
78.
1.Общие
биомолекул
78
свойства
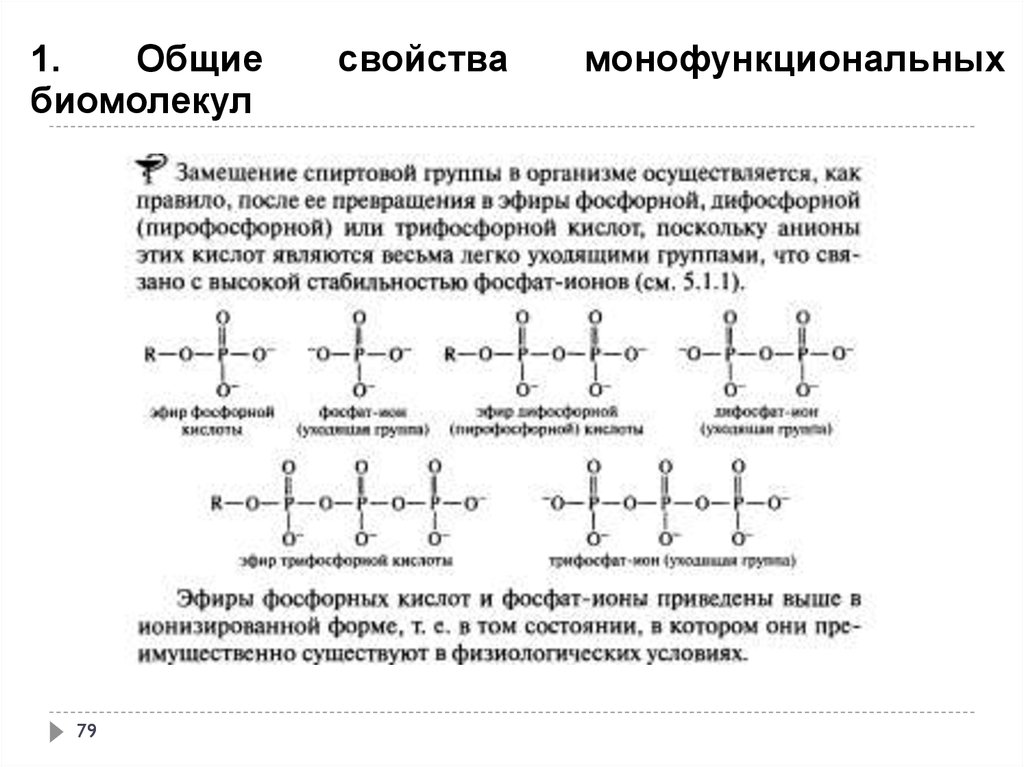
монофункциональных
79.
1.Общие
биомолекул
79
свойства
монофункциональных
80.
2. Галогенопроизводные80
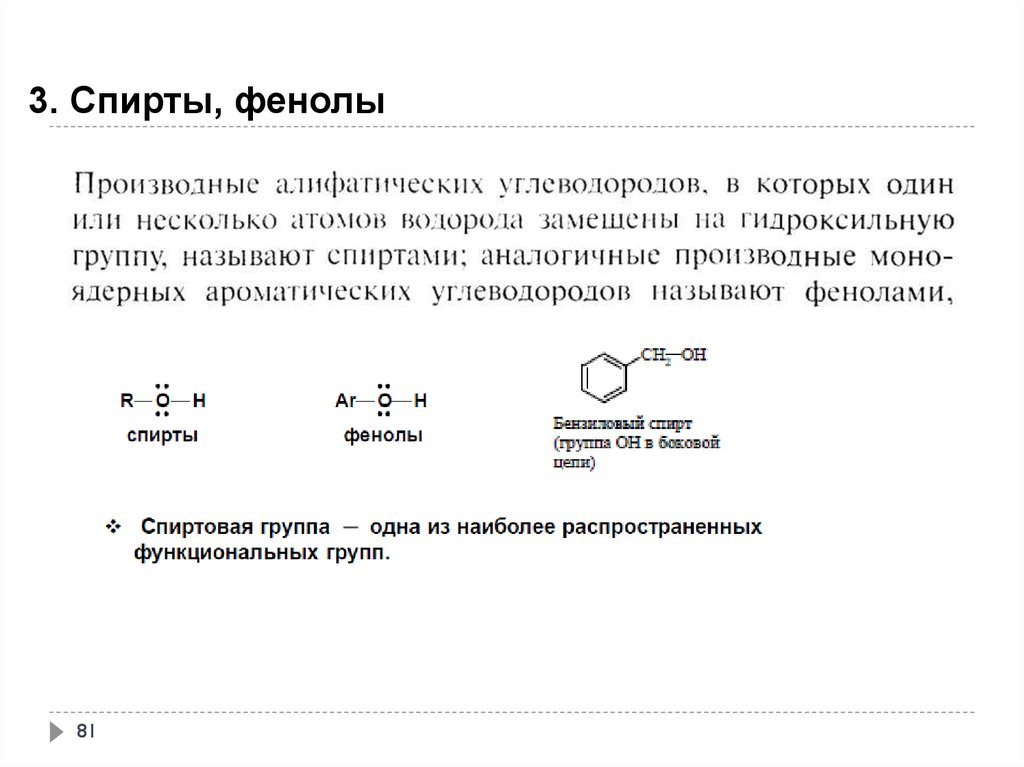
81.
3. Спирты, фенолы81
82.
3. Спирты, фенолы82
83.
3. Спирты, фенолы83
84.
3. Спирты, фенолы84
85.
4. Тиолы, амины85
86.
4. Тиолы, амины86
87.
4. Тиолы, амины87
88.
4. Тиолы, амины88
89.
БИОЛОГИЧЕСКИ ВАЖНЫЕ РЕАКЦИИМОНОФУНКЦИОНАЛЬНЫХ СОЕДИНЕНИЙ.
РЕАКЦИОННАЯ СПОСОБНОСТЬ
АЛЬДЕГИДОВ, КЕТОНОВ, КАРБОНОВЫХ КИСЛОТ
СТРУКТУРА И ФУНКЦИИ БИОЛЕКУЛ. ЛЕКЦИЯ 5.
90.
9091.
9192.
9293.
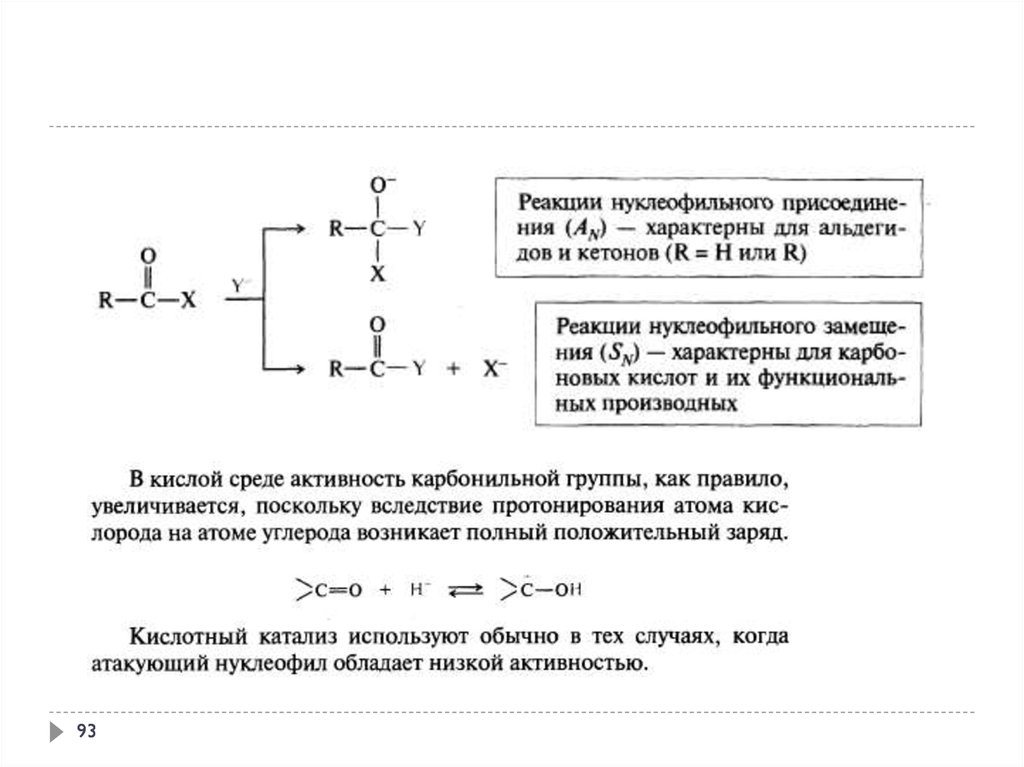
9394.
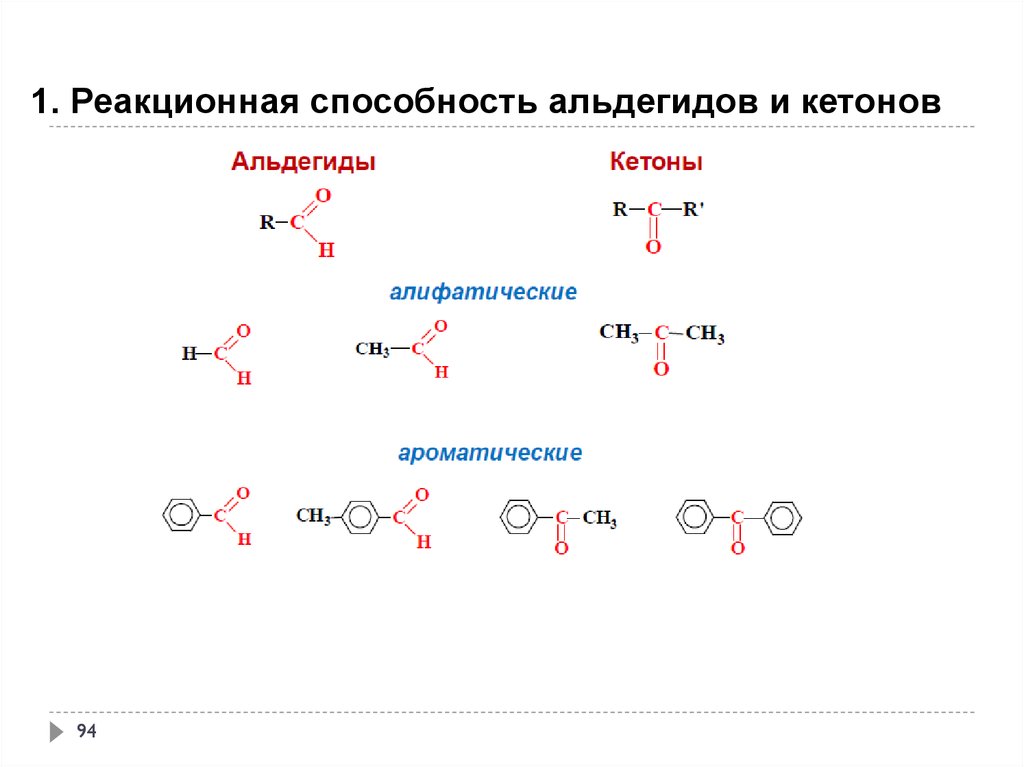
1. Реакционная способность альдегидов и кетонов94
95.
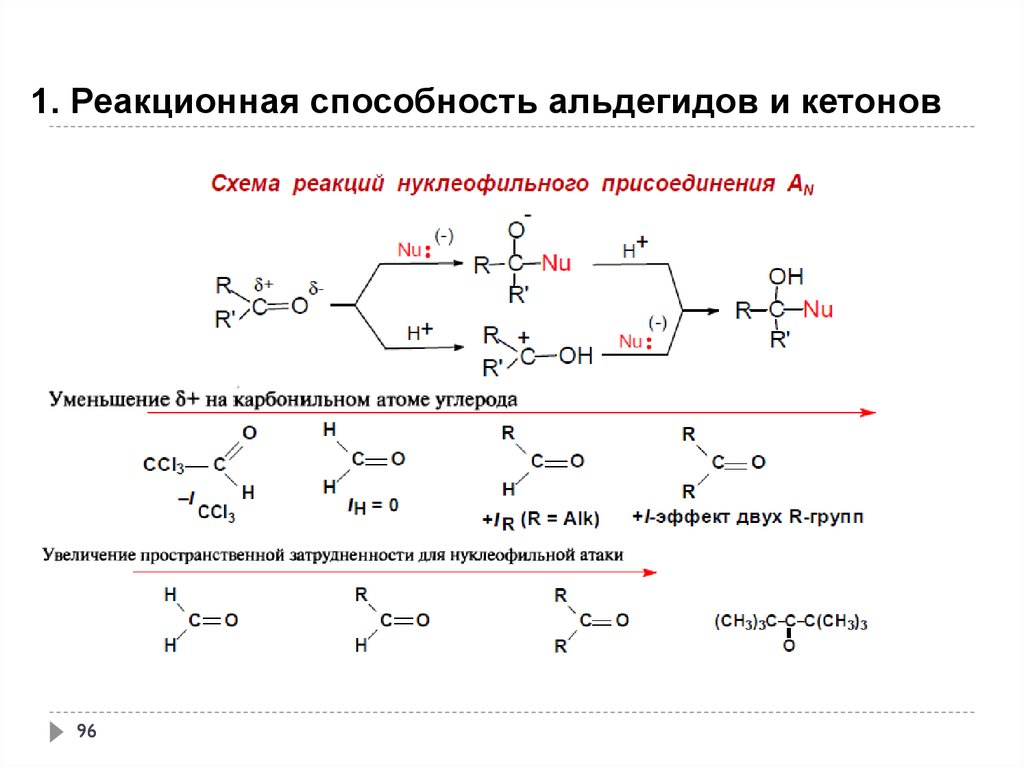
1. Реакционная способность альдегидов и кетонов95
96.
1. Реакционная способность альдегидов и кетонов96
97.
1. Реакционная способность альдегидов и кетонов 197
98.
1. Реакционная способность альдегидов и кетонов 2Полуацетали образуются в качестве промежуточных соединений при обмене
пировиноградной и α–кетоглутаровой кислот при участии витамина В1 –
тиаминпирофосфата.
98
99.
1. Реакционная способность альдегидов и кетонов 3Реакция исключительно важна для понимания процессов с участием ферментов, которые в своем
активном центре содержат тиольные группы аминокислоты цистеина.
R—СН = О
+ Н —SR <=>
АN
R—СН – ОН
|
SR
тиополуацеталь
Образование тиополуацеталей
окисления
99
in vivo необходимо в процессе реакций биологического
100.
1. Реакционная способность альдегидов и кетонов 4100
101.
1. Реакционная способность альдегидов и кетонов 7101
102.
1. Реакционная способность альдегидов и кетонов 7102
103.
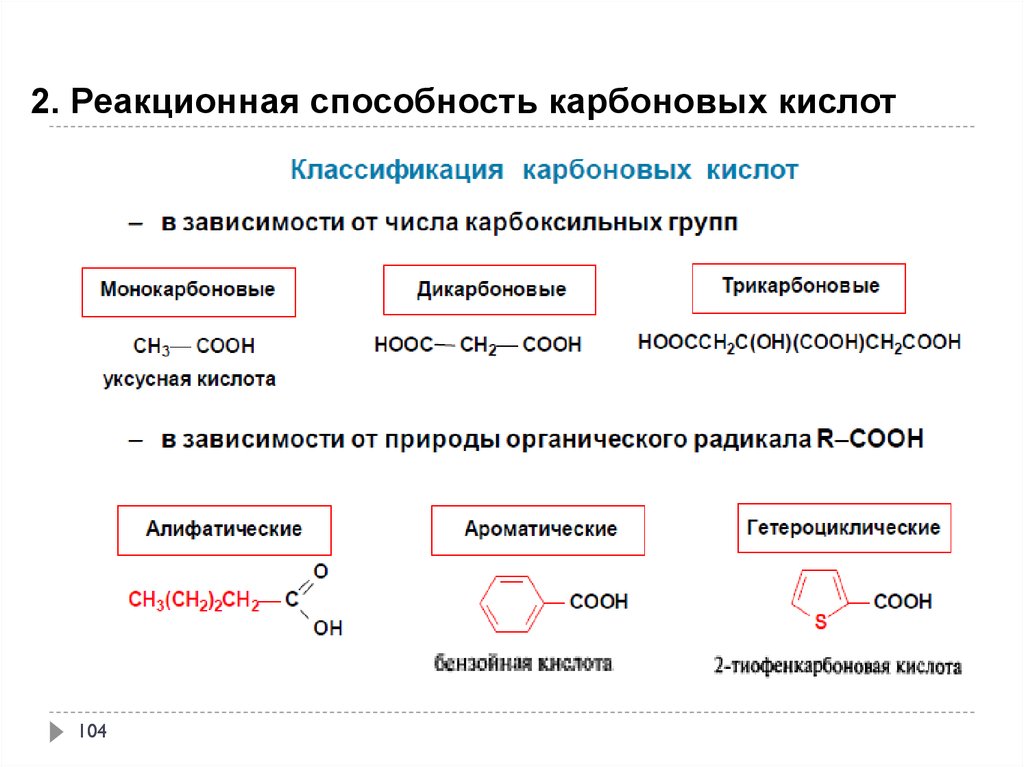
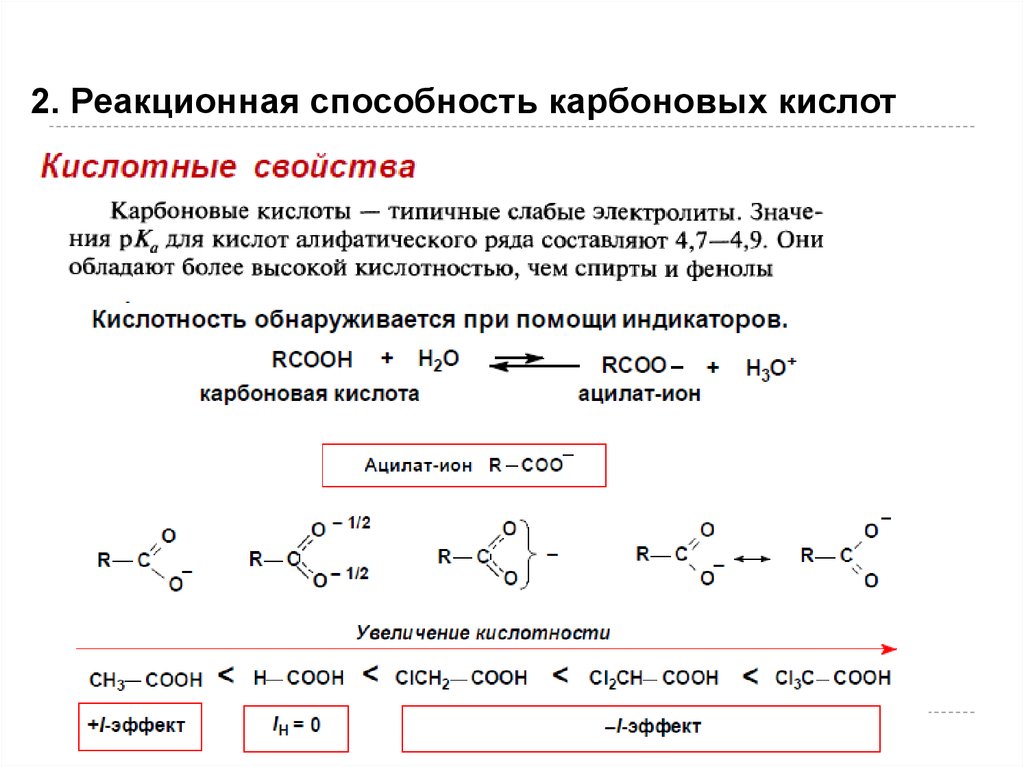
2. Реакционная способность карбоновых кислот103
104.
2. Реакционная способность карбоновых кислот104
105.
2. Реакционная способность карбоновых кислот105
106.
2. Реакционная способность карбоновых кислотКислота( название, формула)
НСООН муравьиная
СН3 СООН уксусная
СН 3СН2 СООН пропионовая
СН2 F СООН фторуксусная
СН2 С1СООН хлоруксусная
СН3 СН(ОН)СООН молочная
Значение Кислота( название, формула) Значение
рК а
рК а
3, 77
СН =СН-СООН пропеновая
4,25
( акриловая)
4, 76
С 6 Н 5 СООН бензойная
4, 17
4, 88
НООС-СООН щавелевая
1, 23
2, 66
НООС-СН2-СООН малоновая
2, 83
2, 86
НООС-СН2-СН2-СООН
4, 21
янтарная
3.97
СН3 -СН=СН-СООН
4,70
кротоновая
В гомологическом ряду кислотные свойства убывают. В таблице представлены два различных гомологических ряда:
насыщенные кислоты- муравьиная, уксусная, пропионовая и дикарбоновые- щавелевая, малоновая, янтарная.
Сравните их кислотные свойства и увидите, что в гомологическом ряду они убывают.
Непредельные кислоты сильнее насыщенных (акриловая и пропионовая). Ароматическая бензойная кислота сильнее
алифатической уксусной .
106
107.
2. Реакционная способность карбоновых кислот107
108.
2. Реакционная способность карбоновых кислот108
109.
2. Реакционная способность карбоновых кислот109
110.
2. Реакционная способность карбоновых кислот110





























































































 chemistry
chemistry








