Similar presentations:
Галогены. История открытия галогенов
1. Галогены
2.
Галогены1. История открытия галогенов
2. Положение в ПСХЭ
3. Химические свойства
4. Применение
5.Проверка знаний
6.Домашнее задание. Итоги урока.
Главная
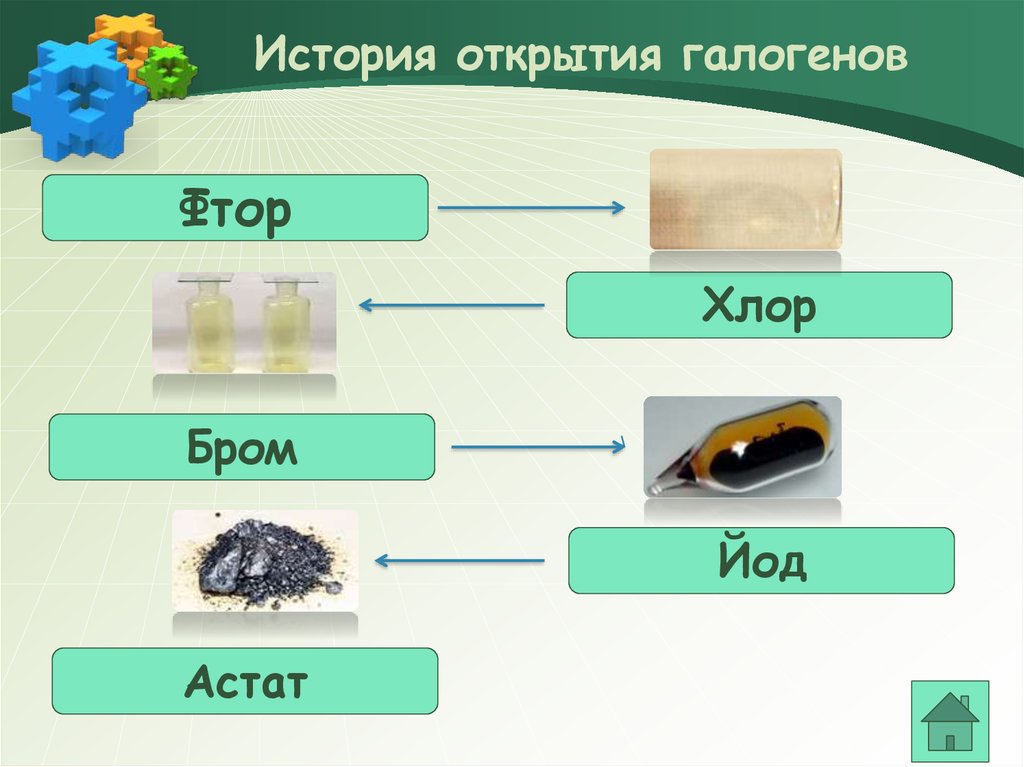
3. История открытия галогенов
ФторХлор
Бром
Йод
Астат
4. История открытия фтора
В 1886 году французский химик А.Муассан,
используя
электролиз
жидкого
фтороводорода,
охлажденного до температуры –23°C,
смог на аноде получить первую
порцию нового, газа. В первых
опытах для получения фтора Муассан
использовал
очень
дорогой
электролизер,
изготовленный
из
платины и иридия. При этом каждый
грамм полученного фтора «съедал»
до 6 г платины.
Анри
Муассан
(1852 –
1907)
5. История открытия хлора
КарлВильгельм
Шееле
(1742 – 1786)
В 1774 году шведский ученый К.
Шееле
открыл
хлор,
который
принял за сложное вещество и назвал
"дефлогистированной
соляной
кислотой".
В 1807 году английский химик
Гемфри Дэви получил тот же газ. Он
пришел к выводу, что получил новый
элемент и назвал его "хлорин" (от
"хлорос" - желто-зеленый).
В 1812 году Гей-Люссак дал
газу название
хлор.
6. История открытия брома
В1825 году французский
химик А.Ж.Балар
при изучении
маточных
рассолов
выделил
темно-бурую жидкость, который он
назвал - "мурид" (от латинского
слова
muria,
означающего
"рассол").
Комиссия
Академии,
проверив
это
сообщение,
подтвердила открытие Балара и
предложила
назвать
элемент
бромом (от "бромос", с греческого
"зловонный").
Антуан
Жером
Балар
(1802 –
1876)
7. История открытия йода
БернарКуртуа
(1777 –
1838 )
В 1811 году французский химик
Бернар Куртуа открыл иод
путём
перегонки маточных растворов от
своего
азотнокислого
кальция
с
серной кислотой
Чтобы другие
химики
могли
изучать
новое
вещество, Б. Куртуа подарил его
(правда, очень небольшое количество)
фармацевтической фирме в Дижоне.
В
1813
году
Гей-Люссак
подробно изучил этот элемент и дал
ему современное название. Название
"иод" происходит от греческого слова
"иодэс" - "фиолетовый" (по цвету
паров).
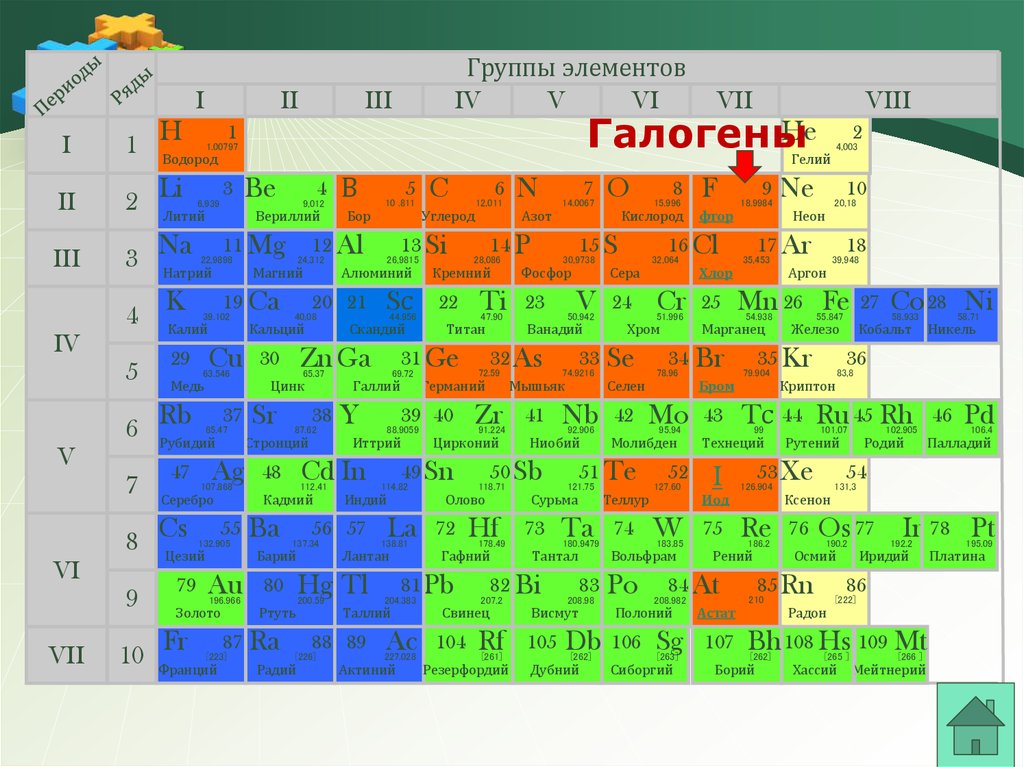
8.
II
1
H
II
2
Li
III
3
Na
4
K
IV
5
6
V
7
8
VI
9
VII
10
II
Группы элементов
IV
V
VI
III
Водород
3
Литий
Cu
63.546
Медь
Rb
37
85.47
Рубидий
47
Ag
107.868
Серебро
Cs
55
132.905
Цезий
79
Au
196.966
Золото
Fr
4
9,012
Франций
65.37
Цинк
38
87.62
Стронций
Sс
44.956
Скандий
Иттрий
112.41
Кадмий
Индий
56 57
137.34
Барий
Ртуть
200.59
Радий
Ac
227.028
Актиний
Ti
47.90
Zr
91.224
Цирконий
Hf
178.49
Гафний
Свинец
Rf
[261]
Резерфордий
O
8
15.996
Кислород
15 S
Фосфор
V
23
50.942
Ванадий
33
74.9216
Мышьяк
41
Nb
92.906
Ниобий
73
Ta
180.9479
Тантал
83
208.98
Висмут
105
Db
[262]
Дубний
F
фтор
16 Cl
32,064
Сера
Cr
24
51.996
Хром
Se
34
78.96
Селен
42
Mo
95.94
Молибден
51 Te
121.75
Сурьма
82 Bi
207.2
7
14.0067
30,9738
50 Sb
118.71
Олово
104
Азот
32 As
72.59
Германий
72
N
14 P
28,086
Титан
81 Pb
204.383
Таллий
88 89
[226]
La
138.81
Лантан
Hg Tl
80
22
49 Sn
114.82
12,011
Кремний
39 40
88.9059
6
Углерод
31 Ge
69.72
Галлий
Y
C
13 Si
26,9815
Алюминий
Cd In
48
87 Ra
[223]
5
10 .811
Zn Ga
30
Ba
Бор
20 21
40,08
Кальций
Sr
В
12 Al
24,312
Магний
19 Ca
39.102
Калий
29
Be
11 Mg
Натрий
2
Гелий
Вериллий
22,9898
VIII
He
Галогены
1
1.00797
6,939
VII
Теллур
74
52
127.60
W
183.85
Вольфрам
Po
25
Br
Бром
43
Иод
75
Sg
[263]
Сиборгий
54.938
107
Неон
18
Аргон
39,948
27
55.847
Железо
35 Kr
79.904
Co 28 Ni
58.933
Кобальт
99
36
Криптон
101.07
Re
186.2
Ксенон
76
Родий
[262]
Pd
106.4
Палладий
131,3
Os 77 Ir 78 Pt
190.2
192.2
Осмий
Иридий
86
Радон
[222]
Bh 108 Hs 109 Mt
Борий
46
54
85 Rn
210
102.905
Рутений
53 Xe
126.904
58.71
Никель
83,8
Tс 44 Ru 45 Rh
Рений
Астат
10
20,18
Mn 26 Fe
Технеций
I
Ne
17 Ar
35,453
Марганец
84 At
208.982
Полоний
106
Хлор
9
18.9984
4,003
[265 ]
Хассий
[266 ]
Мейтнерий
195.09
Платина
9.
II
1
II
2
III
3
4
IV
5
6
V
7
8
VI
9
VII
10
II
III
Группы элементов
IV
V
VI
VII
VIII
Фтор/Fluorum (F)
Внешний вид
Бледно-жёлтый
простого вещества газ.
Очень ядовит.
Электронная
[He] 2s2 2p5
конфигурация
ЭО
3,98
(по Полингу)
Степень окисления −1
Плотность
(при −189 °C)1,108
г/см ³
53,53К
Температура
плавления
Температура
85,01 К
кипения
10.
II
1
II
2
III
3
4
IV
5
6
V
7
8
VI
9
VII
10
II
III
Группы элементов
IV
V
VI
VII
VIII
Хлор / Chlorum (Cl)
Внешний вид
Газ жёлто-зеленого
простого вещества цвета с резким
запахом. Ядовит.
Электронная
[Ne] 3s2 3p5
конфигурация
ЭО
3.16
(по Полингу)
Степень окисления 7, 6, 5, 4, 3, 1, −1
Плотность
(при −33.6 °C)1,56
г/см ³
Температура
172.2 К
плавления
Температура
238.6 К
кипения
11.
II
1
II
2
III
3
4
IV
5
6
V
7
8
VI
9
VII
10
II
III
Группы элементов
IV
V
VI
VII
VIII
Бром / Bromum (Br)
Внешний вид
красно-бурая
простого вещества жидкость с
сильным
неприятным
запахом
Электронная
[Ar] 3d10 4s2 4p5
конфигуранция
ЭО
2,96
(по Полингу)
Степень окисления 7, 5, 3, 1, -1
Плотность
3,12 г/см³
265,9 К
Температура
плавления
Температура
331,9 К
кипения
12.
II
1
II
2
III
3
4
IV
5
6
V
7
8
VI
9
VII
10
II
III
Группы элементов
IV
V
VI
VII
VIII
Ио́д / Iodum (I)
Внешний вид
простого вещества
Черно-фиолетовые
кристаллы с
металлическим
блеском
Электронная
конфигурация
ЭО
(по Полингу)
Степень окисления
Плотность
[Kr] 4d10 5s2 5p5
Температура
плавления
Температура
кипения
386,7 К
2,66
7, 5, 3, 1, -1
4,93г/см³
457,5 К
13.
II
1
II
2
III
3
4
IV
5
6
V
II
III
Группы элементов
IV
V
VI
VII
Аста́т / Astatium (At)
Внешний вид
Нестабильные
простого вещества чёрно-синие
кристаллы
Электронная
[Xe] 4f14 5d10 6s2 6p
5
конфигурация
ЭО
2,2
(по Полингу)
Степень окисления 7, 5, 3, 1, −1
Плотность
n/a г/см
7
8
VI
9
VII
10
VIII
Температура
плавления
Температура
кипения
517 К
582 К
14. Химические свойства
Взаимодействие с металлами:1. 2К + Cl2→ 2КCl
2. 2Fe + 3Cl2 → 2FeCl3
3. Cu + Cl2 → Cu Cl2
4. 2Al + 3Br2 → 2AlBr3
5. 2Al + 3I2 → 2AlI3
15. Химические свойства
Взаимодействие с неметаллами:А) с водородом
1.
2.
3.
4.
H2
H2
H2
H2
+ F2 → 2HF +Q
+ Cl2 → 2HCl +Q
+ Br2 → 2HBr +Q
+ I2 → 2HCl - Q
В) с другими неметаллами
Скорость
реакции
уменьш.
1. 2P + 5Cl2 → 2PCl5 ( tº, в изб.Сl2)
16. Химические свойства
Взаимодействие со сложными веществами:А) с водой
1.
2.
3.
4.
2H2O + F2 → 4HF + O2 (взрыв)
H2O + Cl2 → HCl + HClO хлорная вода
Br2 + H2O → HBr + HBrO бромная вода
I2 + H2O → HI + HIO
17. Химические свойства
Взаимодействие со сложными веществами:Б) «ряд активности» галогенов
F2 > Cl2 > Br2 > I2
1. 2KBr + Cl2 → Br2 + 2КCl
2. 2KI + Cl2 → I2 + 2КCl
3. 2KI
+ Br2 → I2 + 2КCl
В) с органическими веществами:
I2 + крахмал →
18.
FКости, зубы
Br
Регуляция
нервных
процессов
Сl
Кровь, желудочный
сок
I
Регуляция обмена
веществ
19.
ТефлонПрименение
фтора
Заменитель
крови
Фториды
в зубных
пастах
Фреон
Окислитель
ракетного
топлива
20.
Дезинфекцияводы
Органические
растворители
Отбеливатели
Лекарственные
препараты
Применение
хлора
Хлорирование
органических
веществ
Производство
HCl
Получение
неорганических
хлоридов
Получение
брома, йода
21.
Лекарственныепрепараты
Ветеренарные
препараты
Фотография
Применение
брома
Присадки
к бензину
Красители
Ингибиторы
22.
Лекарственныепрепараты
Дезинфекция
одежды
Применение
йода
Фотография
Электролампы
Красители
23. Химические свойства галогенов Вставьте коэффициенты:
Na + Cl2 = NaClS + F2 = SF6
Fe + Br2= FeBr3
P+
Cl2 = PCl5
NaI + Cl2 = NaCl + I2
F2 + H2O = HF + O2
NaBr + Cl2 = NaCl + Br2
KOH + Cl2 = KCl + KClO3 + H2O
24. Подумайте…
Что образуется в даннойреакции, оксид фтора
или фторид кислорода?
F2 + O2























 chemistry
chemistry