Similar presentations:
Алкадієни (дiєнові вуглеводні або дiєни)
1. Алкадієни
АЛКАДІЄНИАлкадiєнами (дiєновими вуглеводнями або
дiєнами) називаються вуглеводнi з вiдкритим
ланцюгом, у молекулах яких є два подвiйнi
С=С-зв’язки. Загальна формула алкадiєнiв
СnН2n-2.
За номенклатурою IUPAC вони мають суфікс дiєн. Їх назви утворюють аналогічно до назв
алкенів.
Положення подвійних зв’язків в головному
ланцюзі
позначається
локантами,
що
ставляться перед перед, або після назви
головного ланцюга.
2.
• За взаємним розмiщенням подвiйних зв’язкiв алкадiєниподiляються на дієни з кумульованими, спряженими та
iзольованими подвійними зв’язками.
• 1. Дієни з кумульованими зв’язками (аленовi дiєни) - це сполуки, у
яких подвiйнi зв’язки знаходяться бiля одного і того ж атома вуглецю.
• СН2= С=СН2
Пропадiєн (ален)
• СН3─СН=С=СН2
1,2-Бутадiєн (метилален)
3. 3. Дiєни з iзольованими подвiйними зв’язками - вуглеводнi, подвiйнi зв’язки яких роздiленi бiльше нiж одним ординарним
2. Дієни зі спряженими подвійними зв’язками (кон’югованi дiєни)- це сполуки, у яких подвiйнi зв’язки роздiленi одним ординарним
зв’язком.
СН2=СН СН=СН2
1,3-Бутадієн (дивініл)
СН2=С СН=СН2
2-Метил-1,3-бутадієн (ізопрен)
СН3
СН2=С СН=СН2
2-Хлоро-1,3-бутадієн (хлоропрен)
СІ
3. Дiєни з iзольованими подвiйними зв’язками - вуглеводнi,
подвiйнi зв’язки яких роздiленi бiльше нiж одним ординарним
зв’язком.
СН2=СН СН2 СН=СН2
1,4-Пентадієн (вінілаліл)
СН2=СН СН2 СН2 СН=СН2
1,5-Гексадієн (діаліл)
Найважливiший тип алкадiєнiв - спряженi дiєни
4. МЕТОДИ ДОБУВАННЯ СПРЯЖЕНИХ ДIЄНIВ
• 1. Дегiдрування алканiв або їх сумiшей з алкенами.СН3=СН СН2 СН3
СН3 СН2 СН2 СН3
Бутан
Cr2O3/Al2O3
1-Бутен
o
300-450 C
-H2
о
650 ,
Cr2O3/Al2O3
-H2
СН2=СН СН=СН2
СН3 СН=СН СН3
(Вихід до 25 %)
2-Бутен
• 2. Дегiдратацiя спиртiв
• 2.1. Метод С.В.Лєбєдєва на основі етилового спирту:
2С2Н5ОН
AI2O3 ZnO
о
450
СН2 СН СН СН2
1,3-Бутадієн
Н2 2 Н2О
5. 2.2. Дегідратація діолів. Дотепер у промисловості застосовують дегiдратацiю двоатомних спиртiв (діолiв). Наприклад,
1,4-бутандiол, який добувають реакцiєюконденсацiї ацетилену i формальдегiду за В.Реппе при нагріванні з
водовідщеплюючими засобами утворює 1,3-бутадієн:
СН СН
2 Н2С=О
Cu2(C C)
НО СН2 C C СН2 ОН
2-Бутин-1,4-діол
НО СН2 С С СН2 ОН
НО СН2 СН2 СН2 СН2 ОН
2 H2
Ni
Na3PO4
300oC
НО СН2 СН2 СН2 СН2 ОН
1,4-Бутандіол
СН2=СН-СН=СН2 + 2 Н2О
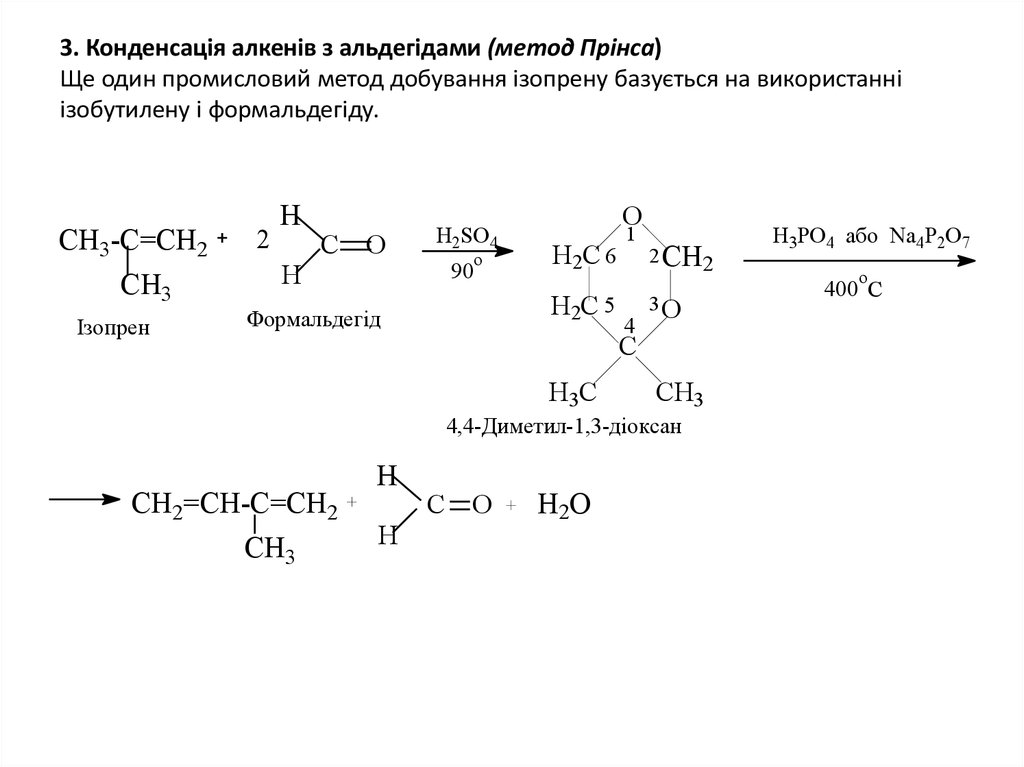
6. 3. Конденсацiя алкенiв з альдегiдами (метод Прiнса) Ще один промисловий метод добування iзопрену базується на використанні
3. Конденсацiя алкенiв з альдегiдами (метод Прiнса)Ще один промисловий метод добування iзопрену базується на використанні
iзобутилену i формальдегiду.
СН3-С=СН2
СН3
Ізопрен
2
Н
С О
Н
H2SO4
90
o
O
H2C 6
H2C 5
Формальдегід
1
4
2 CH2
3O
C
H3C
CH3
4,4-Диметил-1,3-діоксан
СН2=СН-С=СН2
СН3
Н
Н
С О
H2O
H3PO4 або Na4P2O7
o
400 C
7. 4. Добування хлоропрену
• 4.1. З ацетилену (Ю.Ньюленд)СН СН СН СН
Cu2CI2
.
H+
СН2=СН С СН
HCI
Cu
СН2=СH-С=СН2
CI
1-Бутен-3-ін
(вінілацетилен)
• 4.2. 3 1,3- бутадiєну
• Це сучасніший і безпечніший метод в порiвняннi з виробництвом на
основі вiнiлацетилену. 1,3-Бутадієн шляхом хлоруваня перетворюють
у 3,4-дихлоро-1-бутен, який далi пiдлягає дегiдрохлоруванню:
СН2=СН
СН=СН2
CI2
СН2 СH СН СН2
CI CI
3,4-Дихлоро-1-бутен
СН2=СH СН СН2
CI
CI
NaOH
-HCI
СН2=СH С=СН2
CI
Хлоропрен
8. БУДОВА ДІЄНІВ
• Будова 1,3-бутадiєну.• В молекулі 1,3-бутадiєну всі атоми вуглецю перебувають в sp2
гібридному стані. Молекула плоска (всі 10 атомів молекули лежать в
одній площині). В цій же площині розташовані і σ-зв’язки молекули,
які показані рисками.
Н
Н
С4
С2
С1
С3
Н
зв.
Н
Н
Н
зв.
Н
Н
С1
Н
С2
Н
С3
С
4
Н
Н
Вид зверху
• Вісі чотирьох негібридизованих 2р-орбіталей розташовані
перпендикулярно до цієї площини і паралельні між собою. 2рОрбіталі С1, С2 і С3 – С4 попарно перетинаються між собою, утворюючи
два π-зв’язки (на рисунку показані двама рисками). Разом з тим,
перетинання р-орбіталей відбувається і в просторі між С2 і С3 . Отже
має місце, π-π-спряження (на рисунку показане пунктирними лініями),
в результаті чого утворюється єдина спряжена π-електронна система
молекули.
9. Така система характеризується підвищеною термодинамічною стабільністю. Так, реальна ентальпія 1,3-бутадiєну на 13,6 кДж/моль
менша, ніжрозрахована. Цю різницю внутрішньої енергії називають енергією
спряження або енергією резонансу.
• Перерозподіл електронної густини за рахунок π-π-спряження
позначається так:
Н2С СН СН СН2 або Н2С СН СН СН2,
Н2С СН СН СН2
Н2С
1,89
СН
1,45
СН
1,89
СН2,
• Отже в молекулі 1,3-бутадієну нема окремо подвійних і одинарних
вуглець-вуглецевих зв‘язків, що і зумовлює деякі особливості
поведінки 1,3-бутадієну. Зокрема приєднання до спряженої системи
може відбутися як в положення 1,4-, так і в положення 1,2-.
10. 1,3-Бутадiєн завдяки своїй будовi може iснувати у виглядi двох просторових конформерiв. Перехід з одного в другий здійснюється
у результатi обертаннянавколо зв’язку С2-С3, однак, цей перехід утруднений через наявність π-πспряження. Тому обидва ізомери можуть бути легко розділені.
Н
С
Н
С S
С
Н
Н
Н
Н
Н
Н С
С Н
С
С
Н
S-транс-Бутадієн-1,3
(трансоїдне розміщення С=С
зв'язків) відносно одинарного
С С-зв'язку)
Н
S
С
Н
S-цис-Бутадієн-1,3
(цисоїдне розміщення С=С
зв'язків)
• S-транс-форма стабiльнiша, нiж S-цис-форма приблизно на 10-12
кДж/моль i бiля 96% молекул 1,3-бутадiєну-1,3 перебуває в S-трансформi.
11. ХIМIЧНI ВЛАСТИВОСТI Дiєновi вуглеводнi зi спряженими зв’язками
• реакцiї приєднання, аналогiчно алкенам. Але алкадiєни, в порiвняннi залкенами, мають бiльшу реакцiйну здатнiсть.
• 1. Реакцiї електрофiльного i радикального приєднання (АE i АR)
До алкадiєнiв приєднуються як галогени, так і галогенводнi за йонним
або радикальним механiзмами.
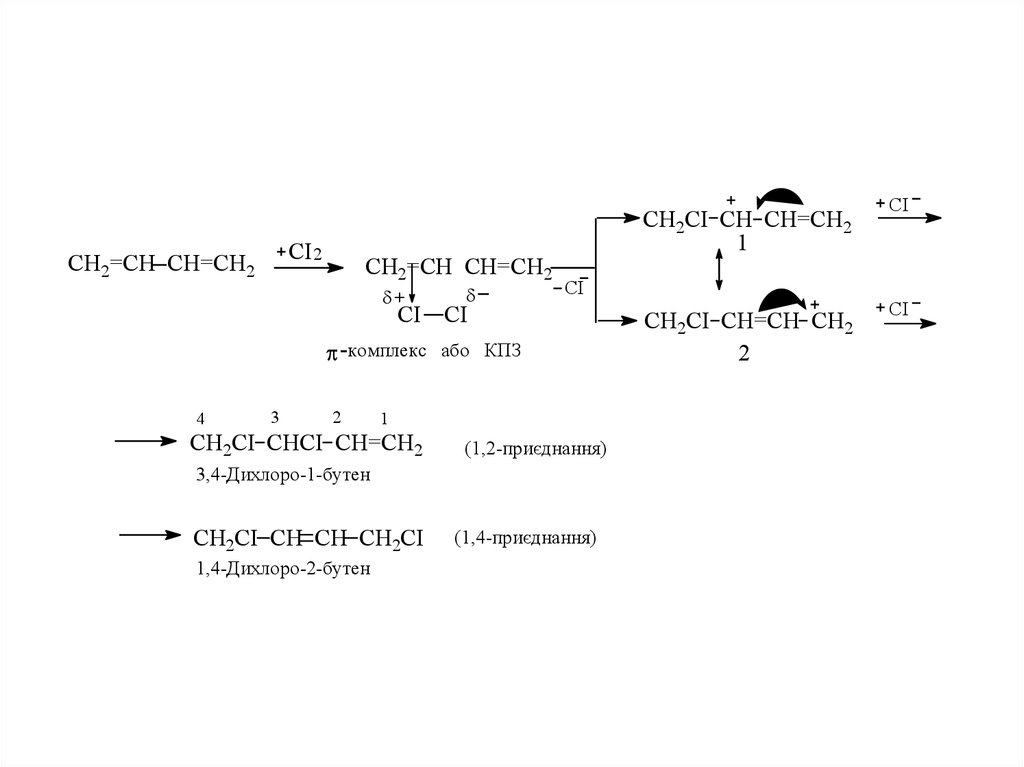
• 1.1.Приєднання галогенiв
Приєднання галогенiв за йонним механізмом протiкає в положення
1,2 та 1,4. Вихiд 1,4-продукту зростає з пiдвищенням температури i при
переходi вiд хлору до йоду. Цей продукт енергетично вигiдніший, нiж
продукт 1,2-приєднання.
12.
СІ 2СН2=СН СН=СН2
СН2=СН СН=СН2
+
СІ
СН2СІ СН СН=СН2
1
СІ
СІ
-комплекс або КПЗ
4
3
2
1
СН2СІ СНСІ СН=СН2
(1,2-приєднання)
3,4-Дихлоро-1-бутен
СН2СІ СН СН СН2СІ
1,4-Дихлоро-2-бутен
(1,4-приєднання)
СН2СІ СН=СН СН2
2
СІ
СІ
13. Приєднання галогенiв за радикальним механiзмом протiкає через стадiю утворення промiжного спряженого радикалу (алiльного типу)
з подвiйноюреакцiйною здатнiстю. Його будову так само можна подати двома граничними
структурами (3) і (4). Цей радикал далі відриває атом від молекули хлору.
Причому переважно утворюються продукти 1,4-приєднання:
СН2=СН-СН=СН2
СІ 2
CI
СН2СІ-СН-СН=СН2
СН2СІ-СН=СН-СН2
Алільний радикал
3
4
СН2СІ-СН=СН-СН2СІ
СІ
14. 1.2. Приєднання галогеноводнiв
• Алкадiєни приєднують галогановоднi переважно, за йонниммеханiзмом, аналогiчно приєднанню галогенiв.
СН2=СН СН=СН2 НCI
СН3 СН-СН=СН2
+СІ
СН2=СН СН=СН2
Н СІ
-Комплекс
СН3 СН СН=СН2
СІ
3-Хлоро-1-бутен
СН3-СН=СН-СН2
+СІ
СН3-СН=СН-СН2
СІ
1-Хлоро-2-бутен
СІ
15. 2. Дiєновий синтез (реакцiя О.Дiльса-К.Альдера, 1928 р.)
• Реакцiя дiєнового синтезу - це приєднання спряжених алкадiєнiв доалкенiв або алкiнiв з утворенням циклiчних сполук (реакцiї
циклоприєднання):
СН
СН
СН
2
СН 2
СН2
o
t
СН2
СН2
НС
СН2
НС
СН 2
СН2
• Реакцiї дiєнового синтезу легко протiкають, якщо алкени мiстять
електроно-акцепторнi групи.
СН2
СН
• СН
СН2
СН 2
100oC
СН
С
СН2
О
Н
Пропеналь
дієнофіл
НС
СН2
СН
НС
СН2
Тетрагідробензойний
альдегід (3-циклогексенкарбальдегід)
С
О
Н
16. 3. Полiмеризацiя алкадiєнiв
• 1,3-Алкадiєни можуть легко полiмеризуватися за участю положень 1,4або 1,2-. У реальних системах реакція вiдбувається одночасно заобома варіантами, але переважає 1,4-приєднання:
1,2-приєдн.
СН2 СН
СН
СН 2 n
n СН2=СН СН=СН2
1,4-приєдн.
СН2 СН=СН СН2 n
• Продукти полiмеризацiї алкадiєнiв називаються синтетичними
каучуками або скорочено - СК.
17. Каучуки і гуми
• Каучуки дiляться на натуральний i синтетичнi.• Натуральний каучук - природний ненасичений полiмер
iзопрену в цис-формi з молекулярною масою вiд 15 тис. до
500 тис., що добувається з соку тропiчних дерев родини
Гевеї бразiльської. Ланки iзопрену приєднані одна до
одної в 1,4-положеннях.
Н
СН3
С С
СН2
СН3
Н
С С
СН2
СН2
Н
СН3
С С
СН2
СН2
СН2
транс-Форма зустрічається в природі у виглядi гутаперчi.
18. Синтетичнi каучуки - аналоги натурального каучуку, що одержують синтетичним шляхом, переважно полімеризацією 1,3-алкадiєнiв.
Бутадiєновi каучуки (СКБ) - полімери 1,3-бутадiєну. Вiдомi бутадiєновiкаучуки з 1,4-цис-, 1,4-транс- та 1,2-будовою. Це каучуки загального
призначення.
Iзопреновий каучук (СКI) - одержують полiмеризацiєю iзопрену в
присутностi каталiзаторiв Циглера-Натта, Al(C2H5)3 і TiCl4. За своїми
властивостями цей каучук наближається до натурального.
• Бутадiєн-стирольнi каучуки - одержують спiльною полiмеризацiєю 1,3бутадiєну i стиролу (стирену). Вони характеризуються високою
стійкістю до стирання і використовуються для виготовлення
атомобільних шин. Їх будова може бути представлена формулою:
CH2 CH CH CH2 CH2 CH
n
• Вмiст зв’язаного стирену до 20%.
C6H5 m
19. Бутадiєн-нiтрильний каучук (СКН) - одержують спiльною полiмеризацiєю 1,3- бутадiєну та акрилонiтрилу (до 40% зв’язаного
Бутадiєн-нiтрильний каучук (СКН) - одержують спiльною полiмеризацiєю 1,3бутадiєну та акрилонiтрилу (до 40% зв’язаного акрилонiтрилу СН2=СН-CN)CH2 CH CH CH2 CH2 CH
n
CN
m
• Хлоропреновий каучук (“Наiрит” або “Неопрен”) - отримують
полiмеризацiєю хлоропрену:
nCH2 C CH CH2
Cl
( CH2 C=CH CH2 )n
Cl
20. Каучуки характеризуються високою пластичністю, еластичністю але низькою пружністю та механічною міцністю. Для збільшення цих
показників каучук перетворюють на гуму. Для цього до каучуку додаютьневелику кількість сірки і нагрівають до 130-150о. Цей процес
називаються вулканізацією. Суть вулканiзацiї полягає в утвореннi нових
поперечних (мiсткових) зв’язкiв мiж полiмерними макромолекулами.
Сьогодні вулканiзацiю здiйснюють не тільки сiркою, але і органічними
пероксидами та iншими сполуками.
S
CH2
CH CH CH2
CH2
CH CH CH2
S
Sn
CH2
CH CH CH2
S
CH2
CH CH CH2
S
Каучук
Гума
• Гуми, на вiдмiну вiд каучукiв, не розчиняються в органiчних
розчинниках, мають високу еластичнiсть i механiчну мiцнiсть.


















 chemistry
chemistry








