Similar presentations:
Строение и свойства белков
1.
Введение в биохимию.Строение и свойства белков.
2.
• Биохимия – наука о химическомсоставе живых организмов и
химических процессах в них
протекающих.
3. Основные разделы биохимии:
• 1 – статическая• 2 – динамическая
• 3 – функциональная
4. Задачи
• статической БХ – изучениехимического состава организмов и
структуры составляющих их
молекул (белков, аминокислот,
нуклеиновых кислот, нуклеотидов,
углеводов, липидов, витаминов,
гормонов)
5.
• динамической БХ - изучениехимических превращений,
происходящих в процессе
жизнедеятельности организма
• функциональной БХ - изучение
химических основ функционирования
отдельных органов и тканей.
6.
Биохимия человека
Молекулярная биология
Генная инженерия
Биотехнология
Медицинская биохимия
Экологическая биохимия
Эволюционная биохимия
Квантовая биохимия
и т.д.
7.
КонстантинСигизмундович Кирхгоф
(русский
химик,
академик
Петербургской АН
(1764-1833)
8.
Академик А.Я.Данилевский один из
основоположников
биохимии
в России
(1838-1923)
9.
НиколайИванович
Лунин
(1853-1937)
10.
немецкийхимик
Эмиль
Фишер
(1853-1919)
11.
АлексейНиколаевич
Бах
(1857-1948)
12.
• АльбертЛестер
Ленинджер –
один из
основоположников
биоэнергетики
(1917-1986)
13.
ЭнгельгардтВладимир
Александрович
(1894 -1984)
14.
• Белки - это полипептиды,способные самопроизвольно
формировать и удерживать
определенную
пространственную структуру.
15. Функции белков
Функции белков
каталитическая (ферменты),
регуляторная (гормоны),
строительная
(структурообрузующие белки),
двигательная (сократит. белки),
транспортная
защитная (антитела),
энергетическая (белки, уч-щие в
энергетическом обмене)
16.
• В 1952 г. датский биохимик К.Линдерштрем-Ланг предложил
рассматривать четыре уровня
организации белковой молекулы:
первичную, вторичную,
третичную и четвертичную
структуры.
17.
18.
Первичная структура19.
20.
21. Свойства пептидной связи:
• на 10% короче одинарной связи (1,53 Å)• расположение С и N в одной плоскости
• постоянное перемещение электрона
между O и N, что приводит к
образованию частично двойной связи.
• возможно образование цис-транс
изомерии относительно пептидной связи
• возможность образования водородной
связи засчет Н пептидной группы
22. Вторичная структура -
Вторичная структура • пространственное расположение атомовглавной цепи молекулы белка на
отдельных ее участках.
• Надвторичные структуры термодинамически или кинетически
стабильные комплексы альфа-спиралей
и бета-структур, формирующиеся за счет
межрадикальных взаимодействий.
23. Вторичная структура
24.
25. Области с нерегулярной вторичной структурой – беспорядочный клубок
26.
• Пространственная структура каждогобелка индивидуальна и
определяется его первичной
структурой.
• Но у разных белков есть похожие
сочетания элементов вторичной
структуры – это называют
супервторичной структурой
(«структурные мотивы»: α/β бочонок,
цинковый палец, лейциновая
застежка-молния и т.д.)
27. Третичная структура
28. Четвертичная структура: пример - гемоглобин
29.
• Фолдинг – укладка белка впространстве (формирование
вторичной, третичной
структуры)
30.
31.
• «Шапероны» - белки, помогающиесинтезируемому белку быстро
найти правильную
пространственную ориентацию
• Впервые были обнаружены при
перегреве организма → белки
теплового шока
32.
• ШП много в функциональноактивных тканях:
эмбриональной, лимфатической,
яичников и т.д.
33. Физико-химические свойства белков
• Белки – высокомолекулярныесоединения, их Mr 6000 -1 000 000 Д
и выше.
• По форме молекул белки делят на
глобулярные и фибриллярные.
34. Коллоидные свойства:
Коллоидные свойства:
высокая вязкость и способность
к гелеобразованию,
способность к набуханию,
неспособность проникать через
полупроницаемые мембраны,
незначительная диффузия,
низкое осмотическое и высокое
онкотическое давление,
оптические свойства
35.
• Растворы белков обладаютхарактерной опалесценцией.
Эффект Тиндаля: при боковом
освещении лучи света образуют
светящийся конус
36. Способность к ионизации
Определяется наличием всоставе белка аминокислот:
диаминомонокарбоновых асп, глу
и моноаминодикарбоновых лиз, арг, гис
37.
Суммарный заряд белка зависитот рН среды:
• в кислой среде
-СОО- + Н+ → -СООН
• в щелочной среде
-NH3+ +ОН- → -NH2 + H2O
38.
→ подвижность в электрическомполе
• Значение рН, при котором белок
электронейтрален, называется
изоэлектрической точкой
39. Растворимость и осаждаемость белков
• Растворимость белков в водезависит от:
формы, молекулярной массы,
величины заряда, соотношения
полярных и неполярных
функциональных групп на
поверхности белка
40. Осаждение белков:
• 1. Высаливание нейтральнымисолями, н-р, (NH4)SO4 обратимый процесс, белок теряет
гидратную оболочку, нативные
свойства сохраняются .
41.
• 2. Осаждение белков с потерейнативных свойств: с белка
снимается гидратная оболочка и
заряд, нарушаются различные
свойства в белке. Н-р, соли Cu,
Hg, As, Fe, концентрированные
неорганические кислоты - HNO3,
H2SO4, HCl, органические
кислоты, алкалоиды - танины,
йодистая ртуть.
42. Необратимое осаждение белка - денатурация
Необратимое осаждение белка денатурация1. Физические факторы денатурации:
температура, давление,
механическое воздействие,
ультразвуковое и ионизирующее
излучение.
2. Химические факторы денатурации:
кислоты, щелочи, органические
растворители, детергенты,
тяжелые металлы, алкалоиды.
43. Ренатурация (ренативация) – обратимый процесс денатурации
Процесс восстановления физикохимических и биологическихсвойств денатурированного белка
после удаления денатурирующих
веществ.
44. Методы выделения и очистки белков
• гомогенизация - клетки растираютсядо однородной массы;
• экстракция белков водными или
водно-солевыми растворами;
• высаливание;
• диализ / гель-фильтрация;
• электрофорез;
• хроматография;
• ультрацентрифугирование.
45.
Для обнаружения белков врастворе применяются:
• цветные реакции
• реакции осаждения
46. Диализ
47. Гель-фильтрация белков
48. Ультрацентрифугирование
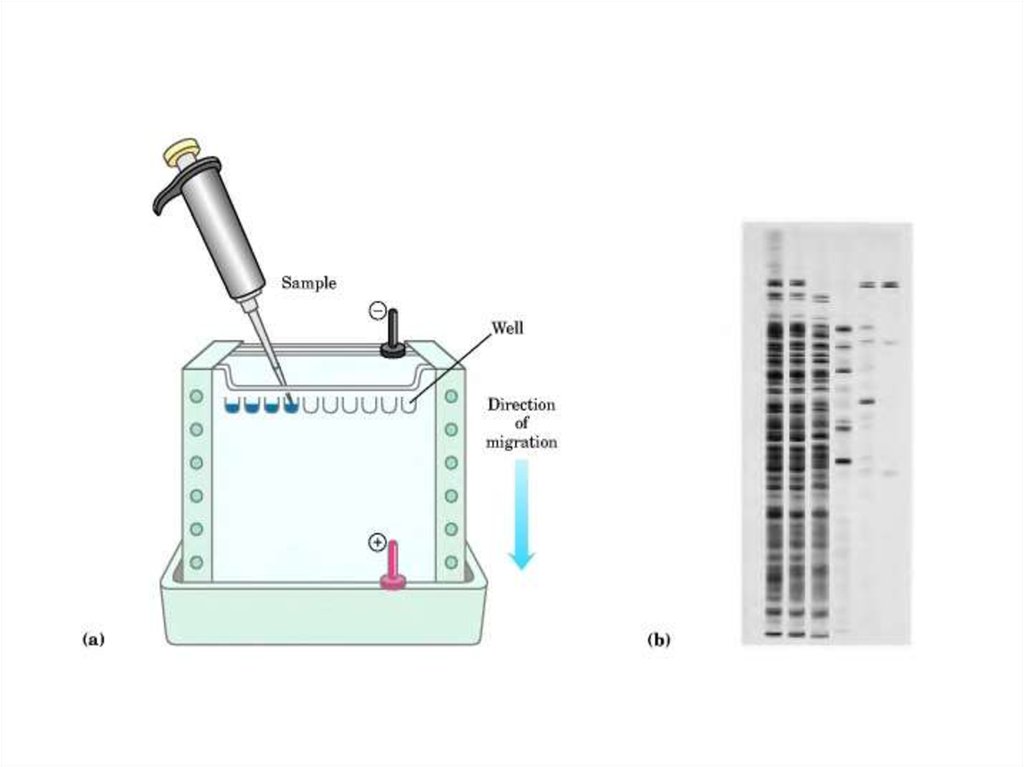
49. Электрофорез белков
50. ЭФ белков сыворотки крови здорового человека на бумаге
51.
52.
53. Хроматография белков
54. Различают:
• положительно заряженныеанионообменники, н-р,
диэтиламиноэтилцеллюлоза
(ДЭАЭ-целлюлоза), содержащая
катионные группы
• отрицательно заряженные
катионообменники, н-р
карбоксиметилцеллюлоза
(КМ-целлюлоза), содержащая
анионные группы.


























































 biology
biology chemistry
chemistry








