Similar presentations:
Спирты и простые эфиры
1. ОСОБЕННОСТИ СТРОЕНИЯ, РЕАКЦИОННОЙ СПОСОБНОСТИ И МЕТОДЫ СИНТЕЗА СПИРТОВ И ПРОСТЫХ ЭФИРОВ
12. Спирты
Соединения, в молекулу которыхвходит одна или несколько
гидроксильных групп, называются
спиртами.
Общая формула
R−OH
карбинолы
2
3. Спирты
Почислу
гидроксильных
групп
спирты
подразделяются на:
- одноатомные
CH3OH, C2H5OH
- двухатомные
CH2OH
CH2OH
- многоатомные
CH2OH
CHOH
CH2OH
3
4.
В зависимости от того, с каким углеводородным остатком связангидроксил, спирты бывают
-
-
предельные спирты
этанол
CH3-CH2-OH
пропанол-1
CH3-CH2-CH2-OH
непредельные спирты
аллиловый спирт
CH2=CH-CH2-OH
4
5. Спирты
Предельный одноатомные спиртыИзомерия и номенклатура
Наиболее часто встречающиеся спирты
CH3OH
CH3CH2OH
CH3CH2CH2OH
CH3CH(OH)CH3
CH3CH2CH2CH2OH
CH3CH2CH(OH)CH3
CH3CHCH2OH
карбинол, метиловый спирт, метанол
этиловый спирт, этанол
пропиловый спирт, 1-пропанол
изопропиловый спирт, 2-пропанол
перв-бутиловый спирт, 1-бутанол
втор-бутиловый спирт, 2-бутанол
изобутиловый спирт, 2-метил-1-пропанол
CH3
OH
CH3CCH3
трет-бутиловый спирт, 2-метил-2-пропанол
CH3
5
6. Спирты
Предельный одноатомные спиртыИзомерия и номенклатура
CH3CHCH2CH2OH
3-метил-1-бутанол
CH3
CH3
CH3 C CH2OH
2,2-диметил-1-пропанол
CH3
OH
CH3CCH3
2-метил-2-пропанол
CH3
6
7. Спирты
Методы полученияГидрирование альдегидов и кетонов
RCH2CHO
H2
Pd/C
RCH2CH2OH
R C R'
H2
R CH R'
O
Pd/C
OH
При гидрировании альдегиды превращаются в первичные, а
кетоны – во вторичные спирты
7
8. Спирты
Методы полученияВосстановление карбоновых кислот и сложных эфиров
Восстановление алюмогидридом лития
RCOOH
CH3COOH
LiAlH4
LiAlH4
RCH2OH
CH3CH2OH
8
9. Спирты
Методы полученияВосстановление карбоновых кислот и сложных эфиров
Гидрирование
C11H23COOCH3
H2
Pd/C
C11H23CH2OH + CH3OH
Восстановление по Буво и Блану
C11H23COOCH3
C2H5OH, Na
C11H23CH2OH + CH3OH
9
10. Спирты
Методы полученияДругие способы
Получение метанола гидрированием оксида углерода (II)
0
400 C,
200-300 атм
CO + 2H2
CH3OH
Получение этанола брожением глюкозы
C6H12O6
2CH3CH2OH + 2CO2
10
11. Спирты
Химические свойстваДегидратация (идет по правилу Зайцева)
Внутримолекулярная дегидратация – идет образование
алкенов
CH3CHCH2CH3
H2SO4
CH3CH CHCH3 + H2O
OH
Правило Зайцева: при дегидратации вторичных и третичных
спиртов
в
присутствие
сильных
кислот
и
при
дегидрогалогенировании
вторичных
и
третичных
алкилгалогенидов
под
действием
оснований
протон
отщепляется
преимущественно
от
наименее
гидрогенизированного атома С
11
12. Спирты
Химические свойстваДегидратация
Межмолекулярная дегидратация – идет образование
простых эфиров
o
CH3CH2OH + CH3CH2OH
o
140 C - 170 C
CH3CH2OCH2CH3
12
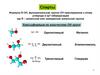
13. Спирты
Химические свойстваКислотно-основные свойства
ROH + Na
RO Na + 1/2 H2
алкоголят Na
RO Na + H2O
более
сильная
кислота
HC
C Na + ROH
более
сильная
кислота
NaOH + ROH
более
слабая
кислота
RO Na + HC
CH
более
слабая
кислота
13
14. Спирты
Химические свойстваКислотно-основные свойства
В ряду спиртов кислотность изменяется в следующем порядке:
CH3OH > первичный > вторичный> третичный
14
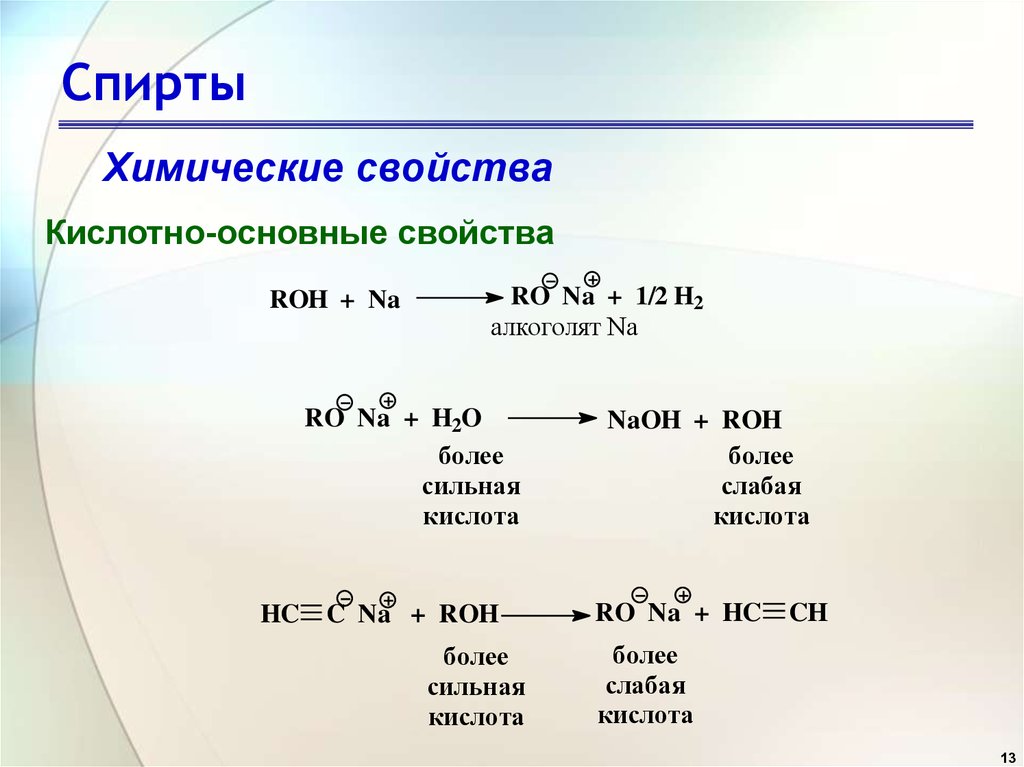
15. Спирты
Химические свойстваЗамещение OH-группы на галоген
CH3
CH3 C OH + HCl
CH3
CH3
CH3 C Cl + H2O
CH3
15
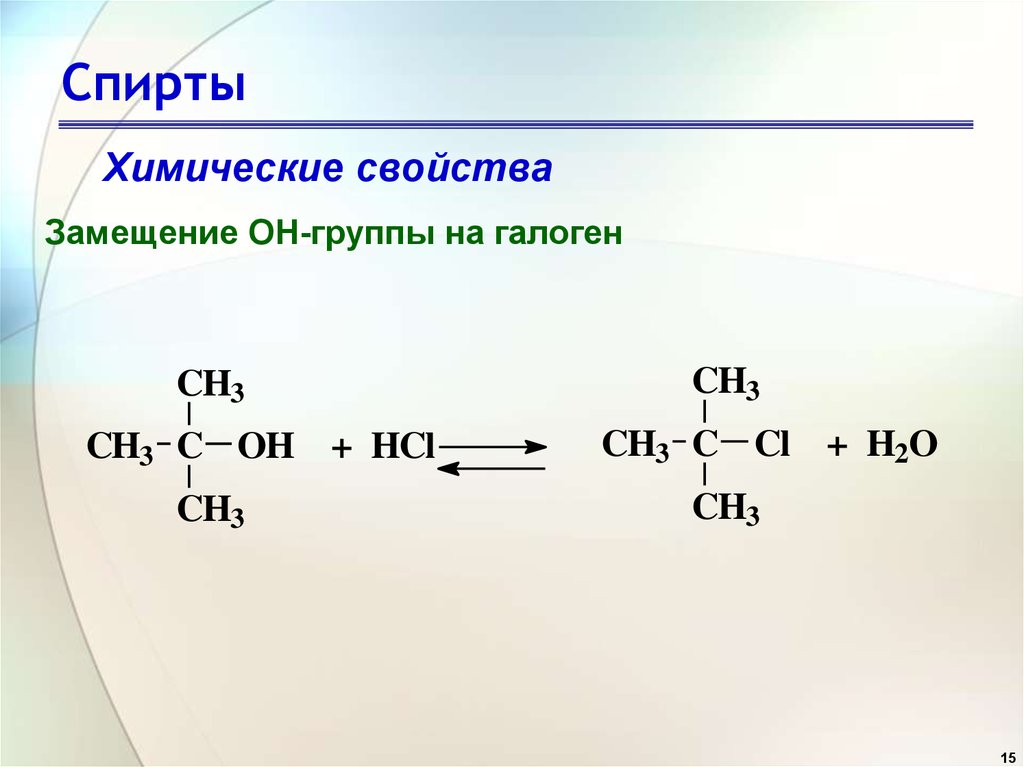
16. Спирты
Химические свойстваЗамещение OH-группы на галоген
Галогенирование спиртов хлористым тионилом
O
ROH + SOCl2
-HCl
ROSCl
RCl + SO2
16
17. Спирты
Химические свойстваОбразование сложных эфиров (этерификация)
RCOOH + R'OH
H2SO4
O
R C OR' + H2O
17
18. Спирты
Химические свойстваОкисление спиртов
Первичные спирты легко окисляются и образуют альдегиды
RCH2OH
K2Cr2O7
R C
O
H
Вторичные спирты при окислении образуют кетоны
OH
CH3CH2CHCH3
KMnO4
O
CH3CH2CCH3
Третичные спирты окисляются с большим трудом и только
с разрывом связей между углеродными атомами
18
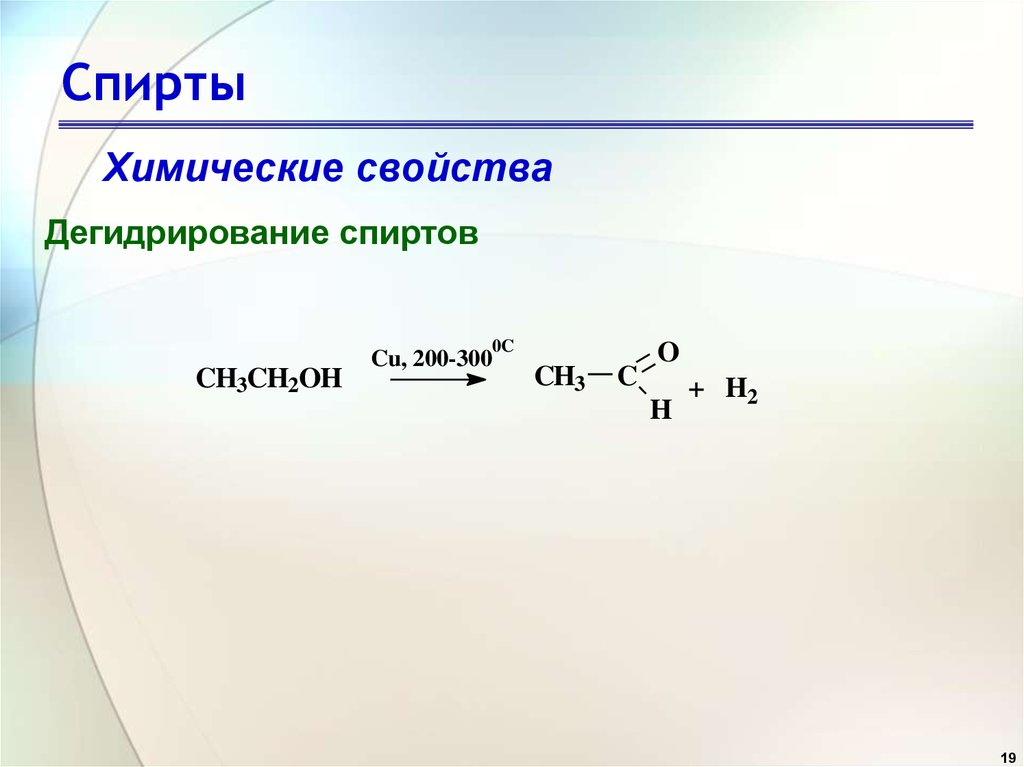
19. Спирты
Химические свойстваДегидрирование спиртов
0C
CH3CH2OH
Cu, 200-300
CH3
C
O
H
+ H2
19
20. Простые эфиры
- это соединения, в молекуле которых кислород связан сдвумя одинаковыми или различными углеводородными
остатками. Общая формула R-O-R или R-O-R`
Представители
CH3OCH3
диметиловый эфир, метоксиметан
CH3OCH2CH3
метилэтиловый эфир, метоксиэтан
CH3CH2OCH2CH3
CH3
CH3
C O CH3
CH3
диэтиловый эфир, этоксиэтан
метил-трет-бутиловый эфир
2-метил-2-метоксипропан
20
21. Простые эфиры
Химические свойстваРасщепление эфирной связи
2H2SO4
C2H5OC2H5
конц. H2SO4
2C2H5OSO3H
C2H5OSO2OC2H5 + H2O
21
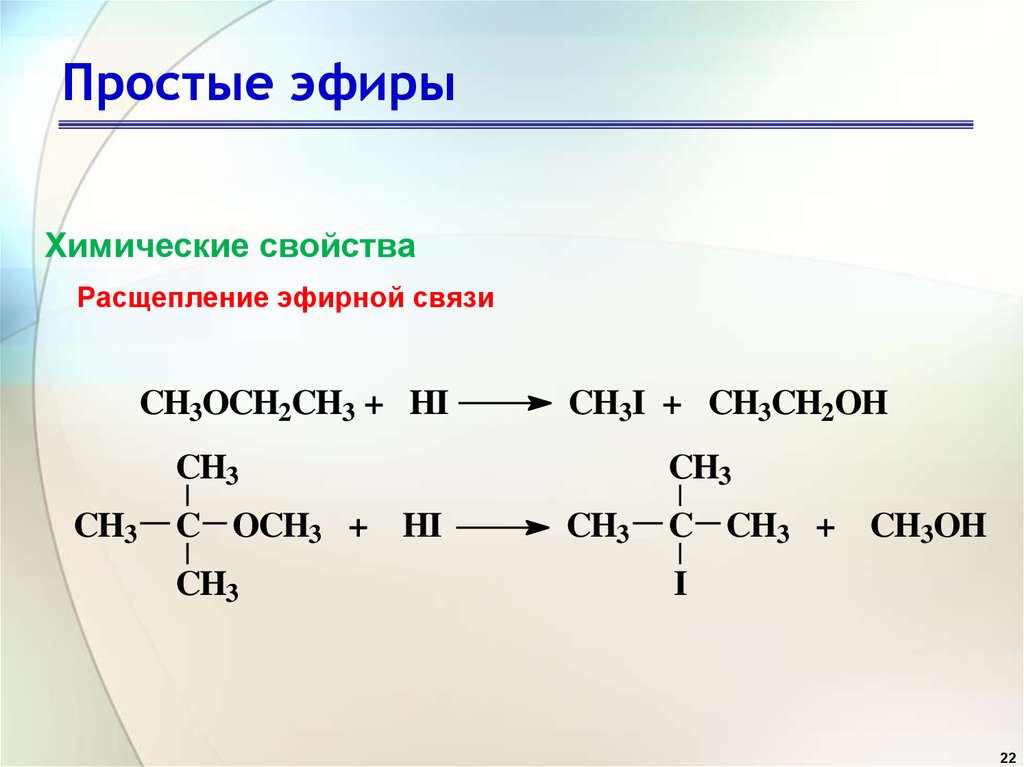
22. Простые эфиры
Химические свойстваРасщепление эфирной связи
CH3OCH2CH3 + HI
CH3I + CH3CH2OH
CH3
CH3
C OCH3 + HI
CH3
CH3
CH3
C CH3 + CH3OH
I
22
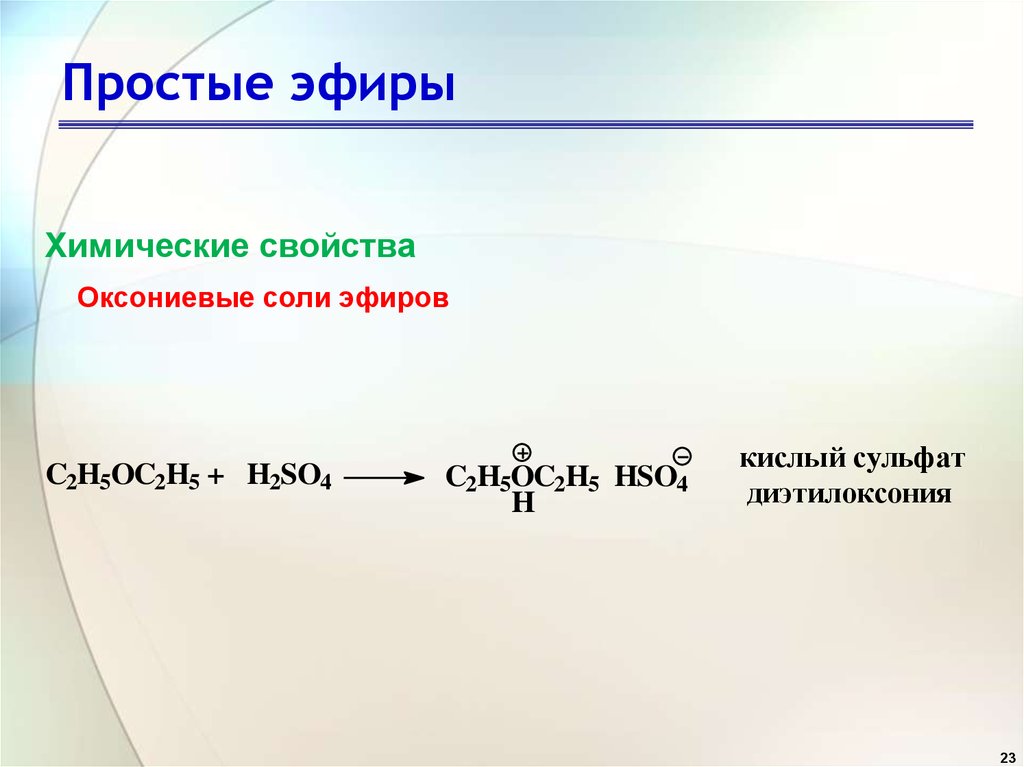
23. Простые эфиры
Химические свойстваОксониевые соли эфиров
C2H5OC2H5 + H2SO4
C2H5OC2H5 HSO4
H
кислый сульфат
диэтилоксония
23
24. Простые эфиры
Химические свойстваОбразование гидроперекисей
CH3CH2OCH2CH3
O2
CH3CHOCH2CH3 пероксид
диэтилового эфира
OOH
24


















 chemistry
chemistry