Similar presentations:
Белки
1.
Типы белков1. Структурные белки. Входят в состав наружных клеточных
и
внутриклеточных
мембран,
формируют
цитоскелет,
обеспечивающий поддержание формы клетки. Входят в состав всех
органелл клетки и хромосом.
Входят в состав соединительных тканей и обеспечивают
"архитектурный остов" всех органов, сосудов и организма в целом.
Входят в состав скелета (кости, хрящи, связки).
2.
Сократительные белки. Обеспечивают сокращение мышц
сосудов и внутренних органов (гладкая мускулатура), сердца и
скелетных мышц (поперечно-полосатая мускулатура).
3.
Энергетические белки. Состоят из аминокислот, которые
"сгорают" с выделением энергии и которые могут быть
синтезированы в клетке из продуктов расщепления углеводов и
липидов. Запасной источник энергии.
2.
4.Белки, трансформирующие энергию:световую в электрическую (белки сетчатки глаза),
энергию химических связей в механическую (несократительные
белки мышц).
5. Защитные белки.
В иммунной системе: защита организма от вирусов, бактерий,
паразитов, чужеродных веществ и последствий
внутриорганизменных нарушений (интоксикация, образование
опухолевых клеток и т.д.).
В крови: защита от потери крови (образование тромба при травме
кровеносных сосудов) и восстановление кровотока - рассасывание
тромба.
6. Транспортные белки.
В крови: транспорт газов, неорганических элементов,
низкомолекулярных органических веществ, в том числе
регуляторных.
В клетке: перенос полярных соединений через мембрану как по, так
и против градиента концентрации, участие во внутриклеточном
транспорте.
3.
7. Регуляторные белки:Многие гормоны и цитокины.
Регуляторы проницаемости клеточных и внутриклеточных
мембран: обеспечивают поступление веществ в клетку и их
выведение, в том числе активный транспорт веществ, идущий
против градиента концентрации.
Внутриклеточные регуляторы: образование, активность и распад
вторичных посредников, внутриклеточных белков и регуляция
генетической активности.
8. Сигнальные белки:
Рецепторы клеток: воспринимают сигналы химической и
физической природы.
Маркёры клеток: воспринимаются клетками иммунной системы.
4.
9. Каталитические белки: ферменты (энзимы). Осуществляютхимические реакции в организме (синтез и распад различных
соединений), а также активизацию и инактивацию различных
веществ.
10. Буферные белки.
1) способствуют поддержанию определенных значений
кислотности в разных отсеках клетки.
2) способствуют поддержанию осмотического давления
11. Питательные белки:
1) источники незаменимых аминокислот (не могут быть
синтезированы в организме и должны поступать извне).
2) источники питания для развития зародыша.
3) источники питания для вскармливания младенца.
Общее число белков в организме человека ~ 50 000
5.
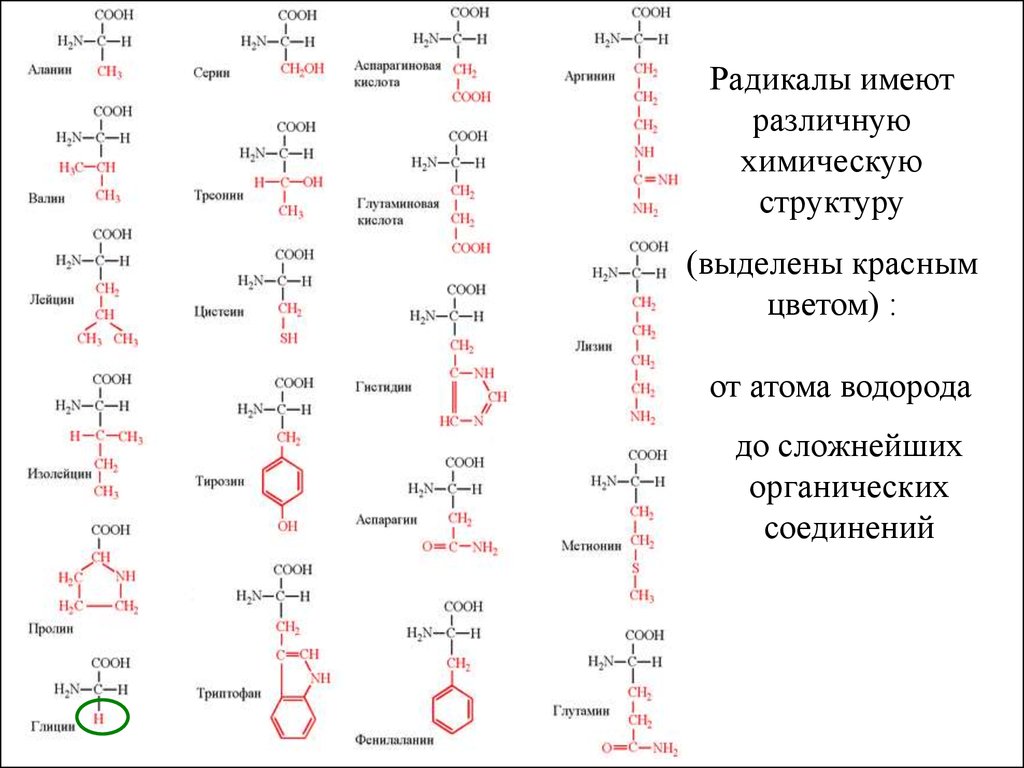
Элементами молекулы белка являютсяаминокислоты
Аминокислота
содержит
одновременно и
кислотную
функциональную группу,
и аминогруппу
6.
Радикалы имеютразличную
химическую
структуру
(выделены красным
цветом) :
от атома водорода
до сложнейших
органических
соединений
7.
Незаменимыеаминокислоты
Незаменимыми
называются
аминокислоты,
которые не могут
быть
синтезированы
организмом из
веществ,
поступающих с
пищей, в
количествах,
достаточных для
того, чтобы
удовлетворить
физиологические
потребности
организма
8.
9.
Полипептидные цепиВысокомолекулярные (одно- и многоцепочечные) белки:
от 50 до нескольких тысяч аминокислот.
Олигопептиды - от 2 до 50 аминокислот:
Дипептиды (из двух аминокислот) - свыше 400,
Трипептиды (три аминокислоты) – свыше 8000,
Тетрапептиды (четыре аминокислоты) – более 160 000,
Гексапептиды (шесть аминокислот) – более 64 000 000.
10.
Разнообразие строения белков обусловлено огромным числомвозможных вариантов расположения аминокислотных остатков в
полипептидных цепях
У трипептида, состоящего из трех разных аминокислот,
возможно 3! = 6 различных первичных структур.
У олигопептида, состоящего из двадцати разных
аминокислот, разнообразие первичных структур 20!, это ≈
2х1018.
Разнообразие первичных структур среднего по размеру
белка (примерно 500 аминокислот) составляет уже ≈ 20500
вариантов (если все аминокислоты представлены в
эквимолярных соотношениях).
На Земле не было, нет и не будет двух людей с
полностью одинаковым набором белков.
11.
Простые белки (протеины):Содержат только аминокислотные остатки
Сложные белки:
+ углеводы (гликопротеины),
+ жироподобные вещества (липопротеины)
+ неорганические ионы (металлопротеины).
12.
Формирование гликопротеиновСпецифический
фермент
Специфические
ферменты
Полипептидная цепь
Улеводный
комплекс (до 15
моносахаров)
Специфические
ферменты
Доля гликопротеинов среди белков:
Поджелудочный сок – 4,7 %
Коровье молоко – 58 %
Белки крови – 60 %
Куриное яйцо – 97 %
13.
Углеводные компоненты молекулы гликопротеиновнеобходимы для:
Межклеточного узнавания
(группы крови, оплодотворение, фагоцитоз),
Взаимодействия клеток с вирусами,
Связывания гормонов с рецепторными белками
Удержания в кровотоке (защищает от ферментов
расщепления)
Встраивания в мембрану
(PIG-tailed = Phospho-Inositol-Glican
белки со «свиными хвостиками»)
14.
Формирование липопротеиновЛипидный якорь
Липидная группировка
Специфический
фермент
Различные остатки
жирных кислот
Полипептидная цепь
Специфический
фермент
Остатки жирных кислот делают конец
полипептидной цепи гидрофобным и дают
возможность взаимодействовать с
липидами мембраны
15.
Липидные компоненты надежно удерживают белок впримембранном состоянии
16.
МеталлопротеиныИоны, входящие в состав белков:
Магний, Ванадий, Марганец, Железо, Никель, Медь, Цинк,
Молибден, Селен
Имеют химические и координационные связи с
аминокислотными остатками
17.
Сложные молекулы : белок + небелковое веществоНапример, гемоглобин состоит из глобина и гема
Гем связан с белком нековалентными связями.
Гем
Глобин
18.
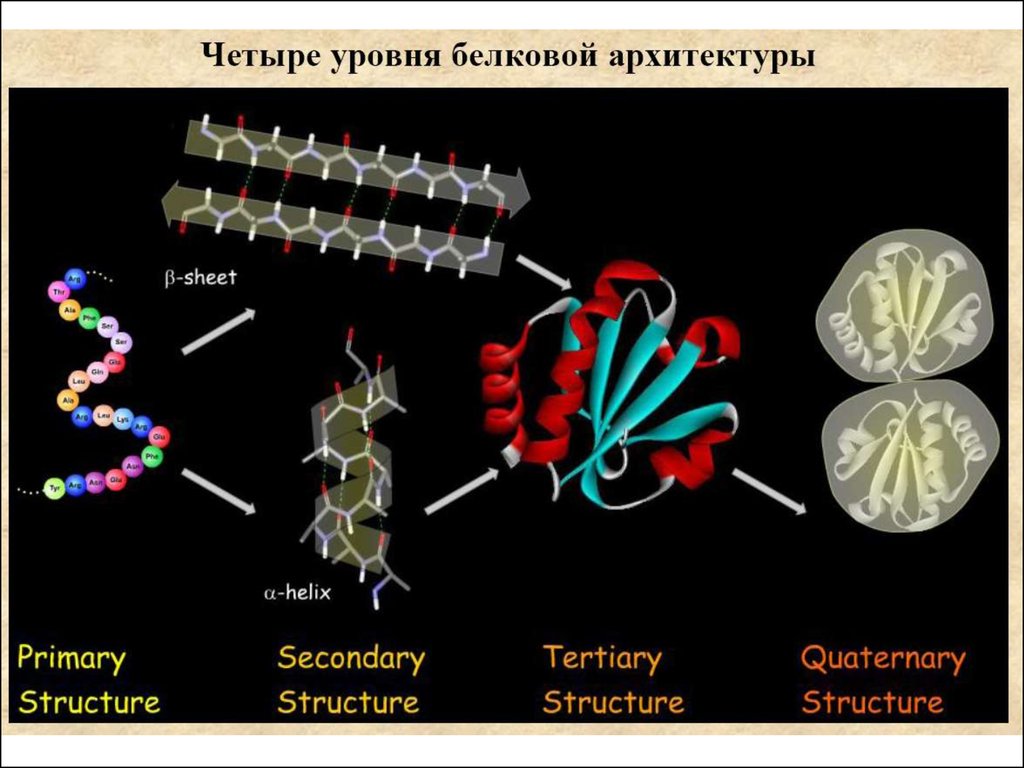
Первичная структура белка - это последовательностьрасположения аминокислотных остатков в полипептидной
цепи.
19.
Вторичная структура белка - это упорядоченное расположениеотдельных участков полипептидной цепи, обусловленное
водородными связями между различными группами разных
аминокислотных остатков, находящихся в сближенном
состоянии.
Благодаря этому
соседние молекулы
АК2
могут
Водородная связь
АК1
на водороде
локализуется
частично
положительный
заряд
Н
С
N
Н
электростатически
притягиваться друг
к другу.
-
+
О
О
Н
на кислороде –
частично
отрицательный
заряд
О
~ 0,3 нм
АК3
АК4
Такой тип
электростатического
притяжения между
частичными
зарядами
электронейтральных
молекул называется
водородной связью,
Энергия, необходимая для
разрушения одной водородной
связи, составляет 18,8
кДж/моль, энергия ,
необходимая для разрушения
одной ковалентной связи Н–О,
равна 460 кДж/моль.
20.
ОБРАЗОВАНИЕ ВНУТРИМОЛЕКУЛЯРНЫХВОДОРОДНЫХ СВЯЗЕЙ (изображены пунктирными
линиями) в молекуле полипептида
Водородные связи
внутри полипептидной
цепи
21.
Первичнаяструктура
Вторичная
структура
Водородные
связи
Формирование α-спирали
22.
ОБЪЕМНАЯ МОДЕЛЬ МОЛЕКУЛЫ БЕЛКА в форме aспирали. Водородные связи показаны зеленымипунктирными линиями
23.
Образование изгиба складкибета-структура белка
24.
В одном и том же белке могут присутствоватьвсе три способа укладки полипептидной цепи:
25. Прямолинейные участки – спирализованные фрагменты (8 спиралей). Изгибы – неспирализованные фрагменты
МиоглобинГем
Прямолинейные участки – спирализованные фрагменты (8 спиралей).
Изгибы – неспирализованные фрагменты
Всего 80 межатомных контактов.
26.
Третичная структура белка – это трехмерная конфигурацияплотной укладки полипептидной цепи. Имеет форму компактного
клубка (глобула) или нитевидных волокон (фибриллы)
Обусловлена взаимодействием между всеми компонентами
молекулы, как ковалентными, так и нековалентными
Первичная структура
Глобула
Фибриллы
Вторичная
структура
27.
Полипептидная цепь, свернутая в глобулу28.
Третичная структура – основа функциональностибелка
1. Необходима для формирования активного центра фермента
Активный
центр
Глобула молекулы фермента
29.
2. Необходима для формирования центра связывания другихмолекул
30.
3. Необходима для формирования регуляторныхцентров белка
31.
4. Необходима для формирования якоря для мембранныхбелков
Внемембранные петли
Внутримембранные αспирали. Содержат
гидрофобные
аминокислоты (не
имеют контакта с
водой)
Внемембранные петли
32.
Якорь может быть связан с одним или несколькими участкамимембраны
33.
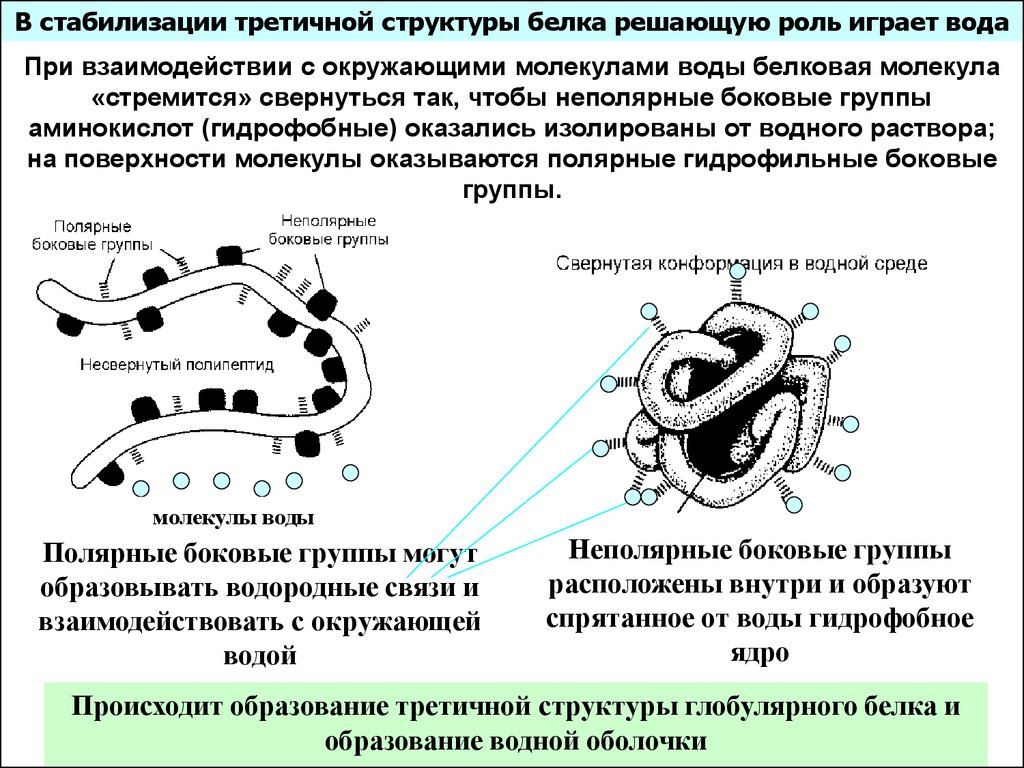
В стабилизации третичной структуры белка решающую роль играет водаПри взаимодействии с окружающими молекулами воды белковая молекула
«стремится» свернуться так, чтобы неполярные боковые группы
аминокислот (гидрофобные) оказались изолированы от водного раствора;
на поверхности молекулы оказываются полярные гидрофильные боковые
группы.
молекулы воды
Полярные боковые группы могут
образовывать водородные связи и
взаимодействовать с окружающей
водой
Неполярные боковые группы
расположены внутри и образуют
спрятанное от воды гидрофобное
ядро
Происходит образование третичной структуры глобулярного белка и
образование водной оболочки
34.
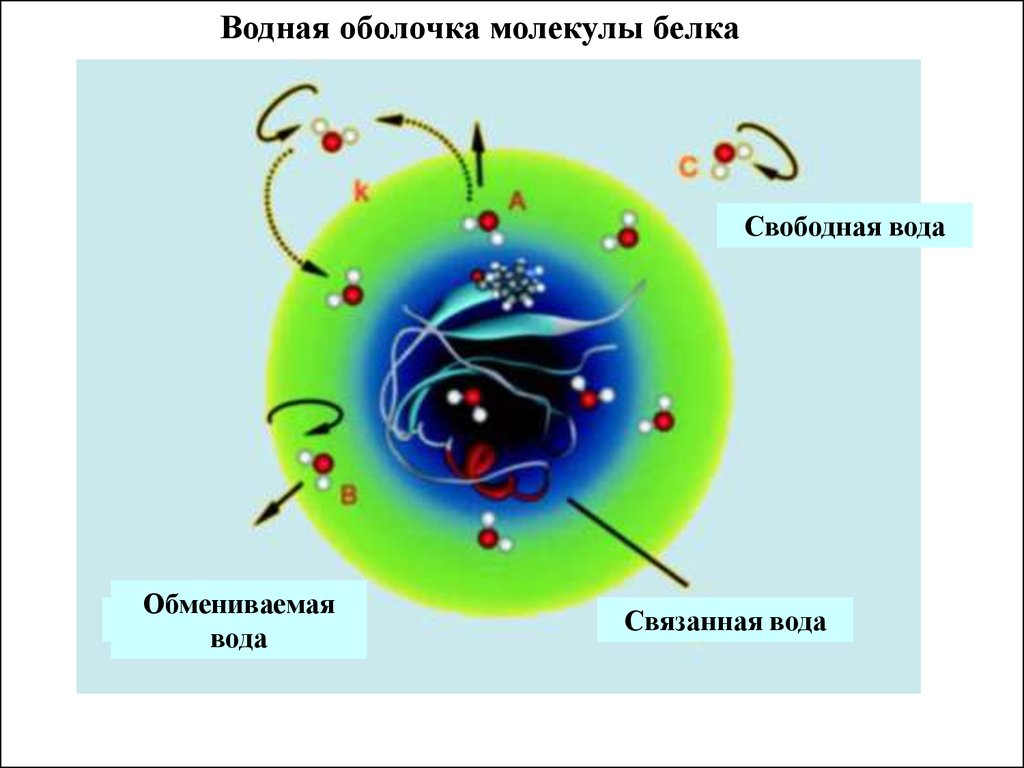
Водная оболочка молекулы белкаСвободная вода
Обмениваемая
вода
Связанная вода
35.
Гидратная оболочка36.
Третичная структура задаёт конформацию белка –определенный вариант взаимной ориентации групп атомов в
молекуле
Схема пространственной
структуры маленького белка
(регулятор активности фермента
поджелудочного сока)
37.
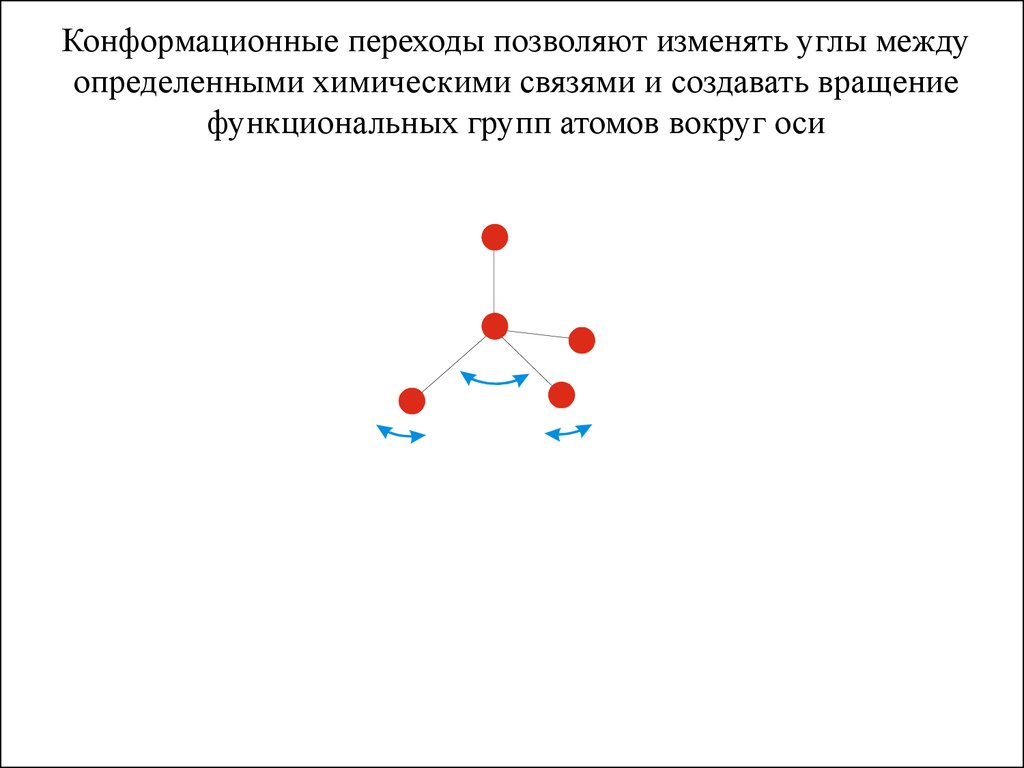
Конформационные переходы позволяют изменять углы междуопределенными химическими связями и создавать вращение
функциональных групп атомов вокруг оси
38.
и создавать торсионные вращения (от фр. torsion —скручивание, кручение)
39.
В реальной ситуации имеет место комбинация всехвозможных переходов
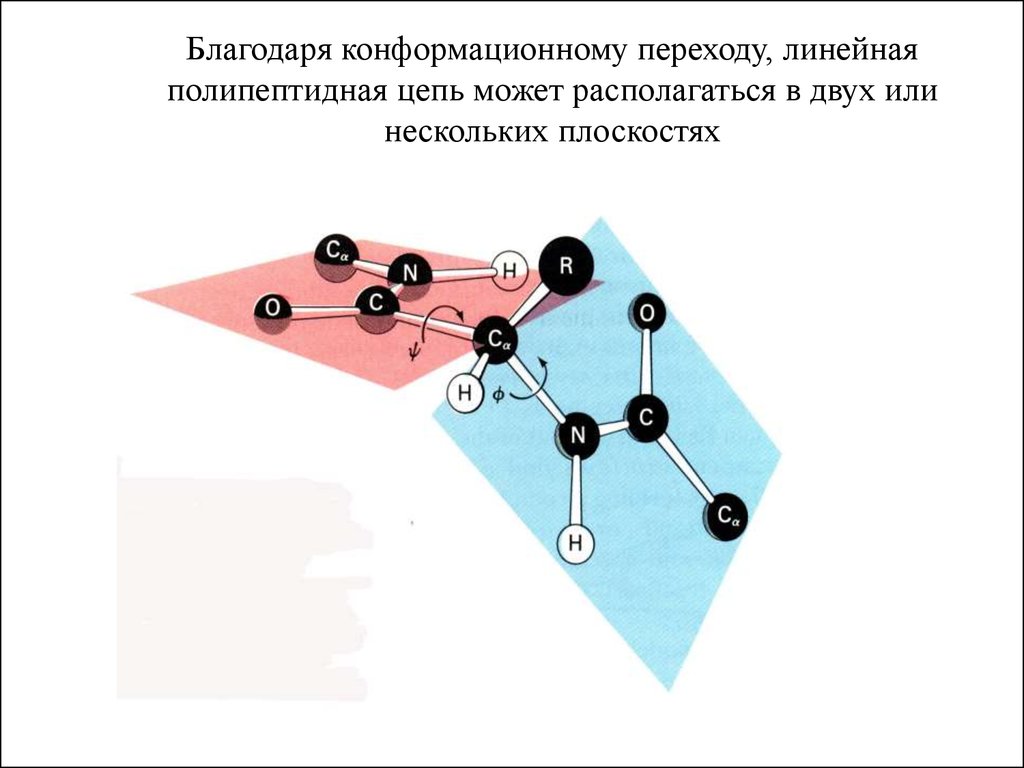
40.
Благодаря конформационному переходу, линейнаяполипептидная цепь может располагаться в двух или
нескольких плоскостях
41.
Факторы, обусловливающие образование третичной структурыбелка
2. Ионные связи между
противоположно заряженными
боковыми группами
аминокислотных остатков
1.Водородные
связи
Реализуется до 90 %
возможных
водородных связей
и водородом бокового
между
радикала кислородом
аминокислотного
СО-остатка
группы
аминокислоты
Ионные
связи
Гидрофобные
взаимодействия
4. Гидрофильногидрофобные
взаимодействия
Ионные
связи
3. Дисульфидные связи (между
аминокислотными остатками,
содержащими серу)
42.
5. Ионы металлов43.
6. Ван-дер-Ваальсовы связиОбусловлены силами притяжения на малых расстояниях (начиная с 0,1 нм) между полярными
боковыми цепями,
между полярными и неполярными боковыми цепями,
между неполярными боковыми цепями
Образуются за счет постоянного или кратковременного перераспределения зарядов в молекулах
и возникающего при этом электрического поля
Отталкивание
Притяжение
При определённом расстоянии происходит отталкивание (приходят в соприкосновение
заполненные электронные оболочки атомов)
44.
45.
Четвертичная структура белка – это пространственноерасположение объединенных в комплекс нескольких белков
(до 60 в одном комплексе)
Комплекс белков выступает как единая молекула
Отдельный белок - субъединица
Субъединицы
Объединение одинаковых или разных субъединиц
(до 15 типов в одном комплексе)
Четвертичную структуру имеет 50% всех белков
46.
В образовании четвертичной структуры белка участвуют непептидные цепи, а белки с третичной структурой
47.
Факторы, обусловливающие образование четвертичнойструктуры белка:
1. Водородные связи в зоне межсубъединичного контакта
2. Электростатические взаимодействия между противоположно
заряженными функциональными группами субъединиц
(ионные пары, кластеры пространственно сближенных
разноименных зарядов)
Субъединица 1
Субъединица 2
48.
3. Контакт между гидрофобными участками наповерхности взаимодействующих субъединиц за
счет ван-дер-ваальсовых связей
49.
На поверхности взаимодействующих белков имеются α-спиральныеучастки, содержащие не менее четырех остатков лейцина. Они находятся на
поверхности каждого второго витка. Между лейциновыми остатками обоих
белков возникают гидрофобные взаимодействия и белки соединяются
вместе.
Остатки лейцина,
гидрофобные радикалы
α-спиральный
участок
α-спиральный
участок
«Лейциновая застежкамолния»
Например, гистоны для
фиксации ДНК
50.
4. Объединение субъединиц единым ионом металлаFe
51.
52.
53.
Объединение в единыйансамбль 24 молекул
ферритина
(транспортный белок
крови)
Формируются каналы для
поступления внутрь ионов
железа
54.
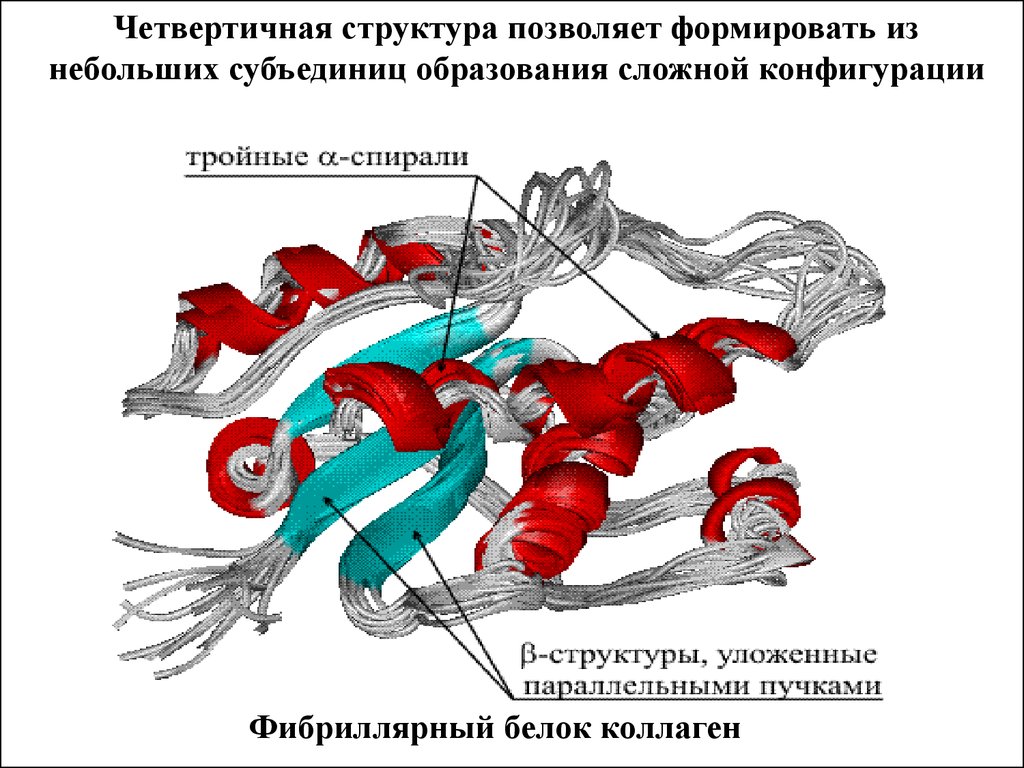
Четвертичная структура позволяет формировать изнебольших субъединиц образования сложной конфигурации
Фибриллярный белок коллаген
55.
Четвертичная структура отличается строгим постоянствомчисла и взаимного расположения субъединиц
Четвертичная структура позволяет объединить несколько
взаимосвязанных функций и создать полифункциональную
молекулу
Такое объединение характерно для ферментов, транспортных
белков и белков с несколькими взаимосвязанными функциями
56.
Активизация промотора, расплетание искручивание транскриптона, сшивка
нуклеотидов в проматричную РНК
57.
Образование трансмембранного каналаМембранный транспортный белок порин
58.
Размещение в мембране59.
Четвертичная структура обеспечивает множественноевзаимодействие белка с протяженными структурами
Регуляторные белки, взаимодействующие с ДНК
Иммуноглобулины (взаимодействуют с антигенами)
Четвертичная структура обеспечивает формирование
активного центра фермента и полную изоляцию субстрата от
воды
Четвертичная структура обеспечивает регуляцию
активности других белков
60.
Межсубъединичные контакты обратимо расщепляются (тогдабелок диссоциирует на отдельные субъединицы) и
устанавливаются вновь (ассоциация белка)
61.
Регуляция активности белков с четвертичной структуройСтруктурные перестройки одной субъединицы
передаются на другие
Даже небольшие изменения в пространственной структуре
каждой из взаимодействующих субъединиц, обусловленные
изменением функциональной активности, вызывают
конформационные изменения других для поддержания этой
активности.























































 biology
biology








