Similar presentations:
Электролитическая диссоциация
1.
ГПОУ «Макеевский медицинский колледж»ЭЛЕКТРОЛИТИЧЕСКАЯ
ДИССОЦИАЦИЯ
Ляскевич Л. Н. преподаватель химии
2.
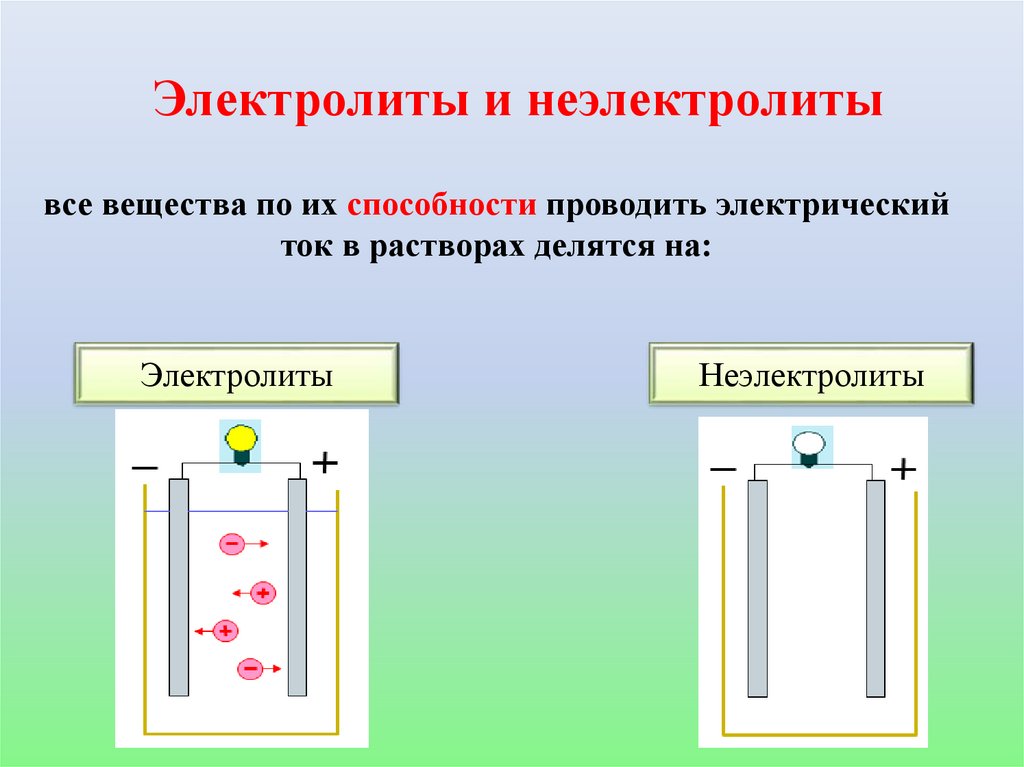
Электролиты и неэлектролитывсе вещества по их способности проводить электрический
ток в растворах делятся на:
Электролиты
Неэлектролиты
3.
Электролиты- вещества, водные растворы илирасплавы которых проводят электрический ток.
● Кислоты
● Основания
● Соли
● Оксиды металлов
Для электролитов характерны ионные или
ковалентные сильнополярные полярные связи.
4.
Неэлектролиты - вещества, которые непроводят электрический ток.
● Большинство органических веществ (спирт,
ацетон, бензин, сахар,масло и другие).
● Некоторые неорганические вещества
(дистиллированная вода, углекислый газ,
кислород).
Для неэлектролитов характерны ковалентные
неполярные или малополярные химические
связи.
5.
Электролитической диссоциацией (ЭД) понимают процесс распада электролитов наионы при растворении его в воде или
расплавлении.
Процесс обратный диссоциации - называется
ассоциацией.
6.
Ионы – это атомы или группы атомов,имеющие положительный или отрицательный
заряд. Ионы бывают простыми, которые
состоят из одного вида атомов (например, ион
натрия, магния, серы, хлора) и сложными,
которые состоят из атомов разных видов
(нитрат-ион, ион аммония, сульфат-ион,
фосфат-ион).
7.
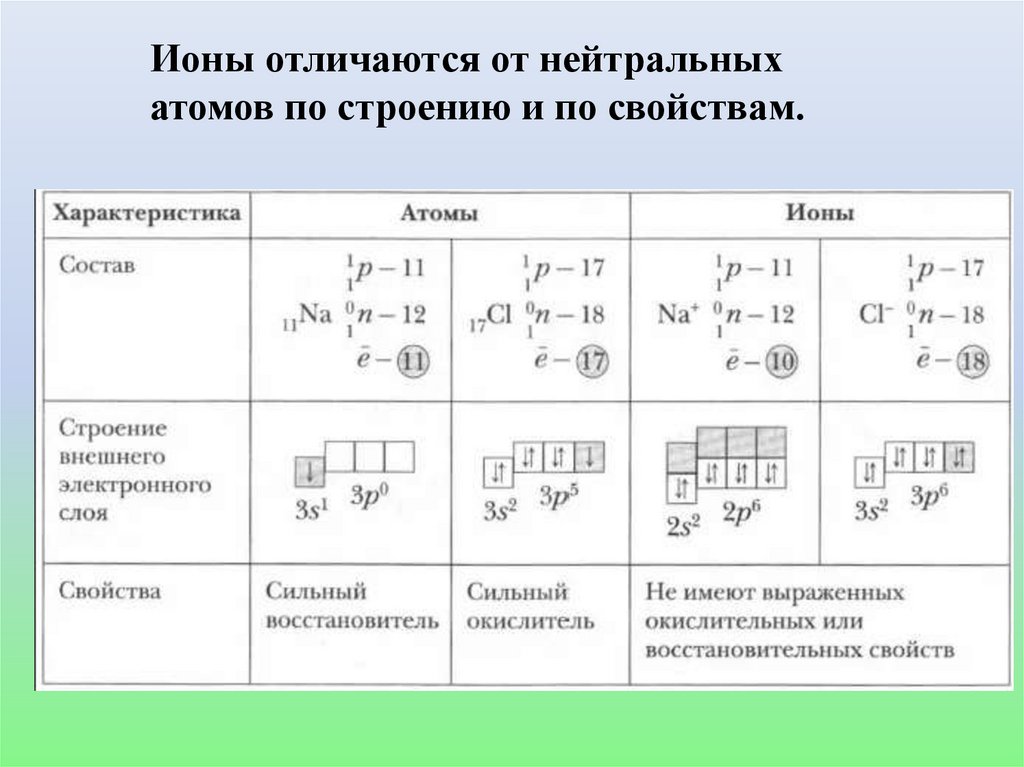
Ионы отличаются от нейтральныхатомов по строению и по свойствам.
8.
Теория электролитическойдиссоциации 1887 г.
Аррениус
Сванте Август
(1859–1927)
Основные работы
посвящены учению о
растворах и кинетике
химических реакций. На
основании своих
исследований (1882–1883)
высказал идею об
электролитической
диссоциации.
9.
Основные положения ТЭД1. При растворении в воде электролиты
диссоциируют на ионы (положительные и
отрицательные). Раствор в целом остаётся
электронейтральным.
2. Причиной диссоциации электролита
является его гидратация, то есть
взаимодействие электролита с молекулами
воды и разрыв химической связи в нём.
10.
Основные положения ТЭД3. Под действием электрического тока
положительные ионы движутся к катоду, а
отрицательные ионы – к аноду.
4. Электролитическая диссоциация – это
процесс обратимый для слабых
электролитов.
11.
Степенью электролитической диссоциации• Отношение числа молекул, распавшихся на ионы, к
общему числу молекул растворенного вещества,
называется степенью электролитической диссоциации
( ):
= n /N*100%
• где n – число молекул распавшихся на ионы; N – общее
число молекул в растворе.
• По степени диссоциации электролиты делятся на:
сильные 30% ( соли, щёлочи, сильные кислоты,
NaOH, KOH, H2SO4, HCl, HClO4, HNO3);
• Средние 3% 30% (Н3РО4, Н2SO4)
• Слабые 3% (H2S, H2CO3, CH3COOH, NH4OH,
• H2SiO3, HF, H2SO3 ).
12.
ЭЛЕКТРОЛИТЫСильные
(все соли, HCl, HBr, HI, H2SO4, HNO3, NaOH, KOH)
Н2SO4 → 2H+ + SO42Слабые
(HF, H2CO3, H3PO4, HClO, H2S Cu(OH)2, NH4OH, Н2О,
H2SiO3, органические кислоты и основания)
H2CO3 ↔ H+ + HCO3-; Кд1
HCO3- ↔ H+ +CO32-; Кд2
13.
Диссоциация слабых электролитов.• СН3СООН ↔ СН3СОО- + Н+
• Константа равновесия, отвечающая диссоциации слабого
электролита, называется константой диссоциации.
[СН3СОО-][Н+]
• Кравн. = Кдис. =
[СН3СООН]
• Константа диссоциации — это отношение произведения
молярных концентраций ионов к молярной концентрации
недиссоциированных молекул.
• Величина Кдис. зависит от природы электролита и
растворителя, а также от температуры, но не зависит от
концентрации раствора.
14.
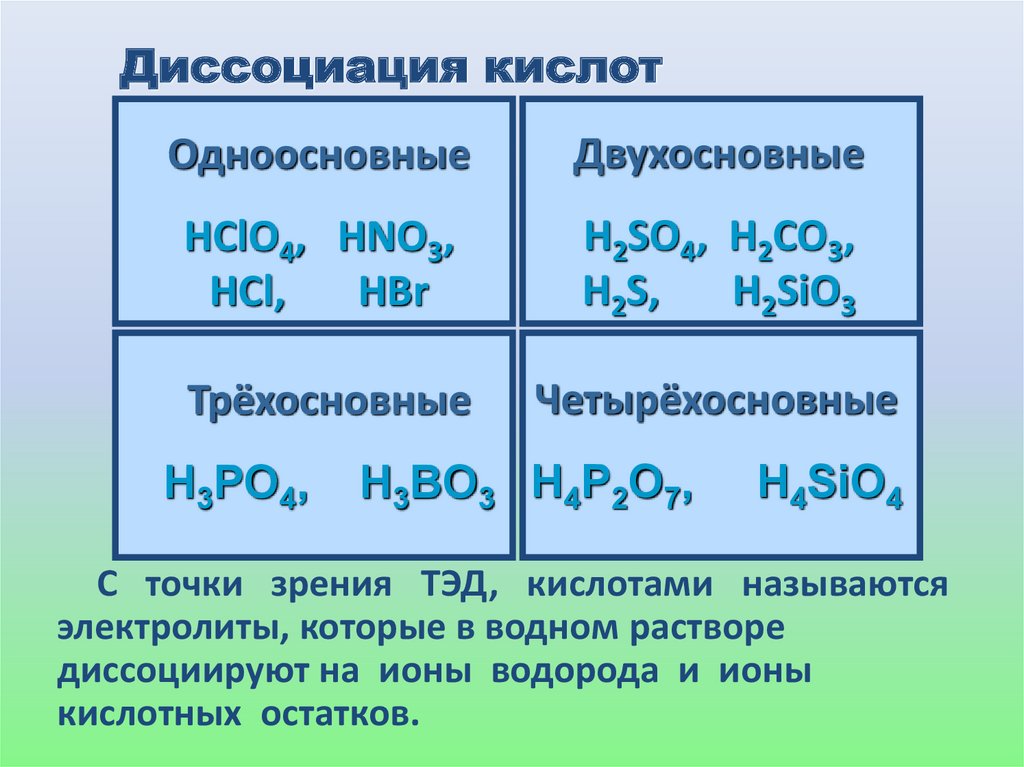
Диссоциация кислотОдноосновные
Двухосновные
HClO4, HNO3,
HCl,
HBr
H2SO4, H2CO3,
H2S,
H2SiO3
Трёхосновные
Четырёхосновные
H3PO4,
H3BO3 H4P2O7,
H4SiO4
С точки зрения ТЭД, кислотами называются
электролиты, которые в водном растворе
диссоциируют на ионы водорода и ионы
кислотных остатков.
15.
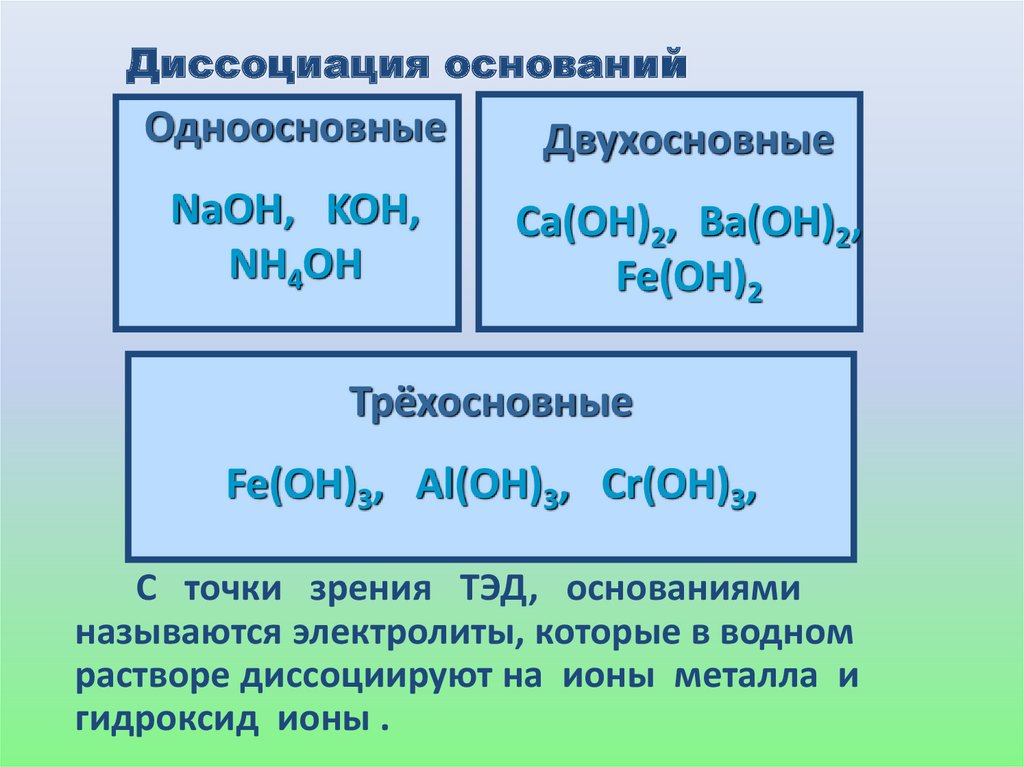
Диссоциация основанийОдноосновные
Двухосновные
NaOH, KOH,
NH4OH
Ca(OH)2, Ba(OH)2,
Fe(OH)2
Трёхосновные
Fe(OH)3, Al(OH)3, Cr(OH)3,
С точки зрения ТЭД, основаниями
называются электролиты, которые в водном
растворе диссоциируют на ионы металла и
гидроксид ионы .
16.
17.
Условия протекания реакции ионногообмена
Реакции в растворах электролитов
протекают до конца если:
• Образуется или растворяется
осадок;
• Выделяется газ;
• Образуется малодиссоциирующее
вещество (например Н2О)
18.
ДИССОЦИАЦИЯ ВОДЫ.ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ.
СРЕДА ВОДНОГО РАСТВОРА
ЭЛЕКТРОЛИТА.
19.
Диссоциация воды. Водородный показатель• Вода служит не только наиболее
распространенным растворителем для многих
веществ, но и сама является очень слабым
амфотерным электролитом:
• Н2О ↔ H+ + ОH-; ∆Н°298 = 56 кДж /моль,
• В воде присутствуют катионы водорода и
гидроксид - анионы в строго эквивалентных
количествах.
• Kдис = [H+][OH-]/[H2O] = 1,8∙10-16 при 22 °С.
20.
• Так как вода - очень слабый электролит, токонцентрация недиссоциированных молекул
может быть принята равной общему числу молей
в 1 дм3 воды, то есть:
• [Н2О] = 1000/18 = 55,56 моль/дм3.
• Тогда
К дис [Н2О] = [H+] [ОН-]= 1,8∙10-16 ∙55,56
= 10-14 = Кw
• Величина [Н+ ][ОН-] = 10-14 называется
ионным произведением воды.
• Так как в воде концентрации гидратированных
ионов равны, то
• [H+]= [ОH-] = √10-14 =10-7 моль/дм3
21.
Кислотные и щелочные свойстварастворов
• Они характеризуются концентрацией катионов H+
и анионов ОH-.
• В кислой среде [H+]>[OH-]; [H+] > 10–7 моль/дм3,
• В щелочной [H+]<[OH-]; [H+] < 10–7 моль/дм3,
• В нейтральных [H+]=[OH-] = 10–7 моль/дм3
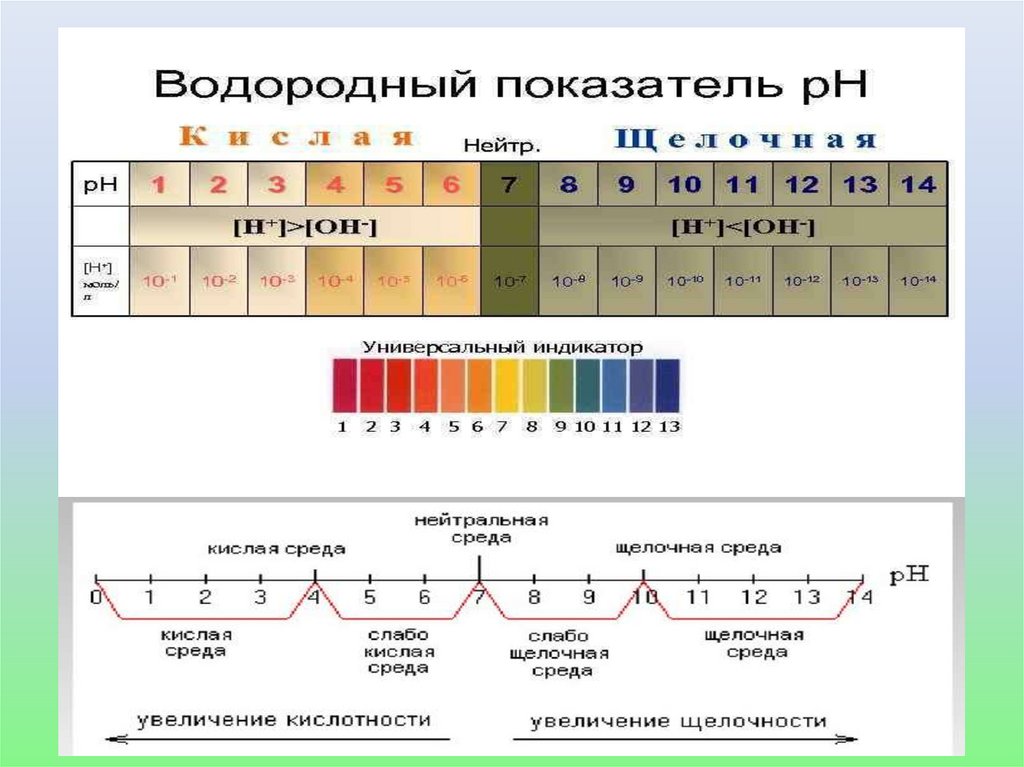
22.
Водородный показатель рН• В 1909 г. Сёренсен ввел значение отрицательного
десятичного логарифма концентрации водородных ионов,
которое называют водородным показателем рН
рН= - lg[H+].
• Отрицательный десятичный логарифм концентрации
гидроксильных ионов называется гидроксильным
показателем
pОH = -lg[ОH-].
• Получим соотношение: рН + рОН = 14.
• Для нейтральной среды рН = -lg10–7 = 7,
• Для кислых растворов рН < 7,
• Для щелочных рН > 7.
23.
24.
Свойства кислотно-основных индикаторовИндикатор
Метиловый
оранжевый
Метиловый
красный
Лакмус
Фенолфталеин
Интервал
перехода
рН
3,1 – 4,5
Изменение цвета
нейтральная
кислая
щелочн.
оранжевый
красный
желтый
4,2 – 6,2
оранжевый
красный
желтый
5,8 – 8,0
фиолетовый
красный
синий
8,3 – 10,0
бесцветн.
бесцветн.
красный
25.
Закрепление материала1. Написать уравнения реакций в полном и
сокращенном ионном виде:
BaCl2 +AgNO3
Na2CO3 + HNO3
2. Дано сокращённое ионное уравнение,
написать полное уравнение реакции в
молекулярном и ионном виде:
H2O
+
OH
H +
Cu
2+
+ 2OH-
Cu(OH)2
26.
Задача 1. Определите, чему равна степеньдиссоциации электролита, если при 20 °С из
каждых 150 молекул распалось на ионы 90.
Сильный или слабый это электролит?
Задача 2.Рассчитайте степень диссоциации
борной кислоты Н3ВО3, если известно, что в
растворе из каждых 500 молекул распались на
ионы только 40. Сильный, средний или слабый
по силе этот электролит?






















 chemistry
chemistry








