Similar presentations:
Государственная система контроля качества лекарственных препаратов и других товаров аптечного ассортимента
1. 1.2. Государственная система контроля качества лекарственных препаратов и других товаров аптечного ассортимента
2. Нормативно-правовые документы
ФЕ ДЕ Р АЛЬ НЫЙ З АК ОН ОТ 1 2 . 04 . 2 0 1 0 N 61 - ФЗ « ОБ ОБ Р АЩЕНИИЛ Е К А РС Т ВЕН Н ЫХ С Р Е Д СТ В»
ПО СТ АНОВЛЕНИЕ ПР А В ИТЕ ЛЬ СТ В А РФ ОТ 26 . 1 1 . 20 1 9 N 1 5 10 "О
ПОРЯ ДКЕ ВВО Д А В ГР А ЖД АН СК ИЙ О БОРОТ Л ЕК АР СТ ВЕННЫХ
П Р Е П А РА Т ОВ Д Л Я М Е ДИ ЦИН СК О Г О П Р И МЕНЕН И Я "
ПО СТ АНОВЛЕН ИЕ ПР А В ИТЕ ЛЬ СТ В А РФ ОТ 23 ДЕКА Б РЯ 2 02 1 Г. №
2425
« ОБ
УТ В Е РЖД ЕН ИИ
ЕД ИНО ГО
ПЕ Р ЕЧНЯ
ПРОД УКЦ ИИ ,
ПОДЛ ЕЖ АЩ ЕЙ
О БЯ З АТ ЕЛЬНОЙ
СЕ РТ ИФИК АЦ ИИ ,
И
ЕД ИНО ГО
П ЕР ЕЧНЯ
П РОД УКЦ ИИ ,
ПОД ЛЕЖ АЩ ЕЙ
Д ЕКЛ А РИ РОВ АНИ Ю
С О ОТВ ЕТ С Т ВИ Я »
ПО СТ АНОВЛЕН ИЕ П Р А ВИТ Е ЛЬ СТ В А РФ ОТ 15 . 0 9 . 20 2 0 N 1 44 7 "ОБ
УТ В ЕР ЖДЕН ИИ
П Р АВ ИЛ
УН ИЧТ ОЖЕН ИЯ
ИЗ ЪЯ Т ЫХ
Ф АЛЬС ИФИЦИ РОВ АННЫХ
ЛЕКА Р СТ ВЕННЫХ
С Р ЕД СТ В,
НЕДОБ РОК АЧЕ СТ ВЕН Н ЫХ
Л ЕК АР СТ В ЕНН ЫХ
С Р ЕД СТ В
И
К О НТР АФА К Т НЫХ Л Е К А Р СТ В ЕН НЫХ С Р Е ДС Т В" .
ПО СТ АНОВЛЕН ИЕ П Р А ВИТ Е ЛЬ СТ В А Р Ф ОТ 2 7 Д ЕК АБР Я 2 01 2 Г . N 1 4 1 6
« ОБ УТ В Е РЖ ДЕН ИИ ПР А В ИЛ ГО СУ Д А Р СТ ВЕН НОЙ Р Е ГИ СТР А ЦИ И
М Е Д ИЦИН С К ИХ И З Д ЕЛ ИЙ» ( В Р Е Д . О Т 2 4 Н О Я Б РЯ 2 0 2 0 Г . )
3.
Термины и определенияфальсифицированное
лекарственное
средство
лекарственное
средство,
сопровождаемое ложной информацией о его
составе и (или) производителе;
недоброкачественное
лекарственное
средство
лекарственное
средство,
не
соответствующее требованиям фармакопейной
статьи либо в случае ее отсутствия требованиям
нормативной документации или нормативного
документа;
контрафактное лекарственное средство лекарственное средство, находящееся в обороте с
нарушением гражданского законодательства
4. Виды фальсификатов
1• Не содержащие действующих веществ
2
• Содержащие недостаточное количество
действующих веществ
3
• Содержащие другие лекарственные вещества,
не соответствующие указанным на этикетке
4
• Фальсифицированная упаковка
5. Причины недоброкачественности ЛП
1. Неэффективная система управления качеством2. Неточные и устаревшие методики анализа
3. Устаревшие технологии производства, несоблюдение
технологии
4. Формальное отношение персонала
5. Нарушение условий хранения и транспортировки
5
6. Способы выявления фальсификатов
1.С помощью компьютерных программ учета информации
2.
Посерийная идентификация при помощи дифрактометров (изучение
угла дифракции)
3.
С использованием верификаторов, микроскопов, люминесцентного
облучателя
а) флюоресцирующее свечение упаковки
6
7.
78. Работа с письмами о выявлении ЛП, имеющих признаки фальсификации
При выявлении серии ЛП, указанной в письме Росздравнадзора:1.
Переместить всю серию выявленного ЛП в карантинную зону
2.
Создать комиссию минимум из трех человек для проведения
сравнительного анализа отличительных признаков фальсификации
(если это возможно при визуальном осмотре)
3.
Провести визуальный осмотр для выявления признаков подделки,
сравнить полученные данные с приложением к письму
4.
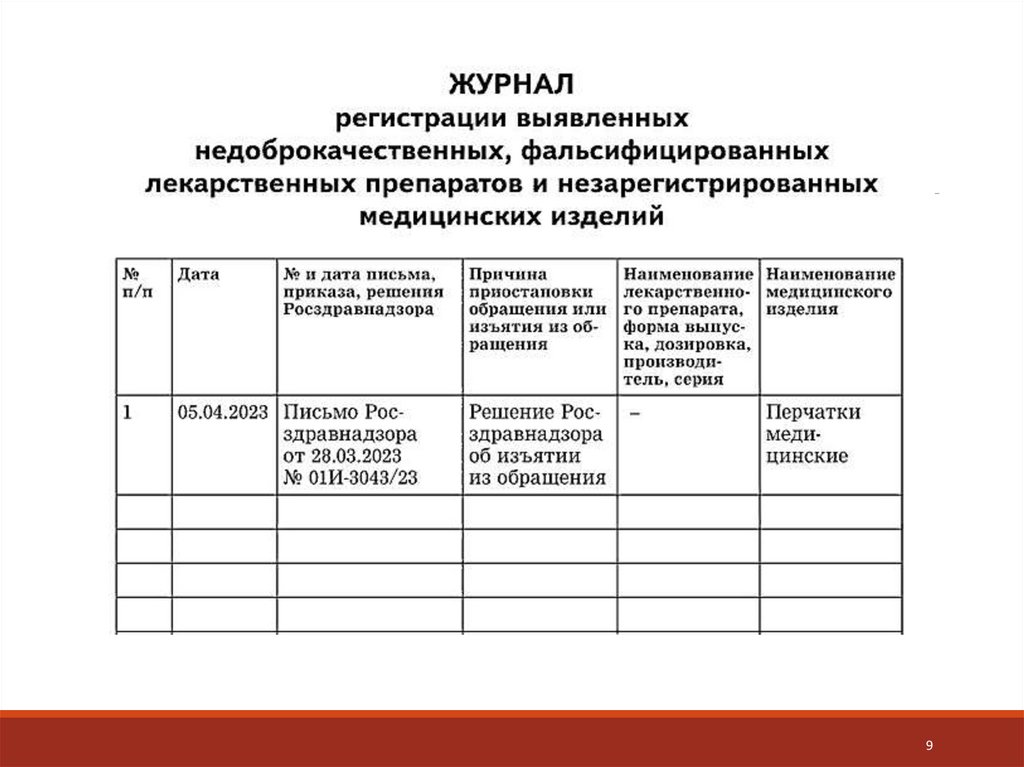
Зарегистрируйте ЛП в Журнале регистрации выявленных
недоброкачественных,
фальсифицированных
лекарственных
препаратов и незарегистрированных медицинских изделий
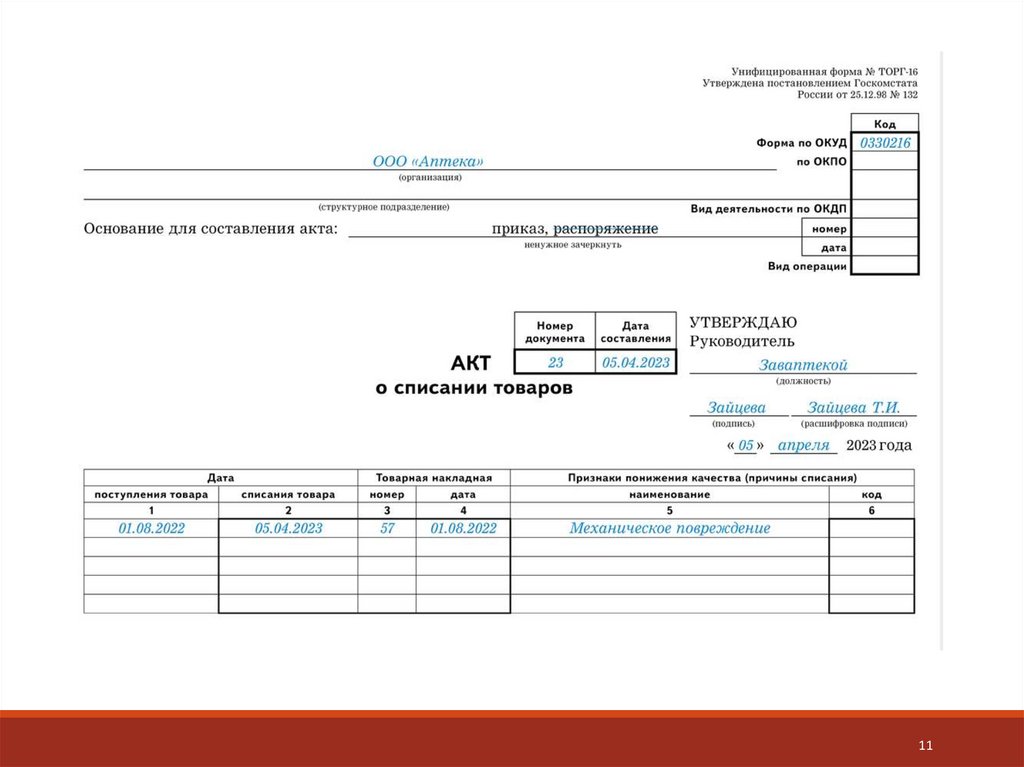
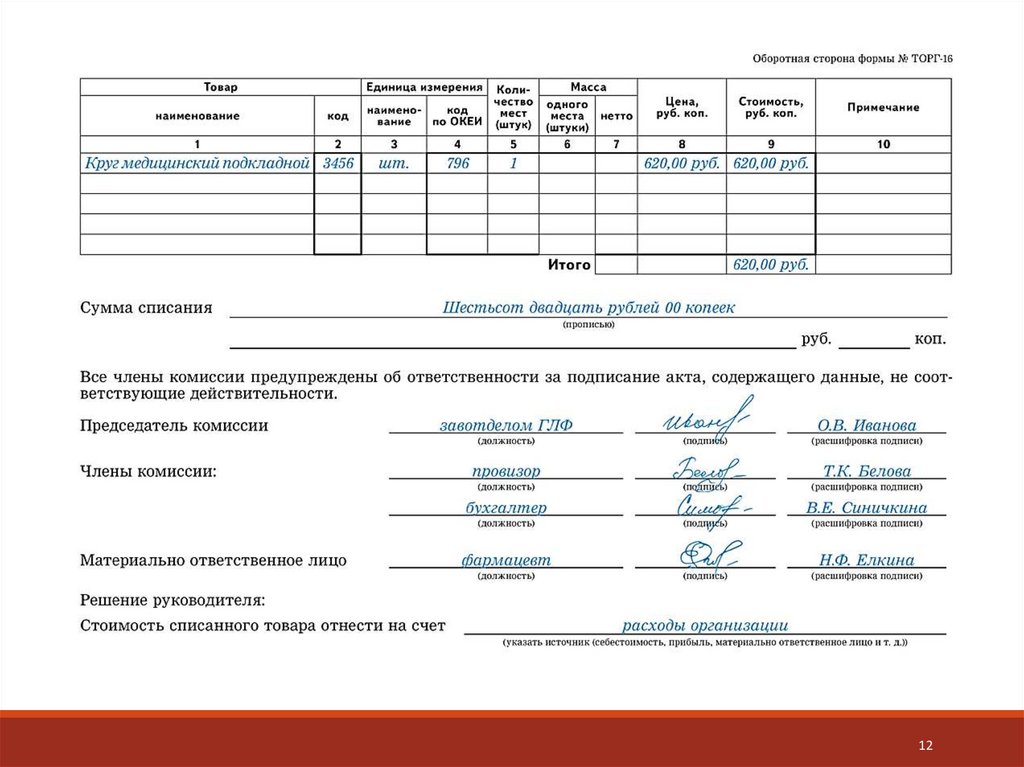
5.
Составить акт – указать состав комиссии, наименование ЛП,
дозировку, фасовку, форму выпуска, производителя, серию,
количество упаковок в наличии, параметры сравнительного анализа,
количество проверенных упаковок, выявлены ли признаки
фальсификации.
8
9.
910.
1011.
1112.
1213. Передача информации в Территориальный орган
1314.
1415. Архивация информационных писем – разрабатывается и утверждается организацией самостоятельно
1516.
1617.
1718. Этапы разработки ЛП
12
3
4
• Доклинические исследования и
разработка
• Клинические исследования
• Регистрация препарата
• Пострегистрационные исследования
19.
1920.
Государственная система контроля качества – это комплексмероприятий по обеспечению качества ЛП, медицинских
изделий, медицинской техники и других товаров аптечного
ассортимента.
Главная задача ГСКК – защита потребителей от негативных
последствий при применении некачественных ЛП, связанных
с недостаточной изученностью на этапе разрешения и
внедрения в практику, выпуском и ввозом в страну
недоброкачественной продукции, нарушением условий
хранения, транспортирования и реализации ЛП.
Система государственного контроля качества ЛП включает:
• оценку эффективности, безопасности и качества ЛП при
регистрации,
• экспертизу и мониторинг качества,
• инспекционный контроль.
21. Уровни ГСКК
Федеральный уровень –Федеральная служба по надзору в сфере здравоохранения
(Росздравнадзор),
Научный центр экспертизы средств медицинского применения,
Департамент государственного регулирования обращения ЛС
Минздрава РФ.
На Росздравнадзор возложен контроль и надзор за
производством, изготовлением, качеством, эффективностью,
безопасностью, оборотом и порядком использования ЛП,
проведением исследований.
НЦЭСМП
(www.regmed.ru)
обеспечивает
руководство
организации контроля качества, эффективности и безопасности
ЛП,
совершенствует
методы
экспертизы,
организует
пострегистрационный мониторинг качества и обеспечение всех
участников информацией о ЛП.
21
22. Уровни ГСКК
Территориальный уровень представлен:территориальными органами Росздравнадзора по субъекту РФ;
испытательными лабораториями,
центрами контроля качества,
федеральными лабораторными комплексами.
Задачи: осуществление мероприятий по обнаружению и предотвращению попадания
в обращение недоброкачественных и фальсифицированных ЛП, организация
проведения выборочного и повторного выборочного контроля, инспектирование
организаций здравоохранения, аптечных организаций, предприятий оптовой торговли.
В Казани действует ФГБУ «Информационно-методический центр по экспертизе, учету и
анализу обращения средств медицинского применения по РТ» Росздравнадзора.
Производственный уровень представлен системами обеспечения
предприятий-изготовителей ЛП, дистрибьюторов и аптечных организаций.
качества
Задача: гарантия возможности приобретения потребителем качественных ЛП, что
включает обеспечение сохранности качества ЛП, поступающих в аптеки, и качества
услуг по реализации ЛП.
22
23. Система обеспечения качества
это совокупность организационных мер, принятых в целяхгарантии качества ЛП и качества фармацевтической деятельности.
В аптечных организациях она включает:
помещение и оборудование для обеспечения условий хранения и изготовления,
документацию для
поступающих ЛП,
идентификации
происхождения,
количества
и
качества
входной контроль поступающего товара,
персонал,
систему непрерывного обучения персонала,
должностные инструкции,
фонд нормативных и справочных материалов.
Положение о системе обеспечения качества утверждается приказом по аптечной
организации.
23
24. Виды государственного контроля качества ЛП
1•Предварительный
2
•Выборочный
3
•Повторный выборочный
4
•Контроль качества субстанций
5
•Проверки производителей ЛП
25. Предварительному контролю подлежат ЛП:
12
3
• впервые производимые
• выпускаемые по измененной технологии
• впервые ввозимые на территорию РФ
4
• выпускаемые после перерыва производства данного
ЛС от 3 лет и более
5
• переведенные на этот вид контроля в связи с
ухудшением их качества
26.
Последующему выборочному контролюподвергаются все ЛП отечественного и
зарубежного производства, находящиеся в сфере
обращения.
Выборочный контроль качества сертифицированных лекарственных средств
осуществляется по показателям " описание", "упаковка",
"маркировка".
Повторному выборочному контролю
подвергаются ЛП в случае возникновения споров
об их качестве между поставщиком и
потребителем.
Приказ Министерства здравоохранения РФ от 10 марта 2022 г. № 1746 “Об
утверждении форм документов, используемых Федеральной службой по
надзору в сфере здравоохранения при осуществлении федерального
государственного контроля (надзора) в сфере обращения лекарственных
средств”
27.
Сертификат соответствия производства(систем качества) ЛП - документ,
удостоверяющий на основания заключения
специальной комиссии или экспертов органа
управления, что производство (система
качества) заявленного(-ных) изготовителем
лекарственного препарата соответствует
установленным требованиям.
28.
Декларация о соответствии – документ, вкотором изготовитель или продавец
удостоверяет, что поставляемая им
продукция или оказываемая услуга
соответствует требованиям,
предусмотренным для обязательной
сертификации этой продукции (услуги).
В качестве декларанта имеют право выступать юридические лица,
либо ИП, которые зарегистрированы в установленном порядке и
являются продавцом, производителем или официальным
представителем иностранного производителя лекарственных
препаратов
29.
В едином перечне продукции, подлежащей декларированиюсоответствия (утв. постановлением Правительства от 23.12.2021
№ 2425) перечислены:
•61.3. Средства дезинфицирующие;
•39.1. Изделия санитарно-гигиенического назначения разового
пользования (прокладки (пакеты) женские гигиенические, полотенца
бумажные, платки носовые бумажные и другие санитарногигиенические изделия разового пользования), кроме изделий для
ухода за детьми;
•11.1. Предметы личной гигиены (кроме изделий для ухода за детьми)
и изделия для хранения таких предметов личной гигиены
из пластмасс;
•60.1. Щетки зубные для взрослых.
Декларация о соответствии ГОСТ Р оформляется на срок до 3-х лет.
Медицинское
изделие,
прошедшее
процедуру
декларирования
соответствия, маркируется соответствующим знаком.
29
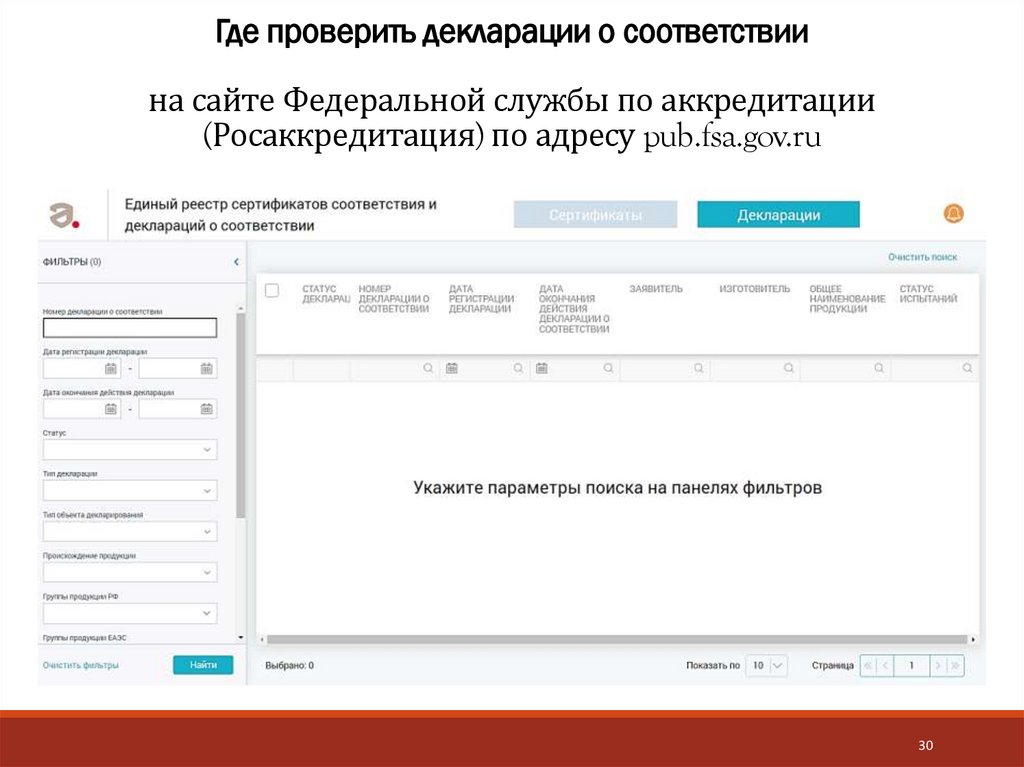
30. Где проверить декларации о соответствии на сайте Федеральной службы по аккредитации (Росаккредитация) по адресу pub.fsa.gov.ru
Где проверить декларации о соответствиина сайте Федеральной службы по аккредитации
(Росаккредитация) по адресу pub.fsa.gov.ru
30
31.
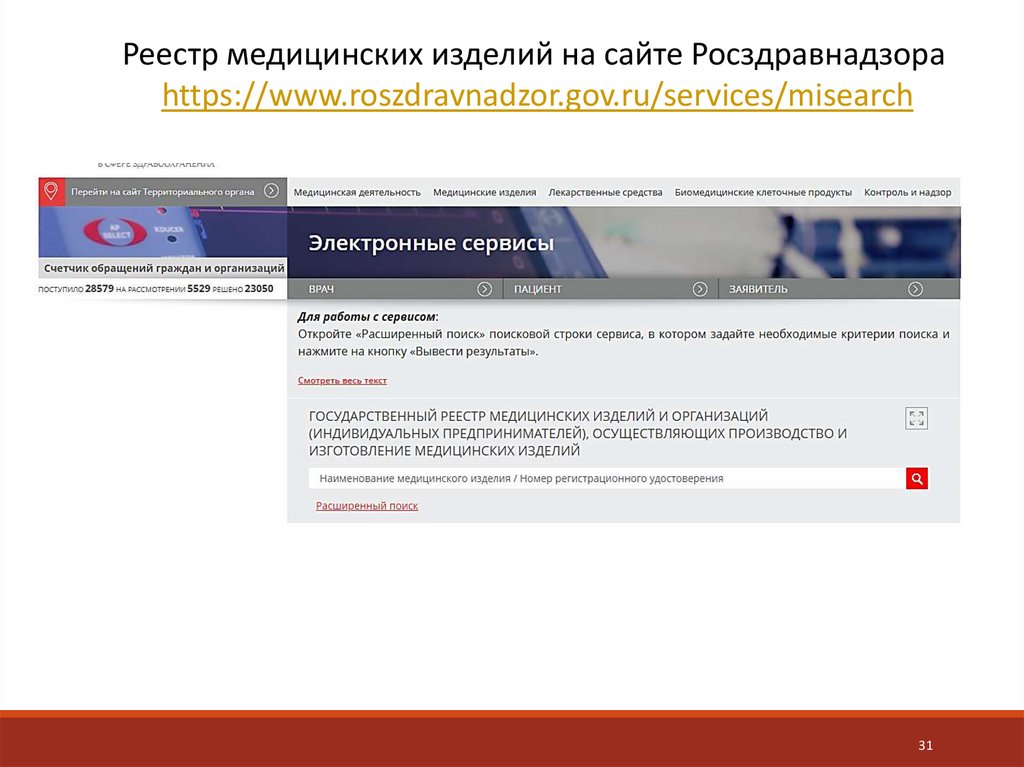
Реестр медицинских изделий на сайте Росздравнадзораhttps://www.roszdravnadzor.gov.ru/services/misearch
31
32.
3233.
Подтверждением соответствия БАД на территории РФ являетсяСвидетельство о государственной регистрации, выдаваемое
Федеральной службой по надзору в сфере защиты прав потребителей и
благополучия человека (Роспотребнадзор).
Регистрация БАД является обязательной
соответствия продукции на территории РФ.
Существует регистр БАД
http://www.registrbad.ru/
–
Источник
информации
о
http://fp.crc.ru/evrazes/?type=max
единый
формой
подтверждения
электронный
зарегистрированных
справочник:
БАД
–
33
34.
Порядок ввода в гражданский оборот на территорииРФ ЛП (за исключением иммунобиологических)
Отечественные производители предоставляют:
• документ производителя, подтверждающий качество;
• подтверждение уполномоченного лица производителя о
соответствии ЛП требованиям, установленным при его
регистрации.
Организации, осуществляющие ввоз ЛП на территорию РФ
предоставляют:
• сертификат производителя, подтверждающий качество;
• подтверждение ответственного лица, уполномоченного
иностранным
производителем
о
соответствии
ЛП
требованиям, установленным при его регистрации.
34
35.
Порядок ввода в гражданский оборот на территории РФ ЛП (заисключением иммунобиологических)
Для трех впервые производимых или ввозимых серий (партий) ЛП
необходим протокол аккредитованной государственной лаборатории по
контролю качества ЛС на соответствие показателям утвержденной НТД
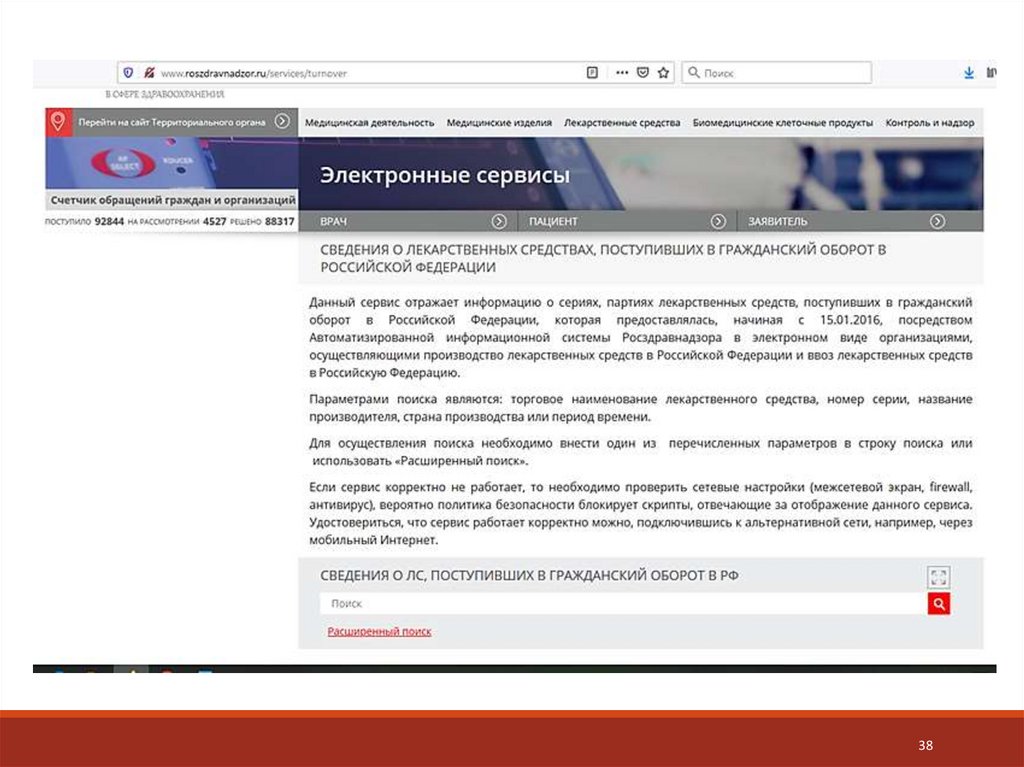
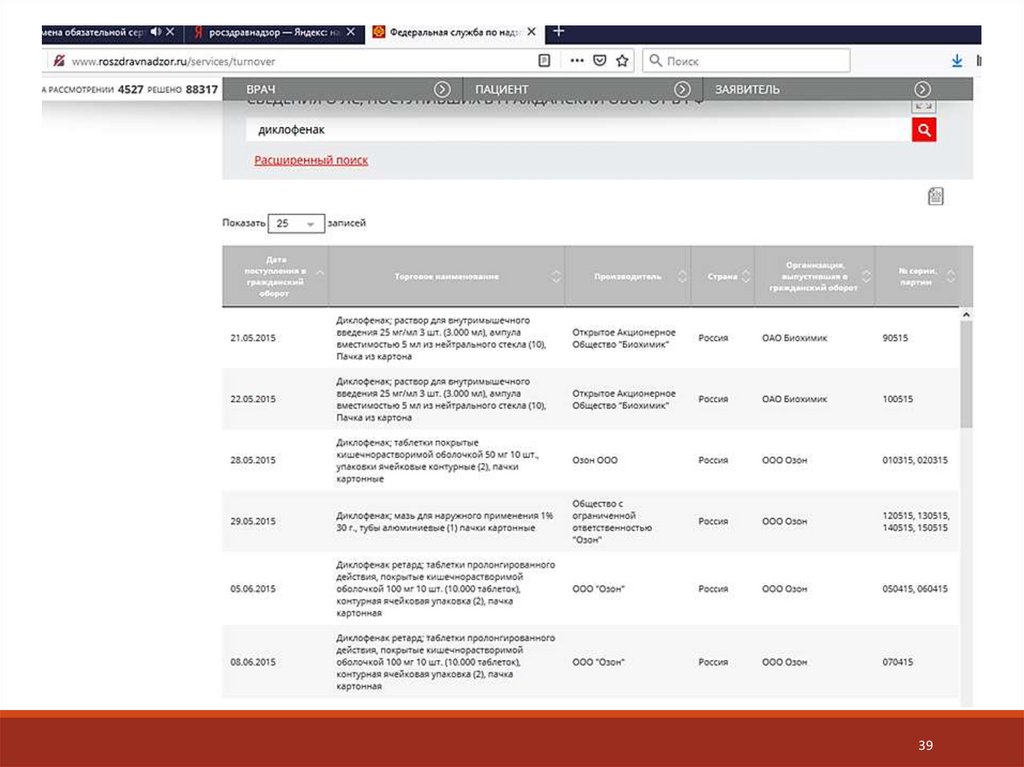
Информация о сериях ЛП публикуется на сайте Росздравнадзора. Если в
обороте выявлен препарат, сведения о качества которого отсутствуют,
Росздрав надзор прекращает его обращение до предоставления сведений.
NB! Впервые производимыми или впервые ввозимыми считаются
лекарственные препараты, получившие регистрационные удостоверения
после 28 ноября 2019 года.
35
36. Порядок ввода в гражданский оборот ИБЛП (вакцины, сыворотки, анатоксины, токсины, иммуноглобулины и аллергены)
Производители или организации, осуществляющие ввоз подают вФГБУ «ИМЦЭУАОСМП» Росздравнадзора или ФГБУ «НЦЭСМП»
Минздрава России:
- документы производителя,
качества ЛС требованиям НТД;
подтверждающие
соответствие
- образцы ИЛП для проведения испытания качества;
- документ производителя, содержащий информацию о стадиях
производства и контроля качества серии ИЛП, заверенный
заявителем.
Далее проводится экспертиза документов и контроль качества
образцов ИЛП. После чего в Росздравнадзор направляется
заключение о соответствии (несоответствии) серии ИЛП
требованием.
Росздравнадзор принимает решение о вводе препарата в оборот.
36
37.
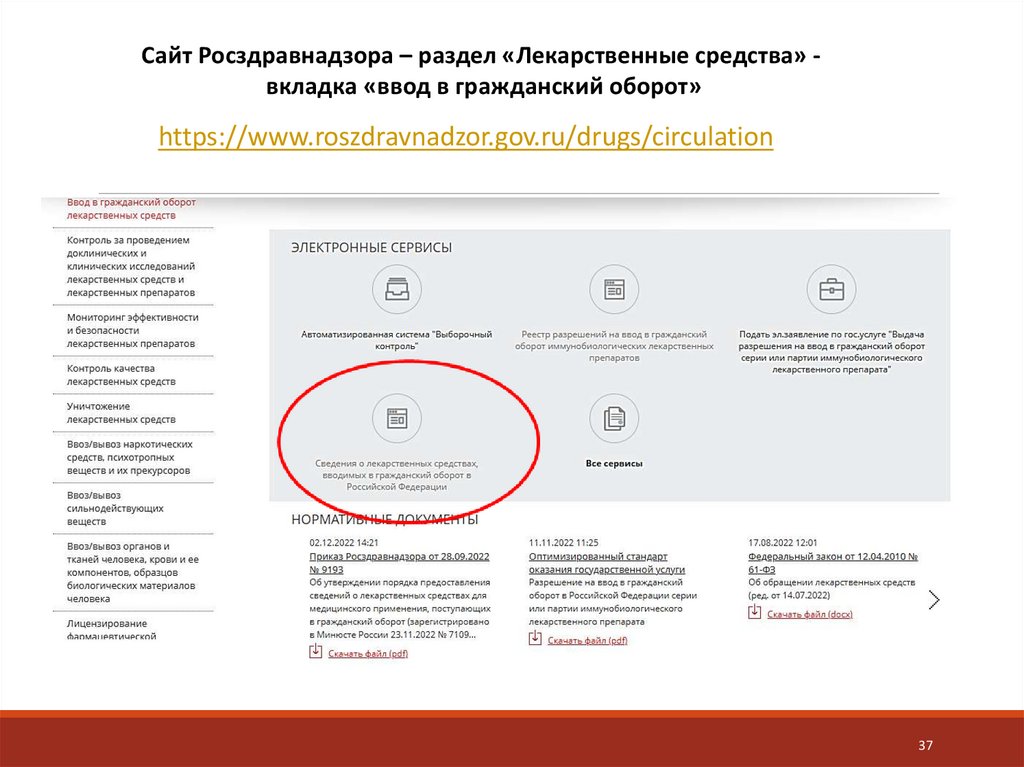
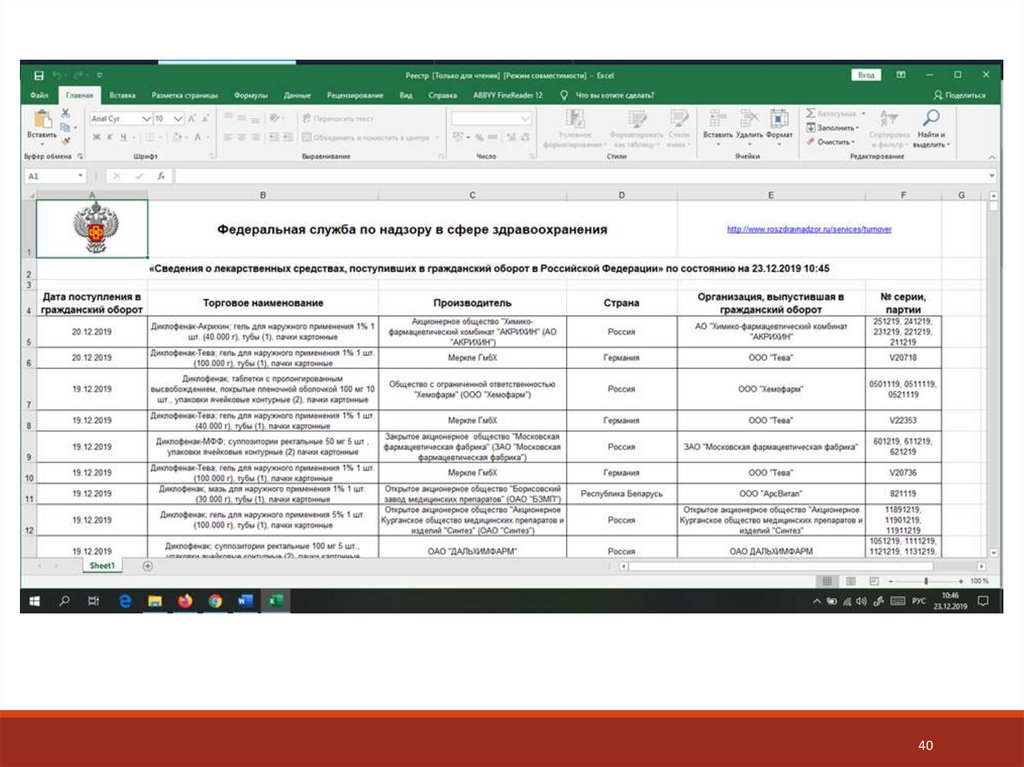
Сайт Росздравнадзора – раздел «Лекарственные средства» вкладка «ввод в гражданский оборот»https://www.roszdravnadzor.gov.ru/drugs/circulation
37
38.
3839.
3940.
4041.
4142. Контрольные вопросы
1. Чтотакое
фальсифицированное,
лекарственное средство?
недоброкачественное,
контрафактное
2. Какие виды фальсификатов вам известны?
3. В чем заключаются причины недоброкачественности препаратов?
4. Назовите способы выявления фальсификатов.
5. Каков порядок работы с письмами Росздравнадзора?
6. Что такое государственная система контроля качества? Ее уровни.
7. Что представляет собой система обеспечения качества в аптеке?
8. Какие виды государственного контроля вы знаете?
9. Какие ЛП подвергаются различным видам контроля?
10. Как осуществляется подтверждение качества ЛП? БАД? медицинских изделий?
42

































 medicine
medicine law
law








