Similar presentations:
Виды химической связи
1.
Виды химической связи.Химическая связь – это связь, возникающая
между атомами в результате различных
взаимодействий: образование общих пар из
валентных неспаренных электронов
внешнего электронного (энергетического)
уровня (слоя); из пары электронов одного
атома и свободной орбитали другого атома;
между положительными и
отрицательными ионами за счет
притяжения (электростатического
взаимодействия); межмолекулярные
вазимодействия между атомами разных
молекул.
2.
Виды химической связи:ковалентная
полярная
неполярная
ионная водородная металлическая
Ковалентная связь – наиболее общий вид
химической связи, возникающий за счет
образования ОБЩЕЙ ЭЛЕКТРОННОЙ
ПАРЫ.
А : В или
А-В или А ⇅В
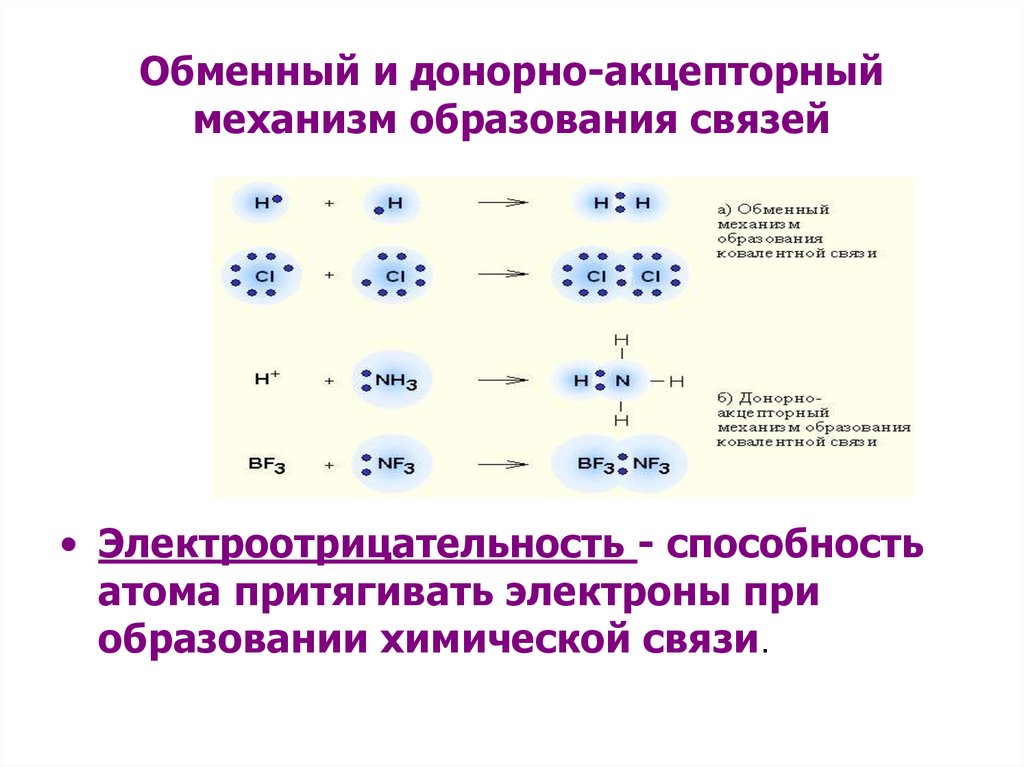
3.
Связьможет
образоваться
либо
посредством обменного механизма, когда
каждый из взаимодействующих атомов
поставляет по одному электрону, либо по
донорно-акцепторному механизму, когда
один из атомов предоставляет для
связи электронную пару (донор), а
другой – пустую (вакантную) орбиталь
(акцептор).
4.
Обменный и донорно-акцепторныймеханизм образования связей
• Электроотрицательность - способность
атома притягивать электроны при
образовании химической связи.
5.
Типы химической связи• Рассмотрим три случая для двух атомов А и В,
образующих связь:
А В
1) ЭО (А) = ЭО(В) (разность
электроотрицательностей равна нулю).
• Общая электронная пара не смещена ни к
одному из атомов. Не возникает ПОЛЮСОВ,
электронная плотность у обоих атомов
одинакова.
Это НЕПОЛЯРНАЯ ковалентная связь.
Классический пример неполярной ковалентной
связи наблюдается у двухатомных простых
веществ: H–H, F–F.
6.
• 2) ЭО (А) > ЭО(В).• При образовании связи общая электронная
пара смещена к более
электроотрицательному атому А, на нём
возникает частичный отрицательный
заряд, а на В – частичный положительный.
• Это ПОЛЯРНАЯ КОВАЛЕНТНАЯ СВЯЗЬ.
• Такой тип связи характерен для большинства
молекул, состоящих из двух и более
неметаллов: HCl, H2O, СН3СООН
7.
• 3) ЭО (А) >> ЭО(В).• Разность электроотрицательностей
настолько велика, что образовавшаяся
электронная пара полностью
принадлежит более
электроотрицательному атому А, который
теперь имеет заряд -1. Атом с меньшей
электроотрицательностью В приобретает
положительный заряд. Получаются ИОНЫ
– заряженные частицы.
• Это ИОННАЯ СВЯЗЬ.
• Она характерна для соединений металлов
с неметаллами.
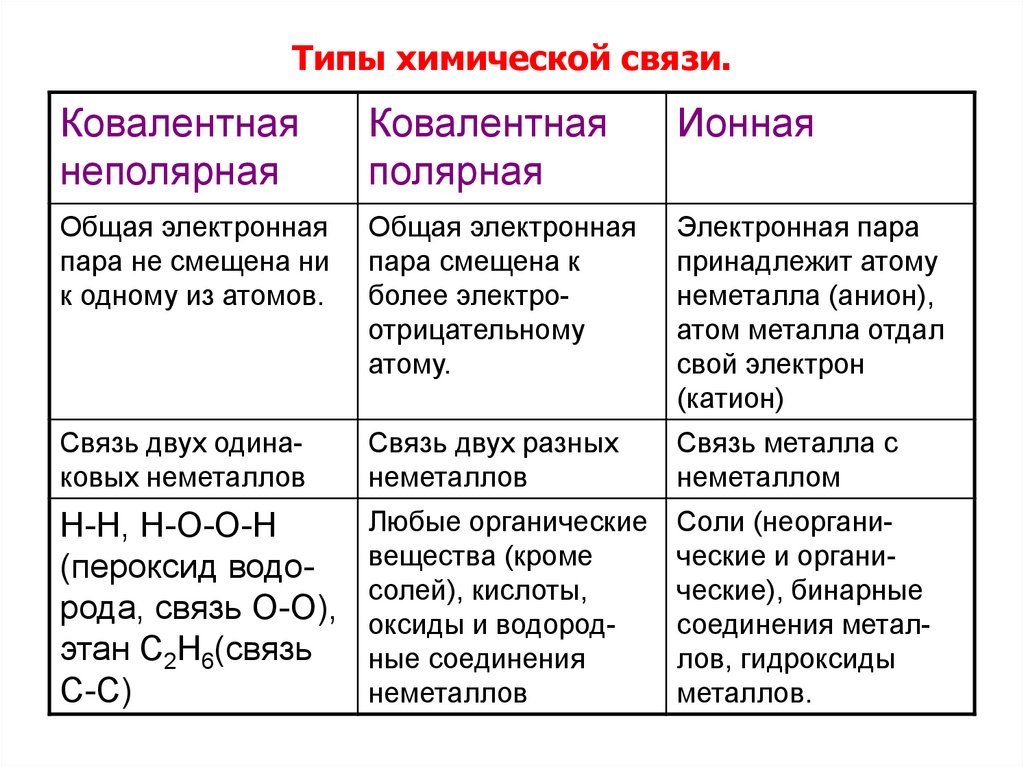
8.
Типы химической связи.Ковалентная
неполярная
Ковалентная
полярная
Ионная
Общая электронная
пара не смещена ни
к одному из атомов.
Общая электронная
пара смещена к
более электроотрицательному
атому.
Электронная пара
принадлежит атому
неметалла (анион),
атом металла отдал
свой электрон
(катион)
Связь двух одинаковых неметаллов
Связь двух разных
неметаллов
Связь металла с
неметаллом
Н-Н, Н-О-О-Н
(пероксид водорода, связь О-О),
этан С2Н6(связь
С-С)
Любые органические
вещества (кроме
солей), кислоты,
оксиды и водородные соединения
неметаллов
Соли (неорганические и органические), бинарные
соединения металлов, гидроксиды
металлов.
9.
Может ли в одном веществе быть несколькоразных типов связей?
• Ответ: Конечно, примеры –
кислородсодержащие соли, например,
К2SО3, в которой связь между S и О –
ковалентная полярная, а между О и К –
ионная.
10.
Металлическая связь• Металлическая связь возникает в
простых веществах –металлах между
положительно заряженными ионами
металла и свободно движущимися
электронами («электронный газ»).
11.
Характеристики металлического типа связи.• Атомы металлов слабо удерживают свои
внешние электроны, эти электроны покидают
свои атомы, превращая их в положительно
заряженные ионы.
• "Обобществленные" электроны
передвигаются в пространстве между
катионами металлов и удерживают их
вместе.
• Наличие «свободно» движущихся электронов
является причиной хорошей электро- и
теплопроводности металлов.
12.
Водородная связь– это связь не внутри молекулами, а между ними или
между частями молекул.
Водородная связь - возникает между сильно
электроотрицательными атомами (обычно кислорода
или фтора, реже азота) и атомом водорода другой
молекулы или части молекулы:
─ О −Н ... О – Н
/
(чертой обозначена ковалентная связь, тремя точками
- водородная связь).
Прочные водородные связи образуются в таких
жидких веществах, как вода, фтороводород,
кислородсодержащие неорганические кислоты,
карбоновые кислоты, фенолы, спирты, аммиак,
амины. При кристаллизации водородные связи в
этих веществах обычно сохраняются.
13.
Необходимые для образованияводородных связей атомы кислорода и
азота содержат все углеводы, белки,
нуклеиновые кислоты.
Известно, например, что глюкоза,
фруктоза и сахароза прекрасно
растворимы в воде.
Не последнюю роль в этом играют
водородные связи, образующиеся в
растворе между молекулами воды и
многочисленными OH-группами
углеводов.
14.
Валентность• Валентность – число связей, образованных
данным атомом в данной молекуле.
• Например, в молекуле SO3 у серы 6 связей, т.е. сера в этой
молекуле имеет валентность VI.
Валентные возможности атомов – весь набор
возможных валентностей.
• Они определяются числом неспаренных электронов и
возможных донорно-акцепторных связей (ДАС).
• Высшая возможная валентность элементов (без учёта ДАС), как
правило, равнa номеру группы.
• Это правило не выполняется:
• А) у элементов второго периода, начиная с азота (у них
отсутствуют d- орбитали и нет возможности для распаривания
электронов)
• Б) у элементов 8 группы (в главной подгруппе для гелия, неона
и в побочной подгруппе для элементов триад)
• В) у элементов 1 группы побочной подгруппы (у них высшая
валентность больше номера группы).












 chemistry
chemistry








