Similar presentations:
Гидролиз. Гидролиз органических веществ
1. «Гидролиз»
«ГИДРОЛИЗ»2. Гидролиз – это реакция обменного разложения веществ водой.
ГидролизГИДРОЛИЗ – ЭТО РЕАКЦИЯ ОБМЕННОГО
РАЗЛОЖЕНИЯ ВЕЩЕСТВ ВОДОЙ.
Частицы растворенного вещества в воде окружены
гидратной оболочкой. В некоторых случаях это приводит
к химическому взаимодействию с образованием новых
веществ, к реакции гидролиза.
hydro – вода, lysis - распад
3.
ГидролизОрганических
веществ
Неорганических
веществ
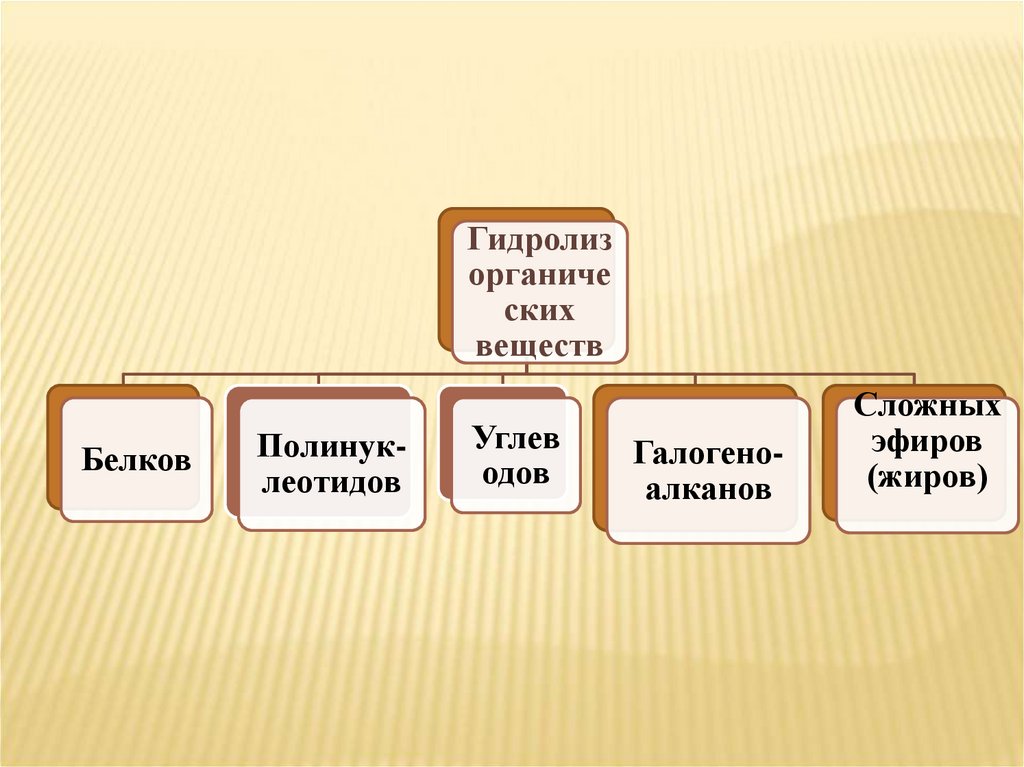
4.
Гидролизорганиче
ских
веществ
Белков
Полинуклеотидов
Углев
одов
Галогеноалканов
Сложных
эфиров
(жиров)
5.
ГидролизГидролиз галогеналканов:
t, OH
R-Cl + H2O ↔ R-OH + HCl
Гидролиз сложных эфиров:
О
О
H,t
∕∕
∕∕
R1-C
+ H2O ↔ R2-OH + R1- C
O-R2
OH
6. Гидролиз углеводов:
ГидролизГИДРОЛИЗ
УГЛЕВОДОВ:
C12H22 O11 + H2O → C6 H12O6 + C6 H12O6
Сахароза
Гидролиз
Глюкоза
фруктоза
Окисление
CO2 , H2O, Q
Гликоген
Окисление
Поликонденсация
Крахмал
пищи
глюкоза
Гидролиз
Глюкоза
7.
ГидролизГидролиз белков:
O H
O H
║ │
║ │
H2N – CH2 – C – N – CH – C – N – CH – COOH
HO H
H2N – CH2 – C
∕∕ O
OH
│
│
CH2
CH2
│
│
OH
OH
HO H
+ H2N – CH – C
│
CH2
│
OH
аминокислоты
трипептид
∕∕ O
O
∕∕
+ H2N – CH – C
│
OH
CH2
│
SH
OH
8.
Гидролиз солейСущность гидролиза сводится к обменному
химическому взаимодействию катионов или
анионов соли с молекулами воды. В результате
образуется слабый электролит.
Любая соль – это продукт взаимодействия
основания с кислотой. В зависимости от силы
основания и кислоты выделяют 4 типа солей.
9.
Гидролиз солейОбразованы
сильным основанием и
слабой кислотой
Образованы
слабым основанием и
сильной кислотой
Соли
Образованы
слабым основанием и
слабой кислотой
Образованы
сильной кислотой и
сильным основанием
10.
Гидролиз солей1.Гидролиз
солей,
образованных
сильным
основанием и слабой кислотой (Na2CO3, K2S,
CH3COOK и др.):
Na2S
H2O
= Na+
+ S2─
=
OH─ + H+
S2─ + H2O = OH ─ + HS─
Na2S + H2O = NaOH + NaHS
Гидролиз идет по аниону. Среда – щелочная,
избыток гидроксид-анионов (рН>7).
11.
Гидролиз солей2.Гидролиз
солей,
образованных
слабым
основанием и сильной кислотой (ZnCI2, CuSO4,
NH4CI, Fe(NO3)2 и др.):
AlCl3
H2O
=
=
Al3+
OH─
+
+
3Cl─
H+
Al3+ + H2O = AlOH2+ + H+
AlCl3 + H2O = AlOHCl2 + HCl
Гидролиз идет по катиону. Среда - кислая,
избыток катионов водорода (рН<7).
12.
Гидролиз солей3.Гидролиз
солей,
образованных
слабым
основанием и слабой кислотой (Ni(NO2)2, CuS,
(NH4)2S, (CH3COO)2Cu и др.):
NH4CN =
H2O =
NH4+ + CN─
OH─ + H+
NH4+ + CN- + H2O = NH3 ● H2O + HCN
NH4CN + H2O = NH3 ● H2O + HCN
Гидролиз идет и по катиону и по аниону. Характер
среды зависит от силы (констант диссоциации) двух
образовавшихся слабых электролитов.
13.
Гидролиз солей4.Гидролиз
солей,
образованных
сильным
основанием и сильной кислотой (NaCI, K2SO4,
CsBr, NaNO3 и др.):
KCl = K+ + ClСлабых ионов нет, гидролиз не идет, среда
нейтральная (рН=7).
14.
Гидролиз солейГидролиз нерастворимых в воде солей,
образованных слабым основанием и слабой
кислотой (CuS, NiSO3, PbS и др.) не идет.
15.
ФормулИзменение окраски
а соли лакмусовой бумаги (цвет)
AlCl3
Розовый цвет
Na2CO3 Яркий синий цвет
NaCl
Лакмусовая бумага не
меняет окраску (гидролиза
нет)
Значение
рН
Реакция
среды
рН<7.
Среда
кислая
рН>7
Среда
щелочная
рН=7
Среда
нейтральная
16.
Гидролиз солейУсловия смещения реакций обратимого гидролиза
(согласно принципу Ле Шателье).
Усилить гидролиз соли можно следующими способами:
1. Добавить воды (уменьшить концентрацию раствора;
2. Нагреть раствор;
3. Связать один из продуктов гидролиза в
труднорастворимое соединение или удалить один из
продуктов в газовую фазу.
17.
Гидролиз солейНеобратимый гидролиз солей, образованных
слабым основанием и слабой кислотой.
Соли, которые нельзя получить реакцией обмена между
водными растворами двух солей (в таблице растворимости
отмечено, что они разлагаются в водной среде):
AI2S3 + 6HOH → 2AI(OH)3↓ + 3H2S↑
Fe2(CO3)3 + 3H2O = 2Fe(OH)3↓ +3CO2↑
Реакция среды в растворах подобных солей зависит от
относительной силы кислоты и основания.
18.
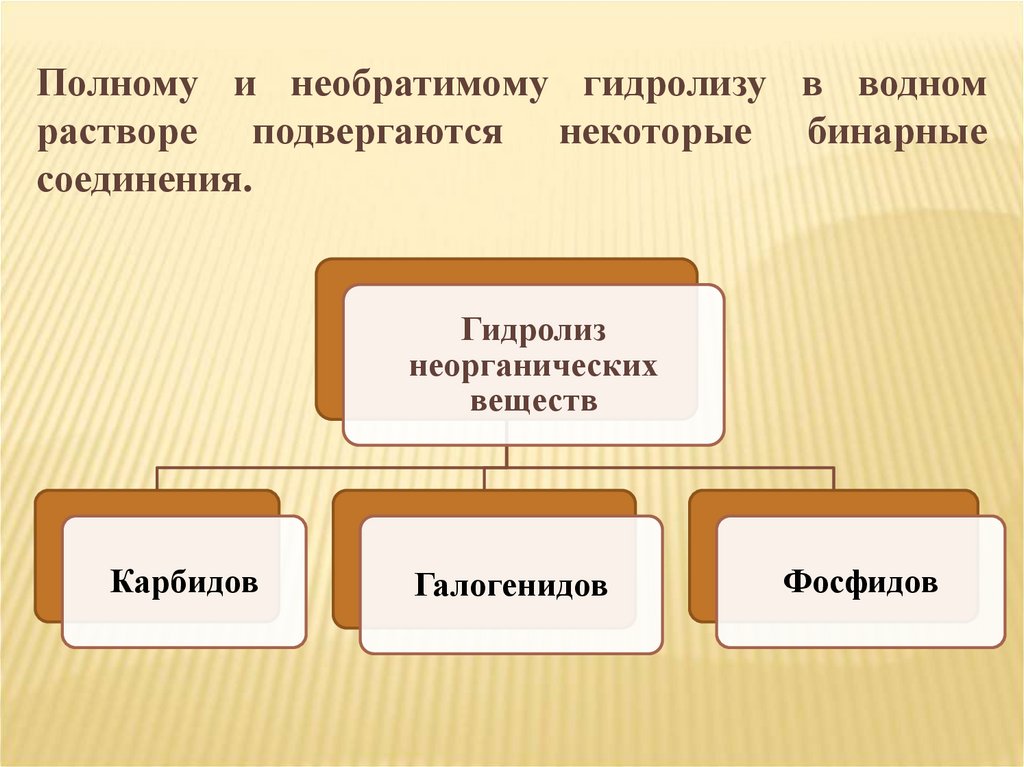
Полному и необратимому гидролизу в водномрастворе подвергаются некоторые бинарные
соединения.
Гидролиз
неорганических
веществ
Карбидов
Галогенидов
Фосфидов
19.
ГидролизГидролиз карбидов:
CaC2 + 2H2O = Ca(OH)2 + C2 H2↑
Карбид
кальция
ацетилен
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4↑
Карбид
алюминия
метан
20.
ГидролизГидролиз галогенидов:
SiCl4 + 3H2O = H2SiO3↓ + 4HСl
хлорид
кремния (+4)
кремниевая
кислота
Гидролиз фосфидов:
Са3P2 + 6H2O = 3Са(OH)2 + 2PH3↑
фосфид
кальция
фосфин
21.
ГидролизРоль гидролиза:
В природе: преобразование земной коры; обеспечение
слабощелочной среды морской воды.
В
народном
хозяйстве:
порча
производственного
оборудования; выработка из непищевого сырья ценных
продуктов (бумага, мыло, спирт, глюкоза, белковые
дрожжи); очистка промышленных стоков и питьевой воды;
подготовка тканей к окрашиванию; известкование почв.
В повседневной жизни: стирка; мытье посуды; умывание с
мылом; процессы пищеварения.



















 chemistry
chemistry








