Similar presentations:
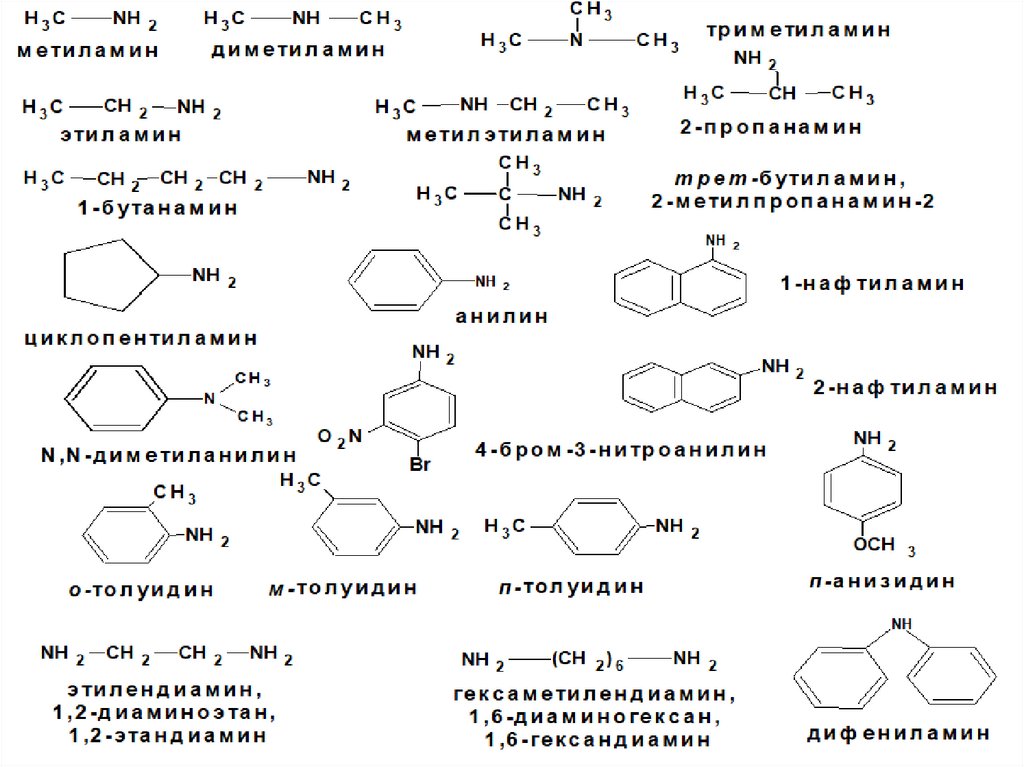
Амины. Номенклатура аминов
1. АМИНЫ
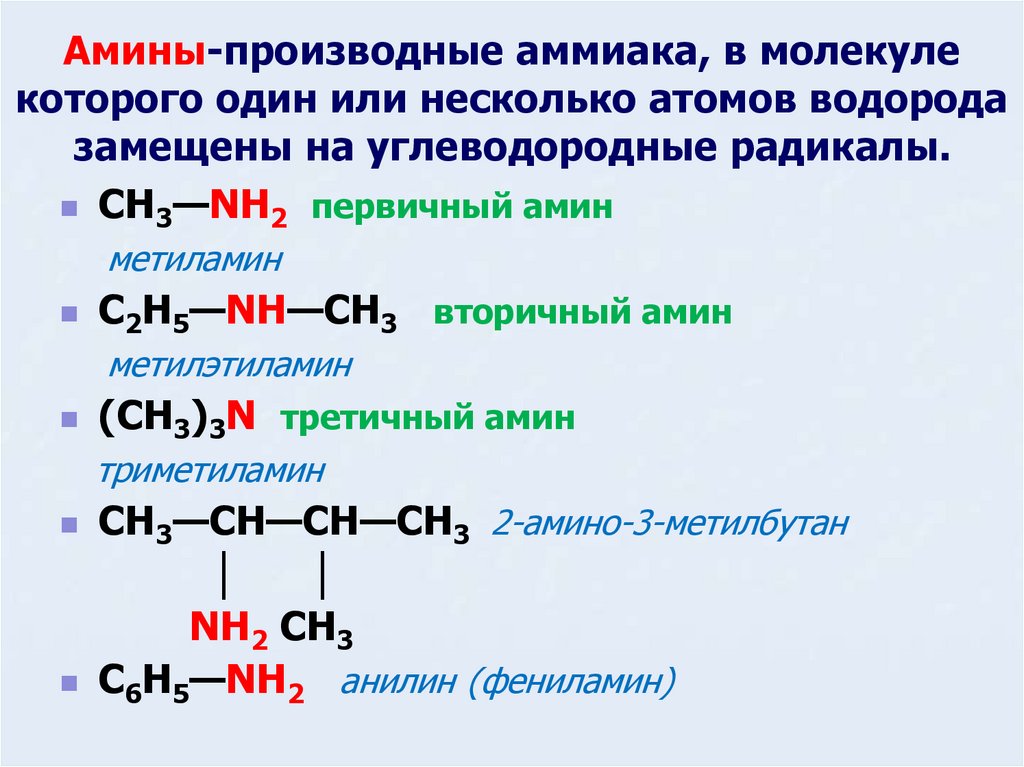
2. Амины-производные аммиака, в молекуле которого один или несколько атомов водорода замещены на углеводородные радикалы.
CH3—NH2 первичный аминметиламин
C2H5—NH—CH3 вторичный амин
метилэтиламин
(CH3)3N третичный амин
триметиламин
CH3—CH—CH—CH3 2-амино-3-метилбутан
│
│
NH2 CH3
C6H5—NH2 анилин (фениламин)
3.
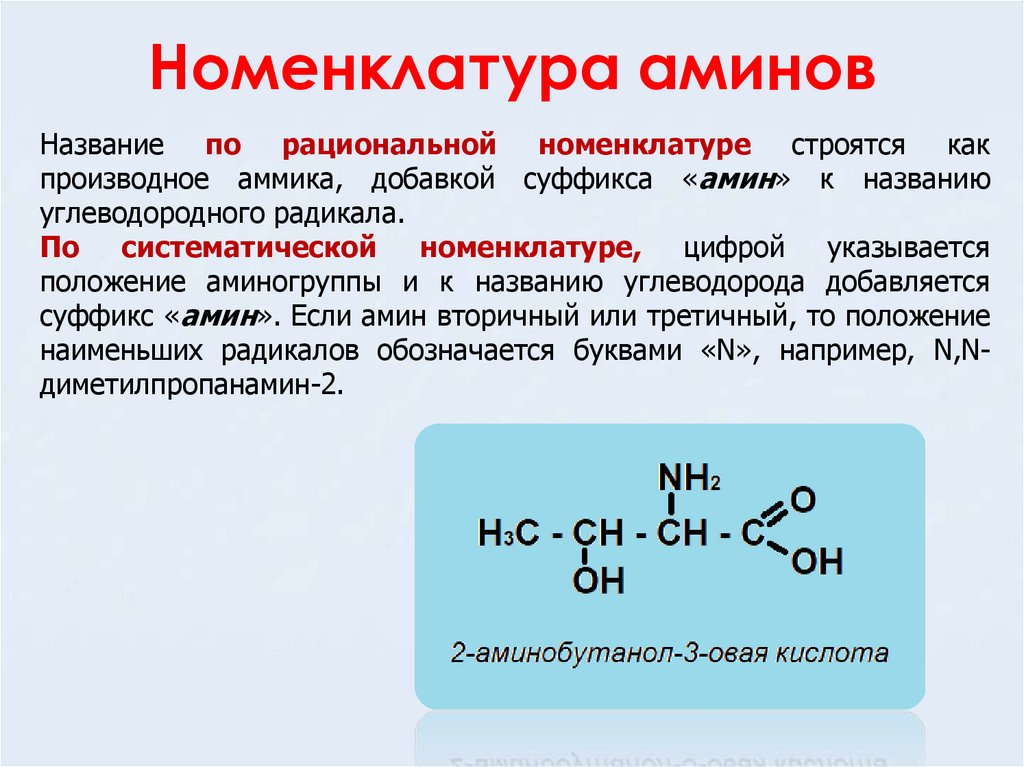
Номенклатура аминовНазвание по рациональной номенклатуре строятся как
производное аммика, добавкой суффикса «амин» к названию
углеводородного радикала.
По систематической номенклатуре, цифрой указывается
положение аминогруппы и к названию углеводорода добавляется
суффикс «амин». Если амин вторичный или третичный, то положение
наименьших радикалов обозначается буквами «N», например, N,Nдиметилпропанамин-2.
4.
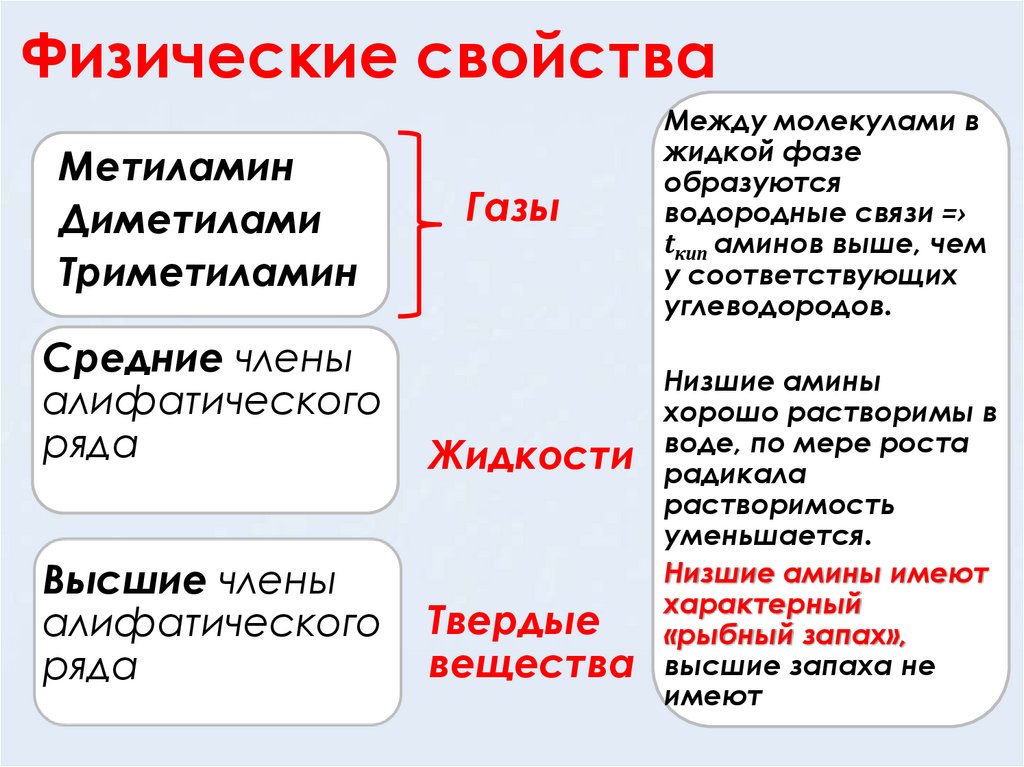
5. Физические свойства
МетиламинДиметилами
Триметиламин
Газы
Средние члены
алифатического
ряда
Жидкости
Высшие члены
алифатического
ряда
Твердые
вещества
Между молекулами в
жидкой фазе
образуются
водородные связи =›
tкип аминов выше, чем
у соответствующих
углеводородов.
Низшие амины
хорошо растворимы в
воде, по мере роста
радикала
растворимость
уменьшается.
Низшие амины имеют
характерный
«рыбный запах»,
высшие запаха не
имеют
6. Получение аминов
1.Взаимодействие аммиака сгалогенпроизводными углеводородов
(а так же со спиртами или менее
замещенными аминами, SN )
o
t
CH3Cl+2NH3→ CH3NH2+NH4Cl
Каt : Al2O3
2.Восстановление нитросоединений
C6H5NO2+6[H] → C6H5NH2+2H2O
Каt : Fe+HCl или
Zn+HCl
7. Получение аминов
2.Получение аминов
Взаимодействие
аммиака
и
аминов
галогенпроизводными углеводородов:
с
Действием аммиака на галогенопроизводные по реакции нуклеофильного замещения получают
смесь солей первичных, вторичных и третичных аминов, т. к. образующиеся в ходе реакции
амины (благодаря частичному разложению солей аммиаком) вступают в свою очередь в реакцию
с галогеналкилами.
8.
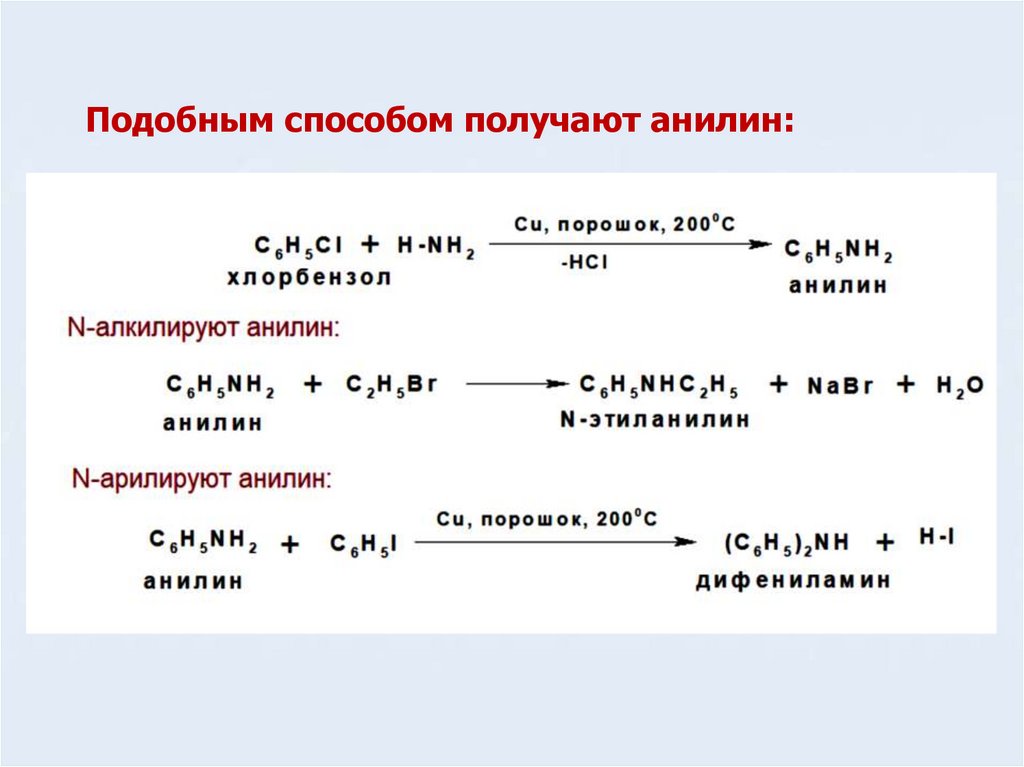
Подобным способом получают анилин:9. Строение и свойства
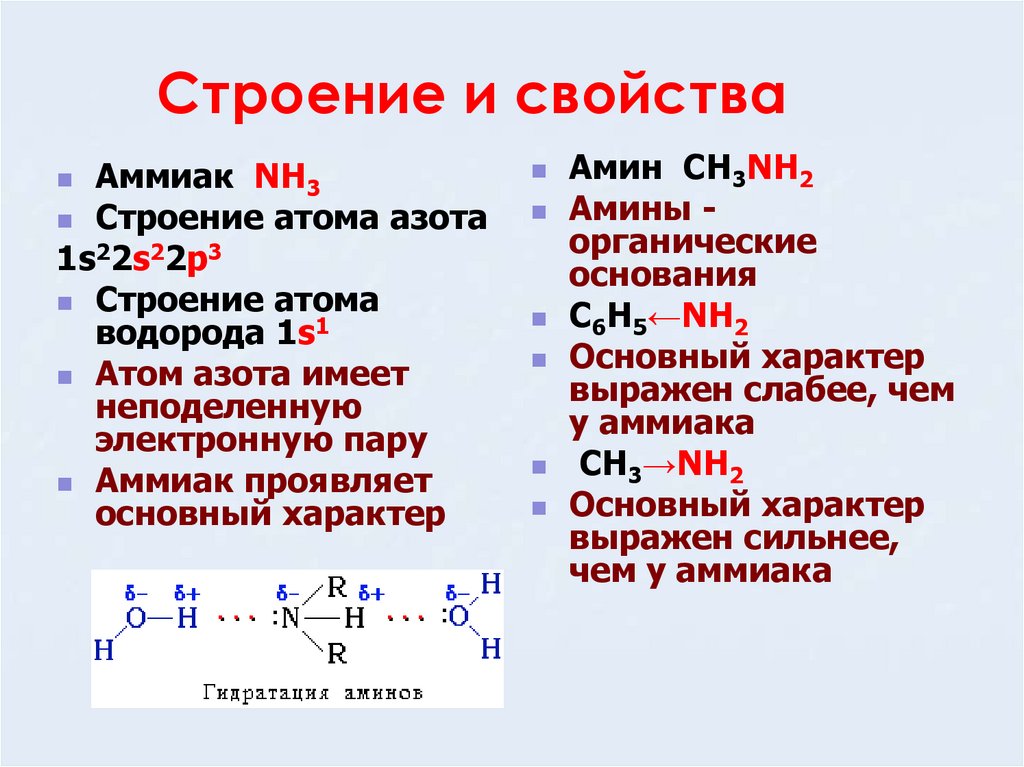
Аммиак NH3Строение атома азота
1s22s22p3
Строение атома
водорода 1s1
Атом азота имеет
неподеленную
электронную пару
Аммиак проявляет
основный характер
Амин CH3NH2
Амины органические
основания
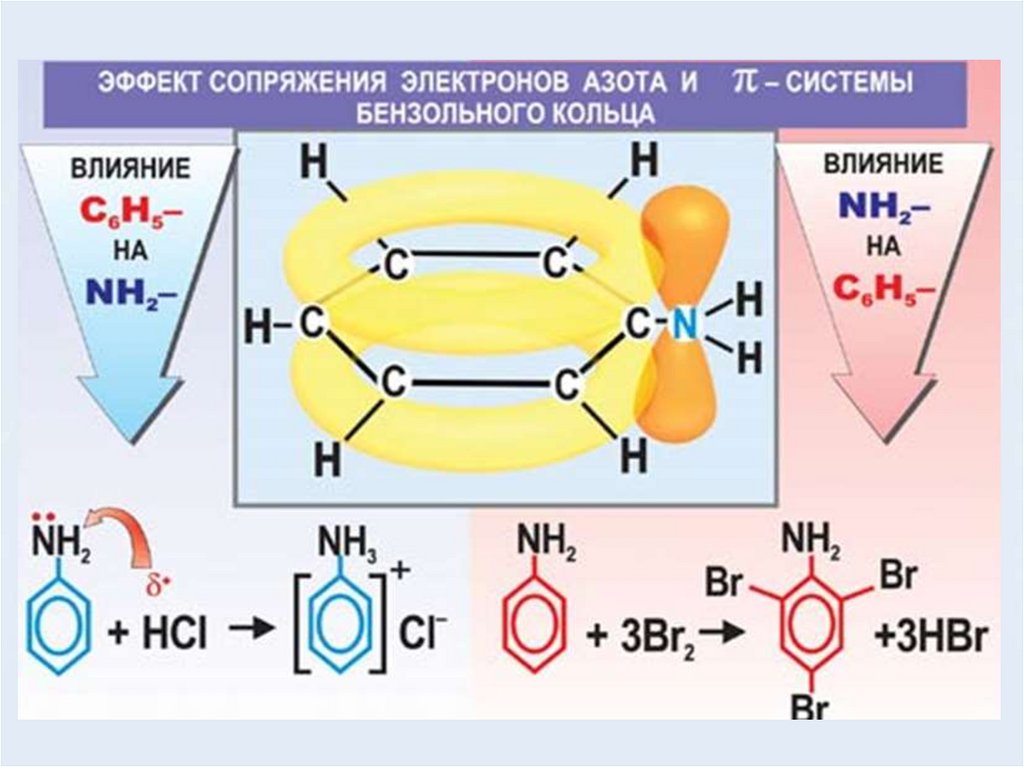
C6H5←NH2
Основный характер
выражен слабее, чем
у аммиака
CH3→NH2
Основный характер
выражен сильнее,
чем у аммиака
10.
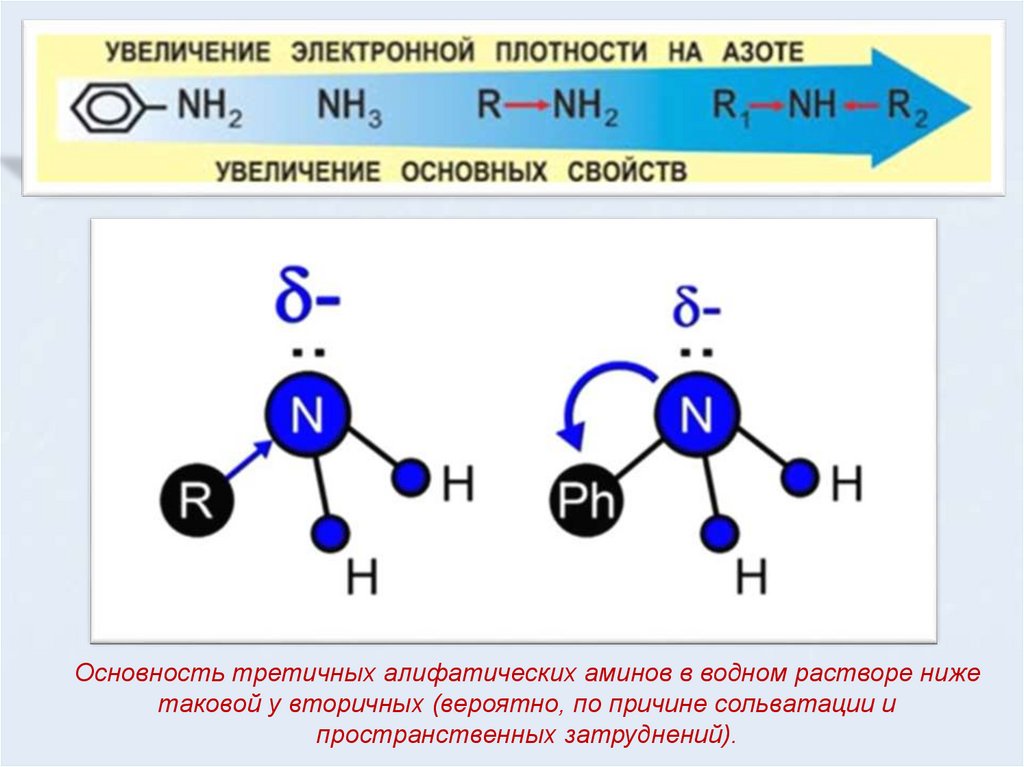
Основность третичных алифатических аминов в водном растворе нижетаковой у вторичных (вероятно, по причине сольватации и
пространственных затруднений).
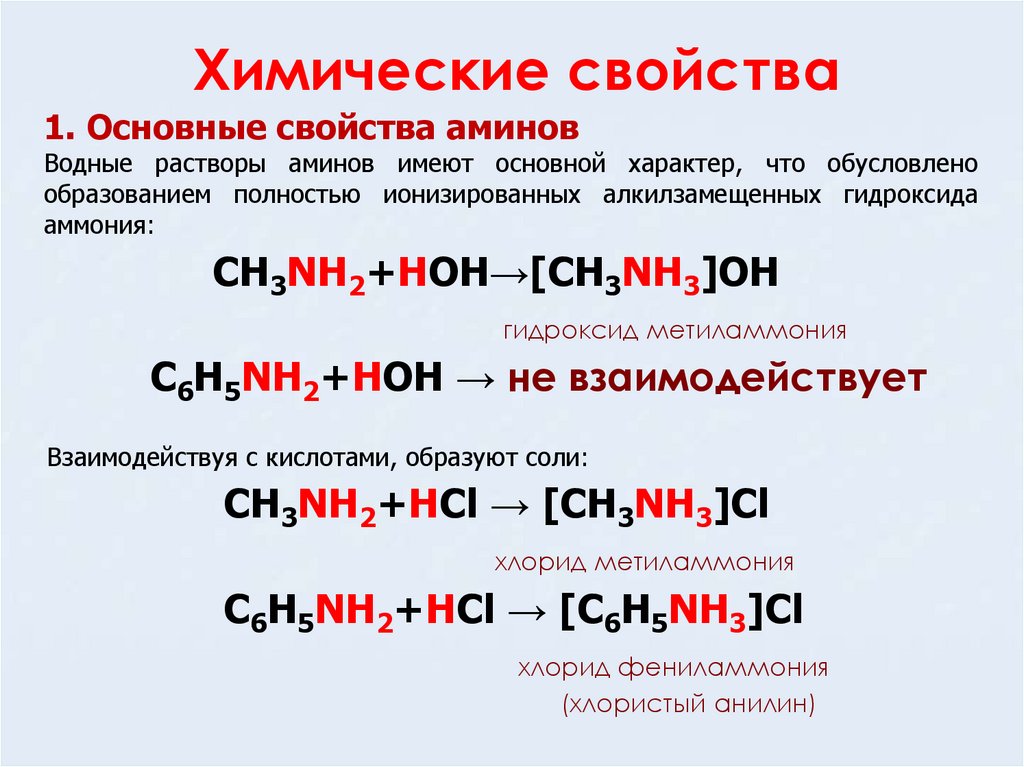
11. Химические свойства
1. Основные свойства аминовВодные растворы аминов имеют основной характер, что обусловлено
образованием полностью ионизированных алкилзамещенных гидроксида
аммония:
CH3NH2+HOH→[CH3NH3]OH
гидроксид метиламмония
C6H5NH2+HOH → не взаимодействует
Взаимодействуя с кислотами, образуют соли:
CH3NH2+HCl → [CH3NH3]Cl
хлорид метиламмония
C6H5NH2+HCl → [C6H5NH3]Cl
хлорид фениламмония
(хлористый анилин)
12.
Подобно аммиаку, алифатические аминыоснования из растворов солей металлов:
осаждают
малорастворимые
AlCl3+3CH3NH2+3H2O →3[CH3NH3]Cl+Al(OH)3↓
хлорид метиламмония
Соли аминов при взаимодействии с сильными основаниями дают амины:
2[CH3NH3]Cl+Сa(OH)2→2CH3NH2↑+CaCl2+2H2O
2. Реакции алкилирования аминов
(см. способы получение вторичных и третичных аминов)
3. Реакции с карбонильными
одразование иминов
соединениями
Первичные амины взаимодействуют с альдегидами
образованием иминов или Шиффовых оснований:
и
кетонами
RCOH + CH3NH2 → RCH=N-CH3 + H2O
имин
–
с
13.
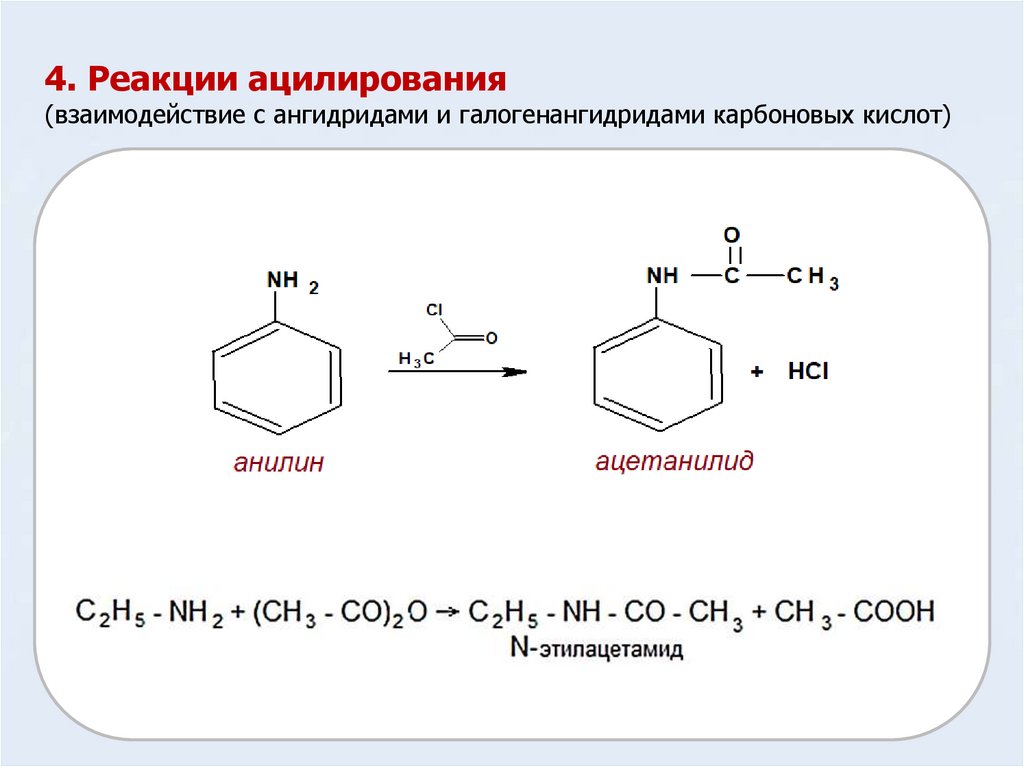
4. Реакции ацилирования(взаимодействие с ангидридами и галогенангидридами карбоновых кислот)
14. КАЧЕСТВЕННАЯ РЕАКЦИЯ: ВЗАИМОДЕЙСТВИЕ С АЗОТИСТОЙ КИСЛОТОЙ
1. Первичные алифатические амины реагируют с образованием азота:2.
Вторичные
(нитрозоамины):
амины
образуют
окрашенные
соединения
3. Третичные алифатические с азотистой кислотой не реагируют
Под действием конц. HNO2 третичные амины разрушаются
образованием вторичных аминов (или нитрозоаминов)
с
15. Анилин
16. Физические свойства анилина
Бесцветнаямаслянистая
жидкость, немного
тяжелее воды,
малорастворим в
воде, хорошо
растворяется в
этаноле и бензоле.
17.
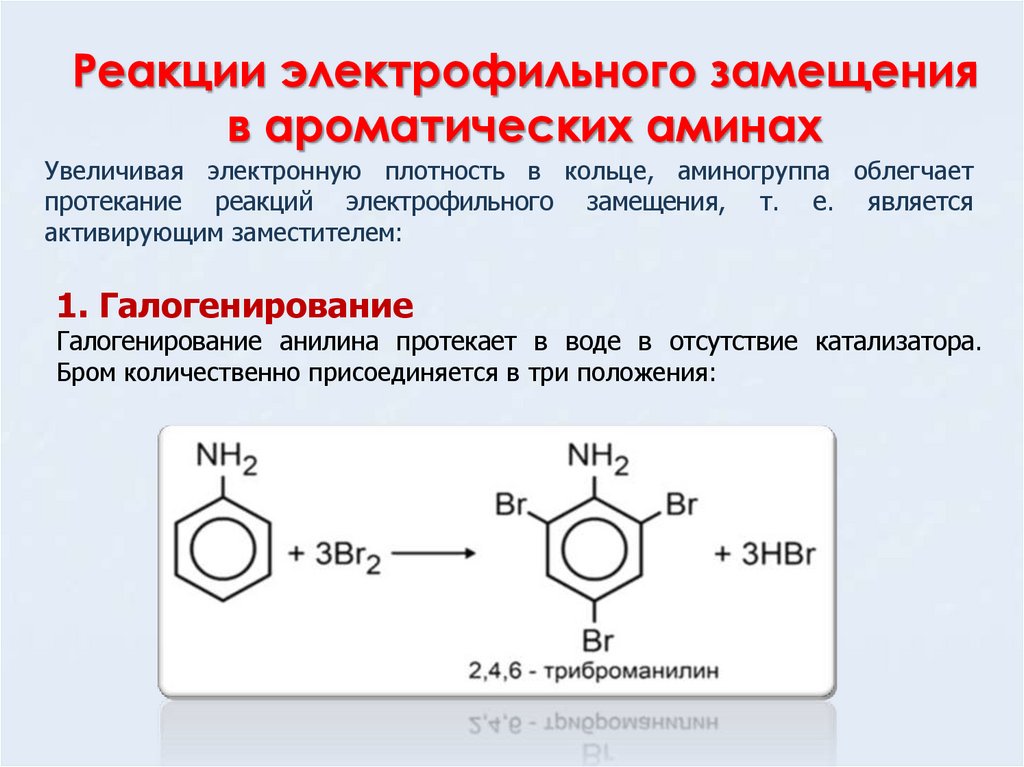
18. Реакции электрофильного замещения в ароматических аминах
Увеличивая электронную плотность в кольце, аминогруппа облегчаетпротекание реакций электрофильного замещения, т. е. является
активирующим заместителем:
1. Галогенирование
Галогенирование анилина протекает в воде в отсутствие катализатора.
Бром количественно присоединяется в три положения:
19. Качественная реакция на анилин
Анилин легко окисляетсяразличными
окислителями, поэтому
темнеет при хранении.
При действии на раствор
анилина хлорной извести
Ca(Cl)OCl
появляется
фиолетовое
окрашивание
Применение - самостоятельно







 chemistry
chemistry








