Similar presentations:
Физико-химические методы анализа вещества
1.
ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА ВЕЩЕСТВАФизико-химический анализ — комплекс методов анализа физикохимических
систем
путём
построения
и
геометрического
анализа диаграмм состояния и диаграмм состав-свойство.
Николай Семёнович Курнаков
(1860-1941)
1
2.
ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА ВЕЩЕСТВАПервоначально исследования в области физико-химического анализа
были сосредоточены на изучении зависимостей температур фазовых
переходов от состава.
Диаграмма состояния
однокомпонентной системы
(H2O)
2
3.
На рубеже XIX—XX веков Н. С. Курнаков показал, что любое физическоесвойство системы является функцией состава, а для изучения фазового
состояния можно использовать электропроводность, вязкость, поверхностное
натяжение, теплоёмкость, коэффициент рефракции, упругость и другие
физические свойства.
В основе теории физико-химического анализа лежат сформулированные
Н. С. Курнаковым принципы соответствия и непрерывности.
Принцип непрерывности утверждает, что если в системе не образуются
новые фазы или не исчезают существующие, то при непрерывном изменении
параметров системы свойства отдельных фаз и свойства системы в целом
изменяются непрерывно.
Принцип соответствия утверждает, что каждому комплексу фаз соответствует
определённый геометрический образ на диаграмме состав-свойство.
3
4.
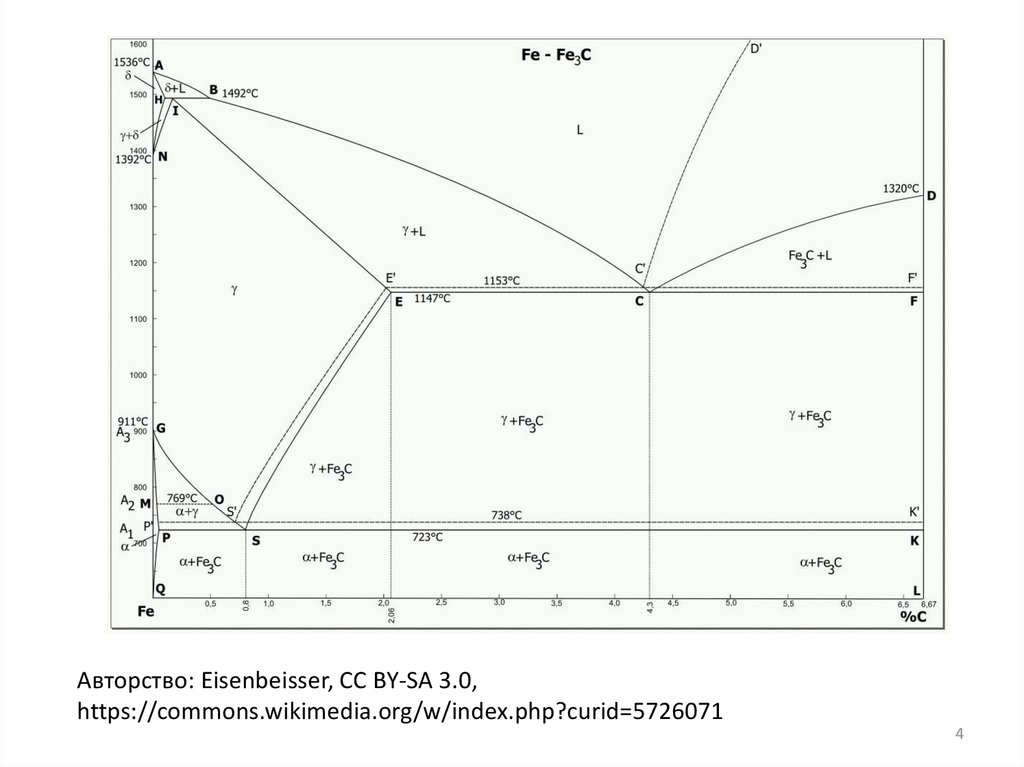
Авторство: Eisenbeisser, CC BY-SA 3.0,https://commons.wikimedia.org/w/index.php?curid=5726071
4
5.
По сравнению с классическими методами физико-химические методыанализа отличаются:
1) повышенной чувствительностью и избирательностью,
2) для анализа требуется незначительное количество
анализируемого вещества,
3) содержание определяемого компонента может быть чрезвычайно
мало,
4) отпадает необходимость отделения определяемых компонентов
от других составных частей определяемого вещества,
5) отсутствие индикаторов.
https://iweb.vyatsu.ru/document/material/45/ФХМА/Лекции%20ФХМА.pdf
5
6.
Выделяют следующие группы ФХМА:- спектральные методы анализа – основаны на измерении оптических
свойств и различных эффектов, наблюдаемых при взаимодействии
вещества с электромагнитным излучением;
- электрохимические методы – используют электрохимические
характеристики систем (потенциал электрода, диффузионный ток,
электропроводность раствора, количество электричества, пошедшее на
электродную реакцию);
- хроматографические методы анализа – основаны на использовании
сорбции в динамических условиях, применяются для разделения и
анализа однородных многокомпонентных смесей.;
- радиометрические методы – основаны на изучении радиоактивности
веществ;
- термические методы анализа – изменение свойств материалов под
воздействием температуры;
- кинетические методы анализа – основаны на измерении скорости
химической реакции, которая пропорциональна концентрации
определяемого вещества.
6
7.
Физико-химические методы анализа веществаФотоколориметрия
Фотоколориметрия оптический метод количественного
анализа, основаннный на взаимодействии вещества с
электромагнитным излучением в видимой области спектра.
Параметры измерения: частота ( ) 2,5.104- 1,5.104 см-1, длина
волны ( ) 380-750 нм и энергия излучения (Е) 1-10 эВ.
Фотоколориметрическим методом определяются точные
концентрации веществ в растворах окрашенных соединений,
цвет которых обусловлен длиной волны поглощенной части
светового луча.
7
8.
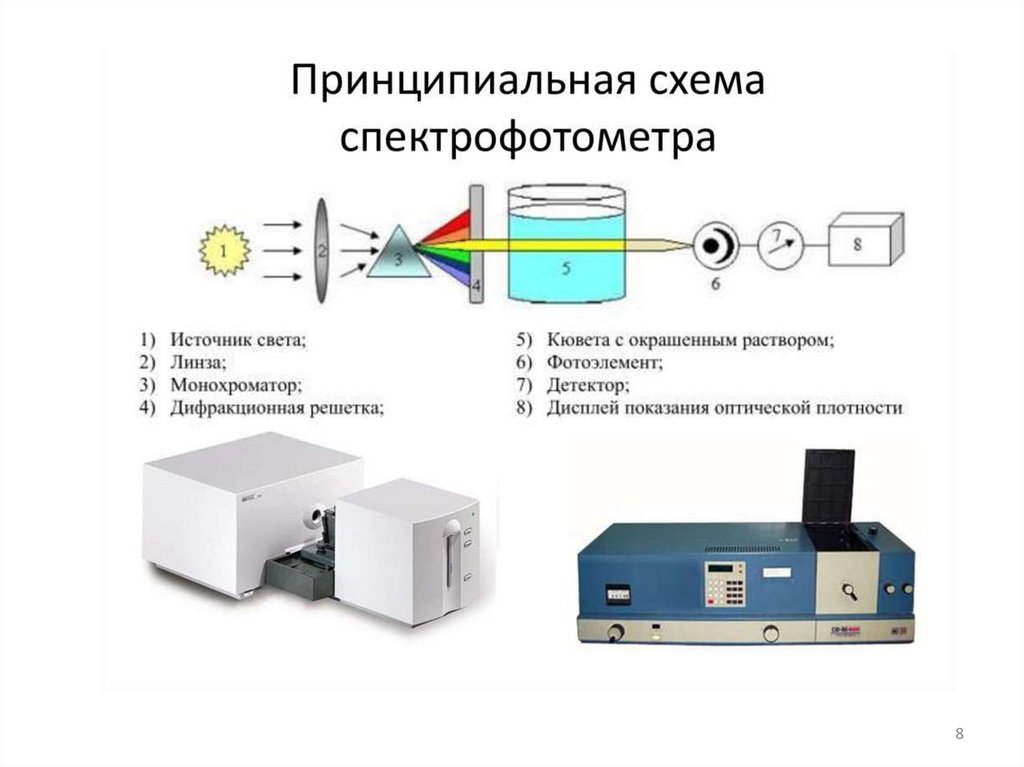
89.
Спектрофотометр для видимойи УФ областей спектра
9
10.
Зависимость цвета вещества от поглощаемой части спектра.Цвет
раствора Цвет поглощенной
поглощенной
вещества
части
светового части спектра, нм
(дополнительный)
потока
желто-зеленый
фиолетовый
400-450
желтый
синий
450-480
оранжевый
зелено-синий
480-490
красный
сине-зеленый
490-500
пурпурный
зеленый
500-560
фиолетовый
желто-зеленый
560-575
синий
желтый
575-590
сине-зеленый
красный
590-625
зеленый
пурпурный
625-750
10
11.
Поглощенное световое излучение описывается уравнениемБугера-Ламберта-Бера:
I
A = lgT = lg .b.C
I0
А - поглощение вещества, или его оптическая плотность;
Т - пропускание образца, т.е. отношение интенсивности света
прошедшего через образец, к интенсивности падающего света,
I/Iо;
C - концентрация вещества (моль/л);
b - толщина кюветы (см);
- молярная поглощательная способность вещества, или
молярный коэффициент поглощения
(л/моль.см).
11
12.
1213.
Расчет молярного коэффициента поглощения проводят поформуле:
= А/(C . b)
Концентрацию исследуемого вещества определяют по графику
зависимости оптической плотности раствора (А) от концентрации
(С) – калибровочный график.
Для этого измеряют оптическую
плотность (А1, А2, А3, А4.) серии
стандартных (с известной
концентрацией) растворов (С1,
С2, С3, С4) исследуемого
вещества. Строят калибровочную
прямую. И измерив оптическую
плотность анализируемого
раствора (Ах), определяют его
концентрацию (Сх).
13
14.
ПотенциометрияПотенциометрия – физико-химический метод анализа вещества основанный
на зависимости потенциала электрода, погруженного в раствор, от
концентрации определенных ионов в данном растворе. Уравнение Нернста:
Е = Е0 +
RT
Окисленнаяформа
ln
nF Восстановленнаяформа
Е0 - стандартный электродный потенциал, В;
R = 8,31 Дж/моль К, универсальная газовая постоянная;
n - зарядовое число ионов;
F = 96 485 Кл/моль, постоянная Фарадея;
Т - температура, К.
14
15.
Потенциал применяемого в работе стеклянного электродазависит от концентрации ионов водорода в растворе, что
используется при измерении рН. Стеклянный электрод в паре с
электродом сравнения, потенциал которого не зависит от рН,
опускают в определяемый раствор и измеряют разность их
потенциалов.
Потенциометрическое титрование
К точному объему определяемого раствора последовательно
добавляют небольшие порции стандартного раствора и после
каждого добавления измеряется рН. Точку эквивалентности
определяют графически:
15
16.
1617.
Интегральная криваяточка эквивалентности соответствует середине
касательной скачка титрования
отрезка
17
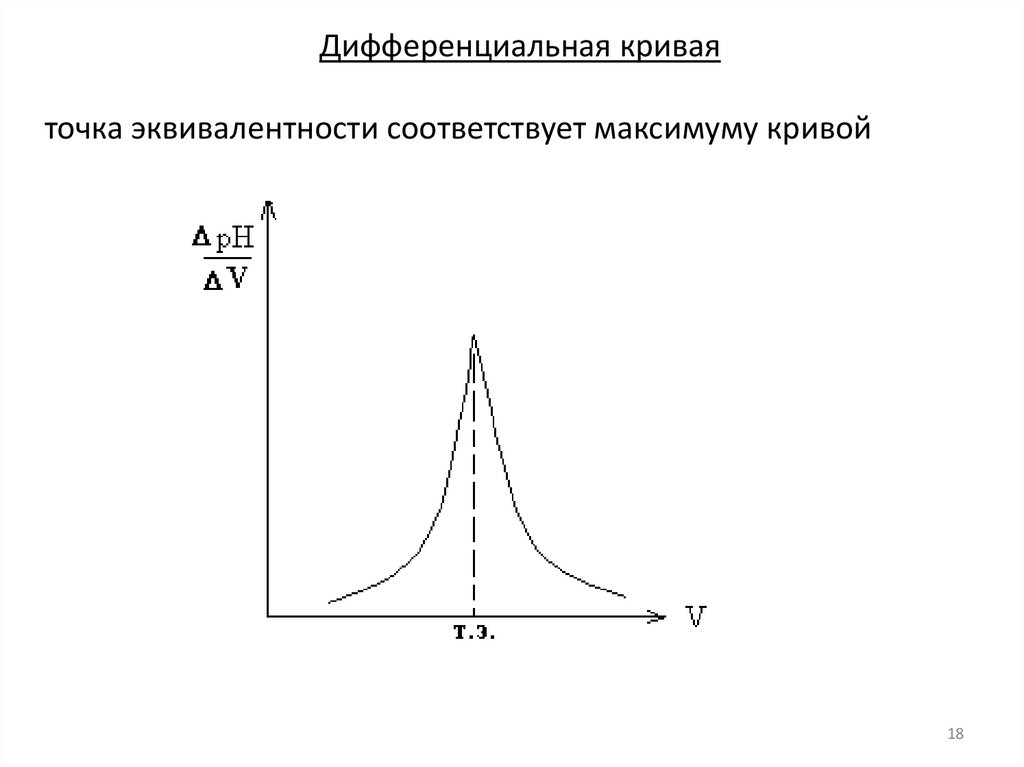
18.
Дифференциальная криваяточка эквивалентности соответствует максимуму кривой
18
19.
ХроматографияХроматография – физико-химический метод анализа основанный на
распределении веществ между двумя фазами — неподвижной (твердая фаза
или жидкость, связанная на инертном носителе, сорбент) и подвижной
(газовая или жидкая фаза, элюент).
Подвижная фаза - элюент, содержащая анализируемую пробу, перемещается
через неподвижную фазу. Обычно неподвижная фаза представляет собой
вещество с развитой поверхностью, а подвижная – поток газа или жидкости,
фильтрующейся через слой сорбента. При этом происходит многократное
повторение актов сорбции – десорбции, что является характерной
особенностью хроматографического процесса и обуславливает эффективность
хроматографического разделения.
19
20.
Виды хроматографических методов анализаПо агрегатному состоянию применяемых фаз:
- Газовая
- Жидкостная
По применяемой технике:
- Колоночная хроматография – разделение веществ проводится в
специальных колонках;
- Плоскостная хроматография :
– бумажная – разделение веществ проводится на
специальной бумаге;
– тонкослойная – разделение веществ проводится в
тонком слое сорбента.
По способу относительного перемещения фаз
- Фронтальная
- Элюентная
- Вытеснительная
20
21.
По механизм разделения:- Адсорбционная хроматография – разделение основано на различии в
адсорбируемости разделяемых веществ твердым адсорбентом;
- Распределительная хроматография – разделение основано на
различии в растворимости разделяемых веществ в неподвижной фазе
(газовая хроматография) и на различии в растворимости разделяемых
веществ в подвижной и неподвижной жидких фазах;
- Ионообменная хроматография – разделение основано на различии в
способности разделяемых веществ к ионному обмену;
- Проникающая хроматография – разделение основано на различии в
размерах или формах молекул разделяемых веществ, например, при
применении молекулярных сит (цеолитов);
- Осадочная хроматография – разделение основано на образовании
различных по растворимости осадков разделяемых веществ с
сорбентом;
- Адсорбционно-комплексообразовательная хроматография –
разделение основано на образовании координационных соединений
различной прочности в фазе или на поверхности адсорбента.
21
22.
Тонкослойная хроматографияНеподвижная твердая фаза тонким слоем наносится на стеклянную,
металлическую или пластмассовую пластинку. В 2–3 см от края
пластинки на стартовую линию вносят пробу анализируемой
жидкости и край пластинки погружают в растворитель, который
действует как подвижная фаза жидкостной адсорбционной
хроматографии. Под действием капиллярных сил растворитель
движется вдоль слоя сорбента и с разной скоростью переносит
компоненты смеси, что приводит к их разделению. Диффузия в
тонком слое происходит в продольном и поперечном направлениях,
поэтому процесс следует рассматривать как двумерный.
Сорбционные свойства системы в ТСХ характеризуются
подвижностью, т.е. величиной Rf, которая рассчитывается из
экспериментальных данных по уравнению:
Rf = Хi / Xf
Хi - расстояние от стартовой линии до центра зоны i-го компонента;
Xf - расстояние, пройденное за это же время растворителем.
22
23.
Ионообменная хроматографияОснована на обратимом стехиометрическом обмене ионов,
находящихся в растворе, на ионы, входящие в состав
ионообменника.
Ионообменник - высокополимерное соединение, например
поперечно-сшитый
полистирол,
содержащий
различные
функциональные группы, которые и определяют наиболее
характерные свойства смол.
Ионообменные смолы
- Катиониты содержат функциональные кислотные группы [SO3-; -COO-; -PO3-; -N(CH2CO2-)2].
- Аниониты содержат функциональные группы четвертичные –
NR3+, третичные –NR2H+ или первичные –NH3+ аммониевые,
пиридиновые или другие основания.
Обменную емкость ионита выражается количеством молей
эквивалента противоиона на единицу массы или объема смолы.
23
24.
Спасибо за внимание!24





















 chemistry
chemistry








