Similar presentations:
Практическое занятие № 2 Количественный анализ
1. СПб ГБУ «3 медколледж»
ОП.06. Физико-химические методыи техника лабораторных работ
Количественный анализ.
Титриметрия
Подготовила
преподаватель
Зубова Т.Ф.
2.
Количественныйхимический анализ – это
определение количественного
состава, т.е. установление
количества химических
элементов, ионов, атомов,
атомных групп, молекул в
анализируемом веществе.
3.
Основоположник количественного анализаМ.В. Ломоносов
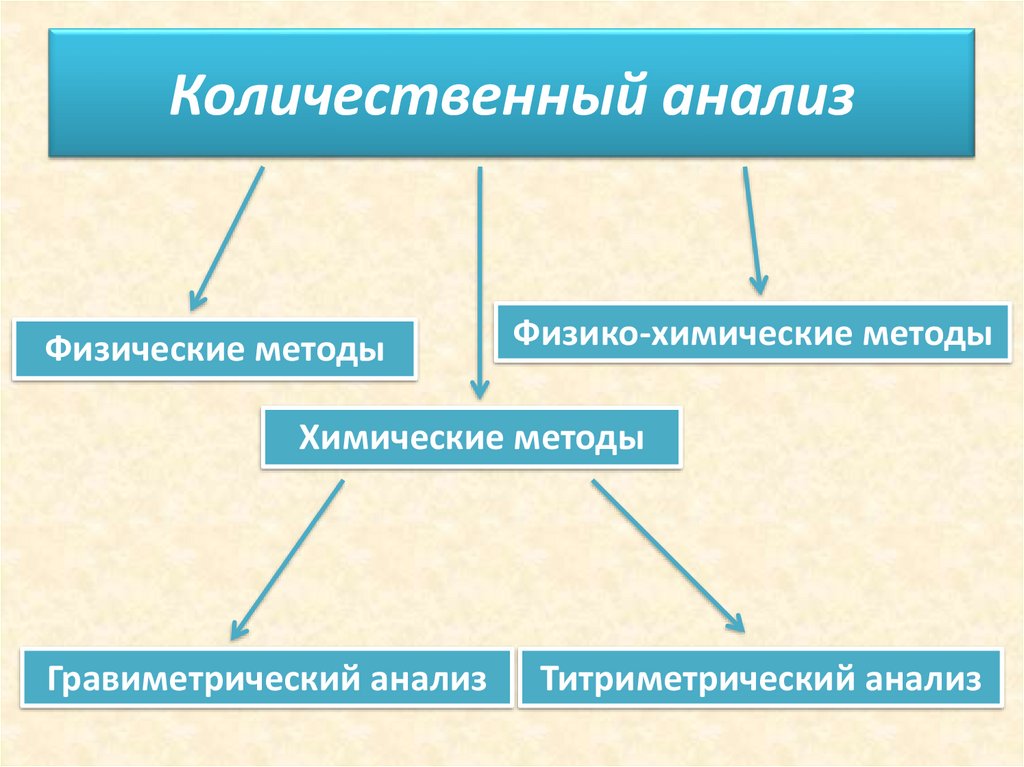
4. Количественный анализ
Физические методыФизико-химические методы
Химические методы
Гравиметрический анализ
Титриметрический анализ
5. Гравиметрический метод анализа
Гравиметрическиманализом
называют
метод
количественного
химического анализа, который базируется
на
точном
измерении
массы
определяемого
вещества
или
его
составных
частей,
выделенных
в
химически чистом состоянии или в виде
соответствующих
соединений
(точно
известного постоянного состава).
6.
7.
8.
9.
10.
Важнейшие операции гравиметрического анализа1. Подготовка тиглей к проведению гравиметрического анализа
Тигли считаются подготовленными, если они прокалены до постоянной массы.
Тигли тщательно промывают, высушивают на пламени горелки и затем прокаливают в
муфельной печи при температуре, при которой будет прокаливаться осадок, в течение
30-40 минут.
Прокаленный тигель помещают в эксикатор на 40-45 минут для охлаждения до
комнатной температуры. После взвешивания тигель снова прокаливают в муфельной
печи в течение 15-20 минут, охлаждают в эксикаторе и снова взвешивают.
Эту операцию проводят до тех пор, пока не доведут тигель до постоянной массы.
2. Осаждение
3. Фильтрование и промывание осадка
Для фильтрования применяют беззольные фильтры, дающие при сжигании очень
незначительное количество золы (0,0001 г).
Простой бумажный фильтр применяют в том случае, если осадок нужен для дальнейшей
работы. Складчатый фильтр применяется в тех случаях, когда отделяемый осадок не
будет нужен.
4. Высушивание и прокаливание осадка
Сначала подсушивают мокрый фильтр с осадком на пламени горелки или в сушильном
шкафу. Чуть влажный фильтр с осадком помещают в тигле в муфельную печь и
прокаливают. Время и температура прокаливания обусловлены составом и количеством
осадка.
11.
12. Прокаливание осадка в муфельной печи
13.
5. Взятие навескиНавеска – это точно отвешенное количество вещества.
На аналитических весах отвешивают вещество в том случае, если нужно взять навеску с
точностью до десятичных долей г (0,0001 мг). При этом поступают следующим образом:
• Взвесить бюкс или часовое стекло, соблюдая все правила взвешивания.
• Определить суммарную массу бюкса (или стекла) и необходимой навески.
• Снять с чашки весов гирьки, соответствующие массе бюкса и поставить новые, равные
суммарной массе бюкса и навески. Ни в коем случае нельзя добавлять гирьки,
соответствующие массе навески к уже стоящим на чашке весов гирькам,
соответствующим массе бюкса. Повернуть внешний и внутренний диски так, чтобы
поставить новую миллиграммовую нагрузку.
• Снять бюкс с весов, насыпать в него немного вещества и снова поставить на весы.
Осторожно открывая арретир, наблюдают за отклонением стрелки и устанавливают,
мало или много вещества в бюксе. Каждый раз снимая бюкс с чашки весов, осторожно
досыпают или отсыпают вещество, пока около отсчетной линии не остановится деление
шкалы, соответствующее третьему и четвертому знаку суммарной массы.
Иногда навеска не должна абсолютно точно соответствовать расчетному количеству, а
должна быть близка к расчетному, но абсолютно точно взвешена. В таком случае
взвешивают на аналитических весах часовое стекло или бюкс. Складывают их массу с
массой нужной навески и на чашку весов ставят новые разновесы, соответствующие этой
сумме. Насыпают в бюкс или на часовое стекло такое количество вещества, чтобы не надо
было менять цифры на внешнем диске, а на внутреннем изменение должно быть не более
одной цифры. Открывают арретир полностью, снимают показания шкалы и записывают
полученную суммарную массу. Вычитая массу бюкса, находят точное значение взятой
навески.
14.
15. 6. Вычисление результатов анализа
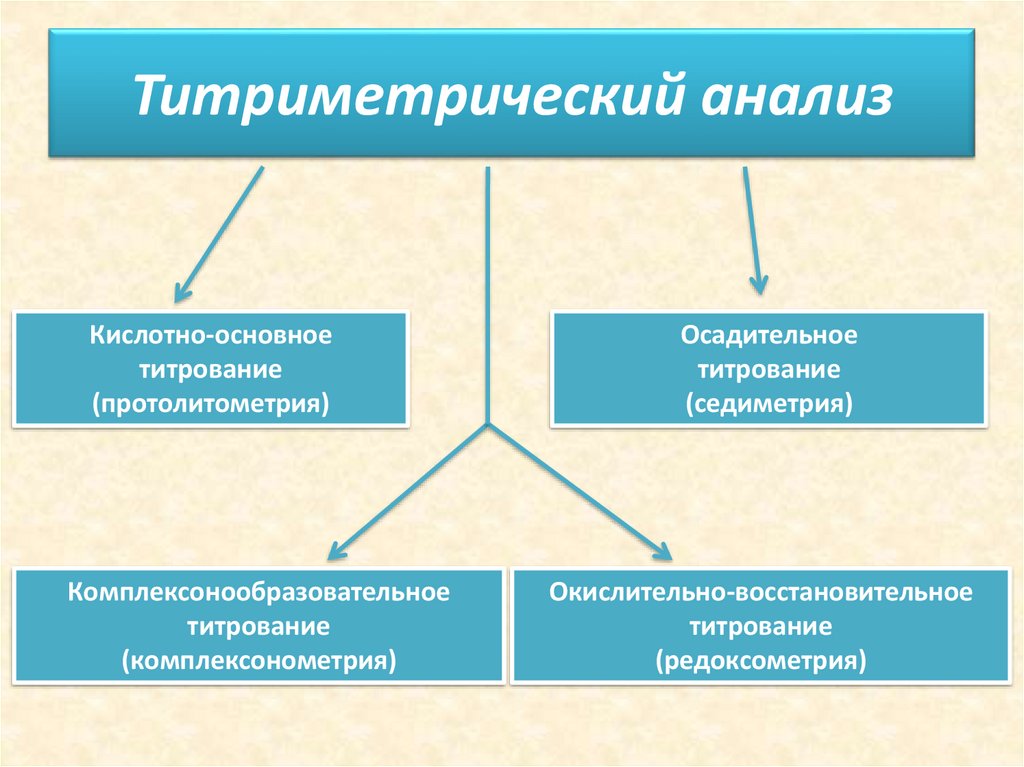
16. Титриметрический метод анализа
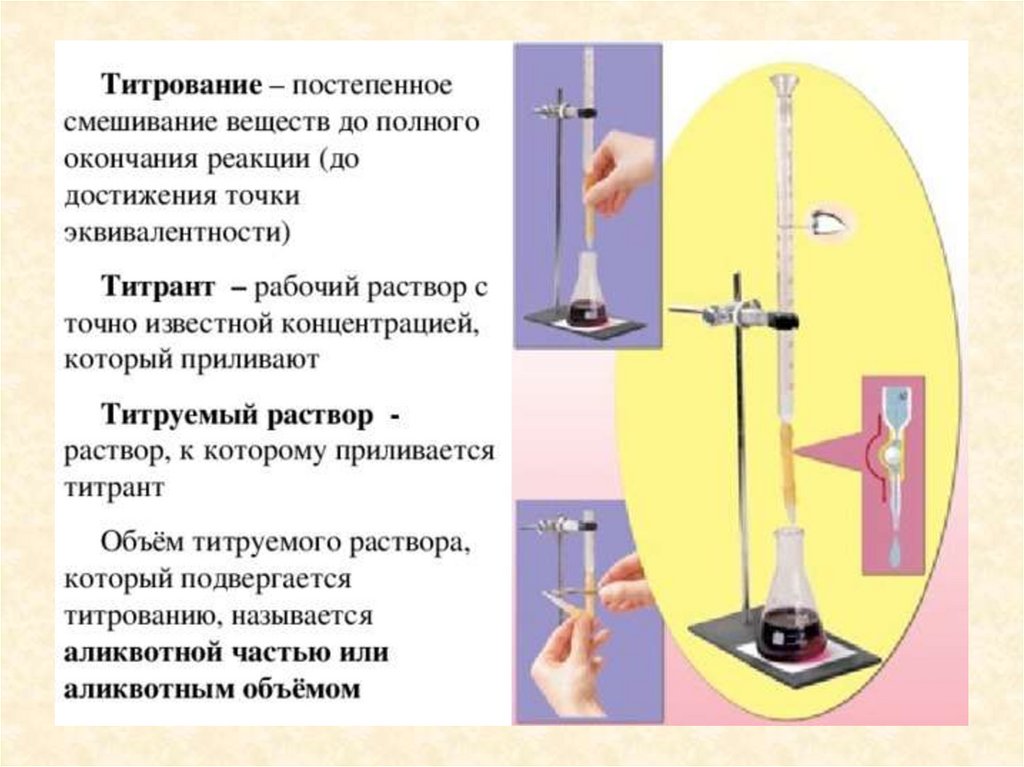
Титриметрический анализ – методколичественного химического анализа,
который базируется на измерении
точного объема раствора с точно
известной концентрацией (титранта),
истраченного на взаимодействие с
определяемым веществом.
17.
Раствор реагентаточно известной концентрации,
который применяется для титрования в методе,
называют стандартным или титрованным раствором
или титрантом.
Требования для титранта:
легко и быстро приготавливаться;
анализироваться
простыми
и
общедоступными
соотношениями с титруемым раствором;
быть устойчивыми в течении достаточно длительного
времени;
обеспечить возможность необходимого количественного
взаимодействия с определяемым компонентом;
быть окрашенными.
18. Закон эквивалентов
19. Титриметрический анализ
Кислотно-основноетитрование
(протолитометрия)
Комплексонообразовательное
титрование
(комплексонометрия)
Осадительное
титрование
(седиметрия)
Окислительно-восстановительное
титрование
(редоксометрия)
20.
21.
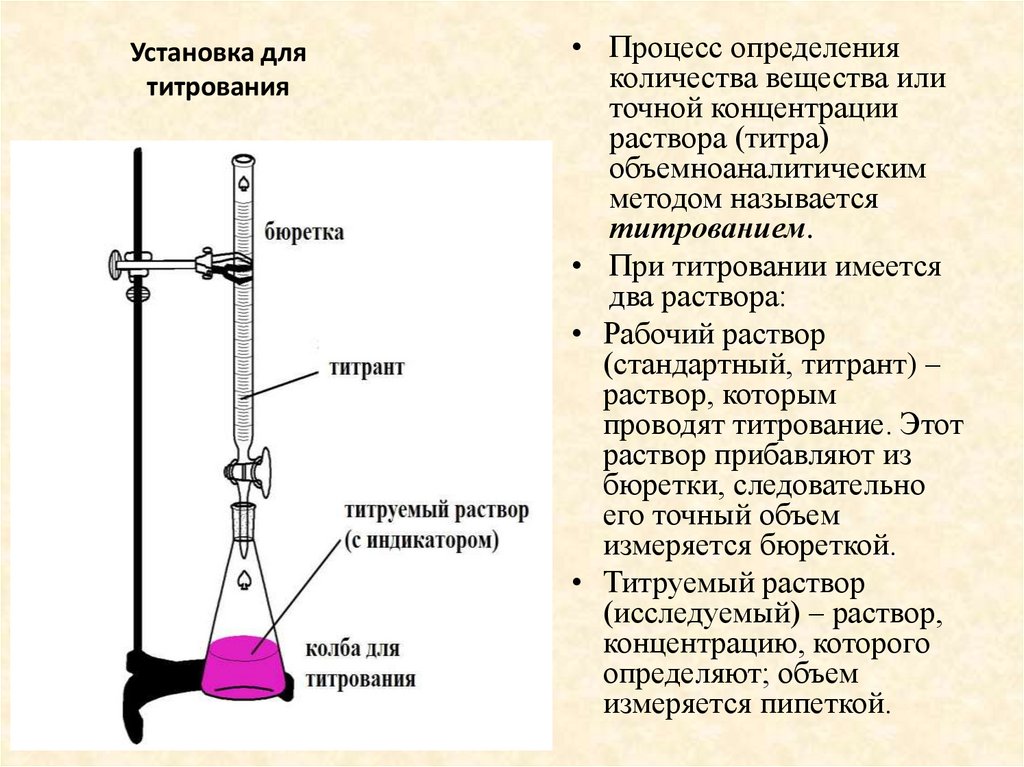
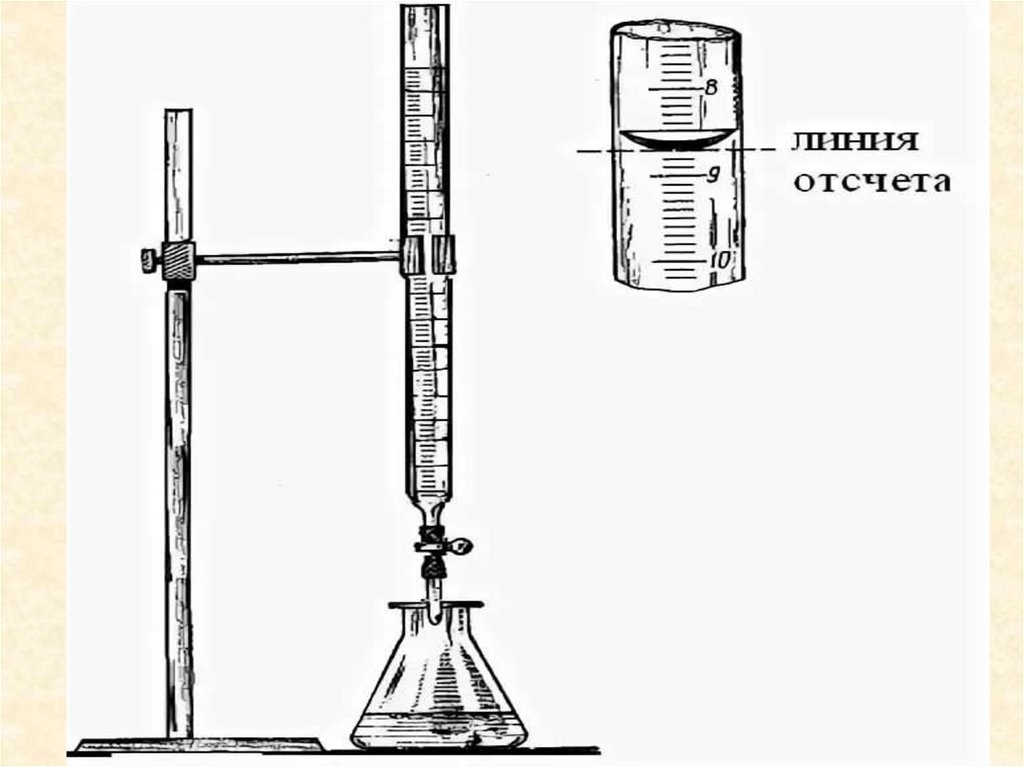
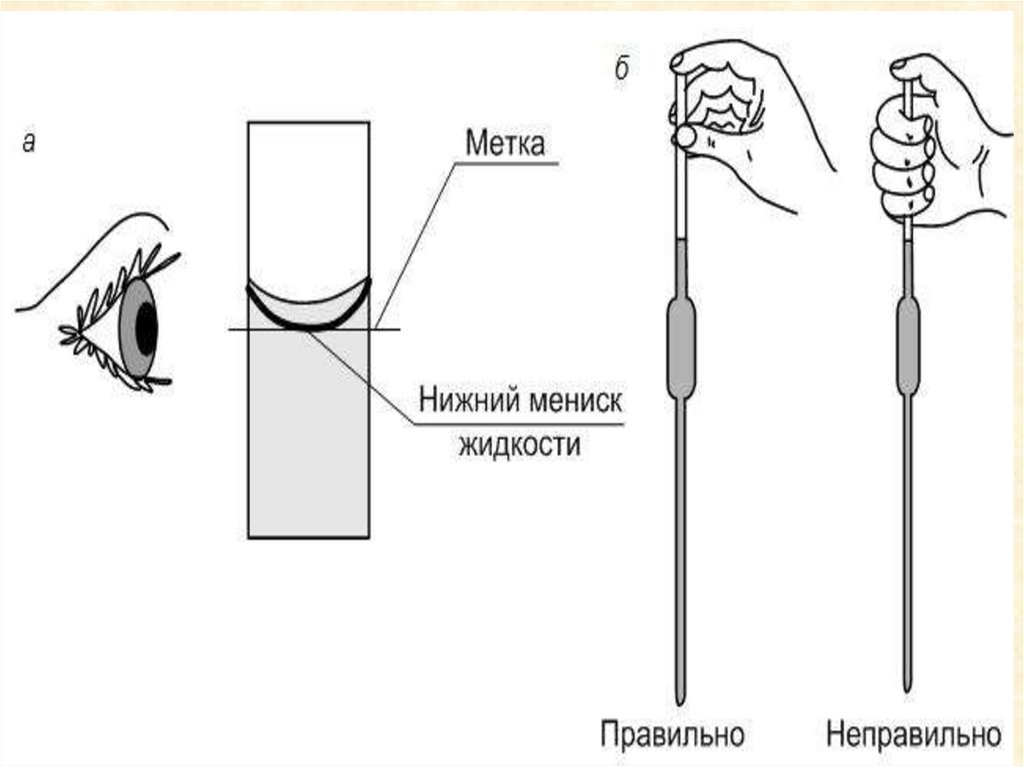
22. Установка для титрования
• Процесс определенияколичества вещества или
точной концентрации
раствора (титра)
объемноаналитическим
методом называется
титрованием.
• При титровании имеется
два раствора:
• Рабочий раствор
(стандартный, титрант) –
раствор, которым
проводят титрование. Этот
раствор прибавляют из
бюретки, следовательно
его точный объем
измеряется бюреткой.
• Титруемый раствор
(исследуемый) – раствор,
концентрацию, которого
определяют; объем
измеряется пипеткой.
23.
24.
25.
26. Требования к реакциям, которые используют в титриметрии:
Вещества, которые вступают в реакцию, должны реагировать встрого
определенных
количественных
соотношениях
(количественно).
2) Реакция между определяемым веществом и стандартным
раствором титранта должна проходить быстро и практически до
конца.
3) Посторонние вещества, которые присутствуют в исследуемой
пробе, и перешли вместе с определяемым веществом в раствор,
не должны мешать титрованию определяемого вещества
(специфичность).
4) Точка эквивалентности (Т.Э.) должна фиксироваться тем или
другим способом четко и точно.
5) Реакции должны проходить по мере возможности при
комнатной tо.
6) Титрование не должно сопровождаться побочными реакциями,
которые искажают результаты анализа.
1)
27. Точка эквивалентности
Момент, в который при титровании добавлено строгоэквивалентное количество вещества, отвечающее
стехиометрическому
уравнению
взаимодействия,
называется точкой эквивалентности.
Способы фиксации точки эквивалентности:
визуальные (титрование с индикатором, специфическое
изменение окраски раствора);
инструментальные методы (потенциометрические,
амперометрические, фотометрические).

























 chemistry
chemistry








