Similar presentations:
Строение, свойства, механизм действия ферментов (лекция)
1.
СЗГМУ им. И. И. МЕЧНИКОВАКАФЕДРА КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ,
БИОЛОГИЧЕСКОЙ И ОБЩЕЙ ХИМИИ им. В.В. СОКОЛОВСКОГО
БИОЛОГИЧЕСКАЯ ХИМИЯ-БИОХИМИЯ ПОЛОСТИ РТА
Раздел II
ЛЕКЦИЯ
СТРОЕНИЕ, СВОЙСТВА, МЕХАНИЗМ ДЕЙСТВИЯ
ФЕРМЕНТОВ.
Доцент Антонова Ж.В.
2023/2024
2.
План лекцииХимическая природа ферментов
Свойства ферментов как белков
Общие свойства небиологических катализаторов и ферментов
Отличия ферментов от небиологических катализаторов.
Функциональная значимость участков АЦ. Виды специфичности ферментов (абсолютная, групповая,
стереоспецифичнось, каталитическая специфичность).
6. Приложение 1. Классификация ферментов.
7. Номенклатура ферментов. Шифр ферментов.
8. Строение ферментов (простых, сложных, регуляторных).
9. Строение АЦ простых и сложных ферментов. Небелковые компоненты сложных ферментов и их роль.
10. Механизм действия ферментов.
11. Приложение 2. Теории ферментативного катализа
12. Этапы ферментативного катализа.
13. Молекулярные механизмы ферментативного катализа. Каталитическая эффективность ферментов.
14. Кинетика ферментативных реакций.. Зависимость скорости ферментативной реакции от концентрации
фермента.
15. Приложение 3. Единицы активности ферментов.
16. Зависимость скорости ферментативной реакции от концентрации субстрата. Уравнение МихаэлисаМентен. Константа Михаэлиса.
17. Зависимость скорости ферментативной реакции от температуры и рН.
1.
2.
3.
4.
5.
2/Ж.В
3.
Химическая природа ферментовОбмен веществ был бы невозможен без резкого ускорения реакций,
на которых он основан, без согласования во времени и пространстве
множества биохимических процессов, т.е. без участия ферментов.
Ферменты (энзимы) – это высокоспециализированные
биологические катализаторы белковой природы*,
осуществляющие с высокой скоростью биохимические реакции
в клетке.
Ферменты Е (от англ. enzyme - фермент) катализируют превращения
веществ, которые называются субстратами (S), - в продукты (Р).
*Примечание: большинство ферментов – это белки, однако в роли
биокатализаторов могут выступать и небелковые соединения. Например,
некоторые типы молекул РНК могут проявлять каталитическую активность. Они
называются «рибозимы».
3/Ж.В.
4.
Свойства ферментов как белков.Большинство ферментов имеют большую молекулярную массу и являются ВМС.
Имеют третичную, иногда четвертичную структуру. Могут формировать
полифункциональные ансамбли и полиферментные надмолекулярные комплексы.
Под влиянием физических и химических денатурирующих факторов происходит
денатурация ферментов с утратой свойств катализировать химическую реакцию, так же
как и у других белков теряются биологические свойства.
Подвергаются высаливанию и при этом не теряют каталитических свойств.
При гидролизе ферменты распадаются на аминокислоты, если они являются простыми
белками.
Ферменты, как и все белки, обладают амфотерностью, т.е. могут существовать в
растворе в виде ионизированных молекул.
Обладают электрофоретической подвижностью, а при рНi не обнаруживают
подвижности.
Большинство ферментов не могут проходить через поры полупроницаемых мембран,
что позволяет очищать их растворы от низкомолекулярных примесей методом диализа.
4/Ж.В.
5.
Общие свойства небиологических катализаторов и ферментовФерменты, так же как и другие небиологические (химические)
катализаторы:
• действуют в малых количествах по сравнению с содержанием
реагирующих веществ;
• катализируют только энергетически возможные реакции (∆G < 0);
• не сдвигают равновесие реакции, а ускоряют его достижение (ускоряют
как прямую, так и обратную реакцию в равной степени);
• не расходуются в процессе реакции и не претерпевают необратимых
изменений;
• повышают скорость реакции, понижая энергию активации (ЕА).
5/Ж.В.
6.
Отличия ферментов от небиологических катализаторовФерменты отличаются следующими свойствами
• Высокой эффективностью каталитического действия (в 105- 1012 раз
выше, чем соответствующих неферментативных реакций)
• Мягкими условиями протекания ферментативных реакций (t ~ 37* ,
постоянное атмосферное давление; физиологические значения рН), а
химический катализ, напротив, требует высоких температур и давления,
экстремальных значений рН
• Способностью к регуляции каталитической активности различными
веществами, снижающими или повышающими активность ферментов
• Изменением активности под действием ингибиторов и активаторов
• Высокой специфичностью (избирательностью) действия
Различают каталитическую и субстратную специфичность,
определяемую строением активного центра фермента.
6/Ж.В.
7.
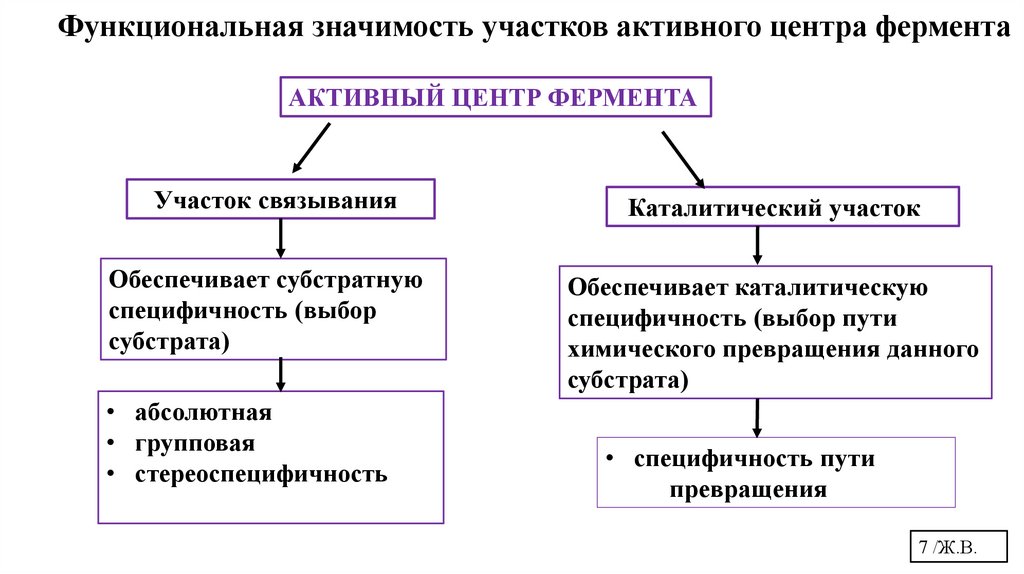
Функциональная значимость участков активного центра ферментаАКТИВНЫЙ ЦЕНТР ФЕРМЕНТА
Участок связывания
Каталитический участок
Обеспечивает субстратную
специфичность (выбор
субстрата)
Обеспечивает каталитическую
специфичность (выбор пути
химического превращения данного
субстрата)
• абсолютная
• групповая
• стереоспецифичность
• специфичность пути
превращения
7 /Ж.В.
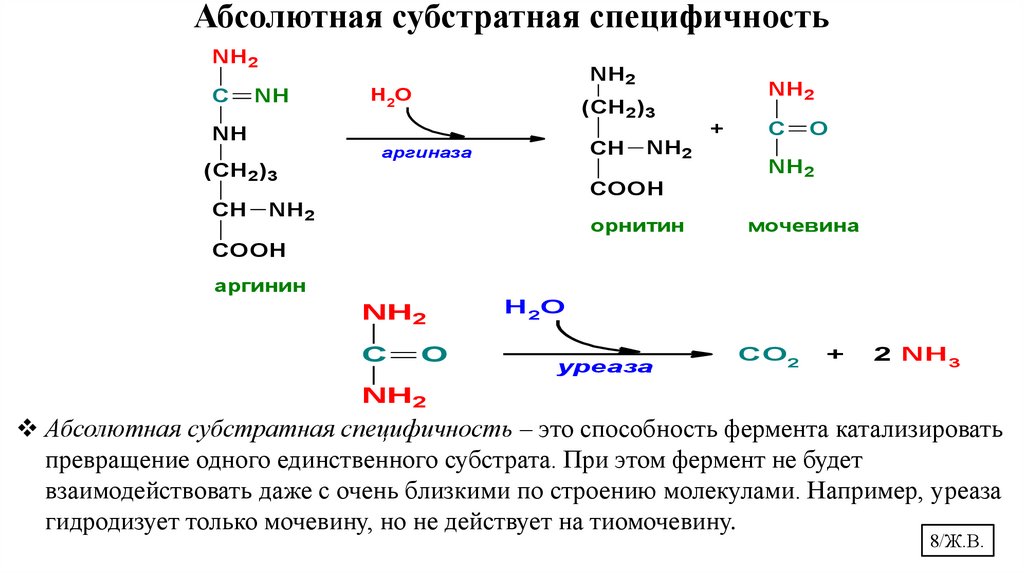
8.
Абсолютная субстратная специфичностьNH2
С
NH
NH
(СН2)3
СН
NH2
Н2О
NH2
(СН2)3
СН
аргиназа
+
NH2
С
O
NH2
COOH
NH2
орнитин
мочевина
COOH
аргинин
NH2
С
O
Н2О
уреаза
СО2
+
2 NH3
NH2
Абсолютная субстратная специфичность – это способность фермента катализировать
превращение одного единственного субстрата. При этом фермент не будет
взаимодействовать даже с очень близкими по строению молекулами. Например, уреаза
гидродизует только мочевину, но не действует на тиомочевину.
8/Ж.В.
9.
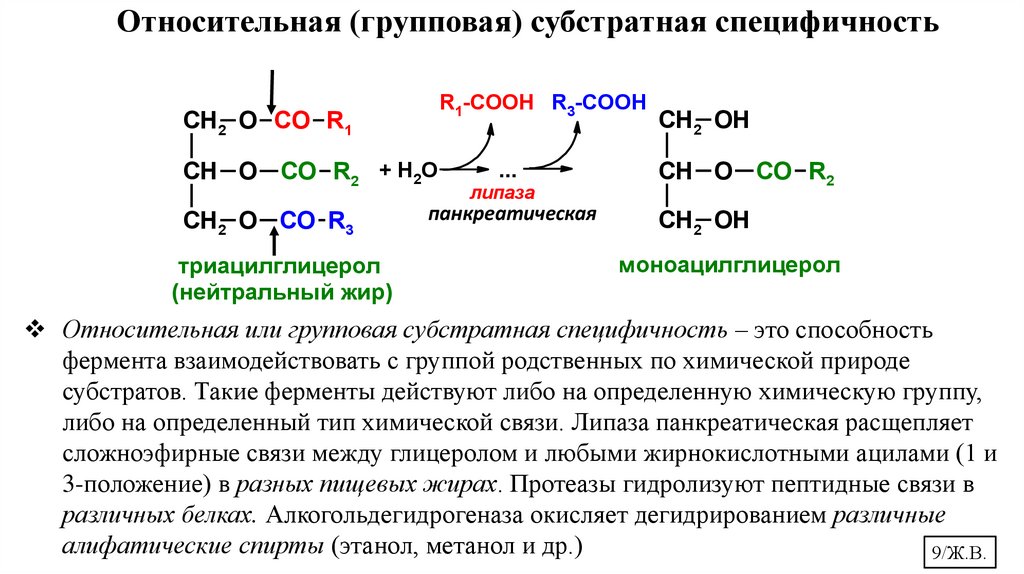
Относительная (групповая) субстратная специфичностьR1-COOH R3-COOH
СН2 O CО R1
СН O CО R2 + Н2О
СН2 O СО R3
триацилглицерол
(нейтральный жир)
...
липаза
панкреатическая
СН2 OH
СН O CО R2
СН2 OH
моноацилглицерол
Относительная или групповая субстратная специфичность – это способность
фермента взаимодействовать с группой родственных по химической природе
субстратов. Такие ферменты действуют либо на определенную химическую группу,
либо на определенный тип химической связи. Липаза панкреатическая расщепляет
сложноэфирные связи между глицеролом и любыми жирнокислотными ацилами (1 и
3-положение) в разных пищевых жирах. Протеазы гидролизуют пептидные связи в
различных белках. Алкогольдегидрогеназа окисляет дегидрированием различные
алифатические спирты (этанол, метанол и др.)
9/Ж.В.
10.
СтереоспецифичностьНаивысшая степень абсолютной субстратной специфичности – это
стереоспецифичность.
Фермент катализирует превращение только одного из стереоизомеров
данного вещества, например:
• D или L- энантиомеры: ферменты метаболизма углеводов специфичны к
D- cахарам, а ферменты обмена аминокислот - к L- аминокислотам
• Цис- или транс- π- диастереомеры: фермент β-окисления ВЖК еноилКоА-гидратаза специфичен только к транс-конфигурации π – связи
еноил-КоА (ненасыщенного ацила)
• - или β- аномеры: амилаза специфична только к -1,4- гликозидным
связям, гидролизуя амилозу, линейные участки амилопектина и
гликогена, но не действуя на β-1,4- гликозидные связи в молекулах
целлюлозы.
10/Ж.В.
11.
СтереоспецифичностьH
COOH
С
С
HOOC
H
фумарат
H
H
С
С
HOOC
Н2О
фумараза
H
COOH
СН
СН
HOOC
OH
малат
COOH
малеинат
Фумараза (фумаратгидратаза), работающая в ЦТК, катализирует
реакцию только с транс-изомером бутен-2-диовой кислоты фумаровой, но не взаимодействует с её цис-изомером –
малеиновой кислотой.
11/Ж.В.
12.
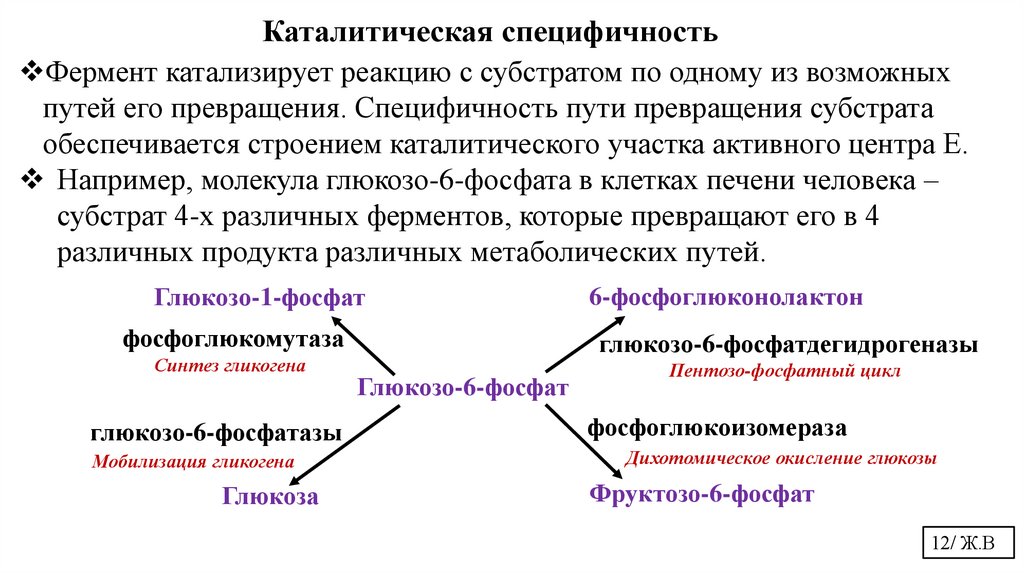
Каталитическая специфичностьФермент катализирует реакцию с субстратом по одному из возможных
путей его превращения. Специфичность пути превращения субстрата
обеспечивается строением каталитического участка активного центра Е.
Например, молекула глюкозо-6-фосфата в клетках печени человека –
субстрат 4-х различных ферментов, которые превращают его в 4
различных продукта различных метаболических путей.
Глюкозо-1-фосфат
фосфоглюкомутаза
Синтез гликогена
глюкозо-6-фосфатазы
Мобилизация гликогена
Глюкоза
6-фосфоглюконолактон
глюкозо-6-фосфатдегидрогеназы
Глюкозо-6-фосфат
Пентозо-фосфатный цикл
фосфоглюкоизомераза
Дихотомическое окисление глюкозы
Фруктозо-6-фосфат
12/ Ж.В
13.
ПРИЛОЖЕНИЕ 1.Классификация ферментов.
Все ферменты разделены на 7 классов в зависимости от типа
катализируемой реакции.
Каждый из классов имеет свой порядковый номер, строго закрепленный за ним.
Каждый класс состоит из подклассов и подподклассов.
Класс 1: Оксидоредуктазы.
• Катализируют окислительно-восстановительные реакции.
Например: дегидрогеназы, оксидазы, оксигеназы (гидроксилазы) и др.
Класс 2: Трансферазы.
• Катализируют реакции переноса различных групп от одного субстрата (донор) к
другому (акцептор).
Например: аминотрансферазы, гликозилтрансферазы, ацилтрансферазы и др.
Класс 3: Гидролазы.
• Катализируют реакции гидролиза (расщепления внутримолекулярных
ковалентных связей с присоединением молекулы воды по месту разрыва).
Например: эстеразы, гликозидазы, пептидазы, фосфатазы, амидазы и др.
13/ Ж.В.
14.
ПРИЛОЖЕНИЕ 1.Классификация ферментов.
Класс 4: Лиазы.
• Катализируют реакции негидролитического отщепления от субстратов различных
химических групп (-NH2, CO2, H2O, -SH и др.) или присоединения по двойной
связи молекулы воды, а также других метаболитов без участия энергии АТФ.
Например: декарбоксилазы, дегидратазы, аденилатциклаза и др.
Класс 5: Изомеразы.
• Катализируют реакции превращения субстрата в его изомер.
Например: рацемазы или эпимеразы, мутазы, цис-транс-Изомеразы др.
Класс 6: Лигазы (синтетазы).
• Катализируют реакции присоединения двух молекул друг к другу с образованием
ковалентной связи. При этом используется энергия АТФ (лигазы, или синтетазы)
или энергия других макроэргических соединений (синтазы).
• Например: пируваткарбоксилаза, тиокиназа, и др.
14 /Ж.В.
15.
ПРИЛОЖЕНИЕ 1.Классификация ферментов.
Класс 7: Транслоказы.
Этот класс ферментов сформировался из ранее принадлежащих другим классам
ферментов. В классификацию ферментов внесен в 2018 году.
• Катализируют перенос ионов или молекул через мембраны или их разделение в
мембранах. Содержит 6 подклассов и 4 подподкласса. ЭТО ИНТЕРЕСНО:
• Подклассы обозначают типы перемещаемых ионов или молекул:
7.1 содержит ферменты, катализирующие транслокацию hydron ( H+),
7.2 содержит вещества, катализирующие перемещение неорганических катионов и их хелатов,
7.3 содержит вещества, катализирующие перемещение неорганических анионов,
7.4 содержит вещества, катализирующие транслокацию аминокислот и пептидов,
7.5 содержит вещества, катализирующие транслокацию углеводов и их производных
7.6 содержит вещества, катализирующие транслокацию других соединений.
• ПОДподклассы относятся к реакции, которая послужила движущей силой для перемещения,
там, где они имеют отношение:
Транслокации EC 7.x.1, связанные с реакциями оксидоредуктазы
Транслокации EC 7.x.2, связанные с гидролизом нуклеозидтрифосфата
Транслокации EC 7.x.3, связанные с гидролизом дифосфата
Транслокации EC 7.x.4, связанные с реакцией декарбоксилирования
15/ Ж.В.
16.
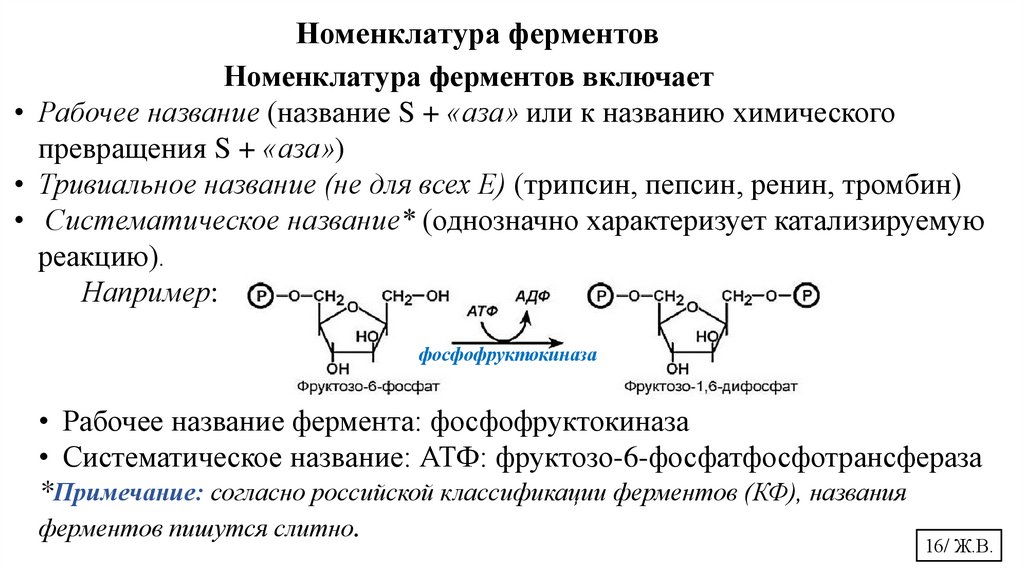
Номенклатура ферментовНоменклатура ферментов включает
• Рабочее название (название S + «аза» или к названию химического
превращения S + «аза»)
• Тривиальное название (не для всех Е) (трипсин, пепсин, ренин, тромбин)
• Систематическое название* (однозначно характеризует катализируемую
реакцию).
Например:
фосфофруктокиназа
• Рабочее название фермента: фосфофруктокиназа
• Систематическое название: АТФ: фруктозо-6-фосфатфосфотрансфераза
*Примечание: согласно российской классификации ферментов (КФ), названия
ферментов пишутся слитно.
16/ Ж.В.
17.
ШИФР ФЕРМЕНТАКаждый фермент имеет кодовое четырехзначное цифровое
обозначение (шифр фермента). Например, 1.1.1.38.
• Первая цифра обозначает класс фермента (тип реакции)
• Вторая цифра – подкласс (уточняет преобразуемую группировку)
• Третья –подподкласс (уточняет дополнительных участников реакции,
например, донора или акцептора)
• Четвертая –порядковый номер фермента в данной подгруппе
Например: рабочее название: малатдегидрогеназа; систематическое
название: L- малат: NAD-оксидоредуктаза; кодовый шифр 1.1.1.38.
Шифр означает:
• фермент относится к первому классу оксидоредуктаз (1.)
• окисляемая группа – гидроксильная группировка (1.)
• дополнительный участник реакции: акцептор электронов NAD+ (1.)
• порядковый номер фермента в этой подгруппе – 38.
17/ Ж.В.
18.
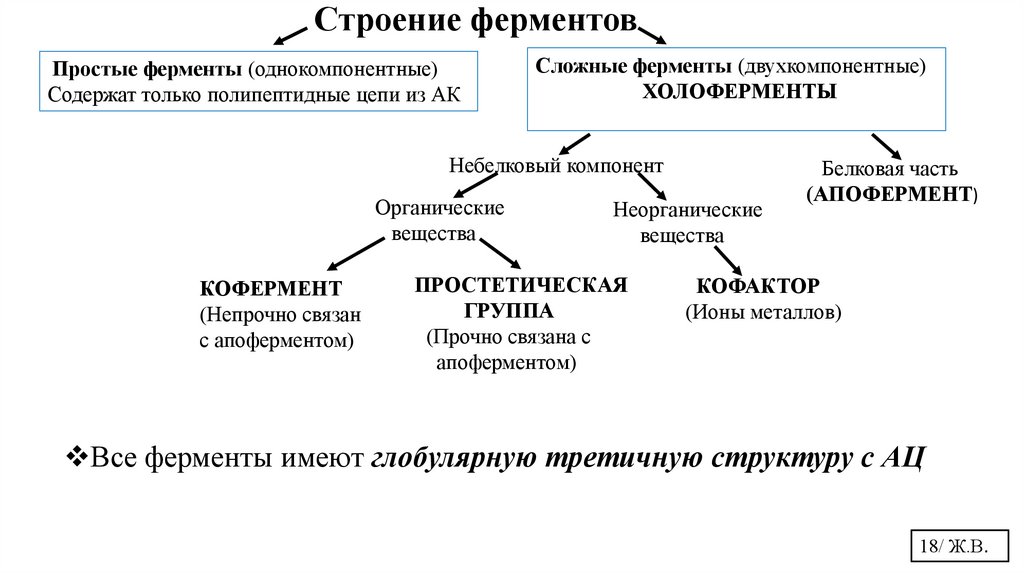
Строение ферментовПростые ферменты (однокомпонентные)
Содержат только полипептидные цепи из АК
Сложные ферменты (двухкомпонентные)
ХОЛОФЕРМЕНТЫ
Небелковый компонент
Органические
вещества
КОФЕРМЕНТ
(Непрочно связан
с апоферментом)
Неорганические
вещества
ПРОСТЕТИЧЕСКАЯ
ГРУППА
(Прочно связана с
апоферментом)
Белковая часть
(АПОФЕРМЕНТ)
КОФАКТОР
(Ионы металлов)
Все ферменты имеют глобулярную третичную структуру с АЦ
18/ Ж.В.
19.
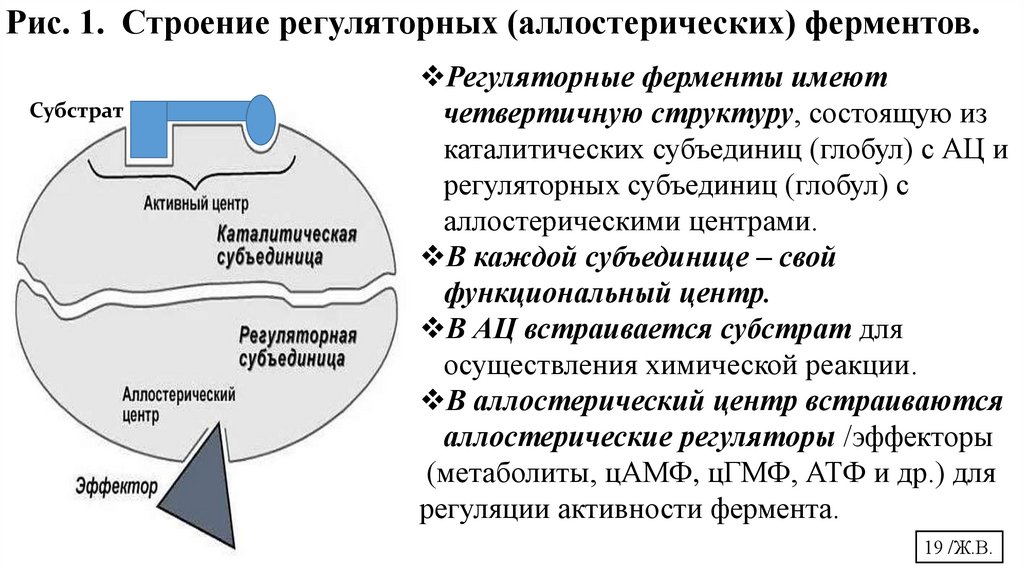
Рис. 1. Строение регуляторных (аллостерических) ферментов.Субстрат
Регуляторные ферменты имеют
четвертичную структуру, состоящую из
каталитических субъединиц (глобул) с АЦ и
регуляторных субъединиц (глобул) с
аллостерическими центрами.
В каждой субъединице – свой
функциональный центр.
В АЦ встраивается субстрат для
осуществления химической реакции.
В аллостерический центр встраиваются
аллостерические регуляторы /эффекторы
(метаболиты, цАМФ, цГМФ, АТФ и др.) для
регуляции активности фермента.
19 /Ж.В.
20.
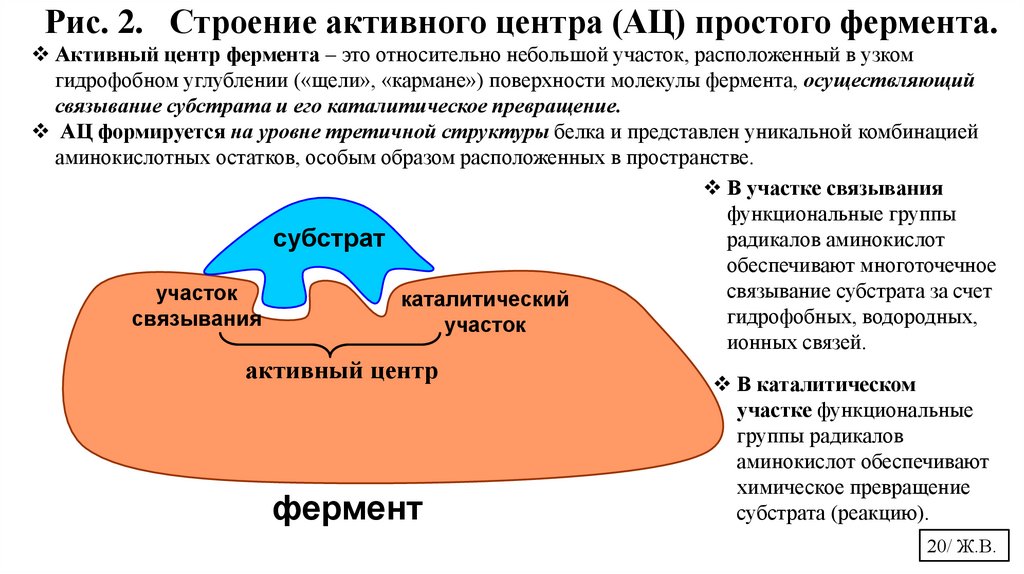
Рис. 2. Строение активного центра (АЦ) простого фермента.Активный центр фермента – это относительно небольшой участок, расположенный в узком
гидрофобном углублении («щели», «кармане») поверхности молекулы фермента, осуществляющий
связывание субстрата и его каталитическое превращение.
АЦ формируется на уровне третичной структуры белка и представлен уникальной комбинацией
аминокислотных остатков, особым образом расположенных в пространстве.
В участке связывания
функциональные группы
радикалов аминокислот
субстрат
обеспечивают многоточечное
связывание субстрата за счет
участок
каталитический
гидрофобных, водородных,
связывания
участок
ионных связей.
активный центр
фермент
В каталитическом
участке функциональные
группы радикалов
аминокислот обеспечивают
химическое превращение
субстрата (реакцию).
20/ Ж.В.
21.
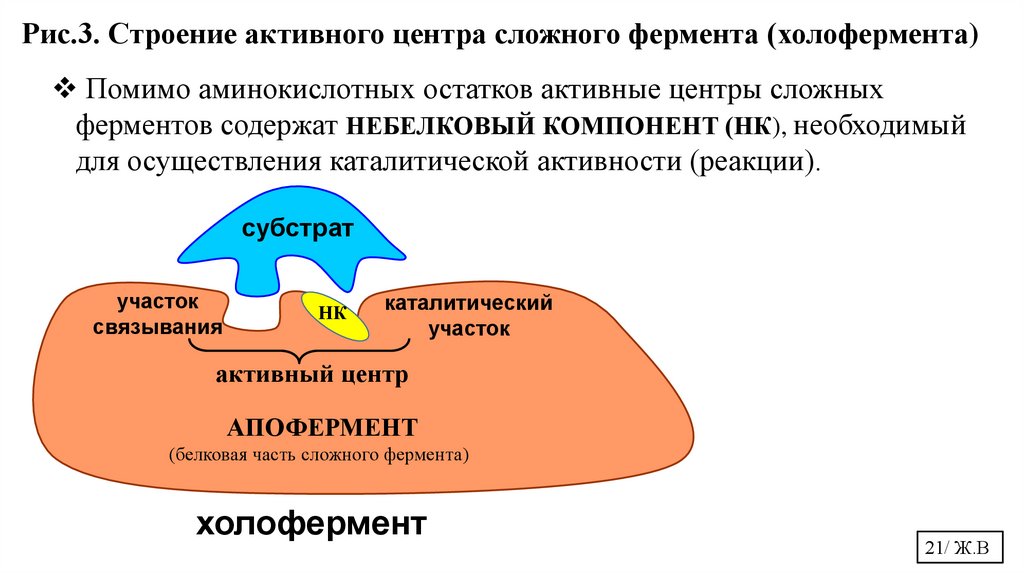
Рис.3. Строение активного центра сложного фермента (холофермента)Помимо аминокислотных остатков активные центры сложных
ферментов содержат НЕБЕЛКОВЫЙ КОМПОНЕНТ (НК), необходимый
для осуществления каталитической активности (реакции).
субстрат
участок
связывания
НК
каталитический
участок
активный центр
АПОФЕРМЕНТ
(белковая часть сложного фермента)
холофермент
21/ Ж.В
22.
Небелковые компоненты сложного ферментаКОФЕРМЕНТ (КоЕ) - небелковый компонент сложного фермента, представленный органическим
соединением, который нековалентно связан с апоферментом в АЦ, поэтому может легко от него
диссоциировать. Часто является производным витаминов
• Например: НАД+ и НАДФ+ (вит. В3); НS- КоА (вит. В5), Н4-фолат (вит. В9)
ПРОСТЕТИЧЕСКАЯ ГРУППА - небелковый компонент сложного фермента, представленный
органическим соединением, который прочно связан (часто ковалентно) с апоферментом в АЦ. Часто
является производным витаминов
• Например : ФАД (вит. В2), гем, биотин (Вит. Н), амид липоевой кислоты и др.
КОФАКТОР – небелковый компонент сложного фермента, представленный неорганическим
веществом, например, ионами металлов: Fe 2+, Mn 2+ , Zn2+, Mg 2+ ,Cu +2 и др. Кофакторы
ковалентно связаны с апоферментом. Более 25% всех ферментов для проявления каталитической
активности нуждаются в ионах металлов.
• Например: Fe 2+ в цитохромоксидазе и каталазе; Mn 2+ в алкогольдегидрогеназе; Zn 2+ в
карбоксипептидазе А.
Ферменты могут содержать в АЦ как кофермент /простетическую группу, так
и ионы металлов.
• Например: для алкогольдегидрогеназы и изоцитратдегидрогеназы необходимы коферменты НАД+ и
кофакторы - ионы металлов.
22 /Ж.В.
23.
Роль небелковых компонентов сложных ферментовРоль кофакторов в ферментативном катализе
• Способствуют стабилизации молекул субстрата, активного центра,
третичной и четвертичной структур фермента
• Участвуют в электрофильном катализе, в окислительновосстановительных реакциях, в регуляции активности ферментов.
Роль коферментов / простетических групп в ферментативном
катализе
• Выступают дополнительными субстратами в реакции
• Могут быть донорами или акцепторами электронов, химических групп
(метильной, аминогруппы)
• Могут быть переносчиками восстановительных эквивалентов в
окислительно-восстановительных реакциях.
23 /Ж.В.
24.
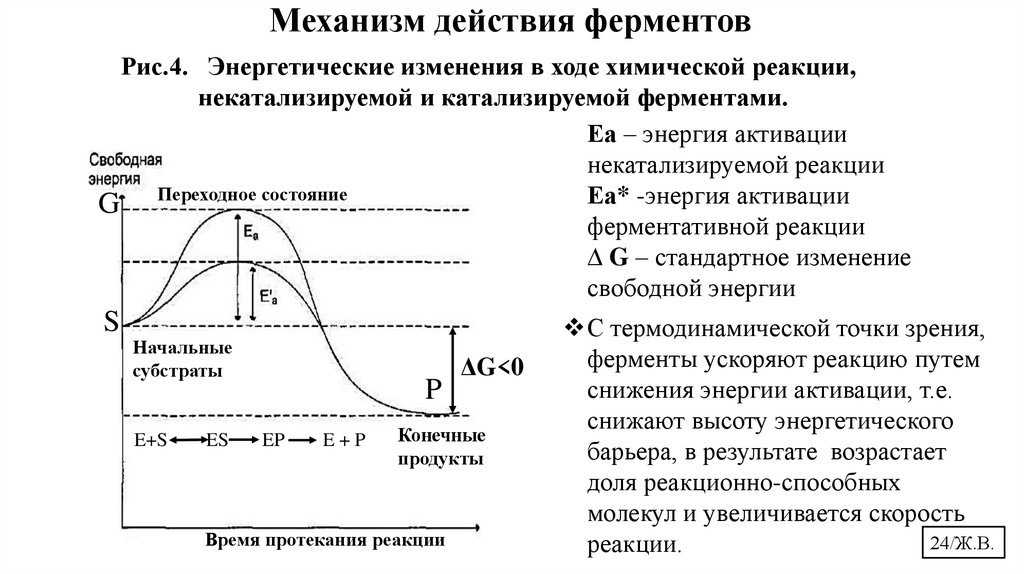
Механизм действия ферментовРис.4. Энергетические изменения в ходе химической реакции,
некатализируемой и катализируемой ферментами.
Еа – энергия активации
некатализируемой реакции
Еа* -энергия активации
G Переходное состояние
ферментативной реакции
∆ G – стандартное изменение
свободной энергии
S
Начальные
субстраты
E+S
ES
P
EP
E+P
ΔG<0
Конечные
продукты
Время протекания реакции
С термодинамической точки зрения,
ферменты ускоряют реакцию путем
снижения энергии активации, т.е.
снижают высоту энергетического
барьера, в результате возрастает
доля реакционно-способных
молекул и увеличивается скорость
24/Ж.В.
реакции.
25.
Энергия активации – это дополнительное количество кинетическойэнергии, которое необходимо дать молекулам для преодоления
энергетического барьера (или для достижения переходного состояния), т.е.
–это та энергия, которая необходима для перевода всех молекул моля
вещества в активированное состояние при данной температуре.
Переходное состояние обозначает максимальную способность молекул к
химическим превращениям. Чем большая часть молекул в 1 моле
вещества находится в переходном состоянии, тем выше скорость реакции.
Время существования ЕS совпадает с временем продолжительности
переходного состояния. Образование ES комплекса – это способ
уменьшить Еа и увеличить скорость реакций в условиях живого
организма, когда нельзя повышать T более 37*
Длительность (III) этапа перехода ЕS в ЕР зависит от Еа реакции, поэтому
эта стадия является лимитирующей. Здесь происходит превращение S в P.
Изменения энергетики на I, II, IV этапах – незначительны.
25/ Ж.В.
26.
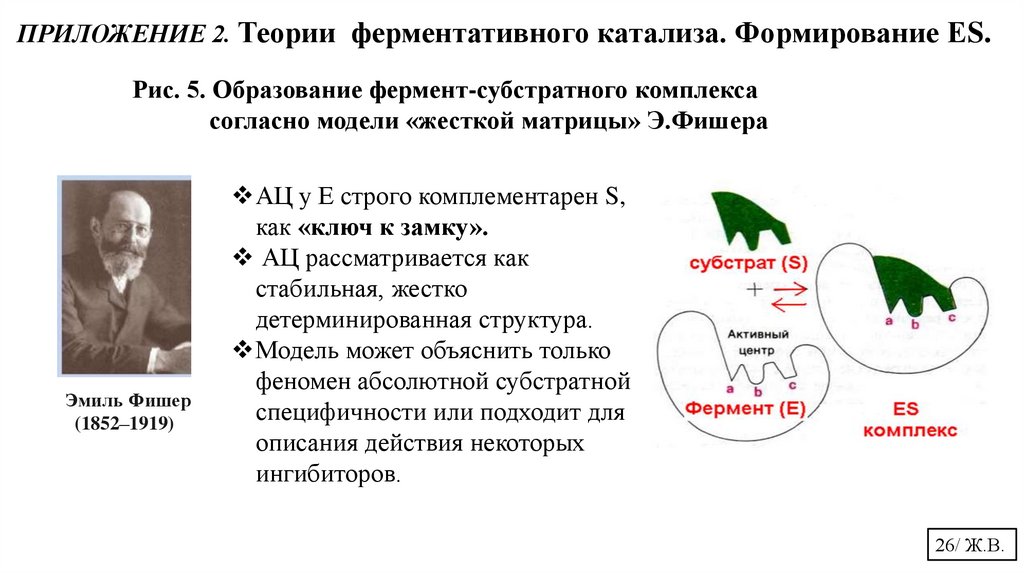
ПРИЛОЖЕНИЕ 2. Теории ферментативного катализа. Формирование ЕS.Рис. 5. Образование фермент-субстратного комплекса
согласно модели «жесткой матрицы» Э.Фишера
Эмиль Фишер
(1852–1919)
АЦ у Е строго комплементарен S,
как «ключ к замку».
АЦ рассматривается как
стабильная, жестко
детерминированная структура.
Модель может объяснить только
феномен абсолютной субстратной
специфичности или подходит для
описания действия некоторых
ингибиторов.
26/ Ж.В.
27.
ПРИЛОЖЕНИЕ 2. Теории ферментативного катализа. Формирование ЕS.Рис.6 Конформационные изменения в активном центре фермента при связывании
субстрата согласно модели «индуцированного соответствия» Д. Кошланда
АЦ является гибкой структурой по отношению к S, а
субстрат является жесткой молекулой. При
вхождении субстрата в активный центр, фермент
изменяет свою конформацию, т.е. подстраивается под
субстрат.(«рука и перчатка»). Такое взаимодействие
приводит к образованию ЕS, благоприятного для
химических модификаций S.
Для правильного ориентирования и связывания
Дэниел Кошланд субстрата в АЦ, необходимо как минимум
три точки (а,в,с; рис.6)
1920-2007
Модель объясняет не только групповую
специфичность, но и стабилизацию переходного
состояния. Подтверждено экспериментально
методами рентгеноструктурного анализа
Активный
центр
27/ Ж.В.
28.
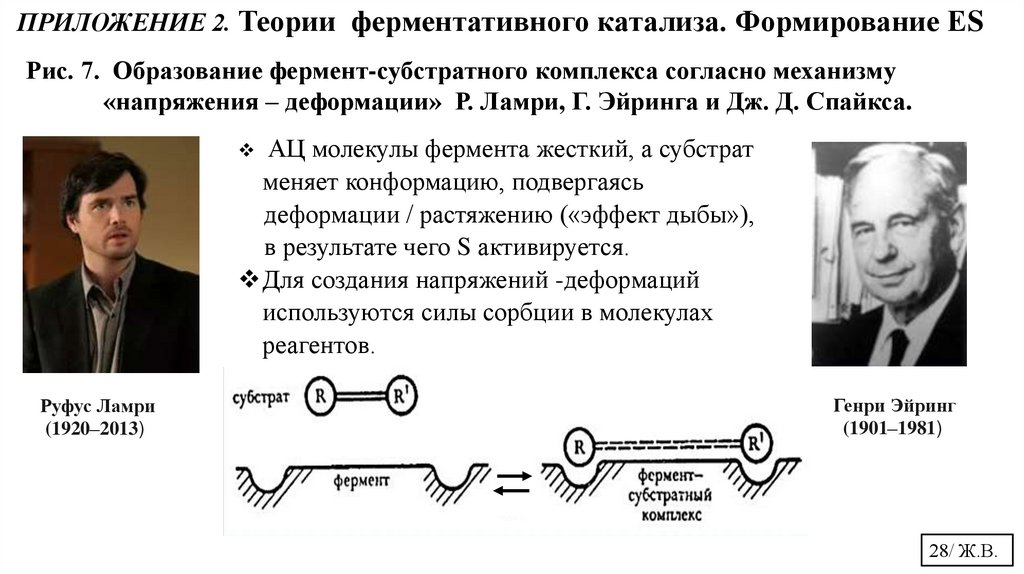
ПРИЛОЖЕНИЕ 2. Теории ферментативного катализа. Формирование ЕSРис. 7. Образование фермент-субстратного комплекса согласно механизму
«напряжения – деформации» Р. Ламри, Г. Эйринга и Дж. Д. Спайкса.
АЦ молекулы фермента жесткий, а субстрат
меняет конформацию, подвергаясь
деформации / растяжению («эффект дыбы»),
в результате чего S активируется.
Для создания напряжений -деформаций
используются силы сорбции в молекулах
реагентов.
Руфус Ламри
(1920–2013)
Генри Эйринг
(1901–1981)
28/ Ж.В.
29.
ПРИЛОЖЕНИЕ 2. Теории ферментативного катализа. Формирование ЕSМеханизм «напряжения-деформации» встречается в работе ряда
ферментов, например, в лизоциме. Остаток N-ацетилмурамовой кислоты
в позиции D, содержащий гидролизуемую связь, переходит при
связывании ферментом из конформации «кресло» в «полукресло», что
облегает катализ.
Механизм «индуцированного соответствия» преобладает, например, в
дегидрогеназе, где целые петли полипептидной цепи фермента движутся
при связывании субстрата.
По механизму «индуцированного соответствия» взаимодействует глюкоза
с гексокиназой. Малая субъединица гексокиназы при связывании глюкозы
поворачивается и приближается на 12 Å к большой субъединице. Глюкоза
оказывается «зажатой» между двумя субъединицами, а АК-остатки двух
субъединиц сближаются и ориентируются для катализа.
29/ Ж.В.
30.
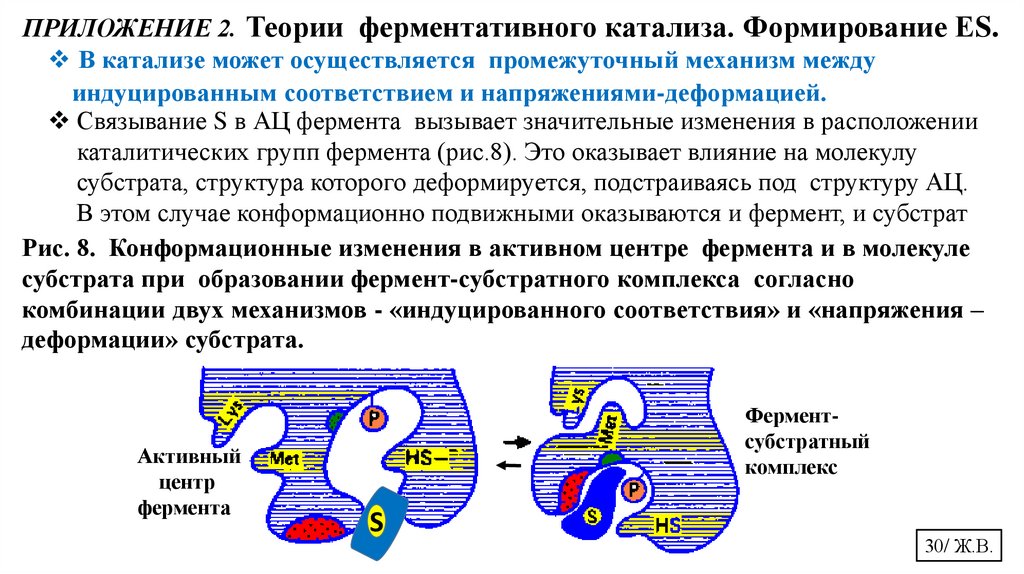
ПРИЛОЖЕНИЕ 2. Теории ферментативного катализа. Формирование ЕS.В катализе может осуществляется промежуточный механизм между
индуцированным соответствием и напряжениями-деформацией.
Связывание S в АЦ фермента вызывает значительные изменения в расположении
каталитических групп фермента (рис.8). Это оказывает влияние на молекулу
субстрата, структура которого деформируется, подстраиваясь под структуру АЦ.
В этом случае конформационно подвижными оказываются и фермент, и субстрат
Рис. 8. Конформационные изменения в активном центре фермента и в молекуле
субстрата при образовании фермент-субстратного комплекса согласно
комбинации двух механизмов - «индуцированного соответствия» и «напряжения –
деформации» субстрата.
Активный
центр
фермента
Ферментсубстратный
комплекс
S
30/ Ж.В.
31.
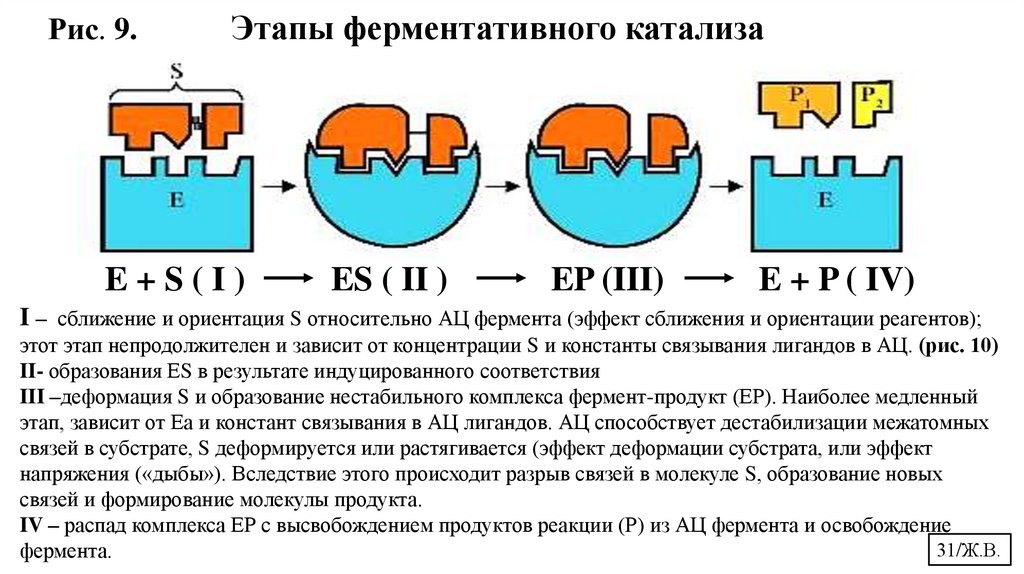
Рис. 9.Этапы ферментативного катализа
E+S(I)
ES ( II )
EP (III)
E + P ( IV)
I – сближение и ориентация S относительно АЦ фермента (эффект сближения и ориентации реагентов);
этот этап непродолжителен и зависит от концентрации S и константы связывания лигандов в АЦ. (рис. 10)
II- образования ЕS в результате индуцированного соответствия
III –деформация S и образование нестабильного комплекса фермент-продукт (ЕР). Наиболее медленный
этап, зависит от Еа и констант связывания в АЦ лигандов. АЦ способствует дестабилизации межатомных
связей в субстрате, S деформируется или растягивается (эффект деформации субстрата, или эффект
напряжения («дыбы»). Вследствие этого происходит разрыв связей в молекуле S, образование новых
связей и формирование молекулы продукта.
IV – распад комплекса ЕР с высвобождением продуктов реакции (Р) из АЦ фермента и освобождение
31/Ж.В.
фермента.
32.
Рис.10.Эффект сближения и ориентации реагентов
АЦ фермента может связывать молекулы реагирующих субстратов таким образом, что их
реакционноспособные группы будут располагаться поблизости друг от друга и от каталитических групп
фермента («эффект сближения»).
При образовании ЕS комплекса достигаются многоточечная фиксация субстрата и его оптимальная для
разрыва и образования химических связей ориентация («эффект ориентации реагентов»). Такое
упорядоченное расположение субстратов вызывает уменьшение энтропии и, как следствие,
снижение Еа. При связывании субстрата из активного центра Е вытесняется вода, что
сопровождается тоже выделением энергии.
Неправильное сближение,
неправильная ориентация
Правильное сближение,
неправильная ориентация
Правильное сближение,
правильная ориентация
32/Ж.В.
33.
Молекулярные механизмы ферментативного катализаОпределяются ролью функциональных групп АЦ фермента в реакции
превращения S в Р. Выделяют два основных механизма ферментативного
катализа
• Кислотно-основный катализ. Функциональные группы АК, входящих в состав АЦ,
проявляют свойства как кислот, так и оснований. Радикалы Цис, Тир, Сер, Лиз, Глу,
Асп, Гис в протонированной форме –кислоты (доноры протонов), в
депротонированной – основания (акцепторы протонов). Осуществляя перенос
протонов, эти группы способствуют многократному увеличению скорости реакции.
• Ковалентный катализ. При связывании S в АЦ его атакуют электрофильные (т.е.
принимающие электроны, положительно заряженные) или нуклеофильные (т.е.
отдающие электроны, отрицательно заряженные) группы каталитических
аминокислотных остатков. Это вызывает перераспределение электронной плотности и
разрыв связей в субстрате. Для такого катализа характерно образование ковалентных
связей между S и коферментом или функциональной группой аминокислотного
остатка АЦ и S.
• Сочетание этих двух механизмов. Характерно для многих ферментов
33/ Ж.В.
34.
Каталитическая эффективность действия ферментов.Высокая каталитическая эффективность ферментов определяется
снижением энергии активации (Еа) в процессе образования ферментсубстратного комплекса (ЕS), что достигается в результате
• Многоточечного сорбционного связывания субстрата
• Эффектов сближения и ориентации
• Различных механизмов работы (индуцированного соответствия, напряжения
/деформации, а также их сочетания)
• Ковалентного и/или кислотно-основного катализа.
К наиболее «быстрым» ферментам относятся каталазы, карбоангидразы,
декарбоксилазы (лиазы).
• Например: фермент оротидин-5’-фосфатдекарбоксилаза увеличивает
скорость декарбоксилирования специфического субстрата в 10 18 раз.
34 /Ж.В.
35.
Кинетика ферментативных реакцийКинетика ферментативных реакций – это раздел энзимологии,
изучающий зависимость скорости ферментативных реакций от
химической природы реагирующих веществ, а также факторов
окружающей среды.
Скорость ферментативной реакции зависит от
• концентрации и активности ферментов (рис. 11)
• концентрации субстрата (рис.12, 15)
• температуры среды и рН раствора (неспецифичекие факторы; рис.17,18)
• присутствия активаторов и ингибиторов (специфические факторы).
35/ Ж.В.
36.
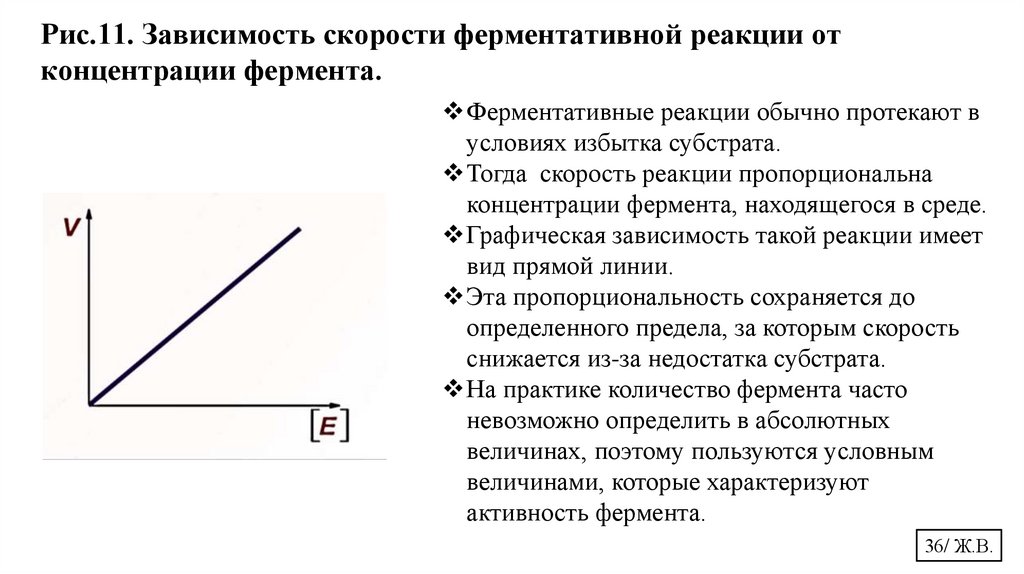
Рис.11. Зависимость скорости ферментативной реакции отконцентрации фермента.
Ферментативные реакции обычно протекают в
условиях избытка субстрата.
Тогда скорость реакции пропорциональна
концентрации фермента, находящегося в среде.
Графическая зависимость такой реакции имеет
вид прямой линии.
Эта пропорциональность сохраняется до
определенного предела, за которым скорость
снижается из-за недостатка субстрата.
На практике количество фермента часто
невозможно определить в абсолютных
величинах, поэтому пользуются условным
величинами, которые характеризуют
активность фермента.
36/ Ж.В.
37.
ПРИЛОЖЕНИЕ 3.Единицы активности ферментов.
Одна международная единица активности (МЕ, Е, U) - это то
количество любого фермента, которое катализирует превращение 1
микромоля субстрата (или образование 1 микромоля продукта) в минуту
(мкмоль/мин) при оптимальных условиях.
1МЕ = мкмоль/ мин; 1МЕ=16,67 нкат
Единица активности ферментов 1 катал (кат) - это такое количество
фермента, который превращает 1 моль субтрата (или образует 1 моль
продукта) в секунду. 1 кат = 1 моль /сек; 1 кат = 6 х 107 МЕ
Удельная активность фермента (уд. ак.) численно равна количеству
единиц активности фермента (nМЕ) в образце ткани, деленному на
массу (мг) белка в этой ткани.
37/Ж.В.
38.
Зависимость скорости ферментативной реакции отконцентрации субстрата.
Если концентрацию фермента оставить постоянной, изменяя только
количество субстрата, то график скорости ферментативной реакции
описывают гиперболой (Рис. 12).
При увеличении количества субстрата начальная скорость возрастает.
Когда фермент полностью насыщен субстратом (максимально
возможное формирование ЕS комплексов), наблюдается наибольшая
скорость образования продукта. Дальнейшее повышение концентрации
S не приводит к увеличению образования продукта, а скорость реакции –
не возрастает, данное состояние соответствует Vmax.
Т. образом, концентрация фермента – лимитирующий фактор в
образовании продукта. Это наблюдение легло в основу ферментативной
кинетики, разработанной Л. Михаэлисом и М. Ментен в 1913г.
Ферментативный процесс выражается уравнением (рис.13)
38/ Ж.В.
39.
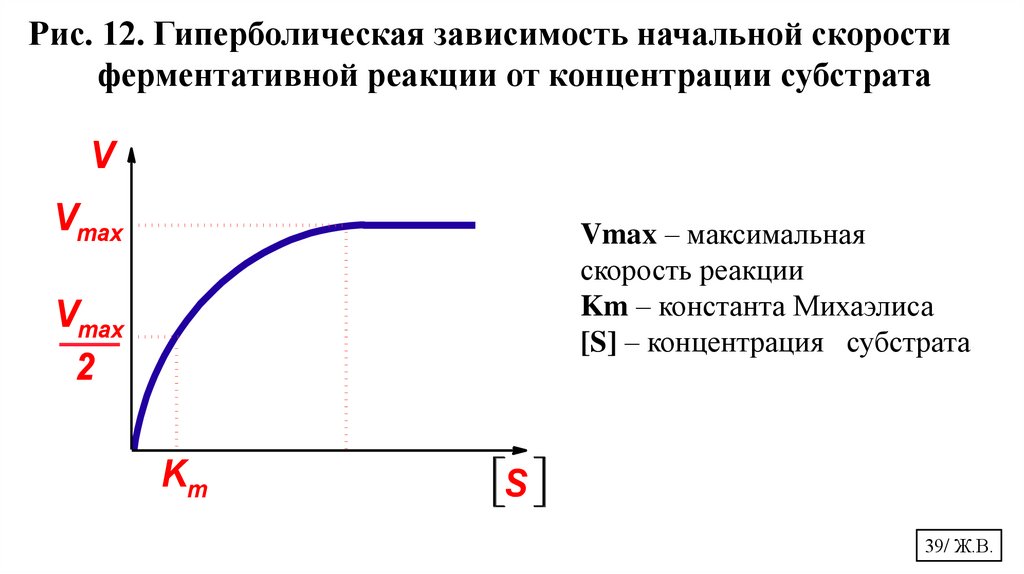
Рис. 12. Гиперболическая зависимость начальной скоростиферментативной реакции от концентрации субстрата
V
Vmax
Vmax – максимальная
скорость реакции
Km – константа Михаэлиса
[S] – концентрация субстрата
Vmax
2
Km
S
39/ Ж.В.
40.
Рис.13 Общее уравнение ферментативной реакцииE+S
k1
ES
k2
EP
E+P
k-1
ES – фермент-субстратный комплекс
EP – нестабильный комплекс фермент-продукт
k1 - константа скорости прямой реакции, образования ES
k-1 -константа скорости обратной реакции, распада ES
k2 - константа скорости образования продукта реакции
40 / Ж.В.
41.
Зависимость скорости ферментативной реакции отконцентрации субстрата.
Следующее соотношение констант скоростей ( k-1 + k2 ) / k1
называют константой Михаэлиса и обозначают Кm.
Скорость реакции пропорциональна концентрации ЕS, а скорость
образования ЕS зависит от концентрации S и концентрации свободного
фермента.
На концентрацию ЕS влияет скорость формирования и распада ЕS.
Наибольшая скорость наблюдается в том случае, когда все молекулы
фермента находятся в комплексе с субстратом, т. е. в ЕS, т.е. [E] = [ES].
Зависимость скорости ферментативной реакции от [S] выражается
уравнением Михаэлиса-Ментен (основное уравнение ферментативной
кинетики, рис. 14).
41/ Ж.В.
42.
Рис. 14. Зависимость скорости ферментативной реакции отконцентрации субстрата – уравнение Михаэлиса-Ментен
42/ Ж.В.
43.
Константа МихаэлисаВ случае, когда скорость реакции равна половине максимальной,
Кm = [S], (рис.15). Таким образом:
Константа Михаэлиса*– численно равна концентрации субстрата
(моль/л), при которой скорость данной ферментативной реакции
составляет половину от максимальной.
Km – это мера сродства фермента к субстрату
Чем больше величина Кm, тем ниже сродство фермента к субстрату,
тем ниже начальная скорость реакции
Чем меньше величина Кm, тем выше сродство фермента к субстрату,
тем выше начальная скорость реакции.
*Примечание: Кm названа в честь Леонора Михаэлиса.
43 /Ж.В.
44.
Рис. 15. Зависимость скорости ферментативной реакции от концентрациисубстрата при постоянной концентрации фермента
[S] << Km; V = Vmax [S] /Km
V
• Здесь сумма (Кm +[S]) примерно равна Кm, т.е скорость
реакции прямо пропорциональна [S]
• а- Реакция первого порядка, т.е. скорость реакции
пропорциональна концентрации субстрата.
[S] = Km; V = ½ Vmax
• б – Реакция смешанного порядка.
[S] >> Km; V = Vmax
• Здесь увеличение концентрации субстрата на величину
Кm практически не влияет на сумму (Кm +[S]).
• в- Реакция нулевого порядка, т.е. скорость реакции не
зависит от концентрации субстрата.
Vmax и Km кинетические характеристики эффективности работы фермента
44/ Ж.В.
45.
Рис. 16. У какого фермента сродство к субстрату выше? Почему?45/ Ж.В.
46.
Рис. 17. Зависимость скорости ферментативной реакции оттемпературы
Скорость ферментативной
реакции имеет свой оптимум
температуры. Это тот диапазон
значений температуры, при котором
фермент проявляет максимальную
активность.
Превышение оптимальных
температур приводит к снижению
Денатурация
ферментативной активности из-за
фермента
термической денатурации белка
(Рис.17).
Для большинства ферментов
человека оптимальная
t = 37-38*.
46/ Ж.В.
47.
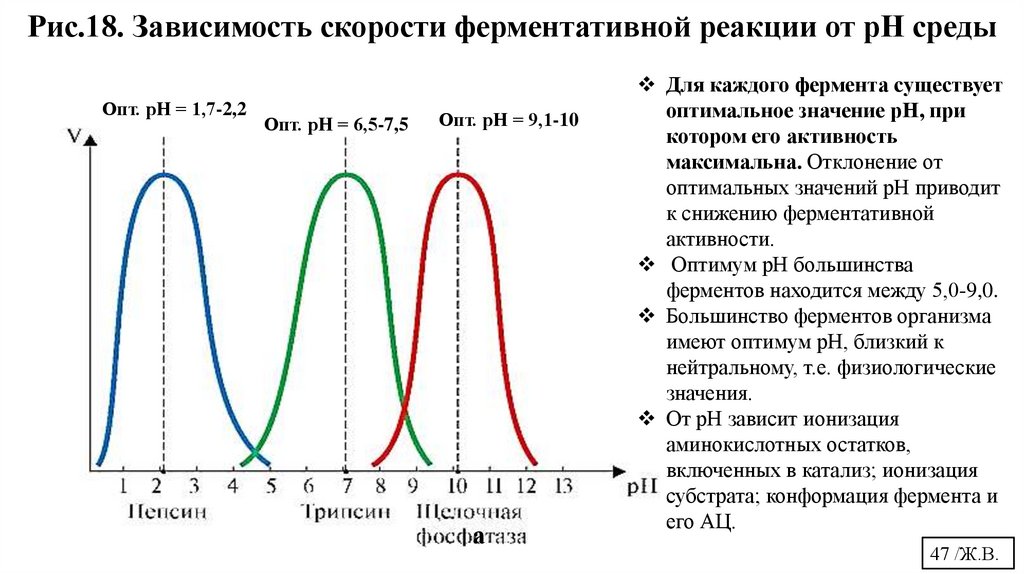
Рис.18. Зависимость скорости ферментативной реакции от рН средыОпт. рН = 1,7-2,2
Опт. рН = 6,5-7,5
Опт. рН = 9,1-10
а
Для каждого фермента существует
оптимальное значение рН, при
котором его активность
максимальна. Отклонение от
оптимальных значений рН приводит
к снижению ферментативной
активности.
Оптимум рН большинства
ферментов находится между 5,0-9,0.
Большинство ферментов организма
имеют оптимум рН, близкий к
нейтральному, т.е. физиологические
значения.
От рН зависит ионизация
аминокислотных остатков,
включенных в катализ; ионизация
субстрата; конформация фермента и
его АЦ.
47 /Ж.В.
48.
Список литературы1. Биохимия : учебник / под ред. Е.С. Северина. – М. : ГЭОТАР-Медиа, 2011. – С. 74–100.
2. Биохимия [Электронный ресурс] : учебник / под ред. Е. С. Северина. – 5-е изд., испр. и доп. –
М. : ГЭОТАР-Медиа, 2015. – http://www.studmedlib.ru / book / ISBN9785970433126.html (разд. 2, п. I–
V, VIII–IX).
3. Биологическая химия. Биохимия полости рта : учебник / Т.П. Вавилова, А.Е. Медведев. – М. :
ГЭОТАР-Медиа, 2014. – С. 115–137, 149–154.
4. Биологическая химия. Биохимия полости рта [Электронный ресурс]: учебник / Т.П. Вавилова,
А.Е. Медведев. – М. : ГЭОТАР-Медиа, 2014. – http://www.studmedlib.ru / book /
ISBN9785970430392.html (ч. II, гл. 5).
5. Белки. Ферменты. Витамины : учебно-методическое пособие к практическим и лабораторным
занятиям по биологической химии – биохимии полости рта для студентов стоматологического
факультета / под ред. Ж.В. Антоновой, Р.Н. Павловой, В.А. Дадали. – СПб. : Изд-во СЗГМУ им. И.И.
Мечникова, 2019. – С. 73–89.
6. Березов, Т.Т. Биологическая химия / Т.Т. Березов, Б.Ф. Коровкин. – М. : Медицина, 1998. – С.
114–144, 165–168.
48 /Ж.В.
49.
Благодарю за внимание!Пройдите тестирование.
49 / Ж.В.
































 biology
biology








