Similar presentations:
Аминокислоты, пептиды и белки. Образование пептидной связи
1. Лекция №2
2. Аминокислоты, пептиды и белки
3. Образование пептидной связи
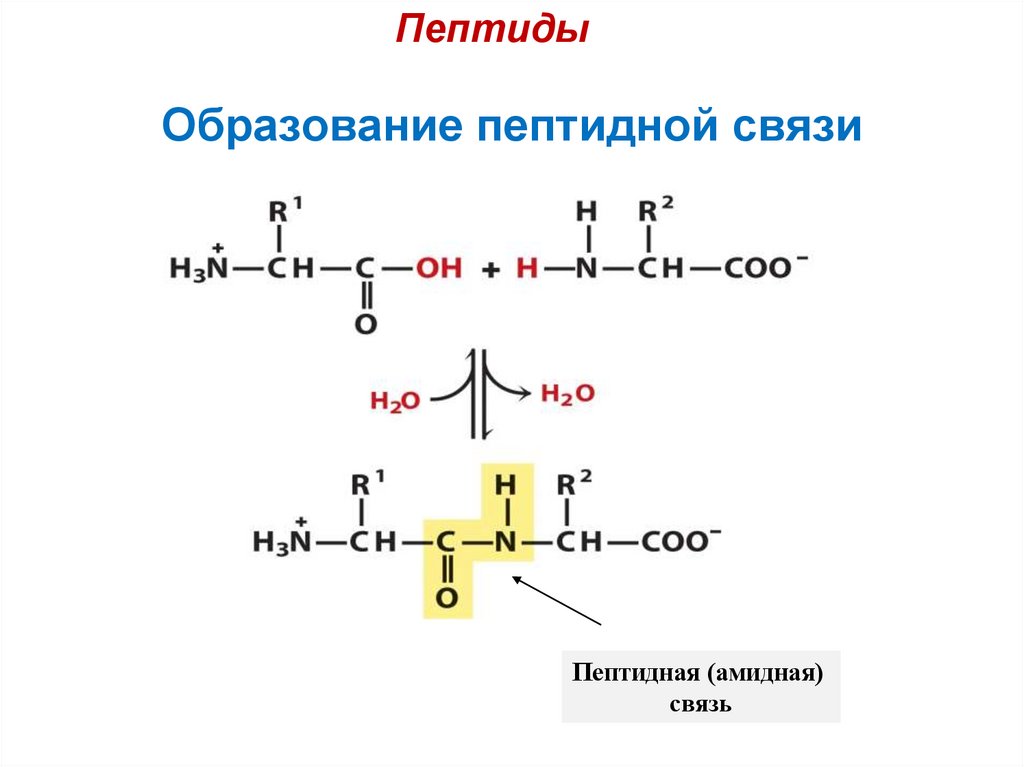
ПептидыОбразование пептидной связи
Пептидная (амидная)
связь
4.
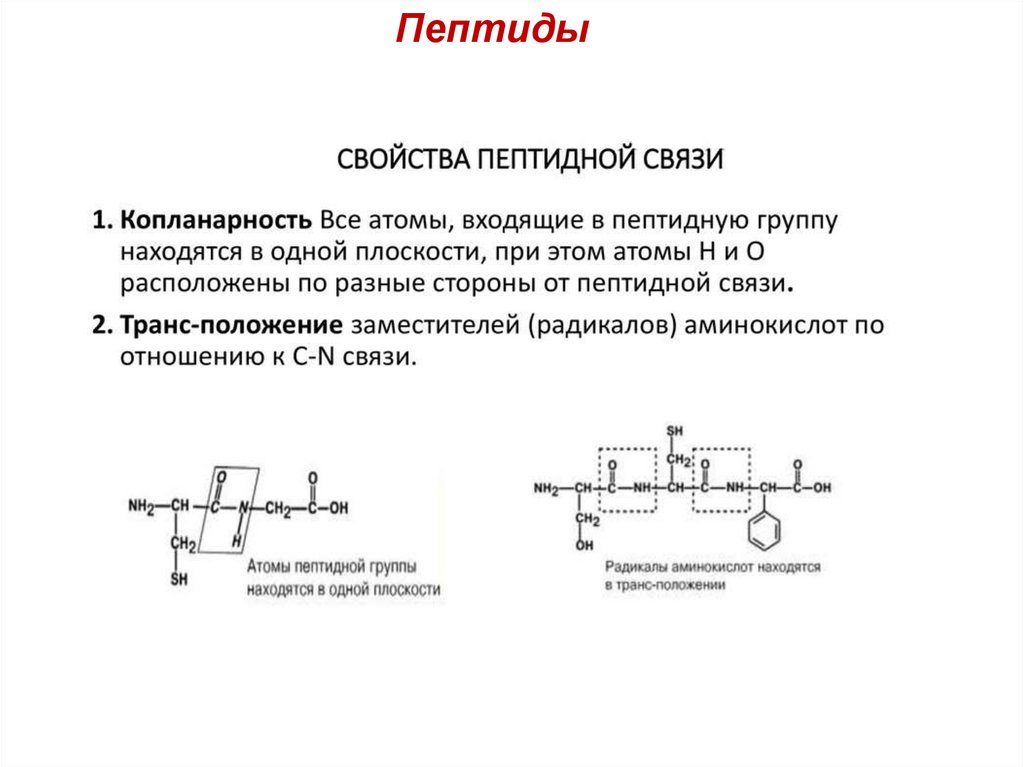
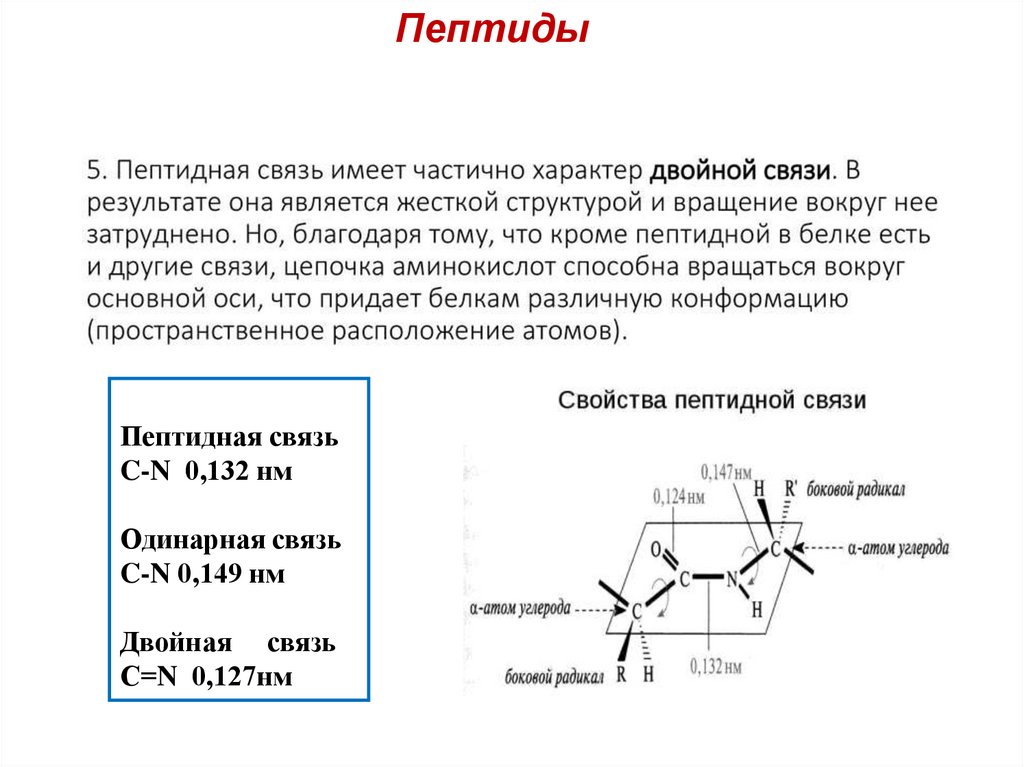
Пептиды5.
Пептиды6.
ПептидыПептидная связь
C-N 0,132 нм
Одинарная связь
C-N 0,149 нм
Двойная связь
С=N 0,127нм
7.
ПептидыБиологические функции
Пептиды являются полимерами
аминокислот. В полипептидах количество
аминокислотных остатков обычно не более
50 (М < 10 000). В отличие от белков,
пептиды имеют более разнородный
аминокислотный состав, в т. ч. могут
включать аминокислотные остатки D ряда. В
структурном отношении они также
разнообразны: содержат циклические
фрагменты, разветвленные цепи и т. д. Для
большинства пептидов свойственна высокая
активность.
8. Биологические функции
ПептидыБиологические функции
Пептидами являются многие важнейшие гормоны
человека
9. Биологические функции
ПептидыБиологические функции
Глутатион
10. Биологические функции
ПептидыБиологические функции
Пептиды, обладающие обезболивающим
действием
11.
ПептидыБиологические функции
Дипептид карнозин постоянно присутствует в
мышечных волокнах, стабилизируя уровень рН.
12.
ПептидыБиологические функции
К пептидам относятся некоторые токсичные вещества,
содержащиеся в микроорганизмах, растениях, животных.
13. Белки
- природные полимеры, состоящие из остатков αаминокислот, связанных пептидной связью.Характерны неразветвленные пептидные цепи,
высокая молекулярная масса (кол-во
аминокислотных остатков в белках 50 – 1000 ).
14. Физико-химические свойства
БелкиФизико-химические свойства
Индивидуальные белки различаются по физикохимическим свойствам: форме молекул,
молекулярной массе, суммарному заряду и т.д.
15. Физико-химические свойства
БелкиФизико-химические свойства
Индивидуальные белки различаются по физикохимическим свойствам: форме молекул,
молекулярной массе, суммарному заряду и т.д.
Факторы, влияющие на стабильность
растворов белков:
• Величина коллоидных частиц;
• Величина гидратной оболочки;
16. Физико-химические свойства
БелкиФизико-химические свойства
Индивидуальные белки различаются по физикохимическим свойствам: форме молекул,
молекулярной массе, суммарному заряду и т.д.
Факторы, влияющие на стабильность
растворов белков:
• Величина коллоидных частиц;
• Величина гидратной оболочки;
• Наличие заряда.
17. Физико-химические свойства
БелкиФизико-химические свойства
Суммарный заряд белков зависят от рН среды. В
ИЭТ суммарный заряд молекулы равен О. При
всех значениях рН выше ИЭТ суммарный заряд
молекулы отрицательный ; ниже ИЭТ –
положительный.
Значение ИЭТ белков может сильно
варьировать. Это связано с тем, какие АК входят
в состав белков. Если в состав белков входят
аминокислотные остатки с дополнительными СООН группами, то ИЭТ таких белков низкая.
Если в состав входит много аминокислот с
положительно заряженными радикалами, в этом
случае ИЭТ высока.
18.
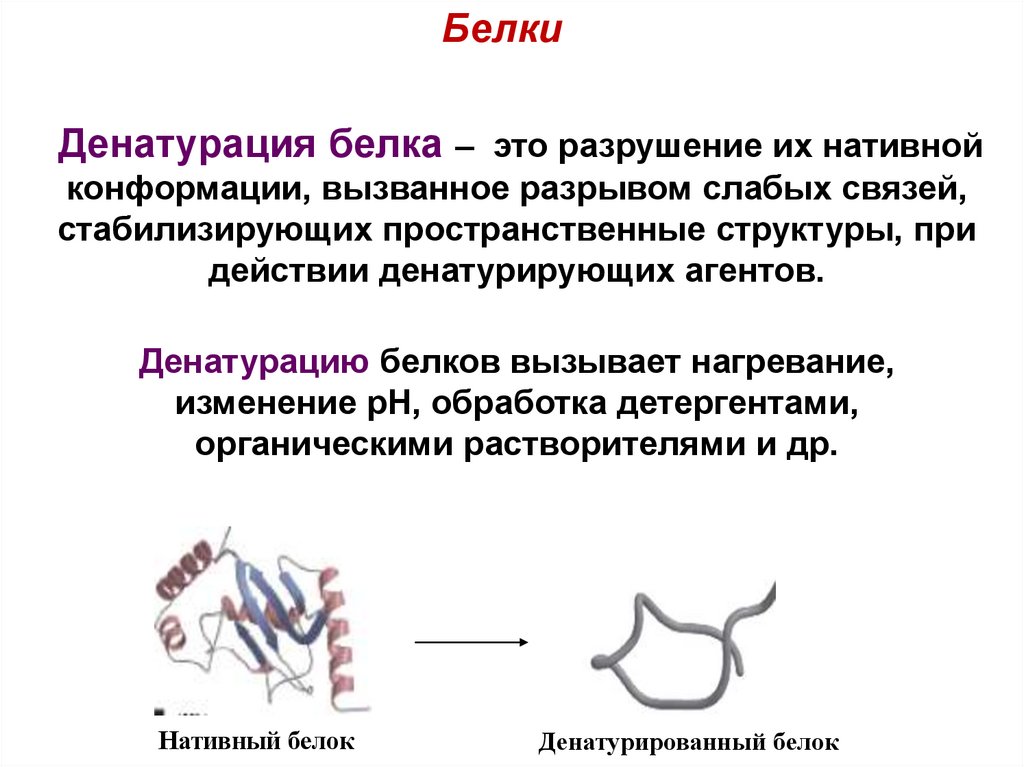
БелкиДенатурация белка – это разрушение их нативной
конформации, вызванное разрывом слабых связей,
стабилизирующих пространственные структуры, при
действии денатурирующих агентов.
Денатурацию белков вызывает нагревание,
изменение рН, обработка детергентами,
органическими растворителями и др.
Нативный белок
Денатурированный белок
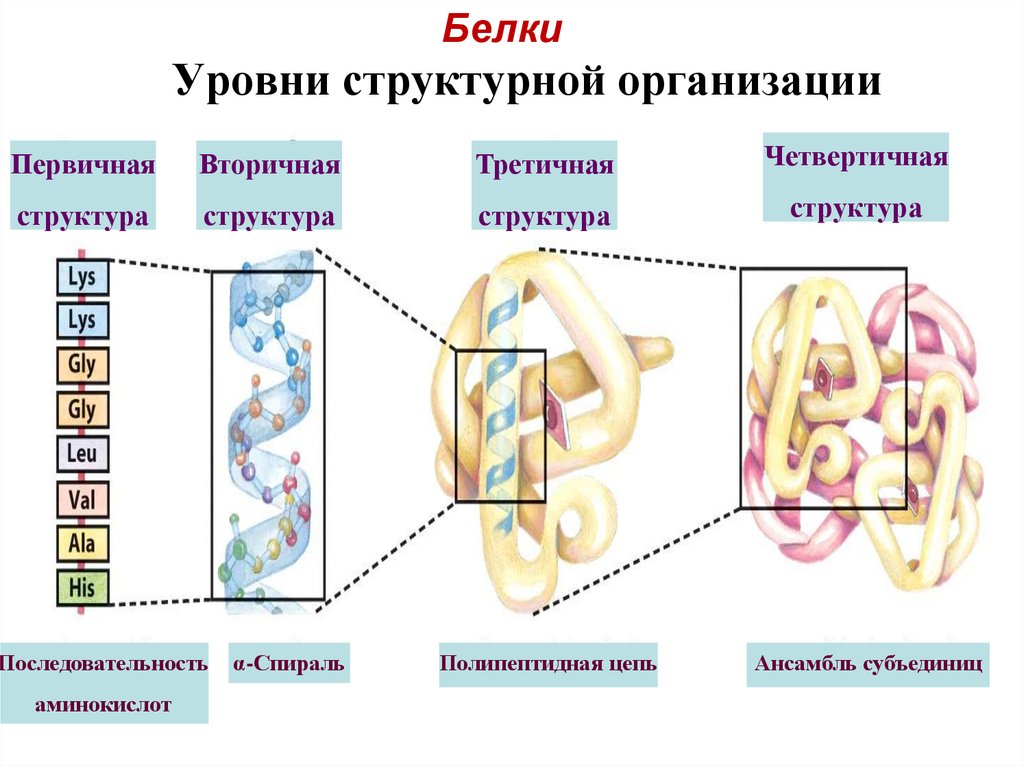
19. Уровни структурной организации
БелкиУровни структурной организации
Первичная
Вторичная
Третичная
Четвертичная
структура
структура
структура
структура
Полипептидная цепь
Ансамбль субъединиц
Последовательность
аминокислот
α-Спираль
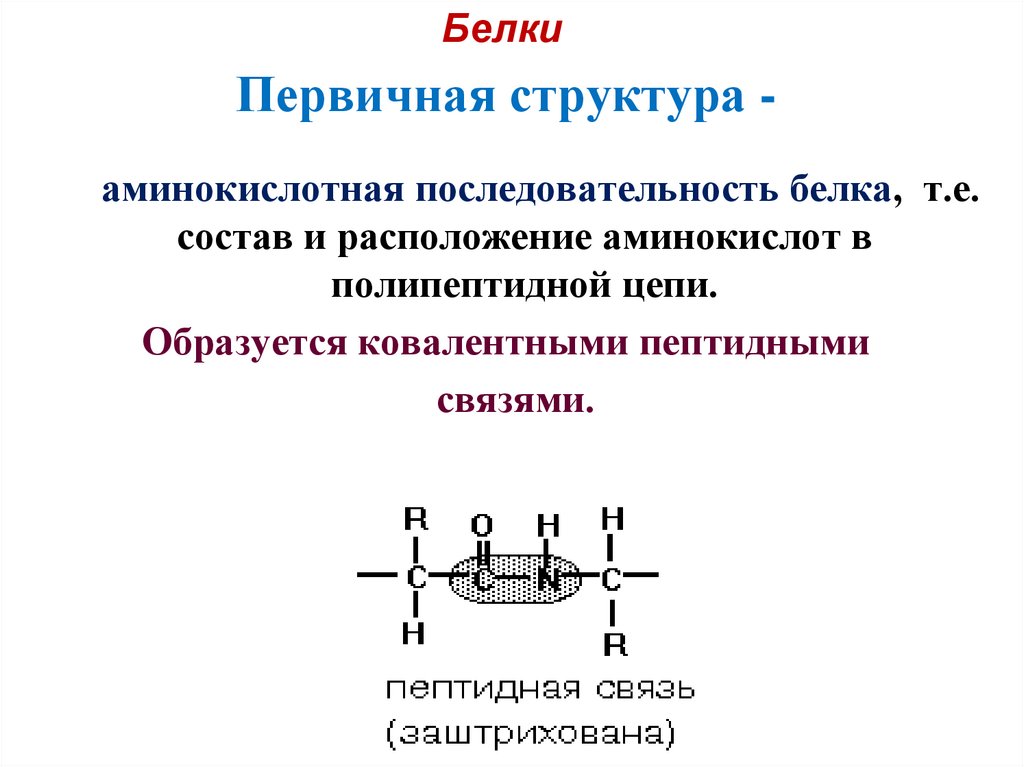
20. Первичная структура -
БелкиПервичная структура аминокислотная последовательность белка, т.е.
состав и расположение аминокислот в
полипептидной цепи.
Образуется ковалентными пептидными
связями.
21. Вторичная структура -
БелкиВторичная структура упорядоченные структуры полипептидных
цепей, стабилизированные водородными
связями между пептидными СО и NHгруппами: α-спираль, β-складчатая
структура; кроме того возникают
неупорядоченные структуры (random coil).
Первичная структура
Вторичная структура
22.
БелкиВодородная связь возникает между двумя
электроотрицательными атомами за счет атома водорода,
который соединен с одним из электроотрицательных атомов
ковалентно.
Водородные связи формируются между амнокислотными
остатками, имеющими полярные группы.
23.
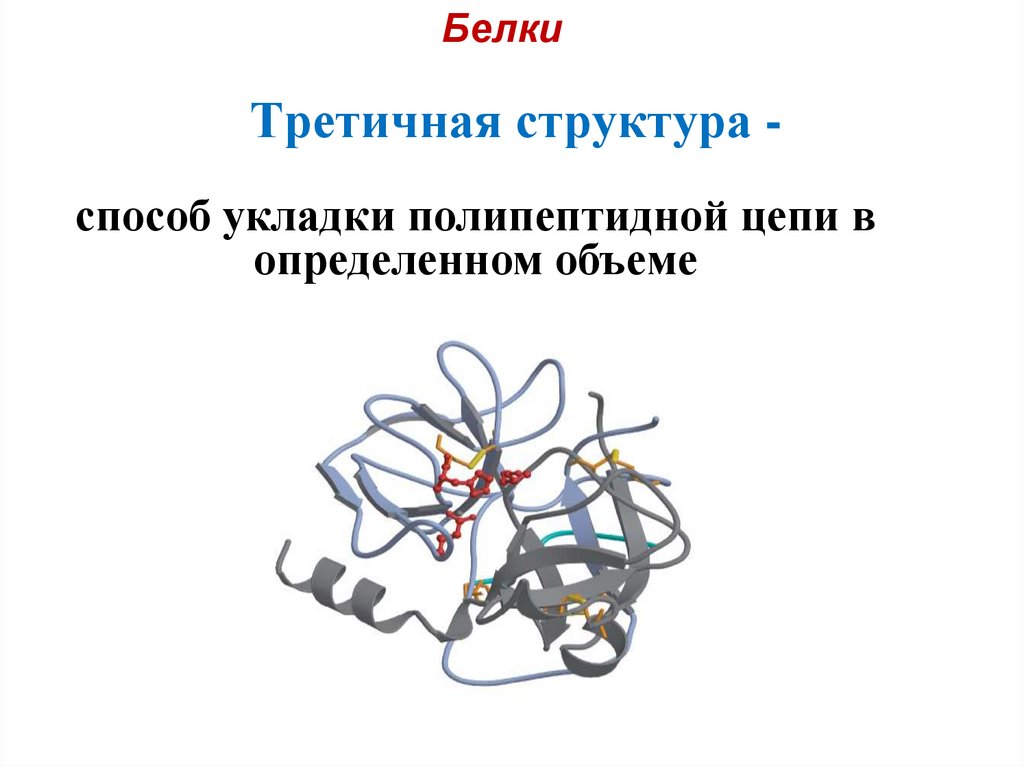
24. Третичная структура -
БелкиТретичная структура способ укладки полипептидной цепи в
определенном объеме
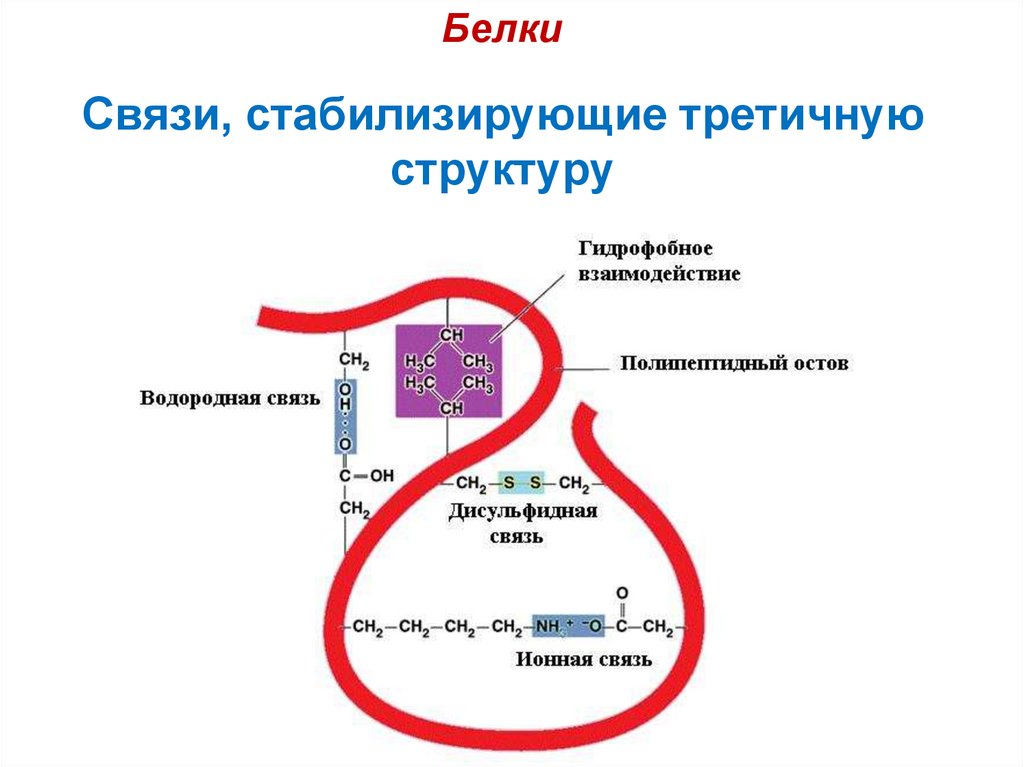
25. Связи, стабилизирующие третичную структуру
БелкиСвязи, стабилизирующие третичную
структуру
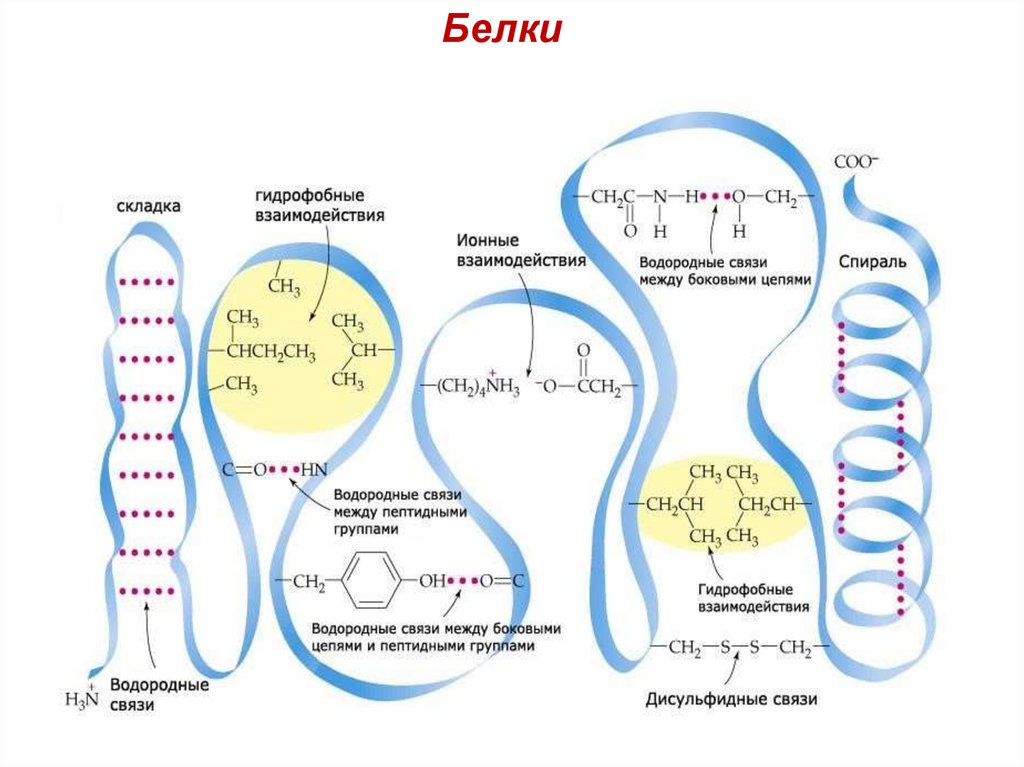
26. Связи, стабилизирующие третичную структуру:
БелкиСвязи, стабилизирующие третичную
структуру:
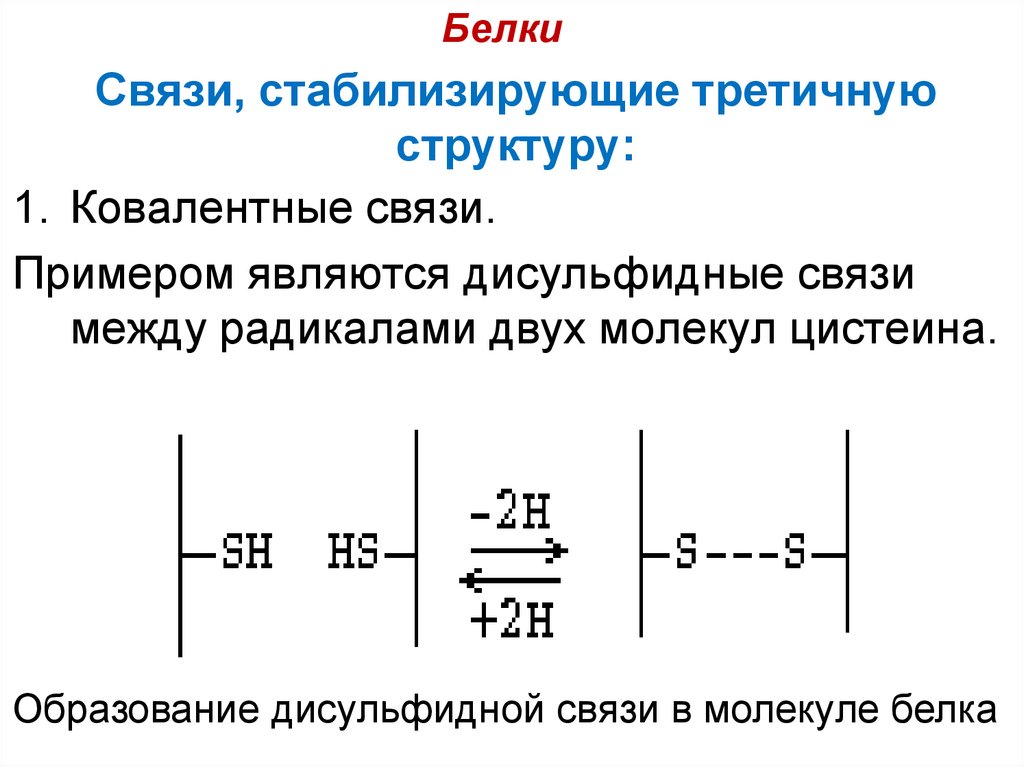
1. Ковалентные связи.
Примером являются дисульфидные связи
между радикалами двух молекул цистеина.
Образование дисульфидной связи в молекуле белка
27. Связи, стабилизирующие третичную структуру:
БелкиСвязи, стабилизирующие третичную
структуру:
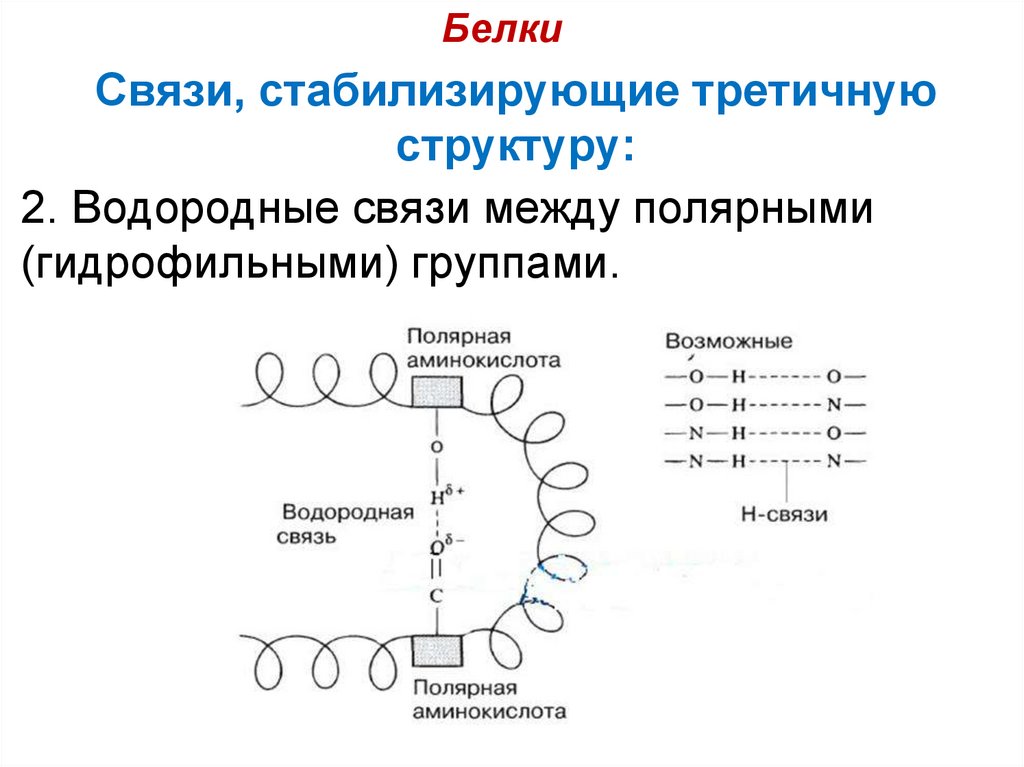
2. Водородные связи между полярными
(гидрофильными) группами.
28. Связи, стабилизирующие третичную структуру:
БелкиСвязи, стабилизирующие третичную
структуру:
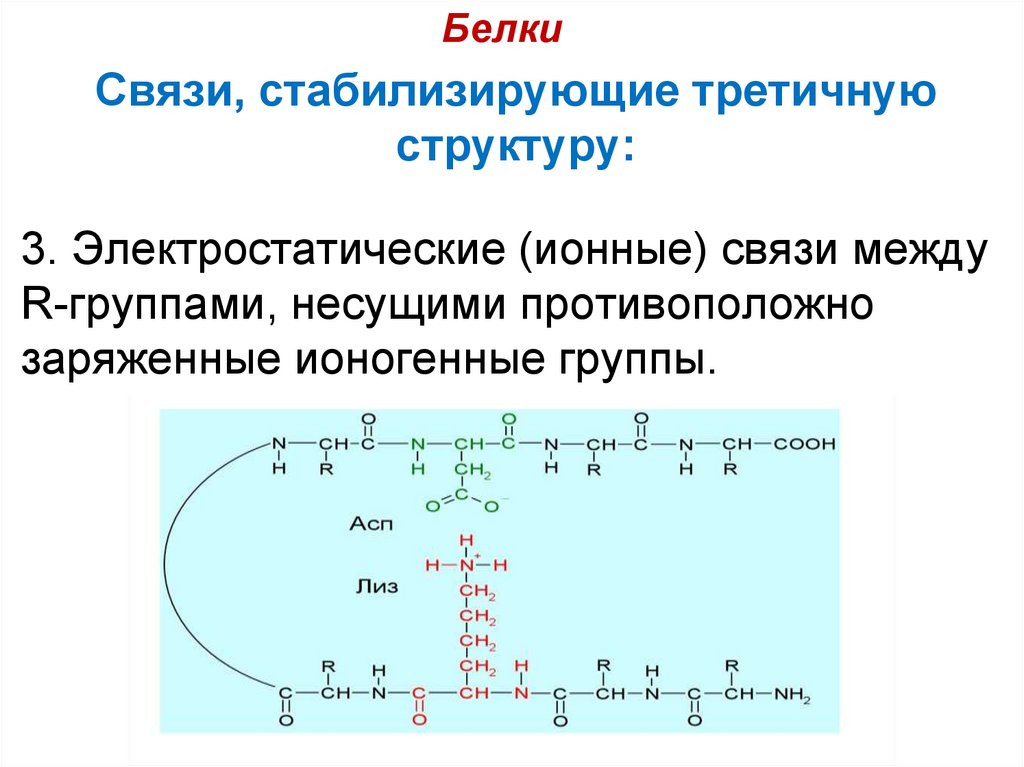
3. Электростатические (ионные) связи между
R-группами, несущими противоположно
заряженные ионогенные группы.
29. Связи, стабилизирующие третичную структуру:
БелкиСвязи, стабилизирующие третичную
структуру:
3. Электростатические (ионные) связи между
R-группами, несущими противоположно
заряженные ионогенные группы.
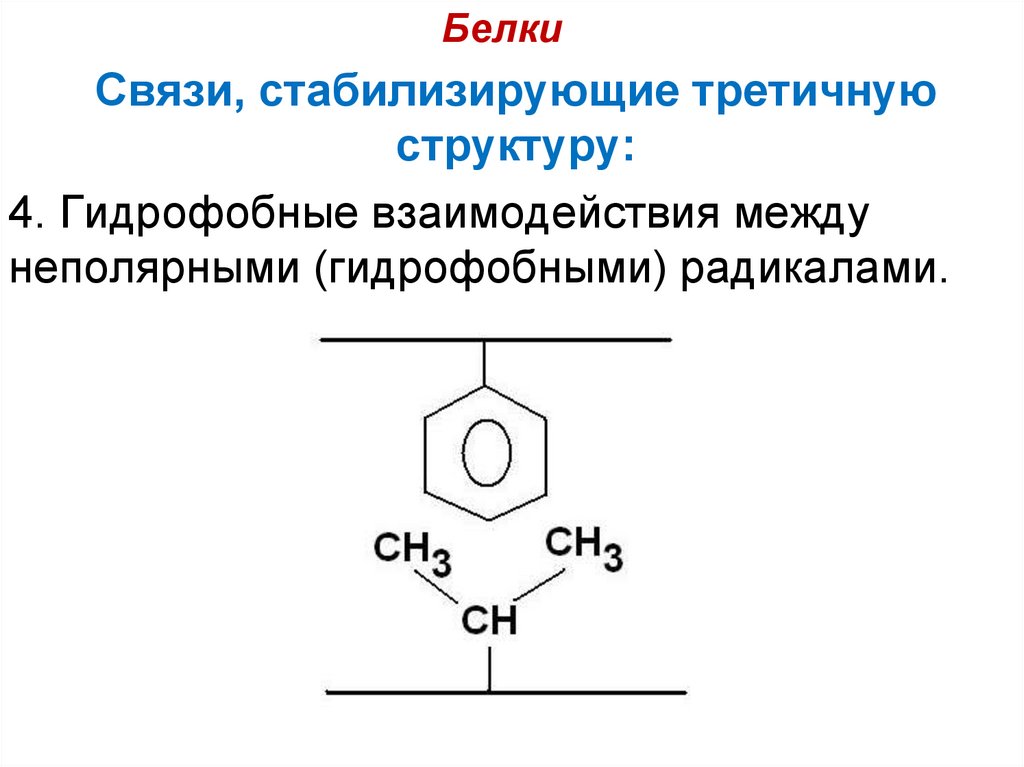
30. Связи, стабилизирующие третичную структуру:
БелкиСвязи, стабилизирующие третичную
структуру:
4. Гидрофобные взаимодействия между
неполярными (гидрофобными) радикалами.
31.
Белки32. Четвертичная структура
БелкиЧетвертичная структура
Характерна для белков, состоящих
из нескольких полипептидных цепей.
Она возникает в результате ассоциации нескольких
субъединиц в компактную глобулу.
Это взаимное расположение субъединиц белка в
пространстве.
2 субъединицы
в белке
4 субъединицы
в белке
12 субъединиц
в белке
33. Классификация белков по форме молекулы
БелкиКлассификация белков по форме
молекулы
34. Фибриллярные и глобулярные
БелкиКлассификация по форме молекулы
Фибриллярные и глобулярные
Волокна белка
коллагена
Миоглобин кита (синим цветом
показаны гидрофобные остатки а.к.,
красным цветом –остаток гема)
35.
Фибриллярные белки- представляют собой вытянутые и складчатые
структуры, выполняют в клетках и тканях структурную
функцию. Для этих белков наиболее характерной
является вторичная структура.
Фибриллярные белки нерастворимы в воде. Это
объясняется особенностями строения: в состав их входит
много гидрофобных АК. Радикалы гидрофобных АК
расположены перпендикулярно к плоскости фибрилл.
36.
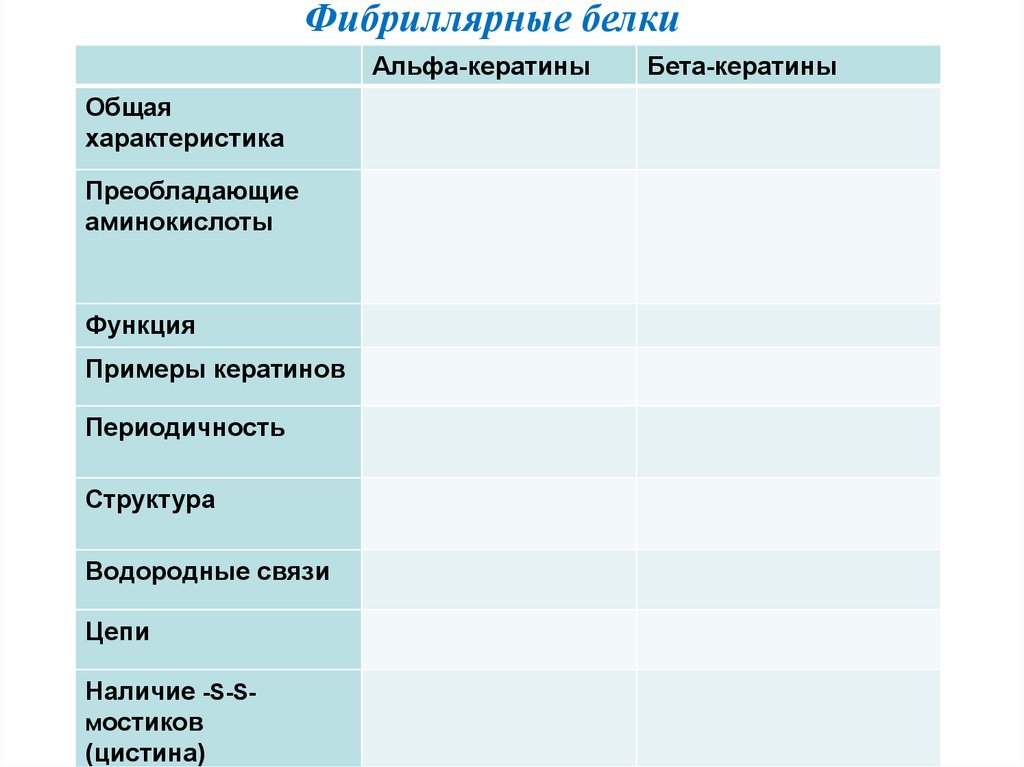
Фибриллярные белкиАльфа-кератины
Общая
характеристика
Преобладающие
аминокислоты
Функция
Примеры кератинов
Периодичность
Структура
Водородные связи
Цепи
Наличие -S-Sмостиков
(цистина)
Бета-кератины
37. α- Кератины
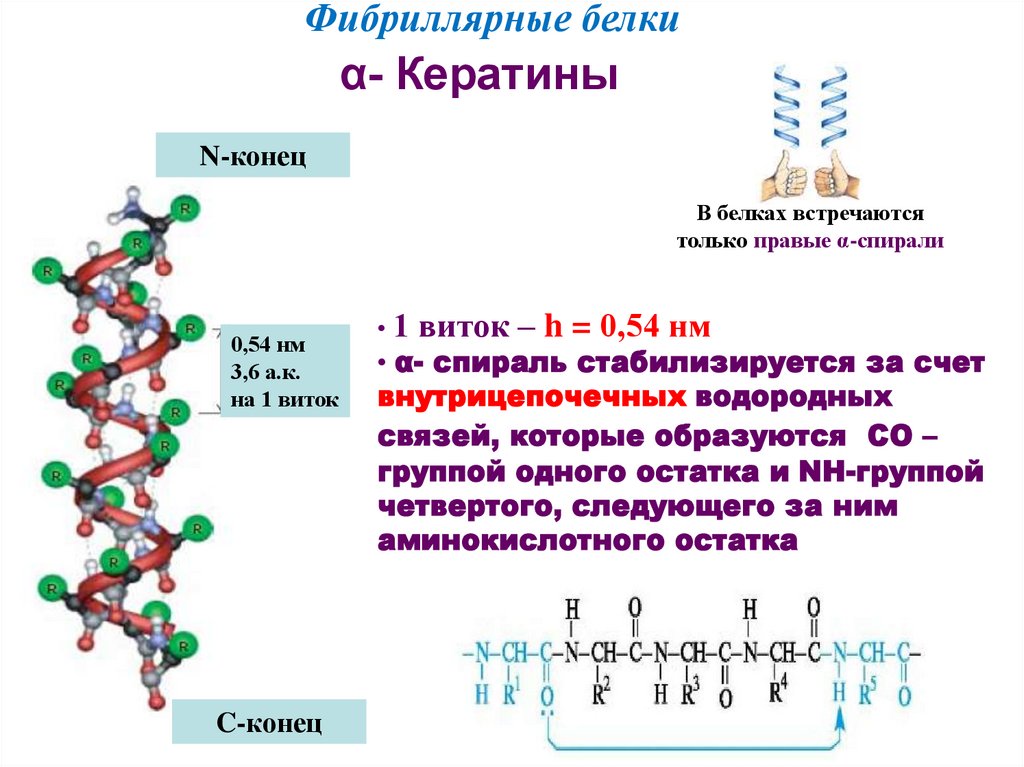
Фибриллярные белкиα- Кератины
N-конец
В белках встречаются
только правые α-спирали
0,54 нм
3,6 а.к.
на 1 виток
C-конец
• 1 виток – h = 0,54 нм
• α- спираль стабилизируется за счет
внутрицепочечных водородных
связей, которые образуются СО –
группой одного остатка и NH-группой
четвертого, следующего за ним
аминокислотного остатка
38.
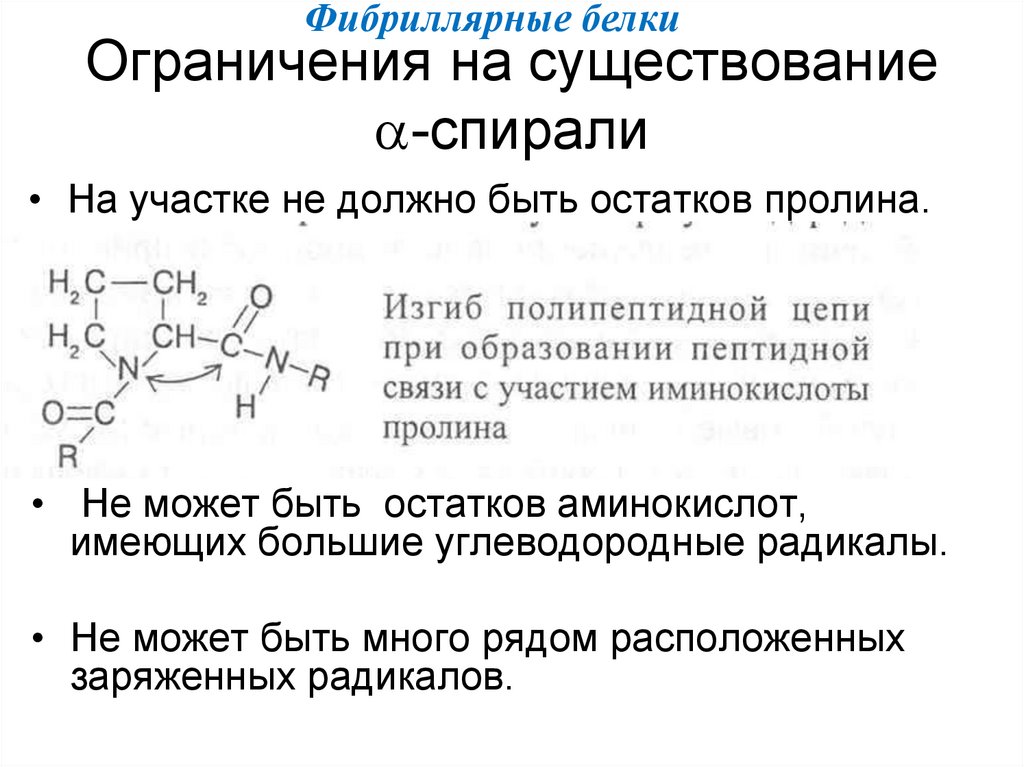
Фибриллярные белки39. Ограничения на существование -спирали
Фибриллярные белкиОграничения на существование
-спирали
• На участке не должно быть остатков пролина.
• Не может быть остатков аминокислот,
имеющих большие углеводородные радикалы.
• Не может быть много рядом расположенных
заряженных радикалов.
40.
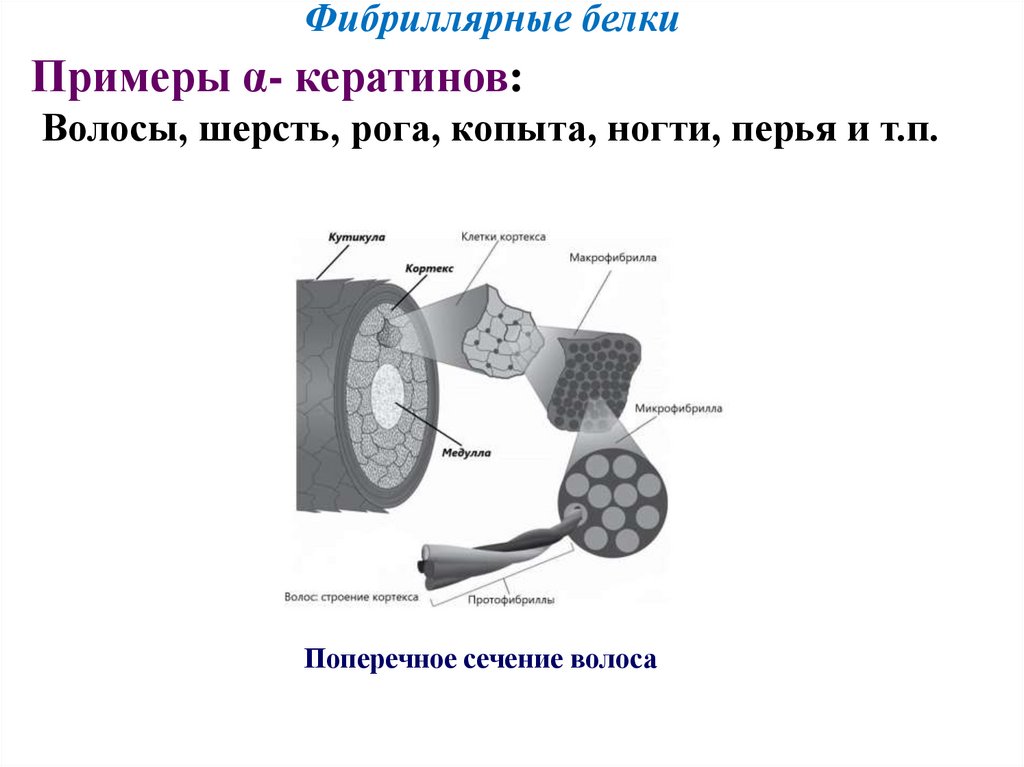
Фибриллярные белкиПримеры α- кератинов:
Волосы, шерсть, рога, копыта, ногти, перья и т.п.
Поперечное сечение волоса
41. β- Кератины
Фибриллярные белкиβ- Кератины
β- Кератин – фиброин (шелк и паутина):
• нерастворимый в воде,
• слабо растяжимый белок, но более гибкий.
“Производство” белка-фиброина
пауком
42.
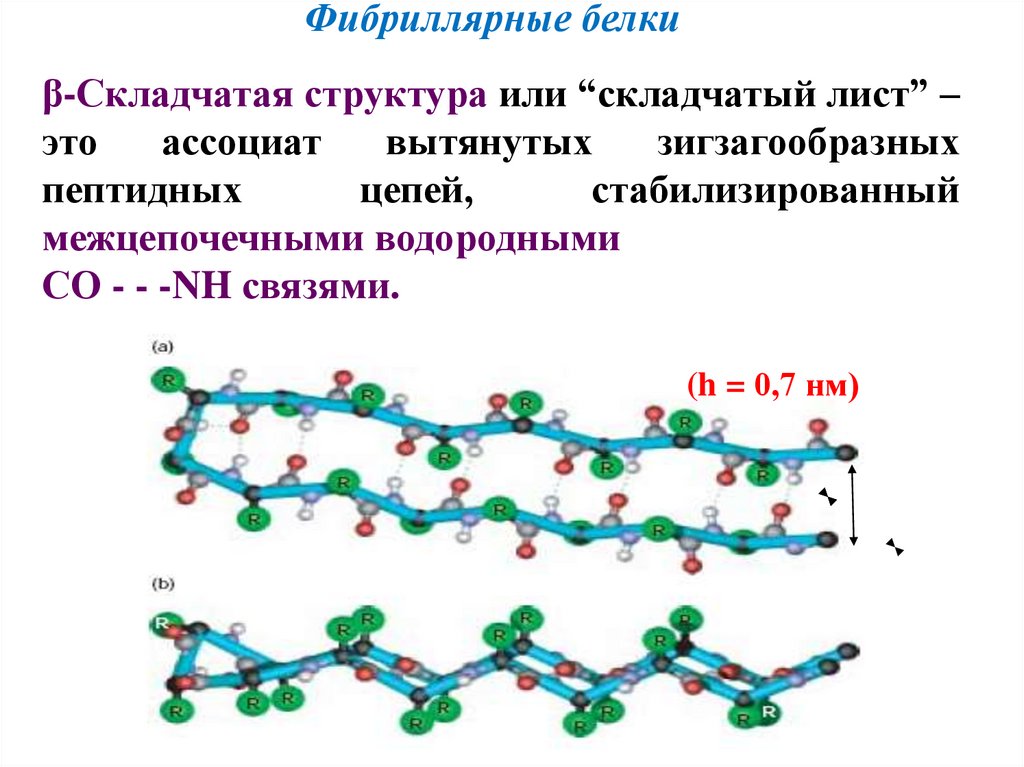
Фибриллярные белкиβ-Складчатая структура или “складчатый лист” –
это
ассоциат
вытянутых
зигзагообразных
пептидных
цепей,
стабилизированный
межцепочечными водородными
СО - - -NH связями.
(h = 0,7 нм)
43.
Фибриллярные белкиФиброин шелка
Антипараллельная структура
Вид сверху
Вид сбоку
44.
Альфа-кератиныБета-кератины
нерастворимые в воде.
нерастворимые в воде.
Преобладающие
аминокислоты
Гидрофобные
аминокислоты с
крупными радикалами
(фенилаланин,изолейцин
валин и др.)
Глицин.
Гидрофобные
аминокислоты с
небольшими радикалами
(аланин)
Функция
Структурная
Структурная
Примеры кератинов
Шерсть, волосы, ногти,
рога, копыта
Фиброин шелка и паутины
Периодичность
0,54 нм
0,7 нм
Структура
В форме альфа-спирали
В форме бета-складок
Водородные связи
Внутрицепочечные
Межцепочечные
Цепи параллельны или
антипараллельны
Параллельные
Антипараллельные (как
правило)
Общая характеристика
Фибриллярные
белки
Плотные белки,
Плотные белки,
45. Глобулярные белки
В глобулярных белках полипептидная цепь свернутав компактную глобулу.
Белки этого класса значительно более сложные по
конформации, чем фибриллярные. Почти все
гидрофобные радикалы скрыты внутри молекулы.
Большинство поверхностных R-групп находится в
гидратированном состоянии и обладают высокой
реакционной способностью.
Для глобулярных белков наиболее типична
третичная структура. Активность этих белков носит
динамический характер (ферменты).
46.
Глобулярные белкиβ
α
α/β
α+β
47.
48. Классификация белков по составу
Простые белки (неконьюгированные)при гидролизе образуют только
аминокислоты.
Сложные белки ( коньюгированные)
при гидролизе образуют кроме
аминокислот небелковый компонент.
Гемопротеины, металлопротеины,
липопротеины, гликопротеины,
фосфопротеины.
49. Транспортные белки
ФункцииТранспортные белки
Участвуют в переносе различных веществ и
ионов.
Примеры:
• Гемоглобин ( переносит О2 от легких к тканям )
• Миоглобин ( переносит О2 в мышечной ткани )
• Цитохром с (транспорт электронов в дыхательной
цепи)
• Мембранные белки – каналообразователи (транспорт
веществ и ионов через биологические мембраны)
50. Пищевые и запасные белки
ФункцииПищевые и запасные белки
• Казеин молока
• Альбумин яичный
• Зеин ржи
• Ферритин (“депо” Fe в
селезенке)
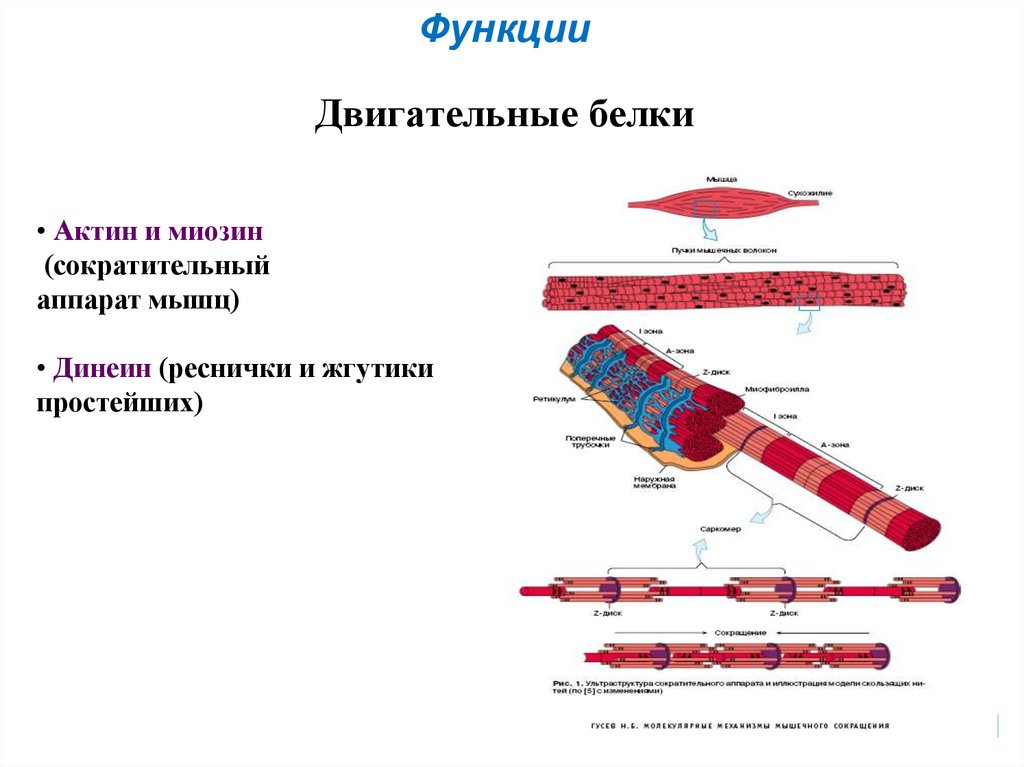
51. Двигательные белки
ФункцииДвигательные белки
• Актин и миозин
(сократительный
аппарат мышц)
• Динеин (реснички и жгутики
простейших)
52. Структурные белки
ФункцииСтруктурные белки
Составляют остов многих тканей и органов.
• Являются фибриллярными белками
• Это белки соединительной ткани:
α- кератины (волосы, шерсть, чешуя, панцири и т.д.)
β- кератины (фиброин шелка и паутины)
эластин (связки, стенки сосудов и др.)
коллаген (кости, хрящи, кожа, сухожилия)
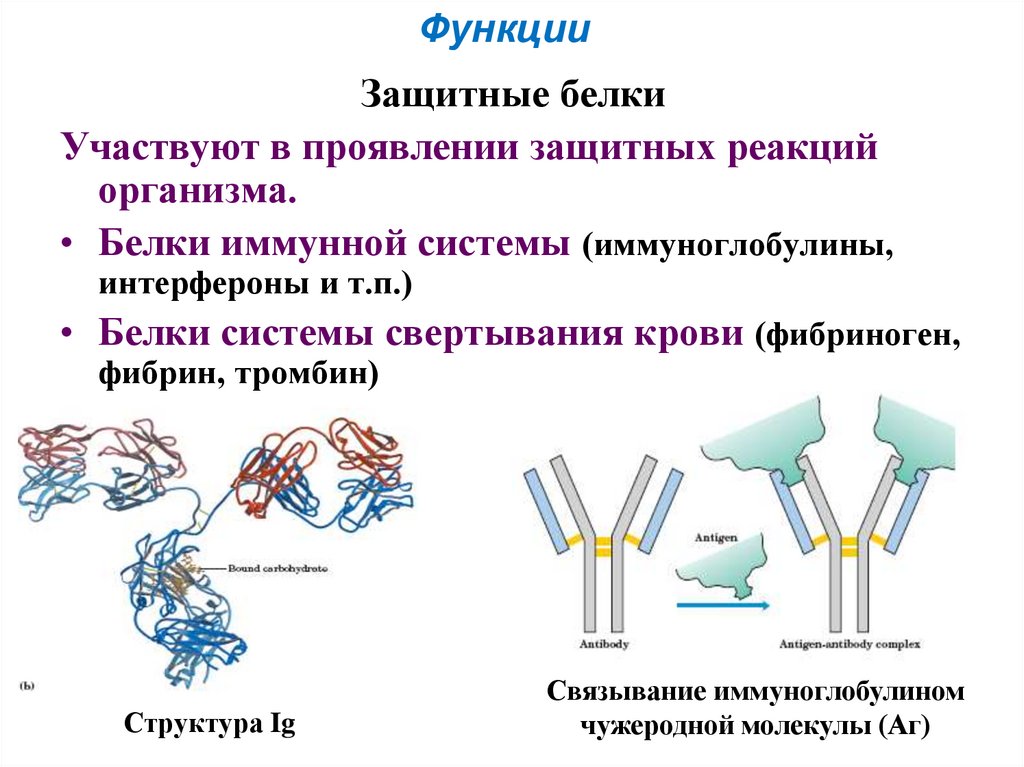
53. Защитные белки
ФункцииЗащитные белки
Участвуют в проявлении защитных реакций
организма.
• Белки иммунной системы (иммуноглобулины,
интерфероны и т.п.)
• Белки системы свертывания крови (фибриноген,
фибрин, тромбин)
Структура Ig
Связывание иммуноглобулином
чужеродной молекулы (Аг)
54. Токсины белковой природы
ФункцииТоксины белковой природы
Антибиотики (антибактериальные,
противовирусные, противогрибковые).
Белки – зоотоксины (змей, скорпионов,
пауков, и др.)
Белки – фитотоксины (рицин из клещевины)
55. Регуляторные белки
ФункцииРегуляторные белки
Белковые гормоны (соматотропин,
тиротропин, гонадотропин, пролактин).
Гистоны, репрессоры и т.п. (регулируют
активность генов и биосинтез белка).
56.
Вопросы по теме: «Аминокислоты, пептиды и белки»1.Классификация аминокислот. Аминокислоты с гидрофобными
неполярными радикалами.
2.Аминокислоты с полярными радикалами.
3.Аминокислоты с заряженными радикалами.
4.Кислотно-основные свойства аминокислот (кривые титрования).
5.Оптические свойства аминокислот.
6.Качественные (цветные) реакции на аминокислоты и белки.
7.Нестандартные аминокислоты.
8.Биологические функции аминокислот.
9.Образование пептидной связи. Свойства пептидной связи.
Биологические функции пептидов.
10.Факторы, влияющие на стабильность растворов белков.
Денатурация.
11.Уровни структурной организации белков.
12.Характеристика α-кератинов.
13.Характеристика β-кератинов.
14.Глобулярные белки.
15.Классификация белков по составу. Функции белков.
57. Лекция №3
58. Тема 2 Ферменты: структура, классификация, механизм действия и регуляция
59.
Особенности ферментов какбиологических катализаторов
Ферменты – катализаторы органической
природы, ускоряющие протекание
биохимических процессов.
Эти вещества, повышая активность
реагирующих молекул, снижают силы
химического сопротивления.
60. Особенности ферментативного катализа: сравнение с неорганическими катализаторами
Сходства:o Увеличивают скорость реакции, но не
расходуются в ходе процесса и не
претерпевают необратимых изменений.
o Снижают энергию активации.
o Катализируют реакции, возможные по
термодинамическим условиям.
o Не изменяют термодинамических
характеристик реакции (не смещают
равновесие).
61. Отличительные особенности биокатализаторов
Особенности ферментативногокатализа: сравнение с
неорганическими катализаторами
Отличительные особенности биокатализаторов
o Ферменты работают в мягких условиях.
o Для ферментов характерна высокая скорость
превращения веществ. Ферменты могут ускорять
реакцию в 108 -1014 раз.
o Ферменты обладают высокой специфичностью
действия.
o Процесс ферментативного катализа
представляет собой серию превращений,
строжайшим образом организованных в
пространстве и во времени.
o Регулируемая активность.
62.
ФерментыПростые
(однокомпонентные)
Состоят только из
белковой части
Сложные
(холоферментные)
63.
ФерментыПростые
(однокомпонентные)
Состоят только из
белковой части
Сложные
(холоферментные)
64.
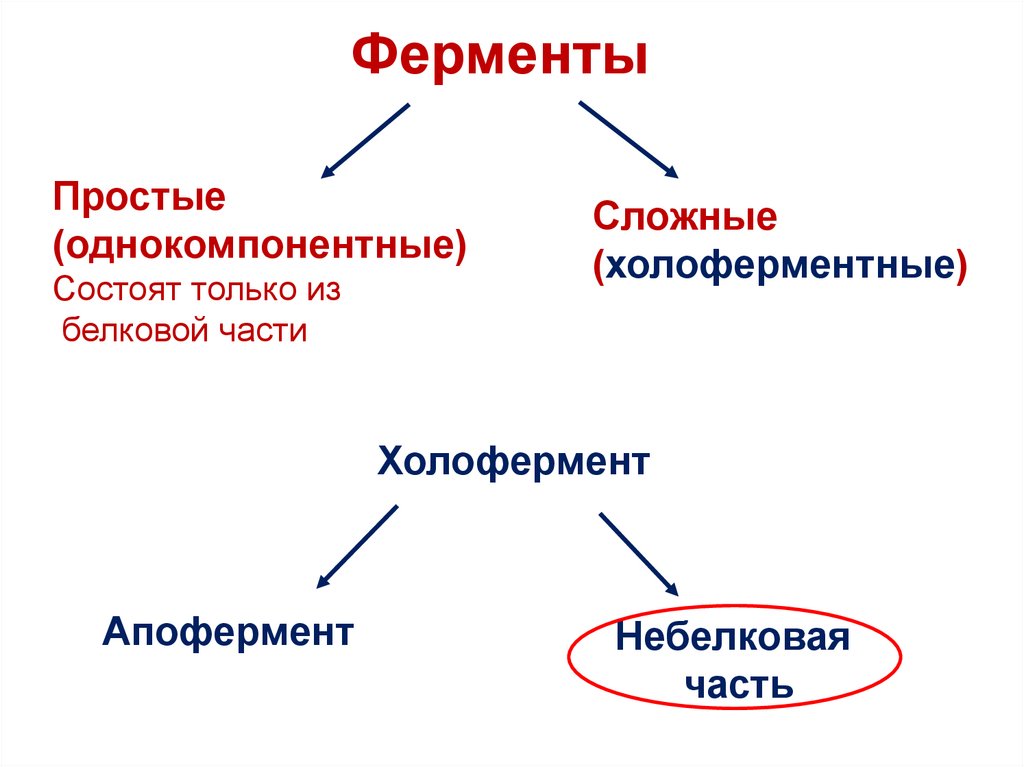
ФерментыПростые
(однокомпонентные)
Состоят только из
белковой части
Сложные
(холоферментные)
Холофермент
Апофермент
Небелковая
часть
65.
ФерментыПростые
(однокомпонентные)
Состоят только из
белковой части
Сложные
(холоферментные)
Холофермент
Апофермент
Небелковая
часть
66.
Небелковая частьОрганический
Компонент
(кофермент)
Неорганический
компонент
(кофактор)
Если небелковая часть с апоферментом связана прочной
ковалентной связью, ее называют простетической группой.
67. Кофакторы
В качестве кофакторов выступают ионыкалия, магния, кальция, цинка, меди,
железа и т.д.
Роль кофакторов:
- стабилизируют молекулы субстрата и
обеспечивают его связывание;
- стабилизируют активный центр фермента,
- стабилизируют третичную и четвертичную
структуру фермента;
- обеспечивают катализ.
68. Коферменты
В качестве коферментов могут функционироватьпроизводные витаминов:
Активация
Витамины
РР (никотиновая кислота)
В1 (тиамин)
В2 (рибофлавин)
В5 (пантотеновая кислота)
В6 (пиридоксаль)
В12
Коферменты
НАД+, НАДФ+
Тиаминпирофосфат
ФАД, ФМН
Кофермент А (СоА-SН)
Пиридоксальфосфат
Кобаламины
Невитаминные и витаминоподобные
коферменты:
Гемы
Глутатион
Нуклеотиды
Коэнзим Q
69. Активный центр фермента
В процессе формирования ферментсубстратного комплекса субстратприсоединяется к специфическому
участку на молекуле фермента активному центру.
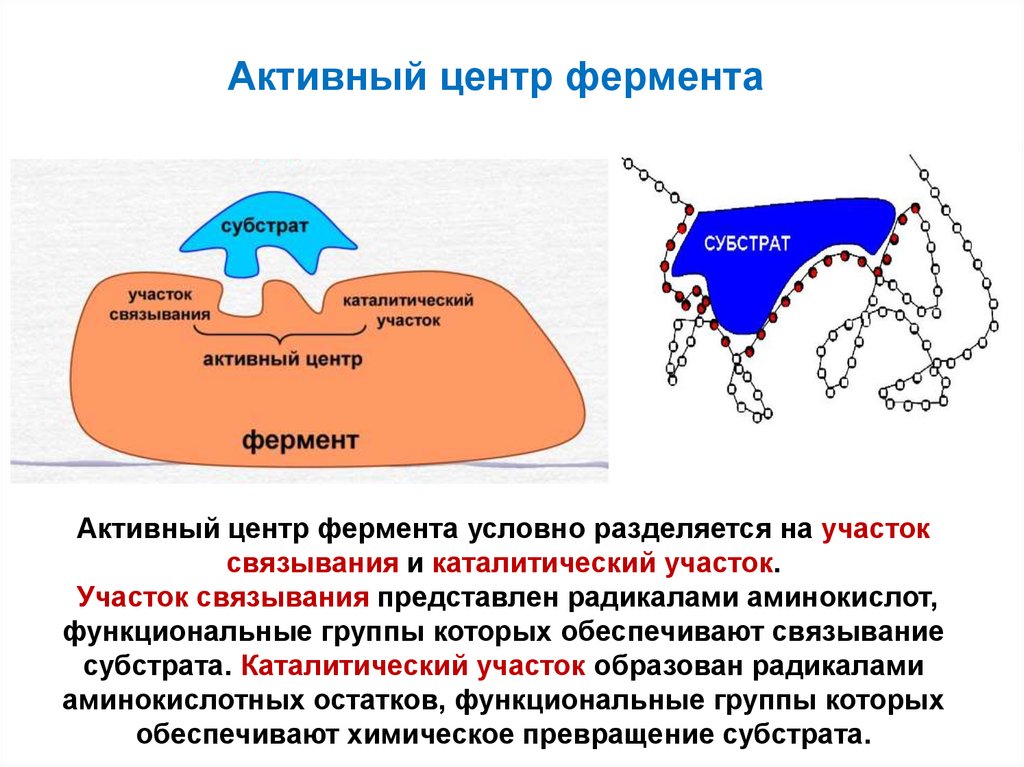
70. Активный центр фермента
Активный центр фермента условно разделяется на участоксвязывания и каталитический участок.
Участок связывания представлен радикалами аминокислот,
функциональные группы которых обеспечивают связывание
субстрата. Каталитический участок образован радикалами
аминокислотных остатков, функциональные группы которых
обеспечивают химическое превращение субстрата.
71.
Специфичность фермента– наиболее важное свойство ферментов, определяющее
биологическую значимость этих молекул. Различают субстратную
и каталитическую специфичности фермента, определяемые
строением активного центра.
Активный центр фермента
Участок связывания
Каталитический участок.
Обеспечивает субстратную
специфичность
Обеспечивает выбор пути
химического превращения
-абсолютная субстратная
специфичность
-групповая субстратная
специфичность
-стереоспецифичность
специфичность пути
превращения
72.
Специфичность ферментаСубстратная
Абсолютная специфичность - это способность фермента
катализировать превращение только одного, строго
определенного субстрата, к которому комплементарен
активный центр.
Относительная (групповая) специфичность – это
способность большинства ферментов катализировать
однотипные реакции с небольшим количеством
(группой) структурно похожих субстратов.
Стереоспецифичность
При наличии у субстрата нескольких стереоизомеров
фермент проявляет абсолютную специфичность к одному
из них.
73.
Специфичность ферментаКаталитическая (специфичность действия)
– это способность фермента катализировать
превращение присоединенного субстрата по
одному из возможных путей его
превращения.
74. Номенклатура и классификация ферментов
75.
76. Классификация ферментов
В основу классификации положен важнейший признак,по которому один фермент отличается от другого — это
катализируемая им реакция.
Оксидоредуктазы (окислительновосстановительные реакции);
Трансферазы (перенос функциональных
групп);
Гидролазы (реакции расщепления с участием
воды);
Лиазы (разрыв связей без участия воды);
Изомеразы (изомерные превращения);
Лигазы (синтез с затратой молекул АТФ).
77.
Любой фермент получает свой уникальныйкодовый номер, состоящий из четырёх чисел,
разделённых точками. Первое число
обозначает класс, второе - подкласс, третье подподкласс, четвёртое - номер фермента в
пределах подподкласса.
Например, фермент α-амилаза, расщепляющая крахмал,
обозначается как 3.2.1.1, где:
• 3 — тип реакции (гидролиз);
• 2 — тип связи в субстрате (гликозидная);
• 1 — разновидность связи (О-гликозидная);
• 1 — номер фермента в подподклассе.
78. 1. Оксидоредуктазы
К классу оксидоредуктаз относят ферменты,катализирующие окислительно-восстановительные
реакции.
где AH2 —донор водорода, B — акцептор водорода. В живых
организмах окисление осуществляется преимущественно путём
отщепления атомов водорода, гидрид-ионов или электронов от
субстратов-доноров. Акцепторами могут быть различные
вещества - коферменты (НАД+, НАДФ+, ФАД, ФМН, гем,
убихинон), железосерные белки и кислород и т. д.
79. 1. Оксидоредуктазы
К классу оксидоредуктаз относят ферменты,катализирующие окислительно-восстановительные
реакции.
где AH2 —донор водорода, B — акцептор водорода. В живых
организмах окисление осуществляется преимущественно путём
отщепления атомов водорода, гидрид-ионов или электронов от
субстратов-доноров. Акцепторами могут быть различные
вещества - коферменты (НАД+, НАДФ+, ФАД, ФМН, гем,
убихинон), железосерные белки и кислород и т. д.
В зависимости от способа окисления различают
следующие подклассы оксидоредуктаз: дегидрогеназы,
оксидазы, оксигеназы и другие.
80. 1. Оксидоредуктазы
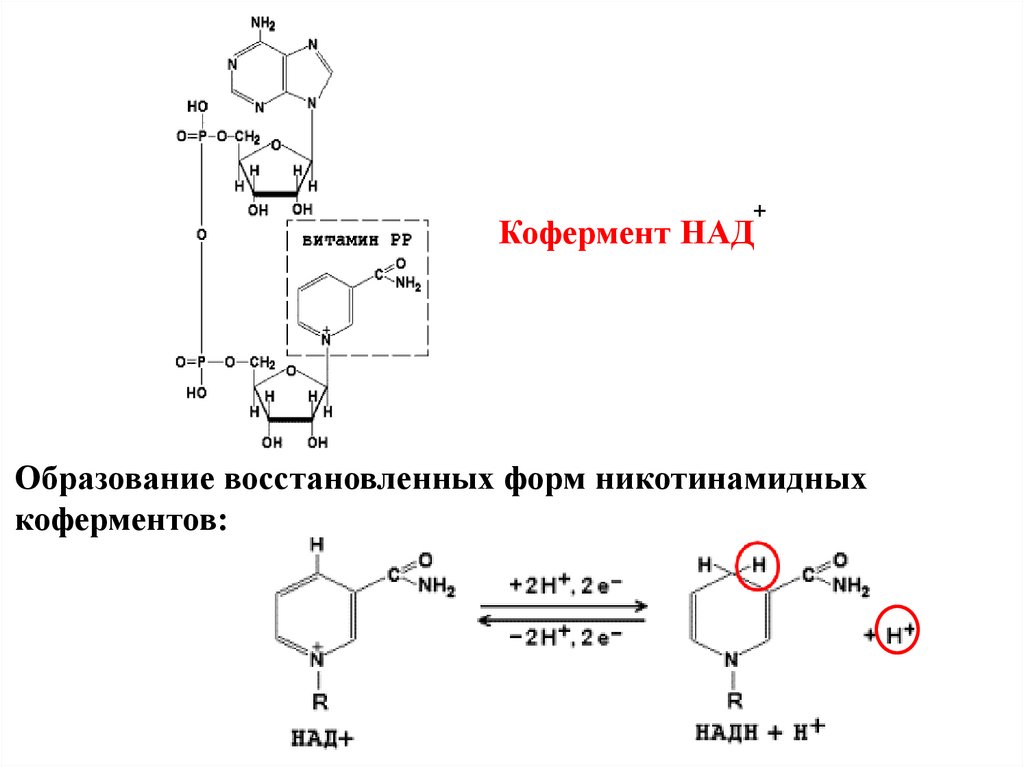
Коферменты НАД+(никотинамидадениндинуклеотид) и
НАДФ+
(никотинамидадениндинуклеотидфосфат)
содержат в своём составе витамин РР
(никотиновая кислота и никотинамид) и
принимают участие в окислительновосстановительных реакциях.
Функция НАД и НАДФ состоит в переносе
гидрид-ионов (эта реакция осуществляется за
счет никотинамидной части молекул
коферментов).
81.
+Кофермент НАД
Образование восстановленных форм никотинамидных
коферментов:
82. 1. Оксидоредуктазы
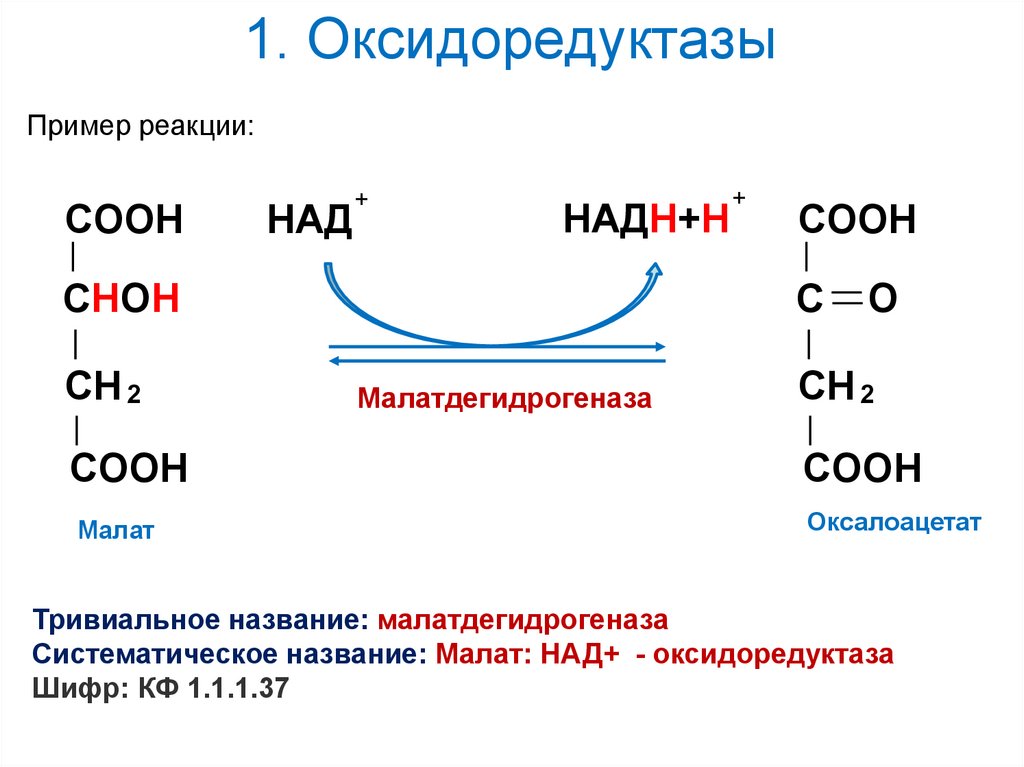
Пример реакции:COOН
НAД
+
НAДН+Н
+
COOН
CHОН
C
CH 2
Малатдегидрогеназа
О
CH 2
CООН
CООН
Малат
Оксалоацетат
Тривиальное название: малатдегидрогеназа
Систематическое название: Малат: НАД+ - оксидоредуктаза
Шифр: КФ 1.1.1.37























































 biology
biology








