Similar presentations:
Общая характеристика металлов и неметаллов
1.
:Общая характеристика
металлов и неметаллов
Преподаватель Юридического колледжа
Валентина Владимировна Киреева
2.
РЕМОНТМеталлы
3.
4.
РЕМОНТИз 118 известных элементов 96
относятся к металлам.
История человечества неразрывно
связана с использованием металлов:
• 5-4 тысячелетие до н.э. – медный
век
• 3-2 тысяч. до н.э. – бронзовый век
• 2-1 тыс. до н.э. – железный век
5.
РЕМОНТСамым распространенным Ме в земной
коре является алюминий. За ним следует
железо, натрий, калий, магний и титан.
Ме встречаются в природе как в свободном
виде, так и в различных соединениях
Боксит
гематит
магнетит
6.
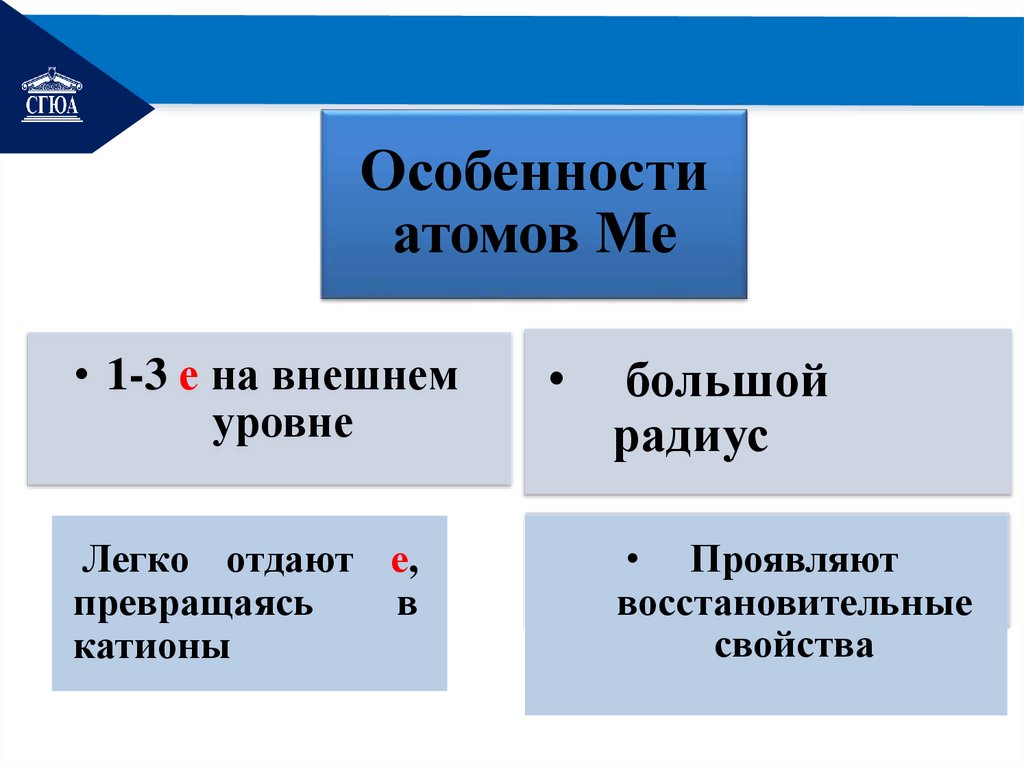
РЕМОНТОсобенности
атомов Ме
• 1-3 е на внешнем
уровне
Легко отдают е,
превращаясь
в
катионы
большой
радиус
• Проявляют
восстановительные
свойства
7.
8.
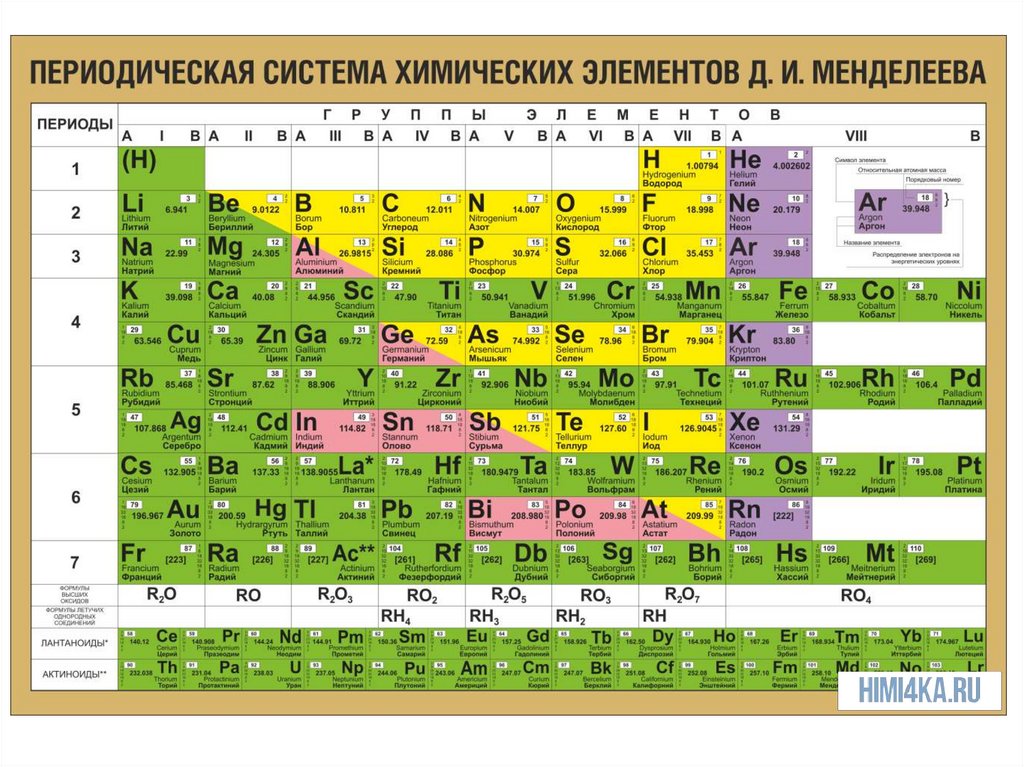
РЕМОНТНахождение в ПСХЭ Д.И. Менделеева
Металлы находятся в левом нижнем
углу
относительно
диагонали,
проведенной от бериллия (Be) к астату
(At), а также в побочных подгруппах
правого верхнего угла ПСХЭ.
• Элементы,
расположенные
вблизи
диагонали (Be, Al, титан Ti, Ge, Nb, Sb и
др.), - переходные металлы.
9.
РЕМОНТКристаллическая
решетка
металлическая: в узлах решеток
находятся катионы, между которыми
передвигаются свободные электроны.
• Связь между катионами металлов,
которую
обеспечивают
свободные
электроны металлическая
10.
РЕМОНТФизические свойства
1) твердые вещества ( кроме ртути)
• металлический блеск
• обычно серый цвет и непрозрачность.
2) хорошая электро – и теплопроводимость,
что
объясняется
присутствием
в
них
свободных
электронов.
Наибольшая электро- и теплопроводимость у серебра, меди, золота,
алюминия, железа. наименьшая – у висмута и ртути.
11.
РЕМОНТФизические свойства
3) Ковкость: не разрушаются под действием
давления.
4) Высокая пластичность
–
смещение слоев
ионов под внешним воздействием на кристалл
относительно друг друга. Она уменьшается в
ряду Au, Ag, Cu, Sn, Pb, Zn, Fe.
Золото можно прокатывать в листы толщиной
0,003 мм,
которые используются для позолоты различных предметов.
12.
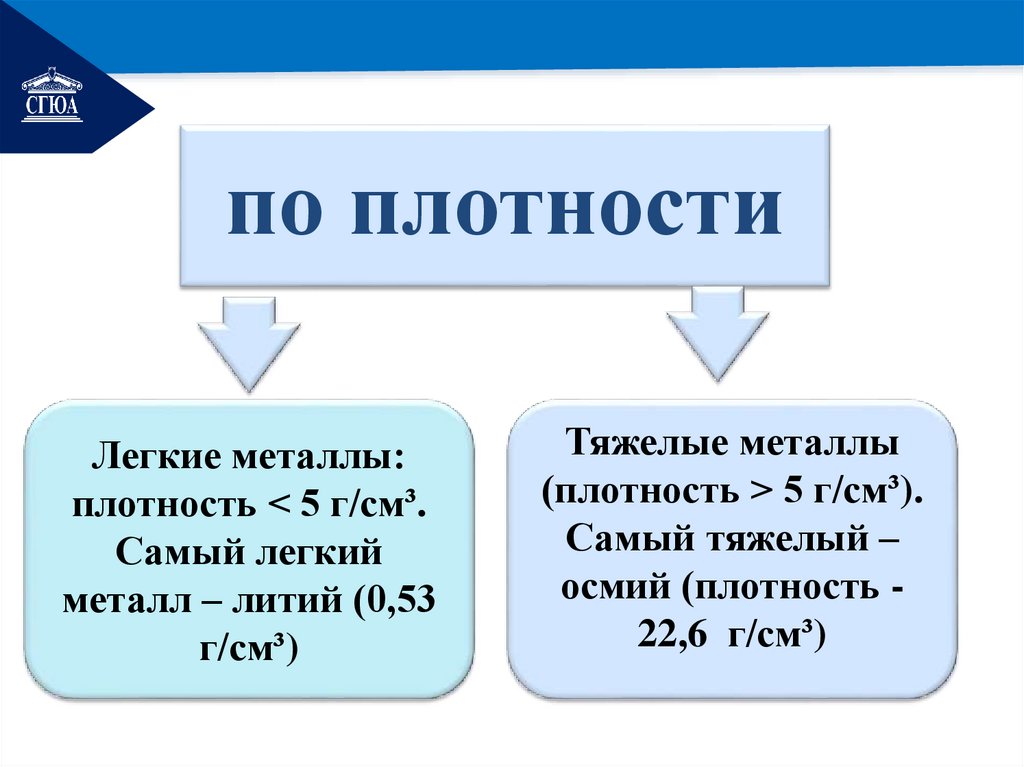
РЕМОНТпо плотности
Легкие металлы:
плотность < 5 г/см³.
Самый легкий
металл – литий (0,53
г/см³)
Тяжелые металлы
(плотность > 5 г/см³).
Самый тяжелый –
осмий (плотность 22,6 г/см³)
13.
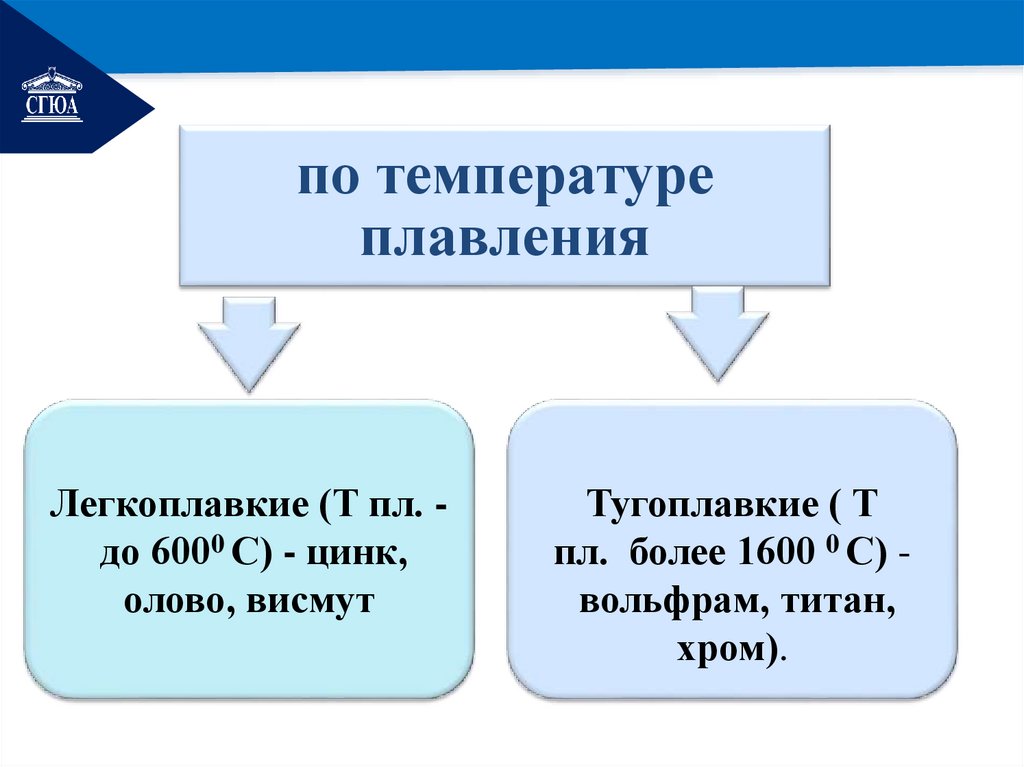
РЕМОНТпо температуре
плавления
Легкоплавкие (Т пл. до 6000 С) - цинк,
олово, висмут
Тугоплавкие ( Т
пл. более 1600 0 С) вольфрам, титан,
хром).
14.
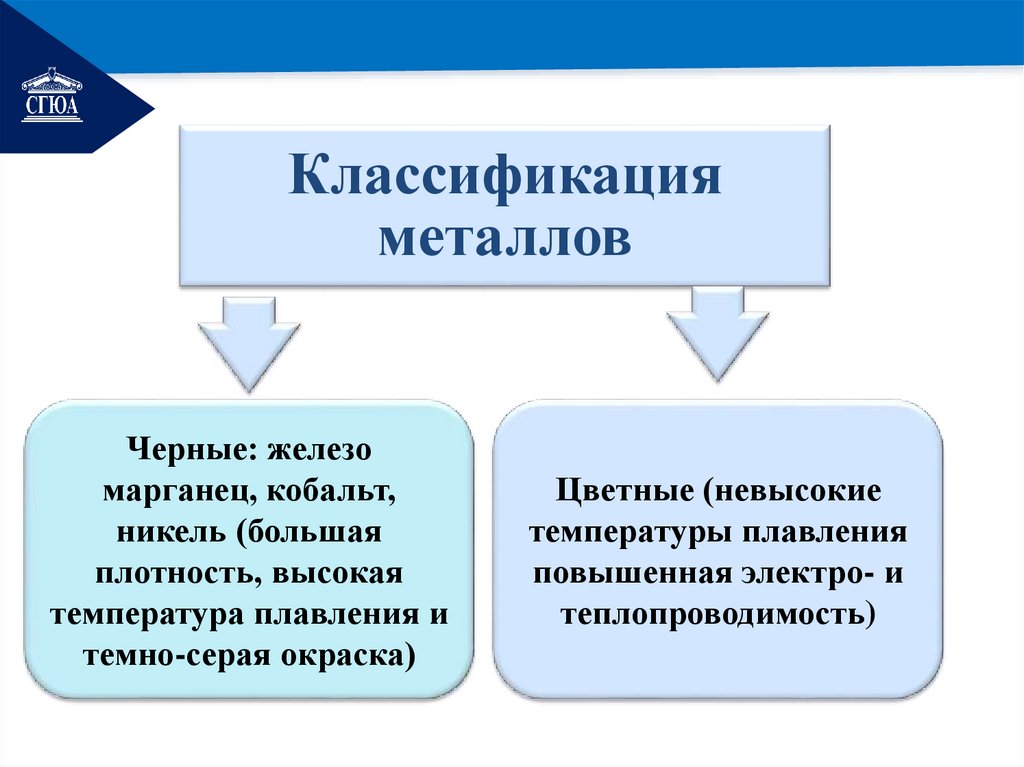
РЕМОНТКлассификация
металлов
Черные: железо
марганец, кобальт,
никель (большая
плотность, высокая
температура плавления и
темно-серая окраска)
Цветные (невысокие
температуры плавления
повышенная электро- и
теплопроводимость)
15.
РЕМОНТХимические свойства
Ряд активности металлов.
Ме расположены в
восстановительных свойств.
порядке
убывания
16.
РЕМОНТметаллы
от Li до Мg
очень
активные
металлы.
от Аl до H2
металлы
средней
активности
после Н2
малоактивные
металлы
17.
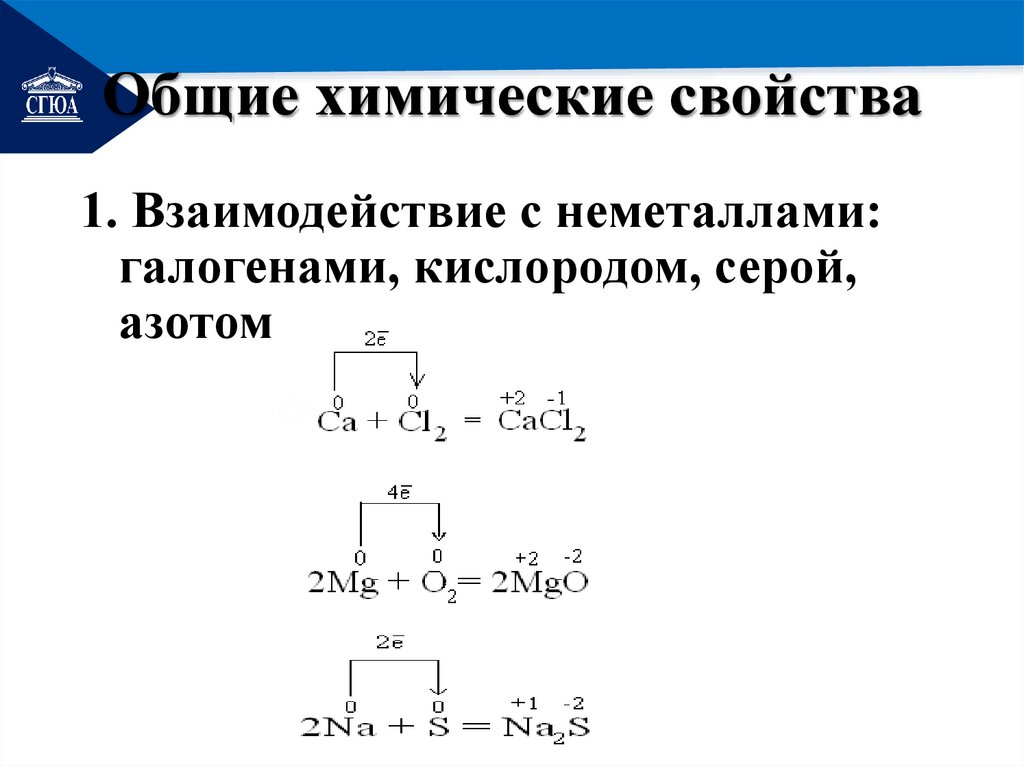
РЕМОНТОбщие химические свойства
1. Взаимодействие с неметаллами:
галогенами, кислородом, серой,
азотом
18.
РЕМОНТ2. Взаимодействие с водой:
а. Активные Ме взаимодействуют с водой с образованием
щелочей и выделением водорода:
2Na + 2H2O → 2Na OH + H2↑
б. Ме , средней активности – в жестких условиях с
образованием оксида Ме и водорода (Al взаимодействует
как активный):
3Fe + 4H2O → Fe3O4 + 4H2↑
в. Ме, стоящие в ряду за H2, с водой не взаимодействуют
19.
РЕМОНТ3. Взаимодействие с растворами кислот
Ме, стоящие в ряду до H, вытесняют его
из растворов кислот:
2Na + 2HCl → 2NaCl+ H2↑
20.
РЕМОНТ3. Взаимодействие с солями
Более активный Ме, стоящий в
ряду активности левее, вытесняет
менее активный Ме из растворов
его солей:
CuSO4 + Fe → FeSO4 +Cu
21.
РЕМОНТ• На основании положения металлов в
электрохимическом ряду напряжений обоснуйте
возможность протекания следующих химических
реакций:
a) Zn и CuSO4
f) AlCl3 и Mg
b) Al и H2O
g) Fe и H2O
c) Cu и HCl
h) Mg и HCl
d) Na и H2O
i) Al и FeCl3
e) Fe и AlCl3
j) Hg и H2O
• Составьте уравнения возможных химических реакций.
22.
РЕМОНТКоррозия металлов
–
это
химическое
и
электрохимическое
разрушение
металлов и их сплавов в
результате воздействия на них
окружающей среды.
23.
РЕМОНТ• Химическая коррозия –разрушение
металла под действием окислителей
(кислорода, хлора и др.) даже в
условиях обычной температуры.
24.
РЕМОНТЭлектрохимическая коррозия –
разрушение металла или сплава в
среде электролита
- растворах щелочей, кислот и солей;
- морской воде;
- в атмосфере любого влажного газа;
- в почве.
25.
РЕМОНТ26.
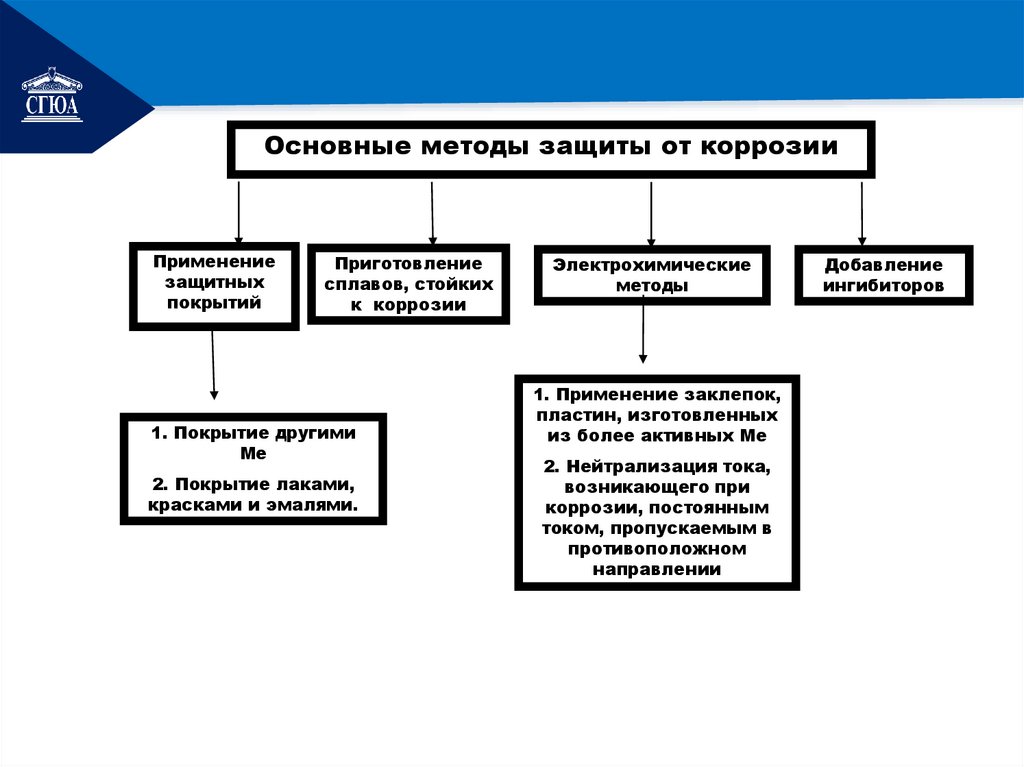
РЕМОНТОсновные методы защиты от коррозии
Применение
защитных
покрытий
Приготовление
сплавов, стойких
к коррозии
1. Покрытие другими
Ме
2. Покрытие лаками,
красками и эмалями.
Электрохимические
методы
1. Применение заклепок,
пластин, изготовленных
из более активных Ме
2. Нейтрализация тока,
возникающего при
коррозии, постоянным
током, пропускаемым в
противоположном
направлении
Добавление
ингибиторов
27.
РЕМОНТПолучение металлов
1. Наиболее активные Ме получают электролизом.
2. Менее активные Ме восстанавливают из их
оксидов углем или оксидом углерода:
3. Восстановление Ме из их оксидов более
активными Ме:
28.
РЕМОНТСплавы
- это материалы с характерными свойствами,
состоящие из двух или более компонентов, из
которых по крайней мере один – металл.
Виды сплавов
• если основой сплава является железо, то
сплавы называются чёрными: чугун и сталь
• если основа сплавов — цветные металлы, то
и сплавы называются цветными. Самые
известные сплавы меди – бронза и латунь.
• бывают ещё сплавы редких металлов и
сплавы радиоактивных металлов
29.
сплавыРЕМОНТ
однородные - при сплавлении образуется раствор
одного Ме в другом.
Припой: одна часть свинца и две части олова
неоднородные - при сплавлении образуется
механическая смесь Ме
Дюралюмин: 95% алюминия, 4% меди, 0,5%
марганца и 0,5% магния
30.
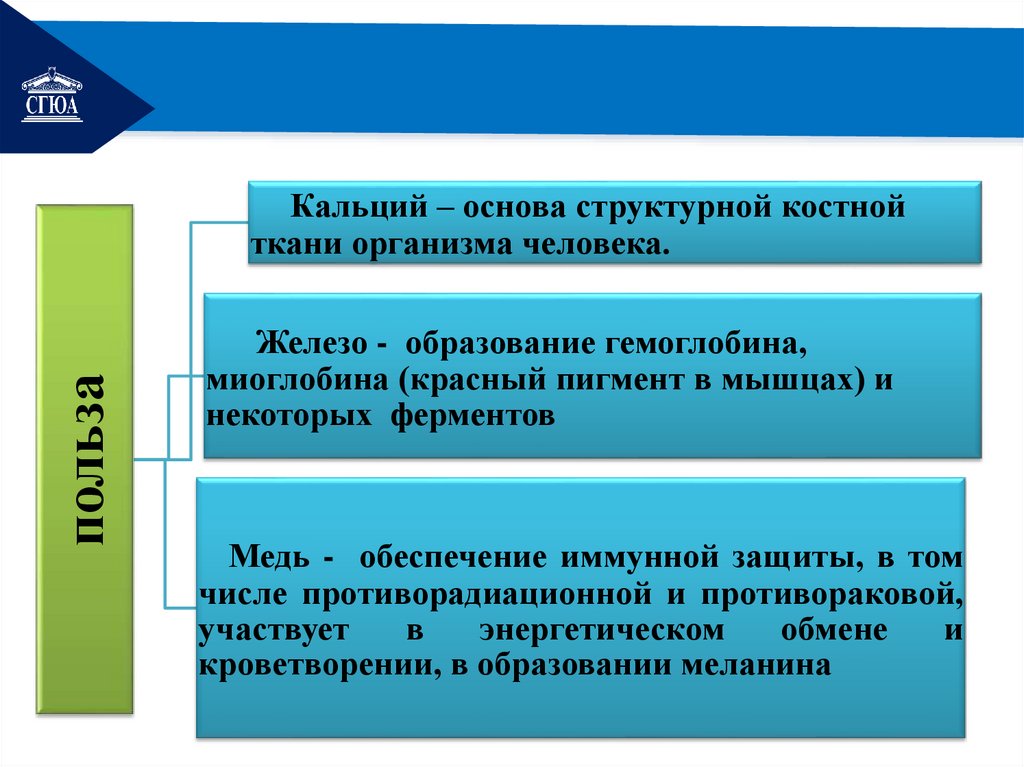
РЕМОНТпольза
Кальций – основа структурной костной
ткани организма человека.
Железо - образование гемоглобина,
миоглобина (красный пигмент в мышцах) и
некоторых ферментов
Медь - обеспечение иммунной защиты, в том
числе противорадиационной и противораковой,
участвует
в
энергетическом
обмене
и
кроветворении, в образовании меланина
31.
РЕМОНТвред
Кадмий – накапливаясь в почках, приводит
к гипертонии, снижению иммунитета,
слабоумию. Содержится в табачном дыме,
питьевой воде, загрязненном воздухе
Алюминий – старческое слабоумие, нарушение
вазомоторных реакций, анемия, заболевание почек и
печени. Пищевая фольга, посуда, пивные банки.
Свинец - нарушение мозговой деятельности,
раковые заболевания, нарушение детородной функции.
Загрязненный воздух – выхлопные газы автомобилей.
32.
РЕМОНТНеметаллы
33.
РЕМОНТ• Кислород и кремний — 76 % от массы
земной коры
• Неметаллы составляют более 84% от
массы почвы, 98,5% от массы растений и
97,6% от массы тела человека.
• Водород и гелий – входят в состав
космических объектов, включая Солнце.
34.
РЕМОНТОсобенности
атомов Неме
• 4-8 е на внешнем
уровне
Легче
принимают
недостающие
е,
превращаясь
в
анионы
Проявляют как
окислительные, так и
восстановительные
свойства
маленький
радиус
35.
РЕМОНТ• Неметаллы (22 х.э.) расположены в
правом верхнем углу ПСХЭ в главных
подгруппах.
36.
РЕМОНТ• Инертные газы существуют в атомарном
состоянии;
• H2 , O 2, N 2 , F 2 , Cl 2 , Br 2 имеют
молекулярную структуру;
• Химическая связь в твердых веществах –
ковалентная неполярная, они имеют
либо молекулярную, либо атомную
кристаллические решетки.
37.
РЕМОНТ• Неметаллы (22 х.э.) расположены в
правом верхнем углу ПСХЭ в главных
подгруппах.
38.
РЕМОНТФИЗИЧЕСКИЕ СВОЙСТВА
• Агрегатное состояние: твердые (сера, фосфор, йод,
алмаз и графит); жидкие (бром); газообразные
(кислород , водород, азот , хлор, фтор).
• Не проводят электрический ток и тепло (кроме
графита и кремния).
• Не имеют металлического блеска (кроме I2, графита и
Si)
• Цвет охватывает все цвета спектра (красный-красный
фосфор, желтый – сера, зеленый - хлор, фиолетовый –
пары иода).
• Температура плавления изменяется в огромном
интервале tпл. (N2)= -210C , а t пл. (Алмаз) =37300С
39.
РЕМОНТАЛЛОТРОПИЯ
- способность атомов одного химического
элемента образовывать несколько простых
веществ - модификаций за счет изменения
числа атомов в молекуле или строения
кристаллической решетки.
40.
РЕМОНТХимические свойства неметаллов
41.
РЕМОНТОкислительные свойства неметаллов
1. с металлами
S + Fe → Fe S
2. с неметаллами, имеющими меньшую ЭО
2Н2 + О2 → 2Н2О
3. с некоторыми сложными веществами:
СН4 +2О2 → СО2 + 2Н2О
4. Вытеснение одних неметаллов другими из растворов
их солей:
2KI + Br2 → 2KBr + I2
42.
РЕМОНТВосстановительные свойства
1. с более ЭО неметаллами:
Н2 + S = Н2 S
2. с кислородом (кроме фтора) :
4P+5O2=2P2O5
Наиболее сильные восстановители - углерод и
водород.
43.
РЕМОНТНекоторые неметаллы встречаются в
природе в свободном виде:
кислород, азот,
инертные газы.
Малоактивные неметаллы: серу, углерод можно
выделить из смесей или очистить от примесей,
используя физические методы.
Химически активные неметаллы встречаются в
природе только в виде соединений: фтору, хлору,
брому и иоду. Их получают химическим путем.
44.
РЕМОНТ• Сера - составная частью белка, способствует
нейтрализации в организме ядовитых веществ, росту
хрящевой и костной тканей, кожи, волос, ногтей,
формированию структуры соединительной ткани.
Дефицит серы может привести к нарушению синтеза
инсулина, раннему старению организма.
• Серу используют для производства серной кислоты,
резины, спичек, черного пороха, лекарственных
препаратов.
• Азот используют для наполнения электролампочек,
создания инертной среды при сварке металлов, для
глубокого охлаждения и замораживания, в
производстве азотной кислоты, удобрений.
45.
РЕМОНТ• Фосфор используется в производстве моющих средств, гербицидов,
красок, фосфорной кислоты, фосфористой бронзы. Белый фосфор
используется для производства авиабомб, снарядов. Красный
фосфор для изготовления спичек, дымовых шашек, полимеров,
полупроводников, инсектицидов.
• Хлор применяют для производства соляной кислоты,
винилхлорида, каучука и пластмасс, как отбеливающее средство,
для обеззараживания питьевой воды.
• Кремний
- для изготовления диодов, фотоэлементов,
транзисторов, сплавов. Оксид кремния используется в
строительстве, для производства цемента, керамики, стекла.
• Водород используется в для синтеза аммиака, хлороводорода и
метанола, применяется для гидрогенизации жиров. Используется
в качестве восстановителя в металлургии
46.
РЕМОНТТемы сообщений:
• «Самые дорогие металлы»
• «Влияние металлов на здоровье человека»
• «Роль металлов в истории человечества»
47.
СПАСИБО ЗАВНИМАНИЕ!






































 chemistry
chemistry








