Similar presentations:
Щелочные металлы. 9 класс
1. Щелочные металлы
9 классПодготовила учитель химии
Кузяшева Ю.В
2. Цель урока
• Сформировать понятие щелочныхметаллов
• Дать сравнительную характеристику
щелочным металлам
• Познакомиться с физическими и
химическими свойствами щелочных
металлов
3. Уберите неверное
УУатомовэлектрона.
атомов металлов
металлов на
на внешнем уровне 1-3 электрона.
Металлы являются восстановителями и окислителями.
Для
решетка.
Для металлов
металлов характерна металлическая кристаллическая решетка.
Металлы
теплопроводностью.
Металлы обладают
обладают электропроводностью и теплопроводностью.
При взаимодействии с кислородом металлы принимают электроны.
Все металлы активно взаимодействуют с кислотами.
Металлы Сu,
Сu, Au,
Au,Ag
Agне
невзаимодействуют
взаимодействуютссводой
водой даже
даже при
при нагревании.
Мg, Be находятся в главной подгруппе II группы
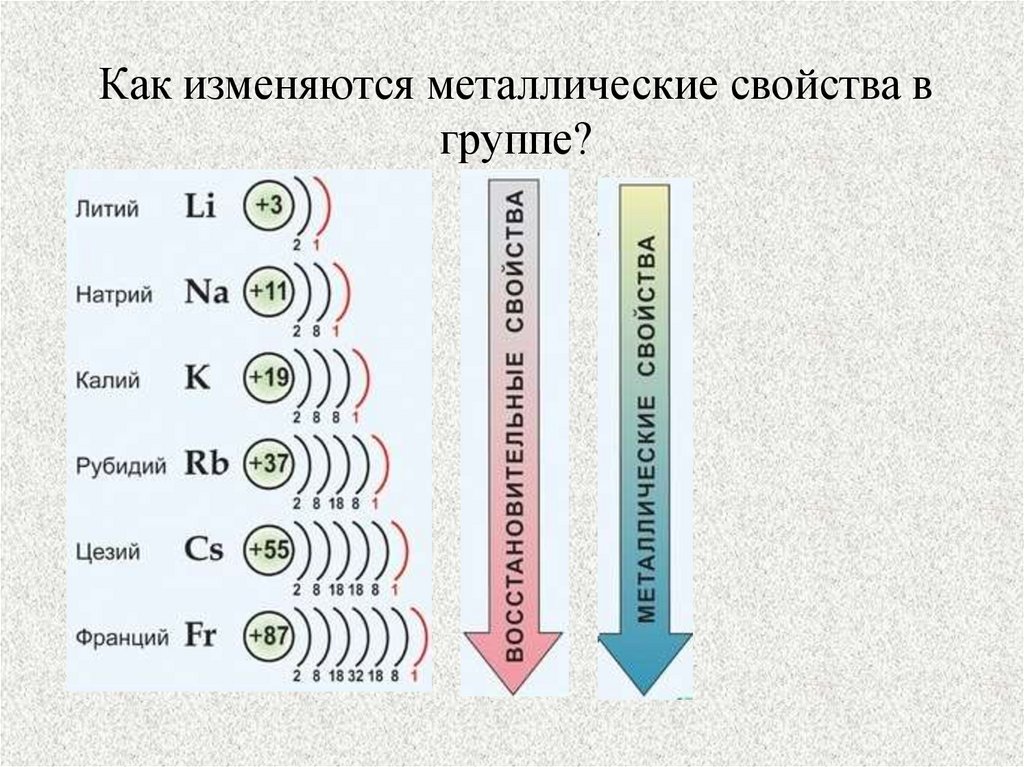
4. Щелочные металлы — это элементы главной подгруппы I группы
литийLi,
натрий Nа,
калий
К,
рубидий Rb,
цезий
Сs ,
франций Fr.
Название группы
связано с тем, что при
взаимодействии этих
металлов с водой
образуются едкие
вещества - щелочи
5. Как изменяются металлические свойства в группе?
6. Радиусы атомов элементов 1А группы
7. Сравнение свойств
• Что общего в атомном строении щелочныхметаллов?
• Как изменяется химическая активность этих
элементов?
8. ИСТОРИЯ ОТКРЫТИЯ
• Натрий и калий – 1807г. Английский химик ифизик Г.Дэви получил их в виде металлов при
электролизе расплавленного едкого натра
NaOH и едкого кали КОН.
• Литий открыт в 1817г. шведским химиком И.
Арфведсон. Этот минерал выглядит как самый
обыкновенный камень, и поэтому металл
назвали литием, от греческого «литос» камень.
9. ИСТОРИЯ ОТКРЫТИЯ
• Рубидий – 1863 г. Р. Бунзен и Г.Кирхгоффобнаружили с помощью спектрального
анализа, а затем выделили в чистом виде из
минерала лепидолит (фторсиликат лития и
алюминия)
• Цезий - 1882 г. Р. Бунзен и Г.Кирхгофф
обнаружили с помощью спектрального
анализа, а затем выделили в чистом виде из
солей, полученных из минеральных вод.
10. ИСТОРИЯ ОТКРЫТИЯ
• Франций - Этот элемент был предсказанД.И.Менделеевым и был открыт в 1939 г.
Маргаритой Пере, сотрудницей Института
радия в Париже. Она же дала ему в 1964 г.
название в честь своей родины – франций. .
Микроскопические количества изотопов
франция-223 и 224 могут быть химически
выделены из минералов урана и тория. Другие
изотопы франция получают искусственным
путём с помощью ядерных реакций.
11. Происхождение названий
Li (1817) лат. " литос" - камень
Na (1807) араб. "натрум" - сода
К (1807) араб. "алкали" - щелочь
Rb (1861) лат. "рубидус" - темно-красный
Cs (1860) лат. "цезиус" - небесно-голубой
Fr (1939) от названия страны Франция –
его на Земле всего 25 мг.
12. Изменение физических свойств
13.
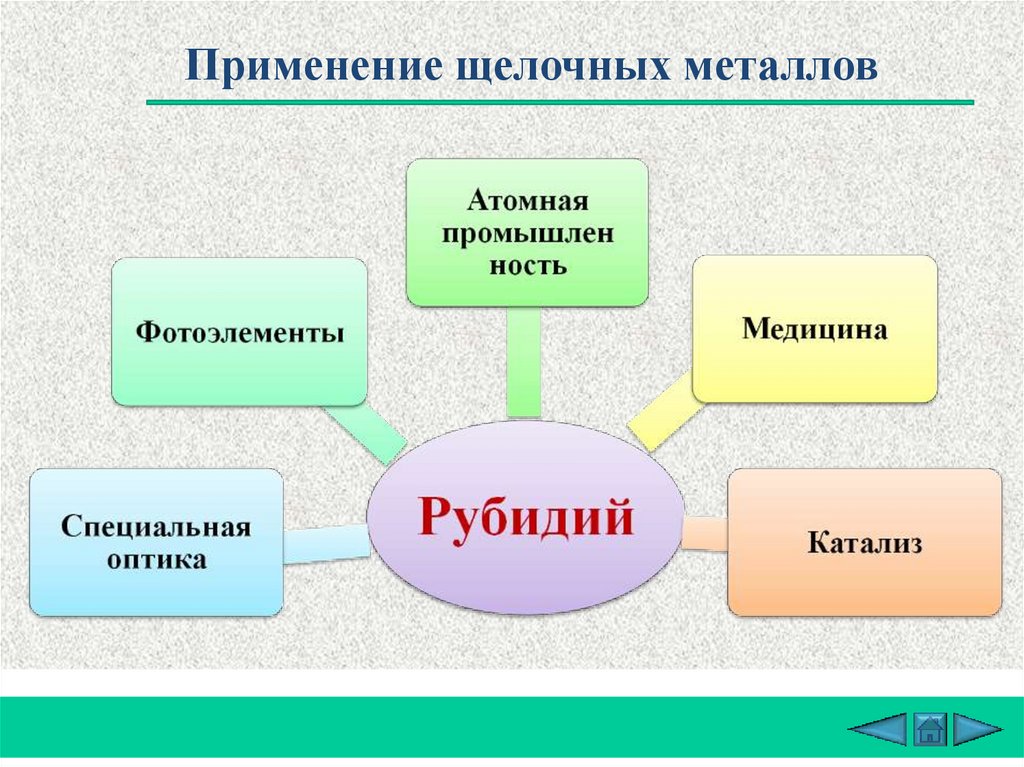
Применение щелочных металловДля
получения
трития
Литий
Получение
сплавов для
подшипников
Химические
источники
тока
Восстановитель
в органическом
синтезе
Пиротехника
14.
Применение щелочных металлов15.
Применение щелочных металловТеплоноситель
в ядерных
реакторах
Калийные
удобрения
Для получения
перекиси калия
Калий
В гальванотехнике
Катализатор
Термическое
получение
металлов
16.
Применение щелочных металлов17.
Применение щелочных металлов18. Химические свойства
19. Нахождение в природе
• В свободном виде в природе щелочныеметаллы не встречаются из-за своей
исключительно высокой химической
активности. Некоторые их природные
соединения, в частности соли натрия и
калия, довольно широко распространены,
они содержатся во многих минералах,
растениях, природных водах.
20. Оксиды щелочных металлов
Оксид литияОксид натрия
Составьте общую формулу оксидов.
21. Гидроксиды щелочных металлов
KOH – гидроксид калияNaOH – гидроксид натрия
Какова общая
формула
гидроксидов?
LiOH – гидроксид лития
22.
23. НЕМНОГО ИСТОРИИ
Древнегреческий поэт Гомер, назвалповаренную соль «божественной». В те
далекие времена она ценилась выше золота.
Из-за месторождений соли происходили
военные столкновения, а нехватка соли у
населения вызывала «соляные бунты».
М.В.Ломоносов писал, что в его время за
четыре-пять плиток соли можно было купить
раба. Многие племена в Центральной Африке
отдавали за чашку соли чашку золота. В Китае
XIII века из каменной соли делали монеты.
24. Поваренная соль и география
Поваренная соль известна человеку снезапамятных времен, и название ее
сходно во многих языках. В честь соли
названы многие города, реки и озера:
Солигалич, Соликамск, Сольвычегорск,
Соль-Илецк, Сольцы, Усолье и УсольеСибирское, реки Усолка и Соленая и
многие другие.
25. Поваренная соль в организме человека
Соль – обязательная составная часть организмачеловека. Соль поддерживает нормальную
деятельность клеток, из которых состоят все
ткани и органы. Из соли в желудке
вырабатывается соляная кислота, без которой
невозможно переваривание пищи. Суточная
потребность в поваренной соли для взрослого
человека составляет 10 – 15 грамм.
26. Применение поваренной соли
• Производство химических веществ--- соляной кислоты
--- гидроксида натрия
--- хлора
--- соды
• Для консервирования
• Приправа к пище
• Производство мыла
27. Сколько нужно времени для того, чтобы съесть пуд соли?
Есть поговорка: «Чтобы хорошо узнатьчеловека, надо съесть с ним пуд соли».
Оказывается это можно сделать всего за
год с небольшим. Ведь потребность соли
для нормального питания человека
составляет не менее 7 килограммов в год.
28.
Карбонат калия - поташКалийная селитра


























 chemistry
chemistry








