Similar presentations:
Кислородсодержащие органические соединения (занятие 2)
1.
Кислородсодержащиеорганические
соединения
2.
СПИРТЫCnH2n-1 OH
Спиртами называются органические
вещества, молекулы которых содержат
одну или несколько гидроксильных групп,
связанных с углеводородным радикалом.
3.
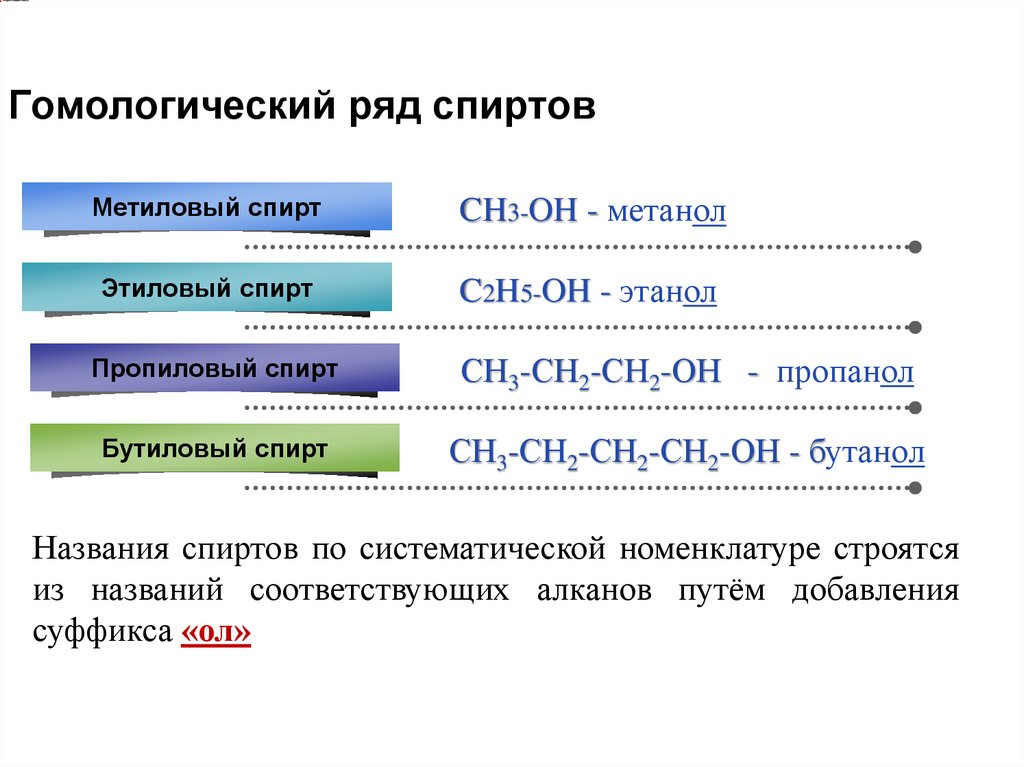
Гомологический ряд спиртовМетиловый спирт
CH3-OH - метанол
Этиловый спирт
C2H5-OH - этанол
Пропиловый спирт
СН3-СН2-СН2-ОН - пропанол
Бутиловый спирт
СН3-СН2-СН2-СН2-ОН - бутанол
Названия спиртов по систематической номенклатуре строятся
из названий соответствующих алканов путём добавления
суффикса «ол»
4.
Физические свойства спиртовСпирты являются бесцветными жидкостями или кристаллическими
веществами с характерным запахом. Первые представители
гомологического ряда имеют приятный запах, для бутанолов и
пентанолов запах становится неприятным и раздражающим. Высшие
алканолы имеют приятный ароматный запах.
5.
Химические свойства спиртовwww.themegallery.com
6.
1. Реакция замещения атомаводорода гидроксильной группы
С2Н5ОН + Na → C2H5ONa + H2
Спирты могут реагировать с щелочными металлами.
Образующиеся при этом металлические производные
спиртов называются алкоголятами.
7.
2) Реакция замещениягидроксильной группы
8.
3) Реакция дегидратацииПри более слабом нагревании этилового спирта с серной кислотой
образуется диэтиловый эфир. Это летучая, легко воспламеняющаяся
жидкость. Диэтиловый эфир относится к классу простых эфиров –
органических веществ, молекулы которых состоят из двух
углеводородных радикалов, соединённых посредством атома кислорода.
Общая формула R – O - R
9.
4. Горение спиртов10.
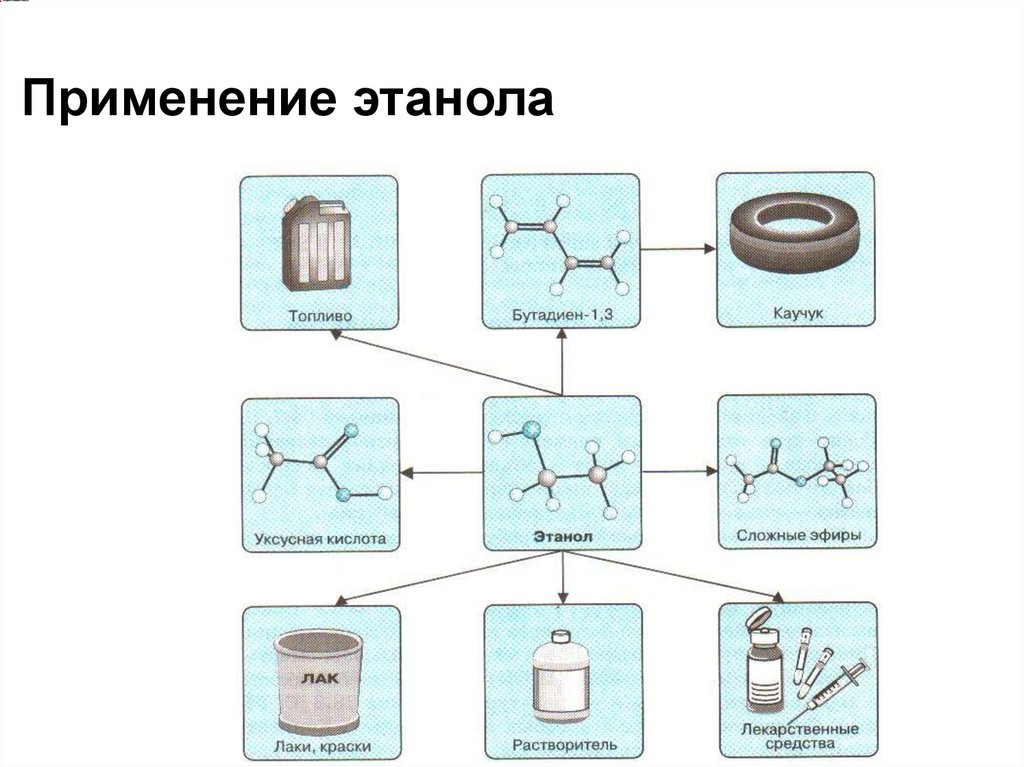
Получение спиртов11.
Применение этанола12.
LOGOАльдегиды
13.
ОПРЕДЕЛЕНИЕАЛЬДЕГИДЫ
(СnH2n+1OН) – это органические
соединения,
молекулы
которых
содержат
карбонильную группу, связанную с атомом водорода и
углеводородным радикалом
С
O
H
КАРБОНИЛЬНАЯ ГРУППА
R С
O
H
ОБЩАЯ ФОРМУЛА
14.
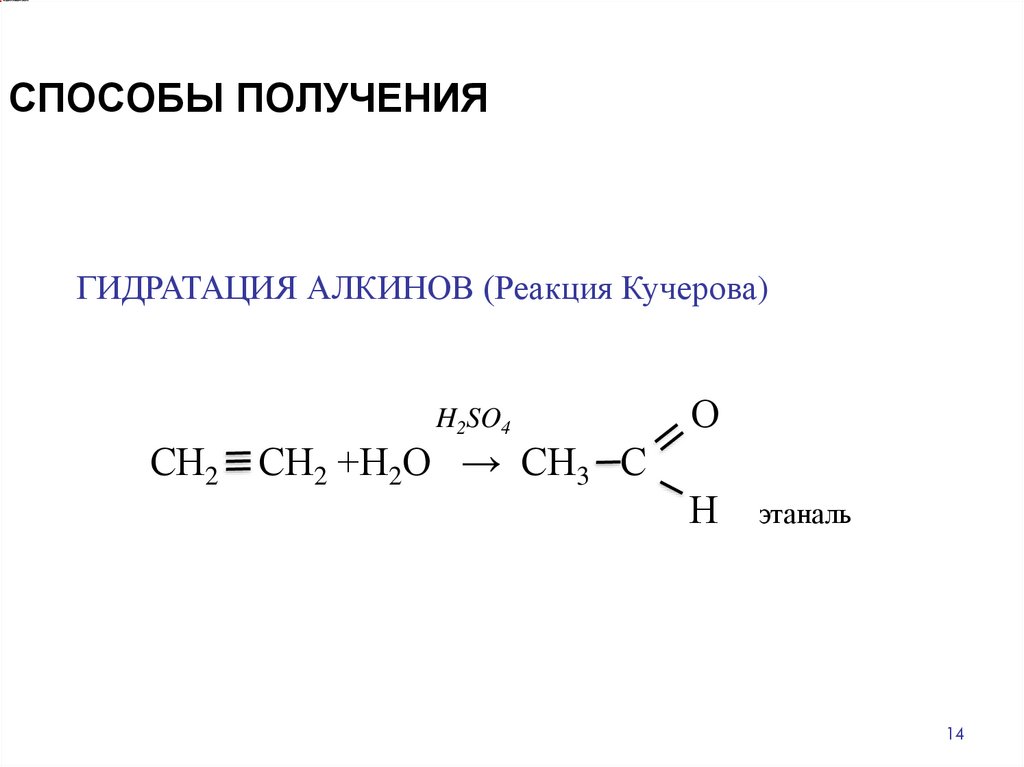
СПОСОБЫ ПОЛУЧЕНИЯГИДРАТАЦИЯ АЛКИНОВ (Реакция Кучерова)
H2SO4
СН2 СН2 +Н2О → СН3 С
О
Н
этаналь
14
15.
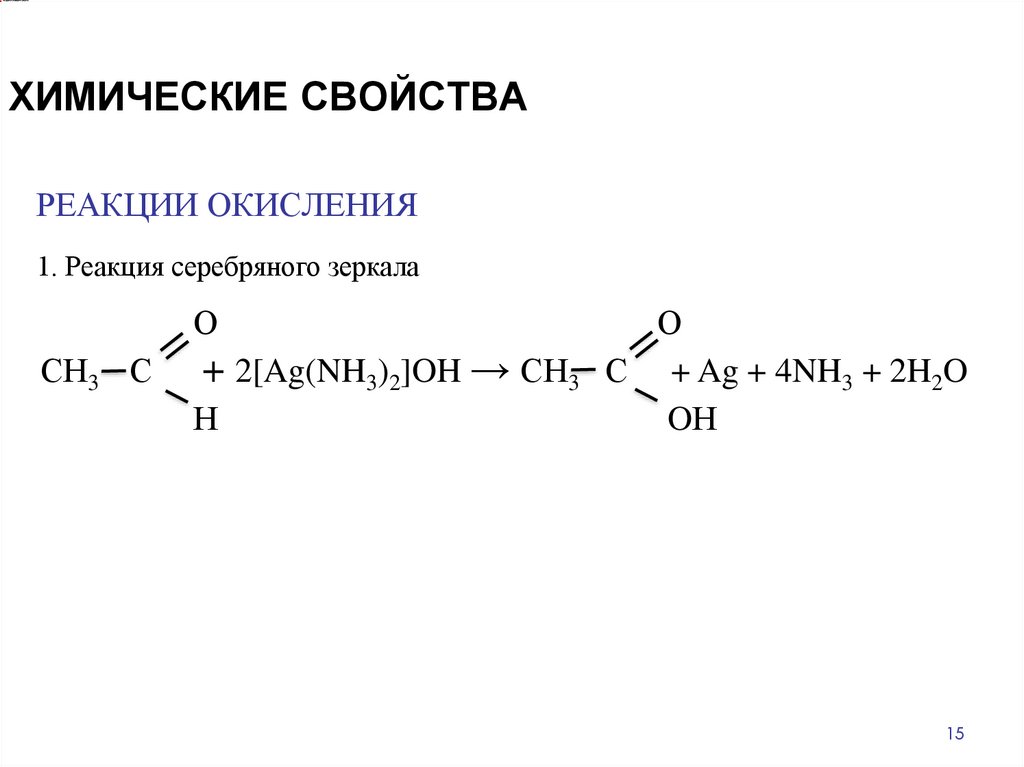
ХИМИЧЕСКИЕ СВОЙСТВАРЕАКЦИИ ОКИСЛЕНИЯ
1. Реакция серебряного зеркала
О
СН3 С
+ 2[Ag(NH3)2]OH → СН3
Н
О
С + Ag + 4NH3 + 2H2O
OН
15
16.
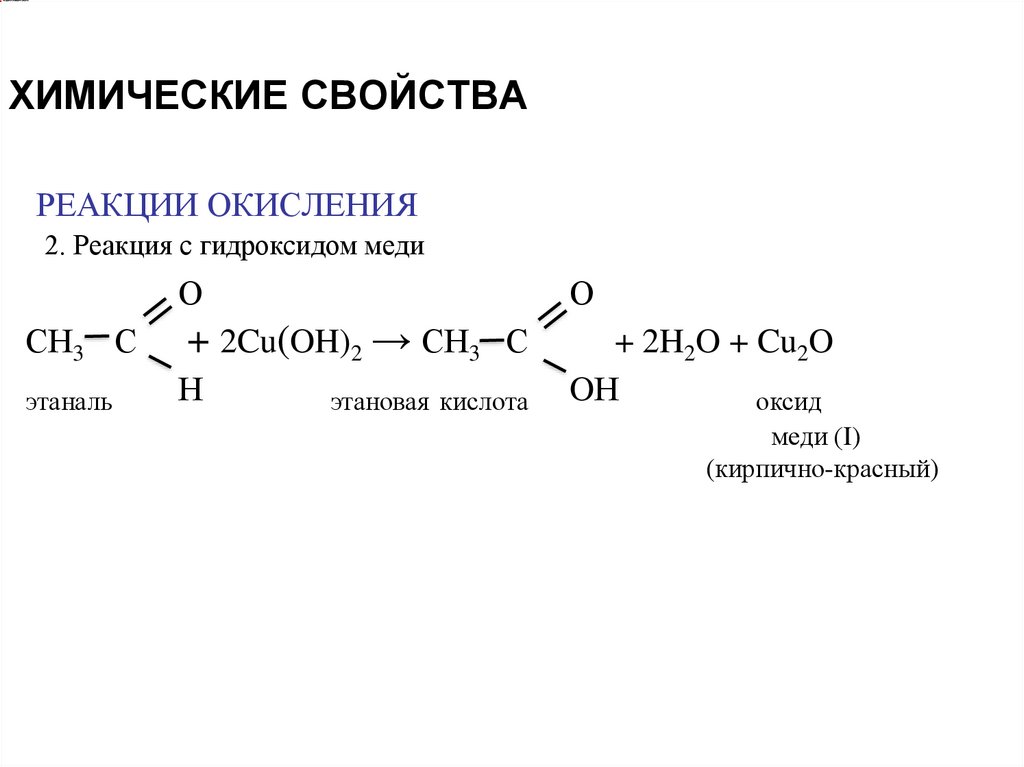
ХИМИЧЕСКИЕ СВОЙСТВАРЕАКЦИИ ОКИСЛЕНИЯ
2. Реакция с гидроксидом меди
О
О
СН3 С
+ 2Cu(OH)2 → СН3 С
этаналь
Н
+ 2H2O + Cu2O
OН
оксид
этановая кислота
меди (I)
(кирпично-красный)
17.
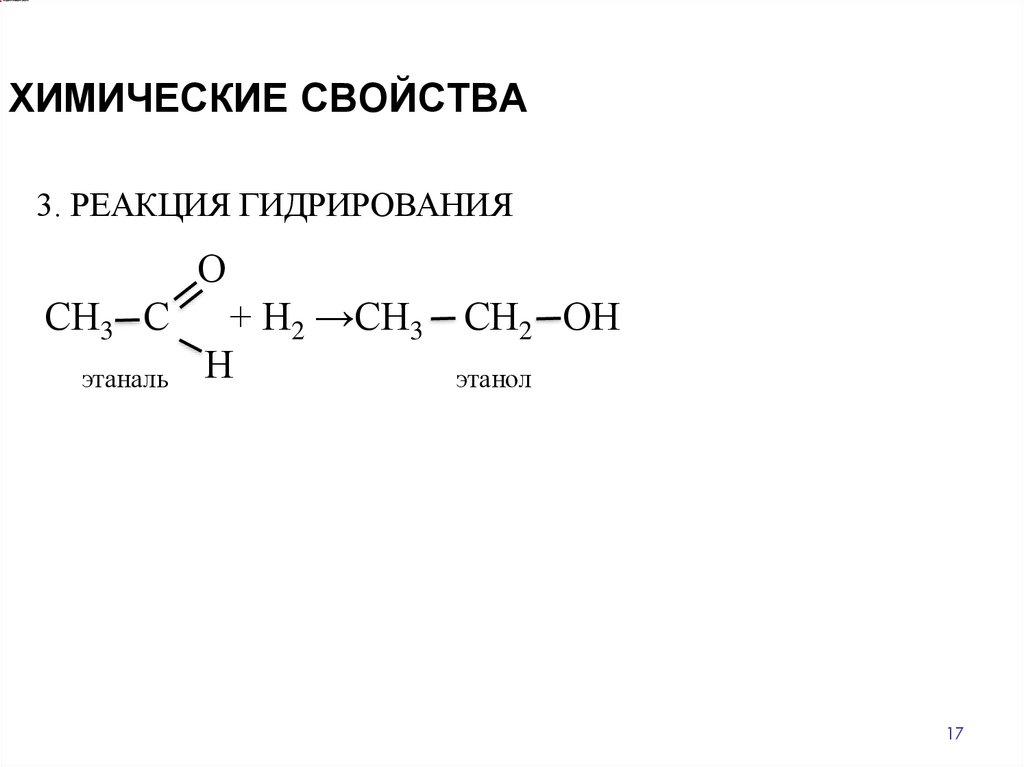
ХИМИЧЕСКИЕ СВОЙСТВА3. РЕАКЦИЯ ГИДРИРОВАНИЯ
О
СН3 С
этаналь
+ Н2 →СН3
Н
СН2 ОН
этанол
17
18.
ПРИМЕНЕНИЕ АЛЬДЕГИДОВПАРФЮМЕРИЯ
• Альдегид анисовый, обепин
– жидкость с приятным
запахом мимозы
• Альдегид дециловый,
деканаль – при разбавлении
появляются нотки запаха
апельсиновой корки
19.
ПРИМЕНЕНИЕ АЛЬДЕГИДОВПОЛИМЕРНЫЕ МАТЕРИАЛЫ
Фенолформальдегидные смолы
20.
ПРИМЕНЕНИЕ АЛЬДЕГИДОВПРОИЗВОДСТВО ВЕЩЕСТВ
Уксусная кислота
Этилацетат
Формалин
21.
LOGOКАРБОНОВЫЕ
КИСЛОТЫ
22.
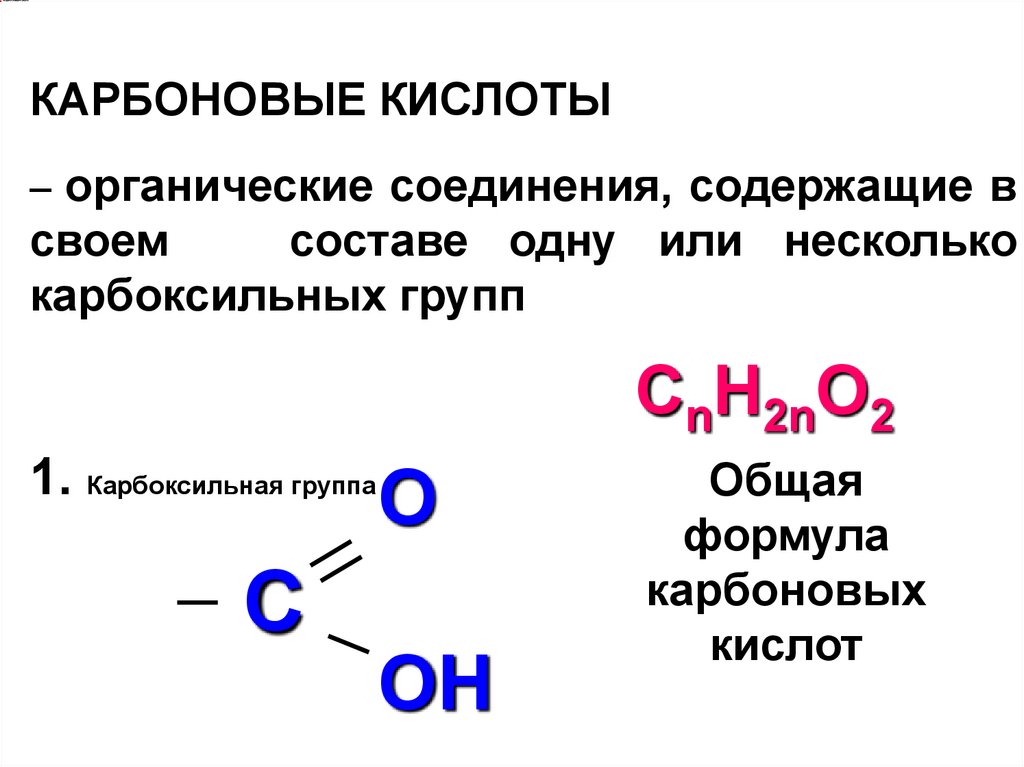
КАРБОНОВЫЕ КИСЛОТЫ– органические соединения, содержащие в
своем
составе одну или несколько
карбоксильных групп
СnH2nO2
1. Карбоксильная группа
O
C
OH
Общая
формула
карбоновых
кислот
23.
МЕТАНОВАЯ КИСЛОТА(МУРАВЬИНАЯ КИСЛОТА)
24.
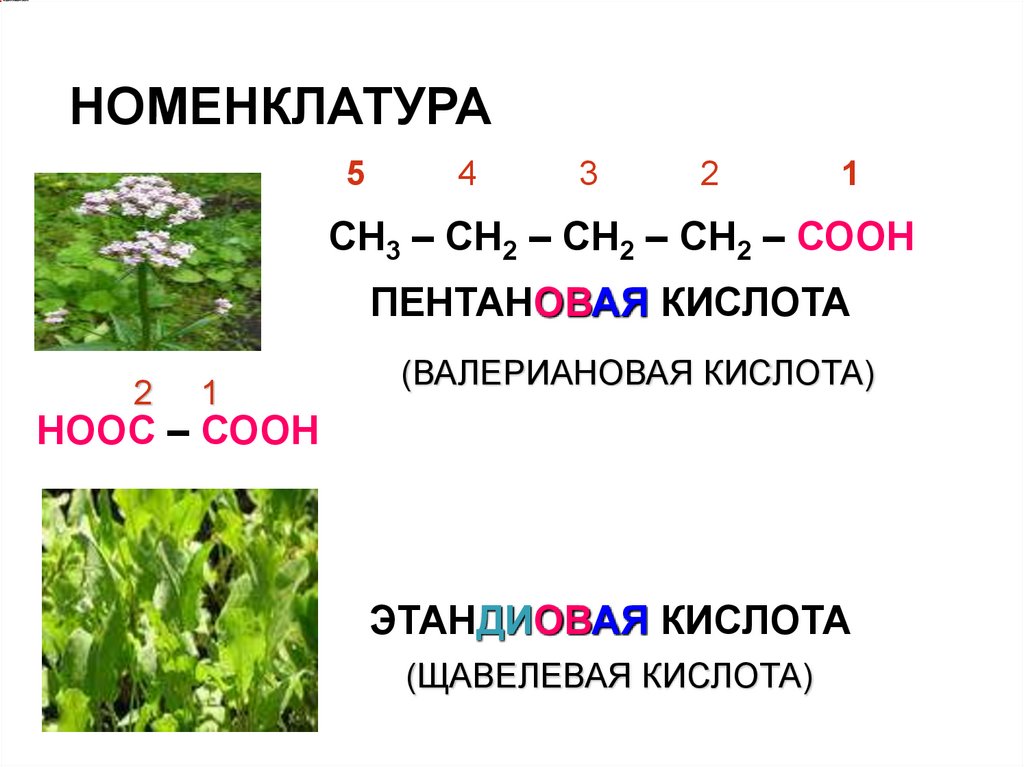
НОМЕНКЛАТУРА5
4
3
2
1
СН3 – СН2 – СН2 – СН2 – СООН
ПЕНТАНОВАЯ КИСЛОТА
2
1
(ВАЛЕРИАНОВАЯ КИСЛОТА)
НООС – СООН
ЭТАНДИОВАЯ КИСЛОТА
(ЩАВЕЛЕВАЯ КИСЛОТА)
25.
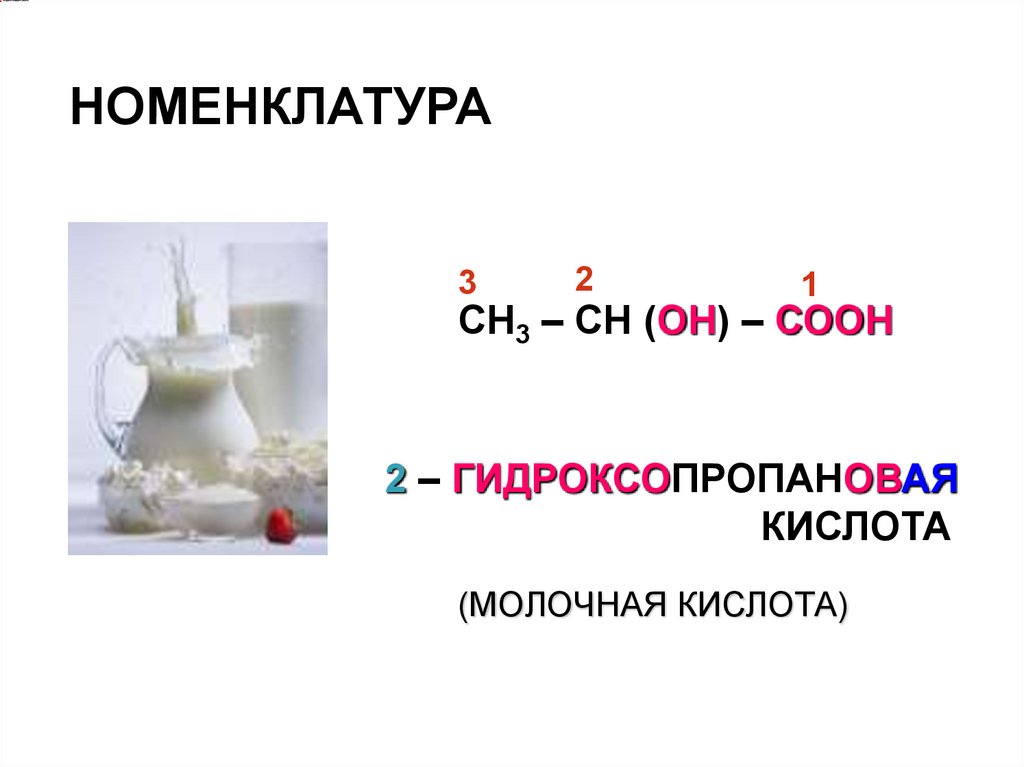
НОМЕНКЛАТУРА3
2
1
СН3 – СН (ОН) – СООН
2 – ГИДРОКСОПРОПАНОВАЯ
КИСЛОТА
(МОЛОЧНАЯ КИСЛОТА)
26.
Физические свойстваС1 – С3 Жидкости с характерным
резким запахом, хорошо
растворимые
в
воде
Вязкие
маслянистые
с неприятным
С4 – С9 жидкости
запахом, плохо растворимые
в воде
Твердые
вещества,
C10 и > не имеющие запаха, не
растворимые в воде
27.
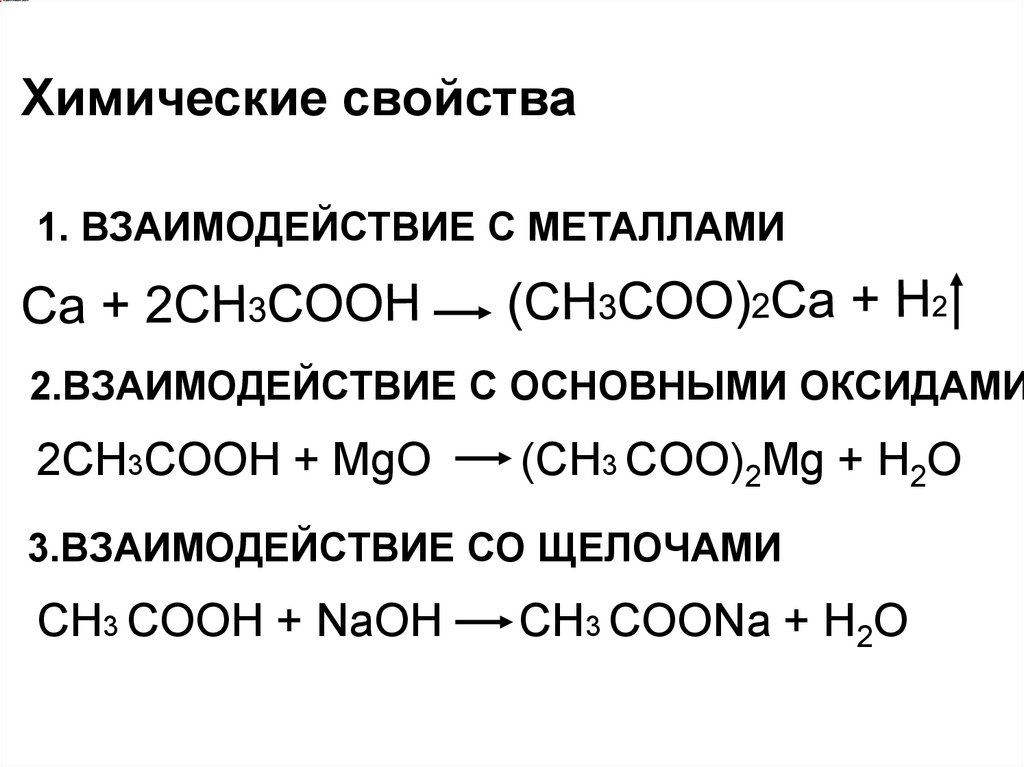
Химические свойства1. ВЗАИМОДЕЙСТВИЕ С МЕТАЛЛАМИ
2.ВЗАИМОДЕЙСТВИЕ С ОСНОВНЫМИ ОКСИДАМИ
2СН3COOH + MgO
(СН3 COO)2Mg + H2O
3.ВЗАИМОДЕЙСТВИЕ СО ЩЕЛОЧАМИ
СН3 COOH + NaOH
СН3 COONa + H2O
28.
СПОСОБЫ ПОЛУЧЕНИЯКАРБОНОВЫХ КИСЛОТ
1. ОКИСЛЕНИЕ СПИРТОВ, АЛЬДЕГИДОВ,
АЛКАНОВ И АЛКЕНОВ
29.
ПРИМЕНЕНИЕв кожевенной (при дублении кож);
в пищевой (для консервирования
фруктов);
в медицине;
в производстве некоторых полимеров
для отбеливания тканей;
в производстве красителей;
для удаления ржавчины и накипи.
30.
LOGOСложные эфиры
31.
Сложные эфирыСложными эфирами называют производные
карбоновых кислот, в которых атом водорода
карбоксильной группы замещён на
углеводородный радикал.
Их состав соответствует общей формуле
32.
ПОЛУЧЕНИЕРеакция этерификации
CH3COOH + НОС2Н5
уксусная кислота
этиловый спирт
CH3COOС2Н5 + H2O
этиловый эфир
уксусной кислоты
(этилацетат)
33.
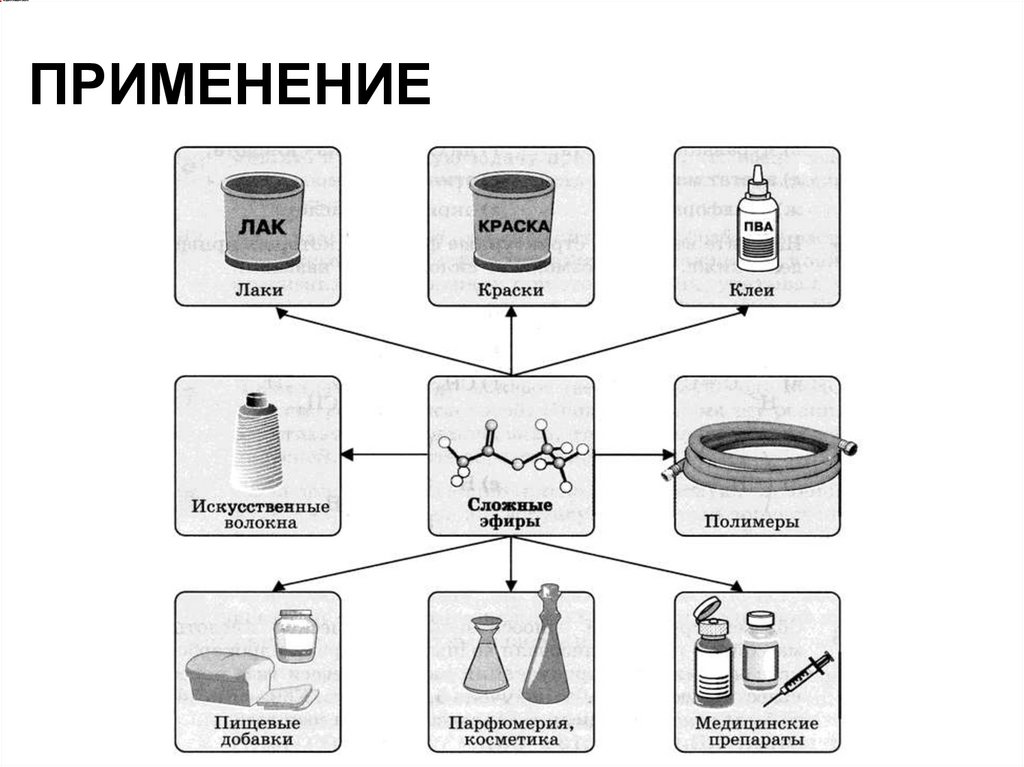
ПРИМЕНЕНИЕ34.
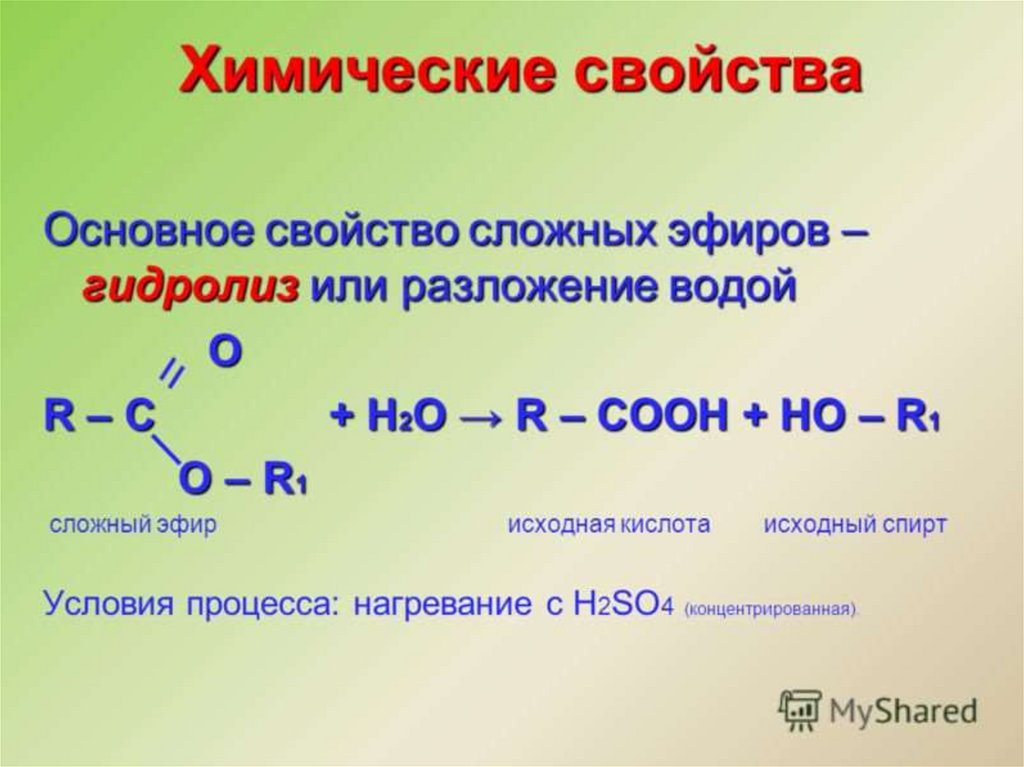
Физические свойстваСложные эфиры – жидкости, обладающие
приятными фруктовыми запахами. В воде они
растворяются очень мало, но хорошо
растворимы в спиртах.
Сложные эфиры очень распространены в
природе. Их наличием обусловлены приятные
запахи цветов и фруктов.
35.
ЖАСМИНОВЫЙ ЗАПАХС2 Н 5СОО СН 2С6 Н 5
Бензил-ацетат
36.
LOGOГРУШЕВЫЙ ЗАПАХ
СН3 СОО С2 Н 5
этилэтанат
37.
Вишнёвый запахНСОО С5 Н11
бутилметанат
38.
39.
40.
Домашнее задание1)Подготовка презентации на тему:
- Формальдегид как основа получения веществ
и материалов для моей профессиональной
деятельности.
- Лавсан как представитель синтетических
волокон.
- Синтетические моющие средства — СМС
(детергенты), их преимущества и недостатки.
41.
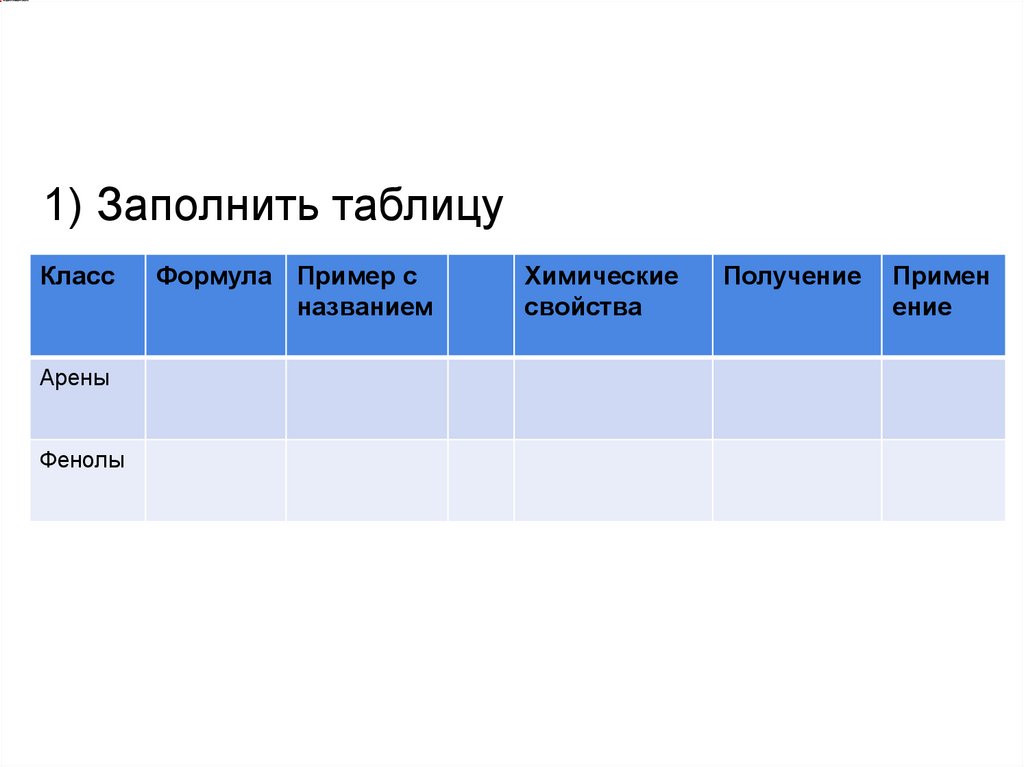
1) Заполнить таблицуКласс
Арены
Фенолы
Формула Пример с
названием
Химические
свойства
Получение
Примен
ение




























 chemistry
chemistry