Similar presentations:
Окисно-відновні реакції. Процеси окиснення, відновлення, окисник та відновник
1. Окисно-відновні реакції.
Процеси окиснення,відновлення, окисники,
відновники.
2. Мета.
Сформувати знання про окисно-відновніреакції.
Сформувати поняття про процеси
окиснення, відновлення.
Навчити розрізняти які з речовин є
окисниками, а які відновниками
3.
Ступінь окиснення (С.О.) — умовнавеличина, що показує заряд того чи
іншого елемента в сполуці .
1. Ступінь окиснення елемента в простій речовині =
0.
H20 ; O20 ; F20 ; Cl20 ; Ca0.
2. Сума ступенів окиснення елементів в сполуці, з
врахуванням коефіціентів= 0.
4.
Найнижча с.о.= № групи –8Нульова с.о.в простих речовинах.
Позитивна с.о.= номеру групи.
5.
С.о. Оксигену в оксиді =-2.С.о. Гідрогену в сполучені з неметалами=+1.
С.о. металів 1 групи гол.підгр. =+1.
С.о. металів 2 гр. гол. підгр. =+2.
С.о. Алюмінію =+3.
6. Находження ступеня окиснення элементів в сполуці.
2 . (+1) + Х + 3 . (-2) = 02 +Х-6=0
H2СO3
Х = +4
Х
H СО
+
-2
7.
Хімічні реакціїОкисно-відновні
(реакції, що відбуваються із
зміною ступенів окиснення
елементів, які входять до
складу реагуючих речовин)
0
0
+4 -2
С + О2 → СО2
-Деякі реакції сполучення;
-Деякі реакції розкладу;
-Реакції заміщення.
Реакції, що відбуваються без зміни
ступенів окиснення
HCl + NaOH → NaCl + H2O
-Деякі реакції сполучення;
-Деякі реакції розкладу;
-Реакції обміну.
8.
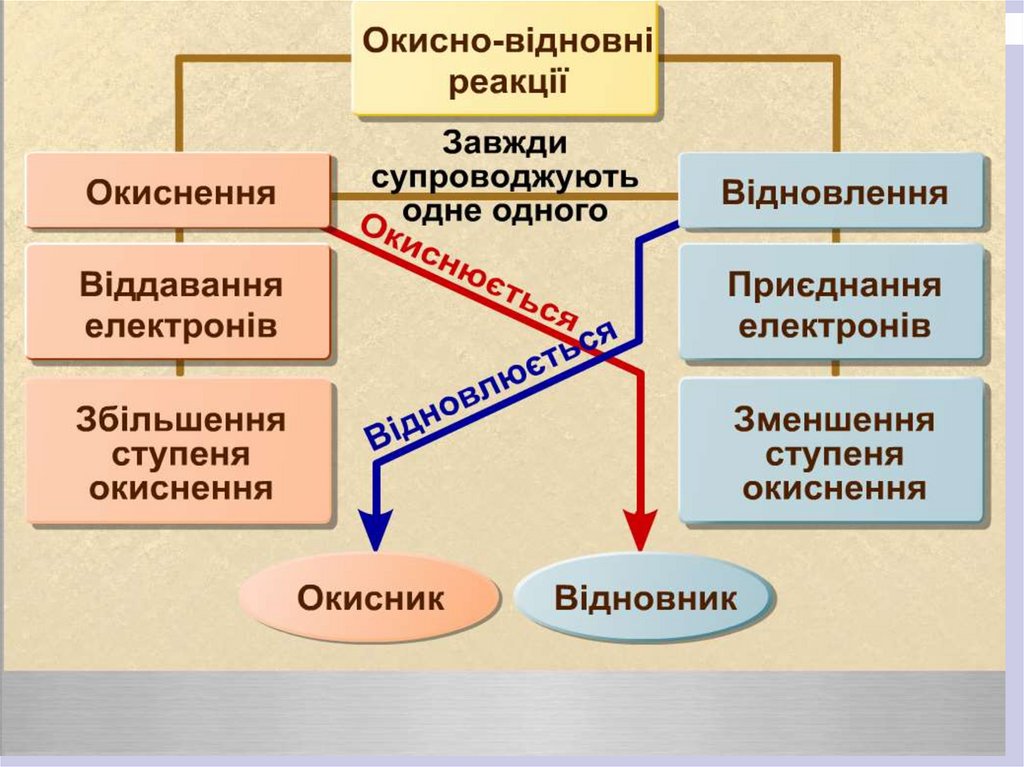
: Відновники – атоми, молекули абойони, що віддають електрони.
Окисники - атоми, молекули або йони,
що приєднують електрони.
Відновлення – процес приєднання
електронів.
Окиснення - процес віддавання
електронів.
9. Окиснення: речовина A як відновник віддає один електрон
10. Відновлення: речовина В як окисник приймає електрон.
11.
12. Прогнозування окисно-відновних властивостей сполук.
Ступінь окиснення(СО)
Вищий (позитивний)
ступінь окиснення
= номеру групи
Тільки окисник ( може
тільки приєднувати
електрони)
Проміжний ступінь
окиснення
Нижчий (негативний)
ступінь окиснення
= 8 відняти номер групи
І окисник, і відновник
Тільки відновник (може
тільки віддавати
електрони)
13. Ступені окиснення Cl
-1,0, +1, +3,
+5,
+7
лише
і окисник, і
відновник
відновник
(найнижчий СО)
лише окисниk
(найвищий СО)
14.
Процес відновлення ( +е )P⁰ + 3e → P‾³
Na⁺ + 1e → Na⁰
Cl⁰ + 1e → Cl‾
Cl⁺⁷ + 8e→ Cl ‾
ступінь окиснення
З М Е Н Ш У Є ТЬ С Я
15.
Процес окиснення ( - е )Ba⁰ - 2e → Ba⁺²
S‾² - 2e → S⁰
Fe⁺² - 1e→ Fe⁺³
Na⁰ - 1e → Na⁺
ступінь окиснення
ЗБІЛЬШУЄТЬСЯ
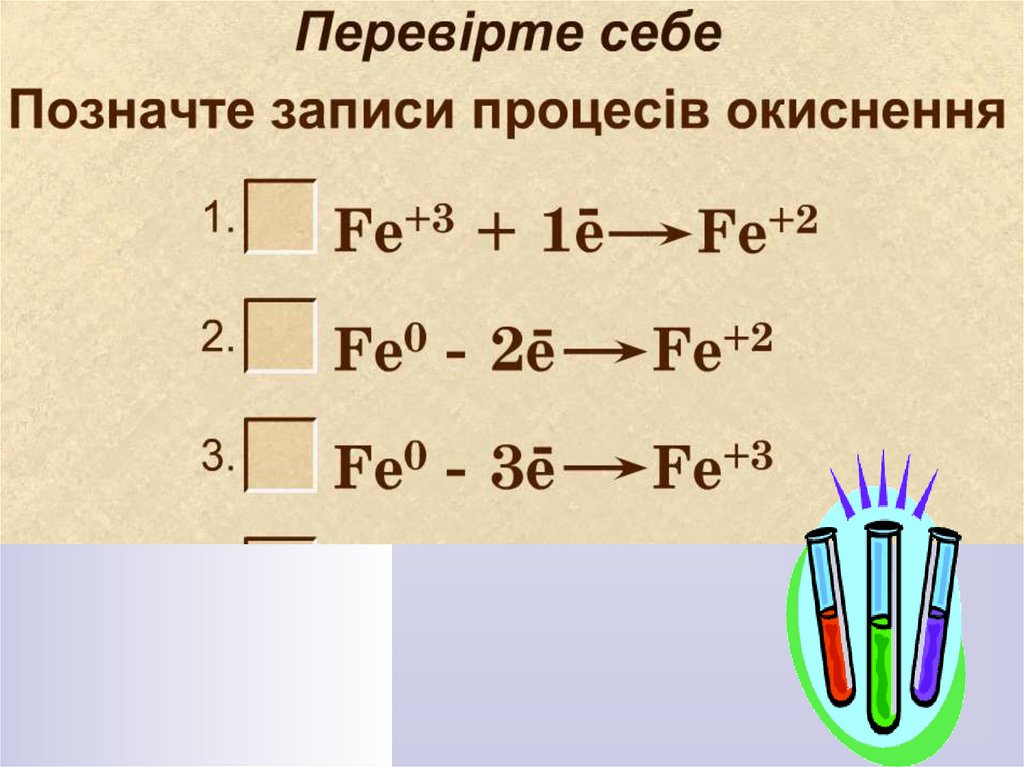
16. Які процеси відображають схеми?
17. Які процеси відображають схеми
18.
19.
20.
21. Окисно-відновна реакція: речовина А віддає електрон речовині В.
22. Український вчений Лев Володимирович Писаржевський
розробив теоріюокисно-відновних
реакцій.
1914 рік.
23. Мета.
Сформувати знання про окисно-відновніреакції.
Сформувати поняття про процеси
окиснення, відновлення.
Навчити розрізняти які з речовин є
окисниками, а які відновниками
24. Види окисно-відновних реакцій.
міжмолекулярні — реакції, в яких атоми, що відновлюються таокиснюються знаходяться в різних молекулах
внутрішньомолекулярні — реакції, в яких атоми, що відновлюються
та окиснюються знаходяться в одній і тій ж самій молекулі
•диспропорціонування (самоокиснення-самовідновлення) реакції, в яких атоми одного елементу перетворюються на речовину
(речовини) зі змінною ступенів окиснення:
25.
Алгоритм складання окисно –відновних реакцій:
1.Розставляємо
ступені окиснення елементів.
.
2. Визначаємо елементи, що змінили ступені
окиснення.
3.Виписуємо ці елементи.
4.Визначаємо зміну кількості електронів за
ступенем окиснення елементів.
5.Складаємо електронний баланс.
6.Проставляємо коефіцієнти в рівнянні реакції.
7.Визначаємо окисник і відновник, процеси
окиснення та відновлення
26. Довести, що реакція окисно-відновна, назвіть процеси та їх учасників.
1) Окиснення:відновник
2) Відновлення:
окисник
27.
Домашнє завдання:Вивчити п.16, завд.1,2 стор.92
28.
ТЕСТ•вкажіть ОВР:
а) PH₃ + 2O₂ = H₃PO₄
б) KOH + HCl = KCl + H₂O
в) CO₂ + CaO = CaCO₃
г) P₂O₅ + H₂O = 2HPO₃
Відповідь: А
•Вказати які процеси відбуваються:
а) N⁰₂ - 4e→ 2N⁺²
б) S⁺⁶ + 2e→ S⁺⁴
в) Fe⁰ - 3e→ Fe⁺³
г) P⁺³ + 2e→ P⁺⁵
ОТВЕТ: а, в - окиснення; б, г - відновлення
3. Скласти ОВР методом електронного балансу.
окисник та відновник.
а) Br₂ + Zn → ZnBr₂
в) Fe₂O₃ + H₂→ H₂O + Fe
Визначити


























 chemistry
chemistry








